Постановка азопирамовой и фенолфталеиновой пробы
Медицинский инструментарий многократного назначения в процессе использования в лечебных и поликлинических учреждениях должен после каждого пациента подвергаться дезинфекционной очистке и стерилизации. Перед этапом стерилизации проводится предстерилизационная обработка инструментов с помощью моющего раствора определённой концентрации. Основная цель предварительной обработки — добиться удаления жировых и белковых отложений с поверхности предметов. После выдержки в моющем растворе инструменты промываются в проточной воде из-под крана и затем в дистиллированной. Постановка азопирамовой и фенолфталеиновой пробы проводится для оценки качества очистки и по СанПину должна проводиться перед каждым этапом стерилизации. Фенолфталеиновая проба определяет наличие остатков моющих веществ. Азопирамовая проводится с целью выявления хлорсодержащих компонентов, остатков крови, ржавчины, кислот.
В медицинских учреждениях для азопирамовой пробы приобретается аптечный раствор, который перед использованием смешивается с перекисью водорода. Оценка реакции определяется путём нанесения нескольких капель на поверхность инструмента, на сложные соединения деталей обрабатываемых приборов, в иглы шприцов. Инструмент держится над белым тампоном, результат окрашивания определяется в течение одной минуты. Оценка реакции после этого срока считается недостоверной. В полостях, иглах, катетерах раствор оставляют на одну минуту, после чего выдавливают на тампон. Появившееся розово – фиолетовое окрашивание говорит о наличии остатков крови. Буроватое окрашивание реактива происходит при наличии на инструментах следов ржавчины, хлорсодержащих препаратов, окислителей.
Не всегда в медицинских учреждениях существует возможность приобрести азопирам готовый раствор, а процесс самостоятельного изготовления может быть не точен. В этом случае можно приобрести заводской набор реагентов, предназначенный для приготовления азопирама и хранящийся до 2-х месяцев. При необходимости с помощью этого раствора готовят рабочий, добавляя в него 3% аптечную перекись водорода. Соотношения перекиси и азопирама соблюдают 1:1.
Азопирам комплект винар состоит из флакона солянокислого анилина и флакона амидопирина. Приготовить рабочий раствор достаточно просто, для этого анилин смешивается с амидопирином, и полученная масса доводится до 100 миллилитров этиловым спиртом в 95%. Полученного флакона хватает примерно на 6000 исследований, при условии использования за один раз 1-2-х миллилитров. Приготовленный раствор хранится в холодильнике до 2-х месяцев, при комнатной температуре в тёмном месте до одного месяца.
Постановка фенолфталеиновой и азопирамовой пробы проводится на одном проценте инструментов, подвергшихся предстерилизационной очистке, но при любом количестве исследуемых предметов их не должно быть меньше 3-5 штук. Результаты проведения проб заносятся в специально оформленные журналы с указанием даты, времени, количества инструментов и наличии реакции. Несоблюдение проведения проб может привести к возникновению аллергий разной степени тяжести, а при использовании инструментов в хирургии и на станциях переливания крови и к пирогенным реакциям организма.
А. Азопирамовая и фенолфталеиновая пробы. — Студопедия
Цель – контроль предстерилизационной очистки.
Оснащение:
· 1% изделий одного наименования, но не менее 3-5 штук;
· Исходный раствор азопирама, приготовленный аптекой;
· 3% перекись водорода;
· Марлевая салфетка;
· Журнал учета результатов контроля предстерилизационной очистки.
Приготовление исходного раствора азопирама.
На один литр раствора отвешивают 100г амидопирина, 1-1,5г солянокислого анилина. Вещества смешивают в сухой посуде и заливают 95% спиртом до 1л, смесь перемешивают палочкой до полного растворения всех ингредиентов, таким образом: азопирам содержит 10% амидопирина, 0,1-0,15% солянокислого анилина; остальное – 95% этиловый спирт.
Готовый раствор может храниться в плотно закрытых флаконах в темноте в холодильнике 2 месяца, в темноте при комнатной температуре – не более 1 месяца. Умеренное пожелтение раствора без выпадения осадка не снижает его рабочего качества.
Приготовление рабочего раствора азопирама.
Перед постановкой пробы на качество очистки нужно смешать в равных количествах исходный раствор азопирама и 3% раствор перекиси водорода. И работать далее данным реактивом в течение 1-2 часов.
Методики постановки реакции.
Рабочим раствором (исходный раствор азопирама +3% Н2О2 в соотношении 1:1) обрабатывают исследуемые изделия: протирают тампонами, смоченными реактивом или в шприц пипеткой наносят 3-4 капли реактива и несколько раз продвигают поршнем для того, чтобы смочить внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь. Реактив в шприце оставляют на 0,5-1 минуту, после чего реактив вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый шприц и пропускают его через иглы, выдавливая 3-4 капли на марлевую салфетку.
Оценка результата пробы.
Если появилось бурое окрашивание, это означает наличие ржавчины или остатков хлорсодержащих дезинфицирующих средств. Для дифференциации нужно дополнительно поставить йодокрахмальную пробу.
Если в срок 1 минуты появилось фиолетовое, синее или розовато-сиреновое окрашивание, это означает наличие остатков щелочи от моющего раствора или наличие следов крови. Для дифференциации необходимо дополнительно поставить фенолфталеиновую пробу.
Если окрашивание наступило в срок более 1 минуты, то этот результат не учитывается.
Если цвет реактива не изменился до 1 минуты – проба считается отрицательной.
Азопирамовая проба в 10 раз чувствительнее амидопириновой пробы.
Фенолфталеиновая проба для проверки медицинского инструментария
Фенолфталеин — всем известный кислотно-основный индикатор, с помощью которого можно легко и быстро визуально оценить степень кислотности жидкой среды (кислая, щелочная, нейтральная). В кислой среде раствор окрашивается в оранжевый цвет, в щелочной среде — в оттенки малинового и розового. Кроме этого, реактив долгое время применялся в качестве слабительного в медицинской практике (лекарство «Пурген»). Сейчас используется в исключительных случаях, так как доказаны его канцерогенные свойства.
Кроме аналитической химии индикаторные свойства фенолфталеина востребованы и в других областях. Пропитанная реактивом индикаторная бумага может пригодиться на производствах для обнаружения посторонних веществ в воздухе рабочей зоны; для определения кислотности воды, крема, шампуня и т. п.; почвы в поле, на огороде, в цветочном горшке. Реактив также применяется в медицине для проверки чистоты медицинского инструментария, процедура называется «фенолфталеиновая проба».
Что такое фенолфталеиновая проба и зачем она нужна
Фенолфталеиновая проба — тест, показывающий качество помывки медицинских инструментов, принадлежностей или оборудования. С ее помощью можно определить, полностью ли смыто моющее средство с поверхности. Так как большинство средств, используемых для мытья инструментов, имеет щелочную основу, то фенолфталеиновая проба просто показывает наличие или отсутствие остатков щелочной среды. Если моющее средство не щелочное, то применяют другие тесты.
Использование пробы позволяет обнаруживать даже небольшие остатки моющих средств, показывая, что на исследуемой поверхности обнаружена щелочная среда с уровнем кислотности рН более 7.
Как проводится тестирование
Для того, чтобы проверить качество мытья инструментов или других медицинских принадлежностей, из партии предметов выбирают несколько штук (по согласованным для данного учреждения нормам). Поверхность инструмента протирают ватным тампоном или ватной палочкой, смоченными в растворе фенолфталеина. Если в инструменте есть каналы (у шприцов, например), то раствор пропускают по каналу. Далее в течение полуминуты наблюдают за обработанной поверхностью. Если она окрасилась в розовый цвет, значит инструмент промыт недостаточно тщательно и всю партию отправляют на повторную обработку. После этого тестирование проводят заново. Если поверхность осталась чистой, то партию можно отправлять на стерилизацию. Наблюдение должно ограничиваться 30-ю секундами. Любые результаты через минуту или две значения уже не имеют.
Фенолфталеиновая проба также позволяет получить дополнительную информацию о виде загрязнений. Если поверхность окрасилась в бурый цвет, то это говорит о примесях ржавчины или хлорсодержащих веществ.
Подготовка раствора фенолфталеина
В сухом кристаллическом виде фенолфталеин может храниться неограниченно долго, но для пробы требуется раствор. Он может храниться в холодильнике при t около +4 °С в течение одного месяца, но самые надежные результаты получают из свежеприготовленного раствора. Хранят раствор в темной стеклянной посуде с герметичной пробкой, например, в капельнице. Реактив для проведения пробы готовят в виде спиртового раствора с концентрацией 1%.
Меры предосторожности
Фенолфталеин относится к веществам 2-й категории опасности для человека. Он может вызывать раздражение кожи или слизистых оболочек глаз, поэтому работать с реактивом следует в халате, резиновых перчатках (подходят и смотровые), в защитных очках и маске.
Для чего нужна фенолфталеиновая проба? Азопирамовая проба :: BusinessMan.ru
Определить, насколько качественно были очищены инструменты от моющих средств, помогает фенолфталеиновая проба. Но это не единственный метод диагностики чистоты медицинских инструментов.
Необходимая очистка и проверка ее качества
Все медицинские инструменты должны подвергаться специальной обработке. С них удаляются все механические, жировые и белковые загрязнения. Также на них не должно оставаться следов лекарственных препаратов.
Качество их очистки проверяется с помощью специальных проб. Они позволяют увидеть, как хорошо изделия отмыты от крови и иных биологических жидкостей. Также необходимо контролировать очистку инструментов от щелочных веществ, содержащихся в моющих средствах, от лекарственных препаратов.
После дезинфекции инструментов оценивают качество ее проведения. В централизованном стерилизационном отделении это необходимо делать ежедневно, проверяя 1% от всех инструментов. При этом их должно быть не менее 3-5 единиц каждого вида. Если хоть на одном из приборов будут обнаружены следы некачественной очистки, то на повторную обработку отправляются все инструменты. В медицинских учреждениях делаются азопирамовая и фенолфталеиновая пробы.
Предстерилизационная обработка
Особое внимание в больницах должно уделяться очистке инструмента. Она может проводиться ручным или механизированным способом. В качестве предстерилизационной обработки используют специальный моющий раствор.
Ручная обработка проводится следующим образом.
Ополаскивание инструментов под проточной водой на протяжении 30 сек.
Замачивание в специально подготовленном моющем растворе в течение 15 минут, температура должна быть не менее 50 0С.
Мойка инструментов в растворе с помощью ватно-марлевого тампона или ерша.
Ополаскивание на протяжении 30-60 сек. проточной, а после дистиллированной водой.
Сушка инструментов до полного исчезновения влаги горячим воздухом, его температура должна быть 80-85 0С.
Механизированная очистка проводится в соответствии с инструкцией, которая прилагается к каждому аппарату.
Проведение фенолфталеиновой пробы
Инструменты, прошедшие предстерилизационную обработку, должны выборочно проверяться. Фенолфталеиновая проба позволяет увидеть следы от моющих веществ. Проводится она с помощью спиртового раствора фенолфталеина (1%). Помимо этого, понадобятся пипетка для реактива, лоток с сухими инструментами и ватные тампоны.
Фенолфталеиновая проба проводится следующим образом.
Раствор с помощью пипетки наносится на инструменты, в просветы игл.
Проверяемые изделия держат над чистой ватой и проверяют цвет стекающего реактива.
Результат оценивается на протяжении двух минут. Если цвет реактивов остается неизменным, то проба считается отрицательной.
После завершения пробы (при условии, что она была отрицательной) инструменты ополаскивают.
При положительной реакции цвет реагента меняется с розового на малиновый. Именно такая фенолфталеиновая проба проводится для определения степени очистки всех инструментов от моющего раствора. Таким образом проверяют качество их ополаскивания.
Азопирамовая проба
Есть исследования, которые позволяют комплексно проконтролировать качество очистки инструментов. Например, фенолфталеиновая проба не позволяет увидеть остатки гемоглобина, следы от лекарственных средств и ржавчины.
Для проведения комплексного исследования необходим азопирамовый реактив. Для его приготовления берут 100 мл амидопирина, смешивают его в сухой посуде с 1 мл солянокислого анилина. Полученная смесь заливается 96% спиртом до объема 1л. Помимо этого, подготавливают ватные тампоны, пипетки для раствора азопирама и 3% перекиси водорода. Подготовленная активная смесь должна храниться не более 2 часов.
Для приготовления реагента смешивают 1% спиртовой раствор азопирама и 3% перекиси. Он наносится на инструменты пипеткой. Азопирамовая (как и фенолфталеиновая) проба проводится для проверки полости изделий, резьбы зажимов, мест соприкосновения с биологическими жидкостями организма. Если цвет реактива не меняется, то реакция считается отрицательной. За цветом реагента наблюдают на протяжении минуты.
Окрашивание в сине-фиолетовый цвет говорит о том, что на инструментах осталась кровь. Бурый цвет появляется при контакте с хлорсодержащими окислителями или ржавчиной. О щелочной реакции свидетельствует розовый оттенок.
Азопирамовая проба — техника выполнения по СанПиНу. Тест на остатки крови
Друзья, сделали для вас еще один полезный ролик про азопирамовую пробу. Он без звука, поэтому одинаково важно как посмотреть видео, так и прочитать текст ниже.
Если у вас будут вопросы, обязательно спрашивайте в комментариях.
Что такое азопирамовая проба?
Это способ проверки качества предстерилизационной очистки (ПСО) инструментов. Проще говоря, мы проверяем, не остались ли на инструментах даже после ПСО следы крови и биологических жидкостей.
В случае некачественной очистки инструмента рабочий раствор азопирама станет фиолетовым. Если ПСО проведена хорошо, раствор не поменяет цвет.
Кому это нужно знать?
Косметологам, мастерам маникюра и педикюра и, само собой, работникам медицинских учреждений. Всем, кто при работе с инструментами может повредить кожу клиента.
Как правильно провести пробу?
Шаг 1. Приготовление рабочего раствора.
Есть два варианта.
Первый — приготовление азопирамовой пробы из сухих реагентов.
Для этого нужно смешать все компоненты реактива в следующих пропорциях:
- амидопирин – 100 г;
- солянокислый аналин – 1-1,5 г,
- до необходимого объема (около 1 л) добавить этиловый спирт 95% концентрации.
- полученную жидкость соединить с 3%-м раствором перекиси водорода в одинаковых пропорциях.
Готовая жидкость называется рабочим раствором.
Раствор готовят непосредственно перед проведением пробы и используют в течение двух часов после смешивания компонентов. В противном случае эффективность пробы будет нулевой.
Если реактив хранится в помещении, где температура воздуха выше 25 градусов, он будет розоветь быстрее.
Готовый раствор может пожелтеть, это допустимо, если нет осадка.
Такой вариант приготовления раствора подходит для учреждений, имеющих медицинскую лицензию и осуществляющих медицинскую деятельность.
Согласно СанПиН 2631-10, на предприятиях коммунально-бытового обслуживания запрещено использование спирта, поэтому следует воспользоваться вторым вариантом.
Второй вариант – использование готового «Азопирам-Комплекта».
Такой набор значительно облегчит приготовление азопирамовой пробы. В наборе всего два пузырька с реактивами. Реактив из маленького пузырька нужно перелить в большой пузырек. Получается готовый раствор азопирама.
Шаг 2. Добавление перекиси водорода.
Для проведения азопирамовой пробы потребуется 3%-я перекись водорода.
На чистую салфетку с помощью пипетки наносим три капли готового рабочего раствора азопирамовой пробы и три капли перекиси водорода.
Шаг 3. Проведение пробы.
Протираем салфеткой режущие элементы инструмента или те его части, которые контактируют с биологическими жидкостями или кровью. В видео мы для примера взяли пинцет.
Если инструмент имеет выемки или шероховатости (например, фрезы, а в нашем случае это ложка Уно), средство используется в виде капель. Для этого мы в равных долях смешаем Азопирам с 3%-й перекисью водорода и нанесем пипеткой 2-3 капли на инструмент. Это необходимо для того, чтобы раствор прошел по всем каналам и стыкам деталей инструмента.
После нанесения средства нужно подождать 1 минуту. В течение этого времени раствору дают возможность стечь на чистую белую салфетку (это условие одно из самых важных).
Результаты пробы мы увидим на салфетке спустя минуту. Результат, полученный через более длительное время, диагностического значения не имеет.
Если ПСО проведена некачественно, и на инструментах остались следы крови или биологической жидкости, через минуту на салфетке появится фиолетовое пятно, через несколько секунд оно станет розовато-синим.
Если пятно на салфетке имеет бурый оттенок, значит, на инструментах есть ржавчина или хлорсодержащие окислители. Розовый цвет говорит о наличии моющих средств.
В нашем случае реактив не дал положительных результатов, поэтому считаем, что инструмент прошел ПСО, и повторно ее осуществлять не нужно.
Для оценки качества ПСО берется не менее 1% инструмента, прошедшего одновременную процедуру очистки. В индустрии красоты для более простого подсчета берут не менее трех инструментов из одной партии.
Как проверить пригодность раствора?
При длительном хранении препарата следует проверить его пригодность перед использованием. Перед тем, как делать азопирамовую пробу на поверхности, 2-3 капли раствора наносят на кровяное пятно. Если в течение 60 секунд оно окрашивается в фиолетовый цвет, то реактив пригоден к использованию. Если окрашивания не происходит, то пользоваться таким раствором нельзя.
Несколько важных правил проведения азопирамовой пробы:
- Окрашивание, наступившее позже одной минуты после обработки, не учитывается при анализе результатов;
- Температура инструментов, которые проходят исследование, должна быть комнатной. Не допускается проведение пробы горячих предметов;
- Запрещается держать рабочий раствор (с перекисью водорода) на ярком свету или в комнате с высокой температурой;
- Рабочий раствор «Азопирама» необходимо использовать в течение двух часов, подготовительный раствор допускается хранить при комнатной температуре один месяц, в холодильнике – два месяца.
- Емкость с раствором должна быть герметично закрыта, а стекло — темным.
- После проведения пробы остатки раствора необходимо удалить с инструмента независимо от результата. Для этого предметы нужно сполоснуть водой или протереть тампоном, смоченным водой или спиртом. После этого при необходимости повторяют предстерилизационную обработку или проводят стерилизацию.
- Результаты всех проведенных проб фиксируются в специальном журнале учета качества ПСО. Если исследование показало наличие загрязнений, вся партия инструментов должна пройти повторную обработку.
Приобрести «Азопирам-Комплект», а также журналы контроля качества ПСО можно на нашем сайте.
На видео мы показали, как проводится азопирамовая проба.
Контроль предстерилизационной обработки: амидопириновая, азопирановая пробы
Фенолфталеин в щелочной среде
Азопирановая проба
Проводится на наличие гемоглобина, окислителей, хлорсодержащих средств, стирального порошка, ржавчины.Состав азопирама:
100 мл амидопирина;
1 мл солянокислого анилина
Смешать в сухой посуде и залить 96%. спиртом до 1 литра. Смесь тщательно перемешать палочкой до полного растворения всех ингредиентов.
Хранить в плотно закрытом флаконе при температуре +4 С (в холодильнике) в течение 2 месяцев, при температуре от + 18 С до 4 — 20 ° С в течение 1 месяца.
ВНИМАНИЕ! Умеренное пожелтение реактива в процессе хранения без выпадения осадков не снижает его рабочих качеств.
Непосредственно перед проверкой качества очистки изделий, готовим рабочий раствор.
Смешивают в равных количествах азопирам и 3% раствор перекиси водорода (азопирамовая проба проводится так же, как амидопириновая). Реакция в течение 1 минуты.
При положительной реакции окрашивание:
сине-фиолетовое — наличие крови;
бурое — наличие хлор содержащих окислителей, ржавчина;
розовое — наличие моющего средства.
Температура исследуемого изделия от + 18 ° С до от +25 0 С. Рабочий раствор азопирама с перекисью водорода должен быть использован в течение 2 часов
Амидопириновая проба
Проводится на наличие КРОВИ.Состав смеси:
5% спиртовой раствор амидопирина,
30% раствор уксусной кислоты,
3% раствор перекиси водорода.
Смешать в отдельной емкости в равных количествах все перечисленные ингредиенты.
Нанести смесь на инструмент в места, соприкасающиеся с раневой поверхностью, в места соединения подвижных частей инструмента. Индикация загрязнений, присутствия следов крови происходит немедленно или не позднее, чем через 1 минуту после контакта реактива с загрязненным участком. В данном месте появляется фиолетовое (сине-зеленое) окрашивание.
Окрашивание, наступившее в течение 2 минут не учитывается.
Рабочий раствор готовят непосредственно перед применением.
Внимание! При получении положительной реакции амидопириновой или азопирамовой пробы всю партию изделий медицинского назначения стерилизуют, а инструмент, на котором проводилась, проба промывают под проточной водой и помещают в емкость с моющим раствором для повторной обработки
Фенолфталеиновая проба
Качество отмывания с поверхности инструмента активных веществ моющего средства проверяют реакцией спиртового раствора фенолфталеина. Нанести 2-3 капли раствора на инструмент (на места соприкосновения инструмента с раневой поверхностью и на места соединения подвижных частей инструмента). При появлении розового окрашивания, свидетельствующего о наличие неотмытых веществ, всю партию изделий промывают повторно проточной водой, затем дистиллированной. Инструмент, на котором проводилась проба, промывают проточной водой от реактива и помещают в емкость с моющим раствором для повторной предстерилизационной очистки.При проверке качества очистки игл, реактив набирают в чистый, не имеющий следов коррозии шприц, и, последовательно меняя иглы, пропускают реактив через них, выдавливая 3-4 капли на марлевую салфетку. Затем, для более тщательного контроля, на чистую иглу накручивают маленький кусочек ваты, смоченный реактивом, и протирают наружную часть иглы.
Качество очистки катетеров или других полых изделий оценивают путем введения реактива внутрь изделий с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия в течение 0,5-1 минуты. После этого его сливают на марлевую салфетку. В лечебно-профилактических учреждениях ежедневному контролю подвергают 1-4% предметов медицинского назначения из каждой обработанной партии, но не менее 3-5 единиц. Результаты заносят в журнал.
Стерилизацию предметов медицинского назначения проводят различными методами: паром, сухим горячим воздухом, растворами химических веществ. Выбор того или иного метода стерилизации зависит от особенностей стерилизуемого объекта
Смотрите также
Контроль качества предстерилизационной очистки
Качество предстерилизационной очистки оценивается по отсутствию положительных проб:
На кровь – азопирамовая проба;
На моющие средства – фенолфталеиновая проба;
На масляные препараты – проба с суданом. Эта проба ставится только на изделия, испачканные масляными препаратами.
Мед. сестра самоконтроль осуществляет после каждой обработанной партии, старшая мед. сестра – один раз в неделю, ЦГСЭН – один раз в месяц в отделениях хирургического профиля и один раз в квартал – в отделениях терапевтического профиля.
Условия проведения контроля
Контролю подлежит 1% от обработанной партии, но не менее 3-5 штук.
Инструмент должен быть холодным и сухим.
При несоблюдении этих условий может быть ложноположительная реакция.
Азопирамовая проба
Маточным раствором является азопирам, который в холодильнике хранится 2 месяца, вне холодильника – 1 месяц с момента изготовления азопирама.
Рабочий раствор азопирама готовится из равных объемов азопирама и 3% раствора перекиси водорода перед применением.
Срок годности рабочего раствора азопирама 40 мин.
Рабочий раствор азопирама проверяется на пригодность не реже одного раза в неделю: на предметное стекло с мазком крови капается 2-3 капли рабочего раствора азопирама, если в течение одной минуты появилось сине-фиолетовое окрашивание, раствор годен к применению.
Техника проведения пробы
Лоток выстилается белой салфеткой, на которую кладется 3-5 шт. инструментов. Инструменты должны быть разной конструкции. Раствор капается на рабочие поверхности, трудно отмываемые части инструмента.
В инструменты, имеющие полости или каналы, раствор набирается, а на плоские – капается из пипетки 2-3 капли раствора и сразу засекается время.
Если в течение одной минуты появилось сине-фиолетовое окрашивание 0 реакция на кровь положительная; бурое – на хлор и ржавчину, розовое – на моющие средства.
Результаты азопирамовой пробы заносятся в журнал.
Журнал учета качества предстерилизационной обработки
Начат «___»___20__г. Окончен «__»____20__г.
Результаты выборочного химического контроля
обработанных изделий
Дата | Способ обработки | Применяемое средство | Наименование изделий | Количество штук | Из них загрязненных | Фамилия лица, проводившего контроль | ||
Кровью | Моющими средствами | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
В случае положительной пробы на кровь, моющие средства, всю группу контролируемых изделий, из которой отбирали контроль, подвергаются очистке.
Фенолфталеиновая проба
Рабочий раствор – 1% спиртовой раствор фенолфталеина. В холодильнике хранится один месяц, вне холодильника – 15 дней.
Техника постановки пробы как и азопирамовая.
Если появилось в течение одной минуты розовое окрашивание, реакция на моющие средства положительная.
Проба суданом-3
Проба ставится только на инструменты, испачканные масляными препаратами.
Рабочий раствор – судан-3. В холодильнике хранится 6 мес., вне холодильника – 3 мес.
Техника постановки пробы.
Инструмент протирается салфеткой, смоченной суданом-3, через 10 сек. Инструмент ополаскивается проточной водой, обильной струей. Если на инструменте появились желтые пятна или подтеки, реакция на масляные препараты положительная. При отрицательных пробах растворы не меняют свою окраску.
При положительных пробах вся партия инструментов проходит повторную обработку.
Инструменты, использованные для контроля, при положительных и отрицательных пробах подвергаются повторной обработке.
Фенолфталеиновый тест — Большая химическая энциклопедия
Конечный остаток маточного раствора представляет собой масло, которое не затвердевает в замораживающей смеси и представляет собой смесь п- и в-толилкарбинолов. Только следы фталевой кислоты (фенолфталеиновый тест) были получены путем окисления этого масла перманганатом, часть его, которая была более легко растворима в воде, давала фенилуретан, который понижал точку плавления фенилуретана либо /> — толилкарбинола, либо бензилового спирта.[Стр.80]Тест карбонат-фенолфталеин натрия Этот тест зависит от того факта, что фенолфталеин становится розовым из-за растворимого карбоната и бесцветным из-за растворимых бикарбонатов. Следовательно, если углекислый газ, выделяемый разбавленными кислотами из карбонатов, вступает в контакт с раствором фенолфталеина, окрашенным в розовый цвет раствором карбоната натрия, это может быть идентифицировано по происходящему обесцвечиванию … [Стр.300]
Результаты фенолфталеиновый тест показывает, что pH падает до 8.5 или ниже в карбонизированной зоне, но более подробных исследований состава порового раствора не сообщалось. Андраде ct al. (A33) пришел к выводу, что такое низкое значение, как 8,5, можно объяснить только в том случае, если щелочные катионы были удалены из раствора путем выщелачивания или поглощения водным диоксидом кремния … [Pg.385]
Удалите мыло из химического стакана. Добавьте к нему каплю раствора фенолфталеина. Таким же образом проверьте чистое туалетное мыло. (1) Объясните причину наблюдаемого различия.(2) Напишите уравнение реакции, связанной с получением мыла из жира, содержащего глицериновый эфир стеариновой кислоты. [Стр.200]
Почему все это вызывает беспокойство? Потому что едкий гидроксид натрия (щелок) может образовываться как побочный продукт химической реакции, при которой надувается воздушный мешок, и официальные лица на месте происшествия думали, что выпущенный белый порошок был гидроксидом натрия. На самом деле это был порошок талтана, который производители подушек безопасности используют в качестве смазки. Исследователи могли бы определить, что гидроксида натрия не было на месте аварии, если бы они провели простой тест на фенолфталеин.[Стр.50]
Тест Кастла Мейера (фенолфталеиновый тест) Предполагаемый тест, используемый для определения крови. Фенолфталеин и перекись водорода используются, реакция с гемоглобином в крови дает розовый цвет. [Pg.446]
Области, где карбонизация проникла в пределах 5 мм от арматуры. Глубину карбонизации можно определить путем тестирования бетона фенолфталеином, который становится розовым в щелочной среде и остается бесцветным в карбонизированной среде. Глубина карбонизации также может быть определена как Глубина карбонатов = (возраст в годах) при относительной влажности 50% и (возраст в годах) при относительной влажности около 90%.Поверхность для испытания должна представлять собой поверхность излома, а не просверливаться (поскольку шлифование делает недействительным фенолфталеиновый тест). [Pg.631]
Реакция фталеина. Аккуратно смешайте в сухой пробирке несколько кристаллов фталевой кислоты или фталата и равное количество ph tol, смоченных 2 каплями конуса. h3SO4. Охлаждают, растворяют в воде и добавляют избыток раствора NaOH, образуется ярко-красный цвет фенолфталеина в щелочном растворе. [Стр.353]
Реакция Соренсена. Сначала внимательно прочтите «Оценка глицина», стр.463. Растворить 0 2 г. глицина в нескольких мл. воды в пробирке A, добавьте 2 капли фенолфталеина, а затем очень разбавленный раствор NaOH по каплям, пока раствор не станет розовым. Во вторую пробирку B поместите 2 мл. 40% раствора формалина добавить 2 капли раствора фенолфталеина и затем разбавить. Раствора NaOH, пока раствор не станет розовым. Вылейте содержимое B в A и обратите внимание на немедленное обесцвечивание фенолфталеина, теперь раствор становится кислым. Обратите также внимание на то, что несколько капель дил.Теперь можно добавить раствор NaOH до восстановления розового цвета. [Pg.381]
Тирозин и цистин нерастворимы в воде, поэтому поместите около 0,2 г. в пробирке А растворить в дил. Раствор NaOH, добавьте фенолфталеин, как и раньше, а затем добавьте дил. HCl до тех пор, пока не перестанет выделяться розовый цвет, затем действуйте, как указано выше. [Стр.381]
Остаток в колбе подкисляют двукратной серной кислотой и отгоняют 10-15 мл. решения. Проверьте небольшую порцию дистиллята на кислотность, а также обратите внимание на запах.Нейтрализовать основную часть раствором гидроксида натрия (добавить каплю фенолфталеина, чтобы действовать как индикатор), выпарить до небольшого объема и превратить натриевую соль в п-бромфенациловый эфир или в какое-либо другое подходящее производное (Раздел 111,85), определить mp производной. [Стр.390]
Раствор сульфита натрия также может быть приготовлен путем растворения 100 г. чистого (или соответствующего количества коммерческого) гидроксида натрия примерно в 125 мл. воды, а затем разбавив до 750 мл.Колбу охлаждают в проточной воде, добавляют несколько капель индикатора фенолфталеина и пропускают диоксид серы до тех пор, пока розовый цвет не исчезнет (рекомендуется добавить еще 1-2 капли индикатора в этот момент), а затем На 2-3 минуты дольше. Лучше всего время от времени извлекать образец для анализа, разбавлять его 3-4 объемами воды и тестировать 1 каплей фенолфталеина. [Pg.637]
Обнаружение небольшого, даже невидимого количества крови является обычным делом. Однако физические характеристики засохших пятен дают минимальную информацию, поскольку засохшая кровь может приобретать разные оттенки.Многие химические тесты на наличие крови полагаются на каталитическую пероксидазную активность гема (56,57). Незначительные количества крови катализируют реакции окисления бесцветных материалов, например фенолфталеина, люминола и т. Д., В цветные или люминесцентные. Окислителем обычно является перекись водорода или перборат натрия (см. Автоматизированные приборы, гематология). [Pg.487]
Большинство результатов анализа воды довольно легко интерпретировать. Однако два простых и полезных теста нуждаются в пояснении.Это щелочность P и M. Воду титруют N / 30 HCl до конечной точки фенолфталеина при pH 8,3. Это называется щелочностью P. Подобное титрование до конечной точки метилового оранжевого при pH 4,3 называется щелочностью М. Они указаны в ppm CaCO. [Стр.145]
Щелочность и содержание извести. Щелочность — это способность раствора или смеси реагировать с кислотой. Щелочность фенолфталеина относится к количеству кислоты, необходимому для снижения pH до 8,3, конечной точки фенолфталеина.Фенолфталеиновая щелочность бурового раствора и фильтрата бурового раствора называется соответственно и Рр. P-тест включает действие только растворенных оснований и солей, тогда как P-тест включает действие как растворенных, так и взвешенных оснований и солей. Щелочность метилового оранжевого относится к количеству кислоты, необходимому для снижения pH до 4,3, конечной точки метилового оранжевого. Щелочность метилового оранжевого бурового раствора и фильтрата бурового раствора называется соответственно. Диагностические тесты API включают определение P, Pp и Mp. Все значения указаны в кубических сантиметрах от 0.02 N (нормальность = 0,02) серной кислоты на кубический сантиметр образца. [Pg.656]
Другой рецепт универсального индикатора: 0,05 г метилового оранжевого, 0,15 г метилового красного, 0,3 г бромтимолового синего и 0,35 г фенолфталеина в 1 л 66-процентного этанола. Изменения цвета: pH до 3, красный pH 4, оранжево-красный pH 5, оранжевый pH 6, желтый pH 7, желтовато-зеленый pH 8, зеленовато-синий pH 9, синий pH 10, фиолетовый pH 11, красновато-фиолетовый. . Несколько универсальных индикаторов доступны в продаже в виде растворов и тестовых листов.[Стр.269]
Бензойная кислота плохо растворяется в воде (что является недостатком), поэтому ее необходимо растворять в 95-процентном этаноле. Режим использования аналогичен уже описанному для гидрофталата калия (Раздел 10.27, Процедура B). Для 0,1 М раствора, например, гидроксида натрия, точно отвешивают порции кислоты 0,4 г в коническую колбу на 250 мл, добавляют 10-20 мл этанола, встряхивают до растворения, а затем титруют раствор сильной щелочью. с использованием фенолфталеина в качестве индикатора.Холостой тест должен быть проведен с тем же объемом этанола, и индикатор вычитает, если необходимо, объем раствора щелочи, израсходованный в холостом тесте. [Стр.294]
ПРИМЕЧАНИЕ Кислотные фосфаты и SHMP могут разрушать химические резервуары и связанное с ними оборудование, поэтому следует указать кислотостойкое оборудование. В качестве альтернативы, добавление каустика до уровня pH от 8,2 до 8,3 (получение розового цвета при тестировании с фенолфталеином) обеспечивает адекватную защиту. Другой альтернативой является добавление в резервуар нейтрализующего амина.[Pg.420]
Щелочность измеряется кислотно-основным титрованием с использованием метилоранжа или фенолфталеина в качестве индикатора. Фенолфталеин меняет цвет при pH 8,3, тогда как метилоранж меняет цвет при pH 4,3. При pH 8 нейтрализация сильных щелочных ингредиентов, таких как NaOH, практически завершена. Дальнейшее снижение pH до 4 также позволит измерить карбонаты и бикарбонаты. Колориметрические тесты и системы стеклянных электродов используются для определения pH. [Стр.33]
Добавьте 2 капли раствора фенолфталеина к каждому раствору в каждой пронумерованной пробирке.[Стр.146]
Поместите по 2 капли фенолфталеина в пробирку и химический стакан. [Стр.154]
Даже полиция использует кислоты и щелочи для поимки преступников. Например, судмедэксперты могут сравнить pH почвы, обнаруженный на месте преступления, со следовыми количествами почвы, обнаруженными на протекторе шины или подошве обуви. Они также используют смесь перекиси водорода и фенолфталеина, называемую раствором Кастле-Мейера, для анализа крови. Раствор Кастле-Мейера используется на месте преступления, когда специалисты на месте преступления находят пятна, которые, как они подозревают, могут быть засохшей кровью.В присутствии крови раствор становится ярко-розовым. Если пятна оказались чем-то другим, например, соусом из сушеных помидоров или красновато-коричневой краской, раствор Кастле-Мейера остается бесцветным. [Стр.67]
.
Фенолфталеиновый тест Википедия
Анализ крови с использованием фенолфталеина
Тест Кастла-Мейера — это предполагаемый анализ крови, впервые описанный в 1903 г., [1] , в котором химический индикатор фенолфталеин используется для определения возможного присутствия гемоглобина. Он основан на пероксидазоподобной активности гемоглобина в крови, чтобы катализировать окисление фенолфталина (бесцветная восстановленная форма фенолфталеина) до фенолфталеина, который виден как ярко-розовый цвет.Тест Кастла-Мейера — это разновидность каталитического анализа крови, одного из двух основных классов судебно-медицинских тестов, обычно используемых криминалистическими лабораториями для химической идентификации крови. Другой класс тестов, используемых для этой цели, — это тесты на микрокристаллы, такие как кристаллический тест Тейхмана и кристаллический тест Такаяма. [2]
Этот тест был назван в честь американского химика-агрохимика Джозефа Хоинга Кастла (1864–1916), который в 1901 году изобрел и проверил анализ сырой крови, и немецкого врача и химика Эриха Мейера (1874–1874). 1927), который модифицировал тест в 1903 году. [3]
Метод []
Предполагаемый образец крови сначала берется тампоном. К образцу добавляется капля реагента фенолфталеина, а через несколько секунд на тампон наносится капля перекиси водорода. Если мазок быстро становится розовым, считается, что анализ крови предположительно положительный. Выдержка более 30 секунд приведет к тому, что большинство тампонов станут розовыми естественным образом, поскольку они окисляются сами по себе на воздухе. [необходима ссылка ]
Необязательно, мазок можно сначала обработать каплей этанола, чтобы лизировать присутствующие клетки и повысить чувствительность и специфичность.Этот тест не разрушает образец, который может храниться и использоваться в дальнейших тестах в лаборатории; однако немногие лаборатории будут использовать тампон, использованный для теста Кастла – Мейера, в любых дальнейших исследованиях, предпочитая вместо этого использовать свежий тампон от исходного красителя. [ необходима ссылка ]
Ограничения []
Несмотря на то, что тест Кастла-Мейера может определять разведения крови до 1:10 7 , у этого теста есть ряд важных ограничений.Химические окислители, такие как соли меди и никеля, заставят реагент Кастла – Мейера стать розовым перед добавлением перекиси водорода, поэтому жизненно важно сначала добавить реагент, затем подождать несколько секунд, а затем добавить перекись водорода.
Тест Кастла – Мейера имеет такую же реакцию с человеческой кровью, как и с любой другой кровью на основе гемоглобина, поэтому необходимо провести подтверждающий тест, такой как тест Оухтерлони, чтобы окончательно определить, от какого вида кровь произошла.
Цветные каталитические тесты очень чувствительны, но не специфичны. Сам по себе положительный цветовой тест не следует интерпретировать как положительный результат анализа крови. Отрицательный результат обычно является доказательством отсутствия детектируемого количества гема, однако ложноотрицательный результат может быть получен в присутствии восстанавливающего агента. Тест не может дать конкретных доказательств того, что находится в крови.
Механизм []
Фенолфталеин, используемый в этом тесте, был модифицирован по сравнению с его обычной формой, так как он был восстановлен на два электрона и предварительно растворен в щелочном растворе.Обычно это достигается путем кипячения щелочного раствора фенолфталеина с порошкообразным цинком, который восстанавливает фенолфталеин до фенолфталина. При восстановлении очень интенсивный розовый цвет катионной формы фенолфталеина бледнеет до слабого желтого цвета. Именно эта форма фенолфталеина присутствует в тест-наборах Kastle – Meyer. Чтобы получить интенсивный розовый цвет, указывающий на положительный результат теста, восстановленный фенолфталеин должен быть окислен до его нормальной окрашенной формы.
В соответствующей реакции перекись водорода вступает в реакцию с гемоглобином в крови.Фенолфталин не принимает непосредственного участия в этом процессе; вместо этого он действует как внешний источник электронов. В реакции с перекисью водорода гемовый центр гемоглобина ведет себя как пероксидаза, восстанавливая перекись до воды. Эта активность истощает гемоглобин электронами, которые, в свою очередь, повторно поставляются фенолфталином. Передача электронов гемоглобину превращает фенолфталин обратно в ярко окрашенный фенолфталеин. Пока фермент выживает, реакция гема с перекисью носит каталитический характер, что делает этот тест очень чувствительным к небольшому количеству крови, присутствующей на тампоне.Катализируемое гемоглобином восстановление пероксида, которое происходит, показано в реакции ниже. Два электрона поставляются фенолфталином:
- HOOH + 2 e — + 2 H + → 2 H 2 O
Расход протонов в ходе реакции приводит к повышению pH раствора, но количество количество полученного основания незначительно по сравнению с количеством основания, уже присутствующего в смеси реагентов.
Список литературы []
- ^ История теста Кастла – Мейера: В 1901 году Джозеф Хоинг Кастл и Оливер Марч Шедд в США.С. обнаружил, что биологический материал может вызывать окисление фенолфталеина до фенолфталеина в слабощелочных растворах. [См .: Джозеф Х. Кастл и Оливер Марч Шедд (1901) «Фенолфталин как реагент для окисляющих ферментов», American Chemical Journal , 26 (6): 526–539.] В 1903 году Эрих Мейер в Германии обнаружили, что клетки крови также могут вызвать реакцию. [См .: Эрих Мейер (1903) «Beiträge zur Leukocytenfrage. Fermente der Leukocyten» [Вклады по вопросу о лейкоцитах.Ферменты лейкоцитов], Münchener Medizinische Wochenschrift , 50 (35): 1489–1493; см. особенно стр. 1492-1493.] В 1906 году Кастл и Амосс обнаружили, что гемоглобин в крови запускает реакцию. [См .: Джозеф Х. Кастл и Гарольд Линдсей Амосс, « вариаций пероксидазной активности крови при здоровье и болезни». США. Бюллетень гигиенической лаборатории № 31. (Вашингтон, округ Колумбия: Служба общественного здравоохранения и морских больниц США, Типография правительства США, 1906).] В 1909 году Кастл обнаружил, что тест чувствителен к очень разбавленным образцам крови. [См .: Джозеф Х. Кастл, Химические тесты крови. Бюллетень гигиенической лаборатории США № 51. (Вашингтон, округ Колумбия: Служба общественного здравоохранения и морской больницы США, Типография правительства США, 1909).] Однако в 1908 году Поцци-Эскот (который к тому времени уже жил в Лиме, Перу) обнаружил, что тест вызывал ложноположительные реакции на ряд веществ, помимо крови. [См .: Мариус Эммануэль Поцци-Эско (1908), «Emploi de la phénolphtalinecom réactif du sang [Использование фенолфталина в качестве реагента для крови]», Бюллетень Sociétés Chimiques Belges , 22 (11): 415–416 . Мейерс, Томас К. (2006). «Глава 21: Серология». In Wecht, Cyril H .; Раго, Джон Т. (ред.). Судебная медицина и право: применение расследований в уголовном, гражданском и семейном правосудии . Бока-Ратон, Флорида: CRC Press. С. 410–412. ISBN 0-8493-1970-6 .
Другие источники []
- Каллифорд, Брайан Дж., Исследование и типирование пятен крови в криминалистической лаборатории, Вашингтон, округ Колумбия: Типография правительства США, 1971.
- Gaensslen, Robert E., Sourcebook in Forensic Serology, Immunology and Biochemistry, Вашингтон, округ Колумбия: Типография правительства США, 1983.
- Кирк, Пол Л., Crime Investigation, John Wiley and Son, 1974.
- Лаборатория судебной экспертизы столичной полиции, Руководство по биологическим методам, 1978.
- Понсе, Ана Кастельо; Паскуаль, Фернандо А. Верду, «Критический пересмотр предварительных тестов на наличие пятен крови», Forensic Science Communications, vol.1, № 2, июль 1999 г., страницы 1–15.
- Saferstein, Richard, Forensic Science Handbook, Prentice Hall, Inc., 1982.
фенолфталеин тест
Фенолфталеин — название ИЮПАК 3,3 бис (4 гидроксифенил) изобензофуран 1 (3H) один… Википедия
Фенолфталеин — Strukturformel Allgemeines Имя Фенолфталеин Андере Имя… Deutsch Wikipedia
Тест Кастла-Мейера — Тест Кастла-Мейера — это предварительный судебно-медицинский анализ крови, впервые описанный в 1903 году, в котором используется химический индикатор фенолфталеин. Он полагается на пероксидазную активность гемоглобина в крови, чтобы катализировать окисление…… Wikipedia
Тест Кастле-Мейера — тест Кастле-Мейера Тест Кастл-Мейера (тест КМ) ist ein forensischer Vortest zur Indikation von mutmaßlichen Blutspuren.Das Nachweisreagenz ist Phenolphthalin, wobei es sich um reduziertes Phenolphthalein handelt… Deutsch Wikipedia
Тест с арилсульфатазой — (для дифференциации видов быстрорастущих микобактерий) образец культуры подозреваемого микроорганизма в бульоне с твин-альбумином инкубируют с трикалиевым фенолфталеин дисульфатом в течение трех дней, а затем подщелачивают. Эти виды…… Медицинский словарь
Фенол красный — Chembox new Name = Фенол красный ImageFile = Фенол красный цвиттерионная форма 2D скелет.png ImageName = Фенол красный ImageFile1 = Фенол красный цвиттерионная форма 3D шары.png ImageName1 = Фенол красный Section1 = Идентификаторы Chembox CASNo = 143 74 8 УЛЫБКИ =…… Wikipedia
pH-индикатор — Кислоты и основания Константа диссоциации кислоты Кислотно-основная экстракция Кислотно-основная реакция Кислотно-основное титрование Константа диссоциации Функция кислотности Буферный раствор… Wikipedia
Blutspur — Eine Blutspur ist eine kleinere oder größere Menge von Blut, die auf eine Verletzung, die zu einem Blutverlust führte, hindeutet.Schon seit alter Zeit werden Blutspuren benutzt, um daraus bestimmte Sachverhalte zu folgern. Inhaltsverzeichnis 1…… Deutsch Wikipedia
Регулирование и фальсификация оливкового масла — Здание Международного совета по оливкам Международный совет по оливкам (МОК) — это межправительственная организация, базирующаяся в Мадриде, Испания, в которую входят 23 государства-члена. Он продвигает оливковое масло во всем мире, отслеживая производство, определяя качество…… Wikipedia
Фенотипическое тестирование микобактерий — Для идентификации и отличия штаммов и видов микобактерий друг от друга можно использовать различные фенотипические тесты.Наиболее часто используемые тесты описаны ниже: Ацетамид, использование в качестве источника чистого углерода и азота Среда: Kh3PO4 (0,5 г), MgSO4 * 7h30… Wikipedia
Биуретовый тест — принцип, требования, реагенты, подготовка, процедура и результат
20 апреля 2018 Гаураб Карки Пробы белков и аминокислот, Тесты 0

Принцип биуретового теста:
- Биуретовый тест — это общий тест для соединений, имеющих пептидную связь. Биурет представляет собой соединение, образующееся при нагревании мочевины до 180 ° C. Когда биурет обрабатывают разбавленным сульфатом меди в щелочных условиях, образуется соединение пурпурного цвета. На этом основан биуретовый тест, широко используемый для идентификации белков и аминокислот.
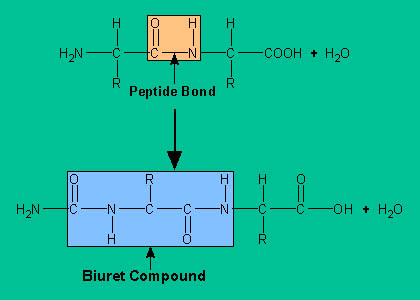
- Этот тест проводится с соединениями, содержащими две или более пептидных связей (группа CO-NH). Поскольку все белки и пептиды, обладающие как минимум двумя пептидными связями, т.е. трипептид дает положительный биуретовый тест.
- Принцип биуретового теста удобно использовать для определения присутствия белков в биологических жидкостях.
- Щелочной CuSO4 реагирует с соединениями, содержащими две или более пептидных связей, давая продукт фиолетового цвета, что связано с образованием координационного комплекса ионов меди с неразделенными электронными парами пептидного азота и O2 воды.

Требования к биуретовому тесту:
- 1% аланин, 5% яичный белок (альбумин)
- Реагент биурета
- Водяная баня
- Пробирки сухие
- Пипетки
Реагенты биурета:
- Сульфат меди (CuSO40
- Гидроксид натрия (NaOH)
- Тартарат натрия и калия (широко известный как соль Рошеля)
Препарат Биуретовый реагент
- Биуретовый реагент готовится путем добавления NaOH в раствор CuSO4, что делает его щелочным.
- Для приготовления 1000 мл биурета
- Возьмите 1,5 г сульфата пятивалентной меди (CuSO4) и 6 г тартрата натрия-калия и растворите их в 500 мл дистиллированной воды.
- ** Тартарат натрия-калия является хелатирующим агентом и стабилизирует ион меди.
- Взять 375 мл 2-молярного гидроксида натрия
- Смешайте оба раствора в мерной колбе и доведите конечный объем до 1000 мл, добавив дистиллированную воду.
Методика биуретового теста
- Взять 1 мл тестовых растворов в сухие пробирки, а в другую пробирку взять 1 мл дистиллированной воды в качестве контроля.
- Добавить во все пробирки по 1 мл биурета, хорошо перемешать.
- Ищем развитие синего цвета
Результат:

Положительный результат теста на биурет:
- цвет меняется на фиолетовый
- все пептиды и белок дают положительный результат анализа
- Гистидин — единственная аминокислота, дающая положительный результат биуретового теста.
Отрицательный результат теста на биурет:
Меры предосторожности:
- Наличие ионов магния и аммония мешает биуретовому тесту.Этого можно избежать, используя избыток щелочи.