Термическая стерилизация в аптечном производстве
Курсовая работа по фармацевтической технологии
на тему: «Термическая стерилизация в аптечном производстве»
Содержание
I. Введение
II. Обзор литературы
1.Способы и объекты стерилизации в аптеке.
2.Режимы стерилизации.
3. Оборудование для стерилизации.
4. Контроль качества стерилизации.
III. Экспериментальная часть
(На основе данных ГАУЗ «ОАС» города Оренбурга)
1. Методы, объекты и аппаратура
термической стерилизации в
2. Соответствие организации и
состояния термической
3. Контроль качества термической стерилизации в аптеке.
4. Рекомендации по
в аптеке.
IV. Выводы и предложения.
V. Литература.
I. Введение
Организм человека в процессе эволюции
приспособился к защите от окружающей
его микрофлоры. Наиболее важные органы
и биологические жидкости организма (кровь,
спинномозговая жидкость, мозг, сердце
и др.) стерильны. Дыхательные пути, желудочно-кишечный
тракт, слизистые, кожа, естественные отверстия
обеспечены разнообразными системами,
удаляющими микрофлору, не позволяющими
ей развиваться или даже вызывающими ее
гибель. В частности, при непрерывно протекающем
шелушении кожи с ее поверхности вместе
с эпидермисом удаляется микрофлора. Эпителий
и слизь дыхательных путей задерживают
проникновение микроорганизмов в альвеолы.
Кислая среда желудка обусловливает гибель
патогенной микрофлоры. Слезная жидкость,
содержащая лизоцим и орошающая слизистую
глаза, лизирует микроорганизмы.
В частности, при непрерывно протекающем
шелушении кожи с ее поверхности вместе
с эпидермисом удаляется микрофлора. Эпителий
и слизь дыхательных путей задерживают
проникновение микроорганизмов в альвеолы.
Кислая среда желудка обусловливает гибель
патогенной микрофлоры. Слезная жидкость,
содержащая лизоцим и орошающая слизистую
глаза, лизирует микроорганизмы.
Следует отметить, что все указанные механизмы защиты человека от проникновения и развития микрофлоры появляются в нем не сразу. В неонатальный период (до 2-3 недель со дня рождения) и в грудной период (до 12 месяцев) ребенок еще в значительной степени беззащитен от вредного воздействия многих внешних факторов, том числе от микрофлоры. Детский организм постепенно приспосабливается к новым для него условиям внеутробной жизни и требует тщательного гигиенического ухода, защиты от микроорганизмов, в том числе при использовании различных лекарств.
Организм больного человека может быть
резко ослаблен и в значительной степени
лишен присущих ему защитным механизмов,
в частности, при ряде глазных заболеваний,
ахилии желудка и других патологиях.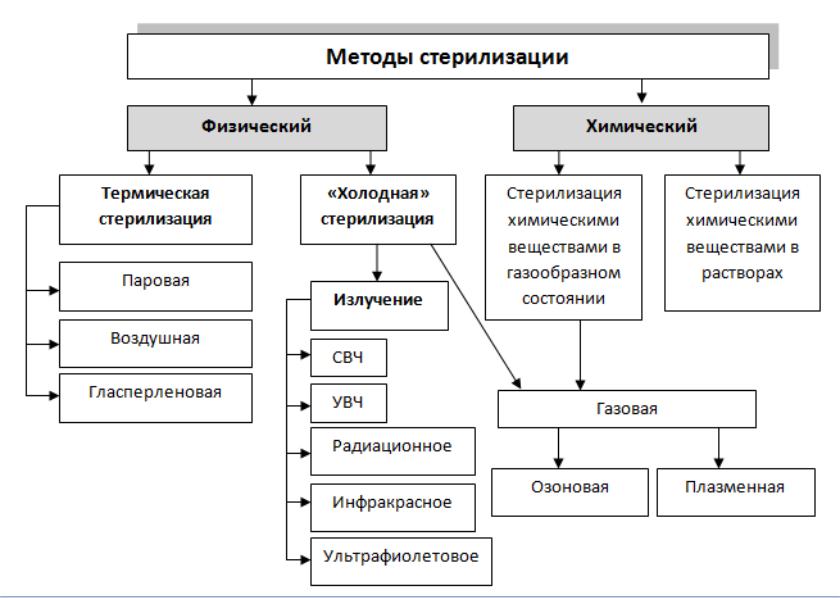
С другой стороны, человек подвергается опасности инфицирования при введении лекарств с нарушением защитных барьеров – прежде всего, при инъекциях, в особенности – при введении растворов в кровяное русло,
стерильные полости, а также лечении ранений, травм, обморожений и ожогов.
В указанных случаях использование загрязненной микрофлорой лекарств может привести к инфицированию больных, тяжелым заболеваниям или даже к смерти. Описаны случаи потери зрения в результате применения лекарства, загрязненного Ps. aeruginosa, гибели сотен людей при использовании нестерильных инъекционных лекарств; заболеваний сальмонеллезом при приеме таблеток из экстракта щитовидной железы; тяжелых поражений кожи и слизистых при использовании мазей, обсемененных стафилококками, стрептококками и грибками.
Вторым аспектом опасности микробного
загрязнения лекарств является воздействие
микрофлоры на ингредиенты лекарства,
разложение микроорганизмами действующих
и вспомогательных веществ.
Таким образом, микробная загрязненность лекарств несет в себе опасность, как инфицирования больных, так и порчи лекарств с появлением нежелательных или даже токсичных свойств у последних.
И следовательно очень важно знать, что
в производстве стерильной продукции
(инъекционные растворы, глазные лекарственные
формы, лекарственные формы с антибиотиками,
лекарственные формы для детей, вода для
инъекций) одну из ведущих ролей играет
стерилизация препаратов. Она необходима
для возможности парентерального введения
лекарственных препаратов, применения
на слизистую оболочку глаза и др. ввиду
того, что с ее помощью достигается полная
стерильность, и риск развития неблагоприятных
реакций снижается в разы.
II. Обзор литературы
1. Способы и объекты
Стерилизация – полное уничтожение в том, или ином объекте живых микроорганизмов и их спор. Стерилизация имеет большое значение при изготовлении всех лекарственных форм и особенно инъекционных. В данном случае следует стерилизовать посуду, вспомогательный материал, растворитель и готовый раствор. Таким образом, работа по изготовлению растворов для инъекций должна начинаться со стерилизации и стерилизацией заканчиваться.
ГФXI определяет стерилизацию как процесс умерщвления в объекте или удаление из него микроорганизмов всех видов, находящихся на всех стадиях развития.
Сложность процесса стерилизации заключается,
с одной стороны, в высокой жизнестойкости
и большом разнообразии микроорганизмов,
с другой стороны – термолабильностью
многих лекарственных веществ и лекарственных
форм или невозможностью по ряду причин
использовать другие методы стерилизации.
Методы стерилизации должны быть удобны для использования в аптеки, особенно в аптеках ЛПУ, в рецептуре которых инъекционные растворы составляют до 60-80%.
Все работы по стерилизации изделий проводятся в асептических условиях в специальных помещениях, подготавливаемых как операционный блок (квар-цевание, генеральная уборка). Персонал использует стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3 сменах стерильной воды, по 5 минут в каждой.
В технологии лекарственных форм используют разные методы стерилизации: термические методы, стерилизация фильтрованием, радиационная стерилизация, химическая стерилизация.
Термическая стерилизация
К термическим методам стерилизации относят стерилизацию паром под давлением и воздушную стерилизацию, стерилизация текучим паром исключена из ГФXI.
-Воздушная стерилизация
Этот метод стерилизации осуществляется
горячим воздухом в воздушном стерилизаторе
(сухожаровом шкафу) при температуре 160-200ºС
.
Эффективность воздушной стерилизации зависит от температуры и времени. Равномерность прогрева объектов зависит от степени теплопроводности и правильности расположения внутри стерилизационной камеры для обеспечения свободной циркуляции горячего воздуха. Стерилизуемые объекты должны быть расфасованы в соответствующую тару или укупорены и свободно размещены в стерилизаторе. В связи с тем, что воздух обладает не высокой теплопроводностью, прогрев стерилизуемых объектов происходит довольно медленно, поэтому загрузка должна производится в не нагретые стерилизаторы или когда температура внутри них не превышает 60ºС. Время, рекомендуемое для стерилизации, должно отсчитываться с момента нагрева в стерилизаторе до температуры 180-200°С
Таблица. Режимы и контроль стерилизации сухим горячим воздухом
Воздушным методом стерилизуют медицинские
изделия, детали приборов и аппаратов
из коррозионностойких металлов, стекла
с пометкой 200°С, изделия из силиконовой
резины. Перед стерилизацией воздушным
методом изделия подвергаются предстерилизационной
очистке и обязательно высушиваются в
сушильном шкафу при температуре 85°С до
исчезновения видимой влаги. Полный цикл
составляет до 150 минут. Преимущество стерилизации
горячим воздухом по сравнению с паровым
методом состоит в низкой себестоимости
оборудования. Недостатками являются:
длинный полный цикл стерилизации (не
менее 30 мин), опасность повреждения инструментов
высокими температурами, невозможность
стерилизации тканей и пластмасс, только
один контрольный параметр — температура,
высокие энергозатраты.
Перед стерилизацией воздушным
методом изделия подвергаются предстерилизационной
очистке и обязательно высушиваются в
сушильном шкафу при температуре 85°С до
исчезновения видимой влаги. Полный цикл
составляет до 150 минут. Преимущество стерилизации
горячим воздухом по сравнению с паровым
методом состоит в низкой себестоимости
оборудования. Недостатками являются:
длинный полный цикл стерилизации (не
менее 30 мин), опасность повреждения инструментов
высокими температурами, невозможность
стерилизации тканей и пластмасс, только
один контрольный параметр — температура,
высокие энергозатраты.
Воздушный метод стерилизации используется для стерилизации термостойких лекарственных веществ, масел, жиров, ланолина, вазелина, воска, а также изделий из стекла, металла, силиконовой резина, фарфора, установки для стерилизации фильтрованием с фильтрами, мелкие стеклянные и металлические предметы.
Для стерилизации растворов этот метод не используют.
— Паровая стерилизация
Паровым методом стерилизуют
медицинские изделия, детали приборов
и аппаратов из коррозионностойких металлов,
стекла, хирургическое белье, перевязочный
и шовный материал, изделия из резины (катетеры,
зонды, трубки), из латекса, пластмасс. При паровом методе стерилизующим средством
является водяной насыщенный пар под избыточным
давлением 0,05 МПа (0,5 кгс/см2) — 0,21 МПа (2,1
кгс/см2) (1,1-2,0 бар) температурой 110-134°С.
Процесс стерилизации происходит в стерилизаторах
(автоклавах). Полный цикл составляет от
5 до 180 минут (табл.). Согласно ГОСТ 17726-81,
название данного класса устройств: «Стерилизатор
паровой». Несмотря на то, что обработка
паром достаточно эффективна, она не всегда
может обеспечить стерилизацию инструмента.
Причина этого состоит в том, что
При паровом методе стерилизующим средством
является водяной насыщенный пар под избыточным
давлением 0,05 МПа (0,5 кгс/см2) — 0,21 МПа (2,1
кгс/см2) (1,1-2,0 бар) температурой 110-134°С.
Процесс стерилизации происходит в стерилизаторах
(автоклавах). Полный цикл составляет от
5 до 180 минут (табл.). Согласно ГОСТ 17726-81,
название данного класса устройств: «Стерилизатор
паровой». Несмотря на то, что обработка
паром достаточно эффективна, она не всегда
может обеспечить стерилизацию инструмента.
Причина этого состоит в том, что
воздушные полости в стерилизуемых объектах могут послужить тепловым изолятором, как например, стоматологические турбинные наконечники. Для решения этой проблемы в автоклавах используется функция создания предварительного вакуума в импульсном режиме. Преимущества метода — короткий цикл, возможность стерилизации нетермостойких изделий, применение различных типов упаковки. Недостатком является высокая стоимость оборудования.
2. Режимы стерилизации
Режимы стерилизации
1. При температуре 132 °С, давлении пара в стерилизационной камере 2 атм. в течение 20 мин рекомендуют стерилизацию для изделий из антикоррозийного материала, стекла, текстильных материалов.
2. При температуре 120 °С, давлении пара 1,1 атм. в течение 45 минут рекомендуют стерилизацию для изделий из резины и латекса, полимерных материалов.
Срок сохранения стерильности изделий, простерилизованных, в коробках без фильтров равен трем суткам, в стерилизационных биксах с фильтром — до 20 суток.
Таблица. Режимы и контроль паровой стерилизации
При этом методе стерилизации происходит комбинированное действие на микроорганизмы высокой температуры и влажности. Надежным методом стерилизации является стерилизация насыщенным паром при избыточном
давлении, а именно: давлении 0,11 мПа (1,1 кгс/см²) и температуре 120°С или давлении0,2 мПа (2,2 кгс/см²) и температуре 132°С .
Насыщенный пар – это пар, находящийся
в состоянии равновесия с жидкостью, из
которой он образуется.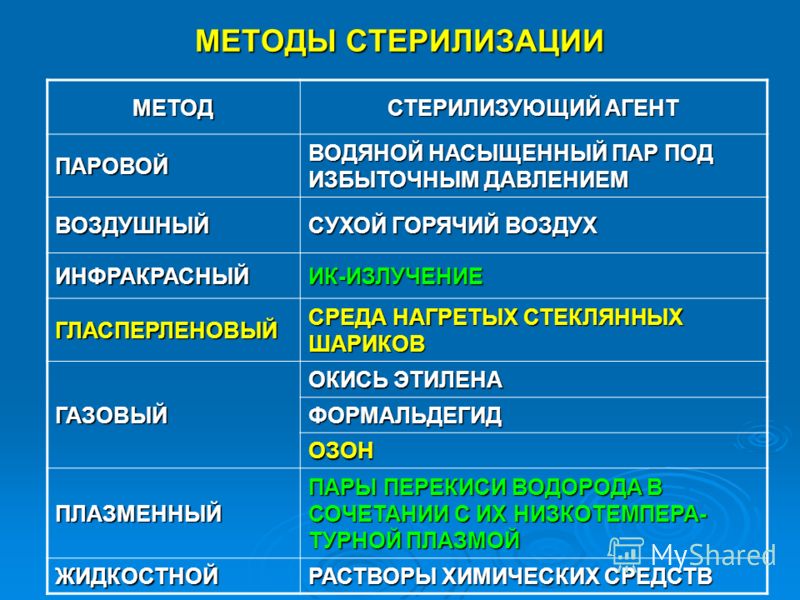 Признаком насыщенного
пара является строгая зависимость его
температуры от давления.
Признаком насыщенного
пара является строгая зависимость его
температуры от давления.
Стерилизация паром при температуре 120°С рекомендуется для растворов термостабильных лекарственных веществ. Время стерилизационной выдержки зависит от физико-химических свойств веществ и объема раствора.
Объем, мл | Минимальное время выдержки, мин |
До 100 От 100 до 500 От 500 до 1000 | 8 12 15 |
Стерилизация инъекционных лекарственных веществ проводят в герметично укупоренных, предварительно простерилизованных флаконах.
Этим методом также стерилизуют жиры
и масла в герметично укупоренных сосудах
при температуре 120°С в течение 2 часов;
изделия из стекла, фарфора, металла, перевязочный
и вспомогательный материал (вата, марля,
бинты, халаты, фильтровальную бумагу,
резиновые пробки, пергамент) – время
выдержки 45 мин при температуре 120°С или
20 мин при температуре 132°С .
В исключительных случаях стерилизуют при температуре ниже 120°С. Режим стерилизации должен быть обоснован и указан в частных статьях ГФXI или другой нормативно-технической документации.
Данный метод стерилизации наиболее часто используется в аптечных учреждениях для стерилизации инъекционных растворов при этом надо учитывать следующие требования:
1. Стерилизация должна проводится не позднее, чем 3 часа с момента изготовления раствора;
2. Стерилизация проводится
3. К заполненным коробкам или
упаковкам должна быть
4. Проведение контроля
5. Стерилизацию имеет право  °
°
Стерилизация фильтрованием.
Микробные клетки и споры могут рассматриваться как не растворимые образования с очень малым (1-2 мкм) поперечником. Подобно другим включениям они могут быть отделены от жидкости механическим путем – фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации также включен в ГФXI для стерилизации растворов термолабильных веществ.
Радиационная стерилизация.
Лучистая энергия губительно действует на клетки живых организмов, в том числе и на различные микроорганизмы. Принцип стерилизующего эффекта радиационного излучения основан на способности вызывать в живых клетках при определенных дозах поглощенной энергии такие изменения, которые неизбежно приводят их к гибели за счет нарушения метаболических процессов. Чувствительность микроорганизмов к ионизирующему излучению зависит от многих факторов: наличия влаги, температуры и др.
Стерилизация — это… Что такое Стерилизация?
полноте уничтожение всех видов микроорганизмов и их спор на поверхности и внутри различных предметов, а также в жидкостях и воздухе. Применяется в медицине, микробиологии, гнотобиологии, пищевой промышленности и в других областях. С. является основой асептики (Асептика), имеет большое значение в борьбе с госпитальной инфекцией, а также в профилактике возникновения послеоперационных гнойных осложнений, гепатита В, ВИЧ-инфекции и гнойных заболеваний. Стерилизуются все инструменты, дренажи, шприцы, перевязочный материал, контактирующие с раневой поверхностью, кровью или инъекционными препаратами, а также медицинские инструменты и приборы, которые в процессе эксплуатации соприкасаются со слизистой оболочкой и могут вызвать ее повреждение. Обеззараживаются воздух в операционной (см. Операционный блок), руки хирурга и операционной сестры (см. Обработка рук).
Современные методы С. подразделяют на физические и химические. К физическим методам относятся паровой, воздушный, радиационный. ультразвуковой. Химическая С. бывает газовой и растворами химических препаратов. С. при высоких температурах (паровая, воздушная) называют термической, а при температуре ниже 100° (радиационная, ультразвуковая и др.
Применяется в медицине, микробиологии, гнотобиологии, пищевой промышленности и в других областях. С. является основой асептики (Асептика), имеет большое значение в борьбе с госпитальной инфекцией, а также в профилактике возникновения послеоперационных гнойных осложнений, гепатита В, ВИЧ-инфекции и гнойных заболеваний. Стерилизуются все инструменты, дренажи, шприцы, перевязочный материал, контактирующие с раневой поверхностью, кровью или инъекционными препаратами, а также медицинские инструменты и приборы, которые в процессе эксплуатации соприкасаются со слизистой оболочкой и могут вызвать ее повреждение. Обеззараживаются воздух в операционной (см. Операционный блок), руки хирурга и операционной сестры (см. Обработка рук).
Современные методы С. подразделяют на физические и химические. К физическим методам относятся паровой, воздушный, радиационный. ультразвуковой. Химическая С. бывает газовой и растворами химических препаратов. С. при высоких температурах (паровая, воздушная) называют термической, а при температуре ниже 100° (радиационная, ультразвуковая и др. ) — холодной. Стерилизация радиационным, ультразвуковым и некоторыми другими методами технически сложна и может осуществляться только в особых условиях. Выбор того или иного метода С. зависит от особенностей стерилизуемого объекта и самого метода. При этом в течение установленного времени (стерилизационной выдержки) обязательно должны погибнуть все микроорганизмы, как патогенные, так и сапрофиты, в т.ч. спороносные формы. Кроме того, выбранные методы, средства и режимы С. не должны вызывать изменений внешнего вида, прочности, эксплуатационных качеств и других свойств стерилизуемых изделий. После С. химическим методом изделия не должны становиться токсичными для организма. Термонестойкие изделия стерилизуют холодными методами, а портящиеся под действием влаги — газовым или воздушным. При всех равных условиях предпочтение обычно отдают термическим методам стерилизации. При паровом методе стерилизационная выдержка короче, а температура ниже, чем при стерилизации сухим горячим воздухом.
Эффективность С.
) — холодной. Стерилизация радиационным, ультразвуковым и некоторыми другими методами технически сложна и может осуществляться только в особых условиях. Выбор того или иного метода С. зависит от особенностей стерилизуемого объекта и самого метода. При этом в течение установленного времени (стерилизационной выдержки) обязательно должны погибнуть все микроорганизмы, как патогенные, так и сапрофиты, в т.ч. спороносные формы. Кроме того, выбранные методы, средства и режимы С. не должны вызывать изменений внешнего вида, прочности, эксплуатационных качеств и других свойств стерилизуемых изделий. После С. химическим методом изделия не должны становиться токсичными для организма. Термонестойкие изделия стерилизуют холодными методами, а портящиеся под действием влаги — газовым или воздушным. При всех равных условиях предпочтение обычно отдают термическим методам стерилизации. При паровом методе стерилизационная выдержка короче, а температура ниже, чем при стерилизации сухим горячим воздухом.
Эффективность С. зависит не только от того, насколько правильно применен избранный метод, но и от степени чистоты стерилизуемых изделий, массивности их микробного обсеменения. Инструменты, использованные при гнойных операциях, диагностических и лечебных манипуляциях у инфекционных больных, перенесших в прошлом гепатит В или гепатит, диагноз которого не уточнен, а также являющихся носителем НВ-антигена, подлежат предварительной дезинфекции (Дезинфекция). Она осуществляется кипячением, а также воздействием водяного насыщенного пара под избыточным давлением, сухого горячего воздуха, растворами хлорамина, перекиси водорода, формалина, дезоксона-1, хлоргексидина биглюконата, дихлора-1, сульфолхлорантина и др. После дезинфекции химическим способом изделие должно быть промыто в проточной воде до полного удаления запаха дезинфицирующего средства.
зависит не только от того, насколько правильно применен избранный метод, но и от степени чистоты стерилизуемых изделий, массивности их микробного обсеменения. Инструменты, использованные при гнойных операциях, диагностических и лечебных манипуляциях у инфекционных больных, перенесших в прошлом гепатит В или гепатит, диагноз которого не уточнен, а также являющихся носителем НВ-антигена, подлежат предварительной дезинфекции (Дезинфекция). Она осуществляется кипячением, а также воздействием водяного насыщенного пара под избыточным давлением, сухого горячего воздуха, растворами хлорамина, перекиси водорода, формалина, дезоксона-1, хлоргексидина биглюконата, дихлора-1, сульфолхлорантина и др. После дезинфекции химическим способом изделие должно быть промыто в проточной воде до полного удаления запаха дезинфицирующего средства. Все изделия после дезинфекции, а также изделия, использующиеся впервые или после «чистых» операций, должны пройти предстерилизационную очистку с целью удаления белковых, жировых и механических загрязнений, а также лекарственных препаратов. Разъемные изделия разбирают на составные части. Новые изделия очищают сжатым воздухом от пыли, затем моют. Инструменты и другие изделия, использованные во время операций и различных манипуляций, тщательно промывают проточной водой, освобождают от слизи, крови, гноя и других загрязнений. Когда предстерилизационная очистка инструментов, загрязненных кровью, выполняется не сразу после их использования, то они предварительно должны быть погружены в 1% раствор бензоата натрия, являющегося ингибитором коррозии металла. После промывания водой изделия погружают на 15 мин в 0,5% раствор Биолота, подогретый до 40°, или в комплексный раствор, состоящий из 17 мл 27,5% раствора перекиси водорода, 5 г синтетического моющего средства (Лотос, Прогресс, Айна, Астра) и 978 мл питьевой воды при температуре 50°. Затем каждое изделие моют в том же растворе с помощью ерша или ватного тампона, а затем повторно промывают в проточной воде в течение 5—10 мин при использовании одного из моющих средств.
Разъемные изделия разбирают на составные части. Новые изделия очищают сжатым воздухом от пыли, затем моют. Инструменты и другие изделия, использованные во время операций и различных манипуляций, тщательно промывают проточной водой, освобождают от слизи, крови, гноя и других загрязнений. Когда предстерилизационная очистка инструментов, загрязненных кровью, выполняется не сразу после их использования, то они предварительно должны быть погружены в 1% раствор бензоата натрия, являющегося ингибитором коррозии металла. После промывания водой изделия погружают на 15 мин в 0,5% раствор Биолота, подогретый до 40°, или в комплексный раствор, состоящий из 17 мл 27,5% раствора перекиси водорода, 5 г синтетического моющего средства (Лотос, Прогресс, Айна, Астра) и 978 мл питьевой воды при температуре 50°. Затем каждое изделие моют в том же растворе с помощью ерша или ватного тампона, а затем повторно промывают в проточной воде в течение 5—10 мин при использовании одного из моющих средств. Моющий раствор можно применять многократно до его загрязнения в течение 1 сут. с момента приготовления Предстерилизационная очистка заканчивается сушкой изделий в сушильных шкафах при температуре 85° до полного исчезновения влаги. Качество очистки хирургических инструментов и других изделий от крови определяется путем постановки бензидиновой, ортотолиновой или амидопириновой проб.
Моющий раствор можно применять многократно до его загрязнения в течение 1 сут. с момента приготовления Предстерилизационная очистка заканчивается сушкой изделий в сушильных шкафах при температуре 85° до полного исчезновения влаги. Качество очистки хирургических инструментов и других изделий от крови определяется путем постановки бензидиновой, ортотолиновой или амидопириновой проб.
Сухие изделия группируют по назначению и в зависимости от их особенностей и метода стерилизации укладывают в стерилизационные коробки (биксы), упаковочный материал или открытые емкости. С. осуществляется в специально оборудованном помещении — стерилизационной или в центральных стерилизационных отделениях, где изделия стерилизуются для нескольких отделений больницы (поликлиники) или нескольких лечебных учреждений.
При стерилизации паровым методом стерилизующим агентом является водяной насыщенный пар под избыточным давлением. С. производят в паровых стерилизаторах (см. Стерилизационное оборудование) в течение 20—22 мин при давлении пара в стерилизационной камере 2 ± 0,2 кгс/см2 (0,2 ± 0,02 МПа) и температуре 132 ± 2°. Паровым методом стерилизуют изделия из текстильных материалов, стекла, коррозионно-устойчивого металла, резины. Стерилизуемые объекты укладывают в стерилизационные коробки с фильтром или без него, в качестве упаковки используют также влагопрочную бумагу, например пергамент, и двойной слой бязи. Стерилизационные коробки без фильтра должны быть выстланы изнутри одним слоем хлопчатобумажной ткани. Для эффективности С. и достижения необходимого прогрева необходимо полное удаление воздуха из стерилизационной камеры и стерилизуемых объектов. В паровых стерилизаторах, не имеющих вакуум-насосов и управляемых вручную, необходимо вытеснить воздух паром (продувка) в течение 10 мин. На качество удаления воздуха оказывают влияние плотность и равномерность загрузки стерилизационной камеры, вид упаковки и плотность расположения в ней стерилизуемых объектов. Достоинствами парового метода являются его высокая надежность, обеспечение стерильности не только на поверхности изделий, но и в их толще, возможность стерилизовать материалы, разрушающиеся под действием горячего сухого воздуха.
Паровым методом стерилизуют изделия из текстильных материалов, стекла, коррозионно-устойчивого металла, резины. Стерилизуемые объекты укладывают в стерилизационные коробки с фильтром или без него, в качестве упаковки используют также влагопрочную бумагу, например пергамент, и двойной слой бязи. Стерилизационные коробки без фильтра должны быть выстланы изнутри одним слоем хлопчатобумажной ткани. Для эффективности С. и достижения необходимого прогрева необходимо полное удаление воздуха из стерилизационной камеры и стерилизуемых объектов. В паровых стерилизаторах, не имеющих вакуум-насосов и управляемых вручную, необходимо вытеснить воздух паром (продувка) в течение 10 мин. На качество удаления воздуха оказывают влияние плотность и равномерность загрузки стерилизационной камеры, вид упаковки и плотность расположения в ней стерилизуемых объектов. Достоинствами парового метода являются его высокая надежность, обеспечение стерильности не только на поверхности изделий, но и в их толще, возможность стерилизовать материалы, разрушающиеся под действием горячего сухого воздуха. Однако он не пригоден для С. изделий, неустойчивых к воздействию тепла или влаги. Недостатком метода является также вероятность вторичного инфицирования простерилизованных объектов. Оно происходит непосредственно после окончания С. и обусловлено тем, что при охлаждении вместе с воздухом внутрь упаковки (кроме стерилизационных коробок с фильтром) поступает и микрофлора. В связи с этим после С. упаковки складывают на специальных столах, покрытых стерильной простыней, и накрывают второй стерильной простыней до полного охлаждения стерилизуемых объектов. Боковые отверстия стерилизационных коробок должны быть закрыты. Категорически запрещается выдавать в отделения стерилизованные изделия до их полного остывания.
Стерилизация воздушным методом осуществляется сухим горячим воздухом в воздушных стерилизаторах (см. Стерилизационное оборудование) при температуре 180° в течение 60—65 мин или при температуре 160° в течение 150 мин. Стерилизуют изделия из металла, стекла и силиконовой резины, а также разрушающиеся под действием влаги.
Однако он не пригоден для С. изделий, неустойчивых к воздействию тепла или влаги. Недостатком метода является также вероятность вторичного инфицирования простерилизованных объектов. Оно происходит непосредственно после окончания С. и обусловлено тем, что при охлаждении вместе с воздухом внутрь упаковки (кроме стерилизационных коробок с фильтром) поступает и микрофлора. В связи с этим после С. упаковки складывают на специальных столах, покрытых стерильной простыней, и накрывают второй стерильной простыней до полного охлаждения стерилизуемых объектов. Боковые отверстия стерилизационных коробок должны быть закрыты. Категорически запрещается выдавать в отделения стерилизованные изделия до их полного остывания.
Стерилизация воздушным методом осуществляется сухим горячим воздухом в воздушных стерилизаторах (см. Стерилизационное оборудование) при температуре 180° в течение 60—65 мин или при температуре 160° в течение 150 мин. Стерилизуют изделия из металла, стекла и силиконовой резины, а также разрушающиеся под действием влаги. Их укладывают в пакеты из крафт-бумаги (сильфитно-оберточная бумага) или в открытые емкости. Пакеты склеивают 10% раствором поливинилового спирта или 5% крахмальным клеем. После укладки стерилизуемого материала свободный край пакета трижды перегибают и закрепляют металлической скрепкой. В камере стерилизатора могут образоваться участки со значительной разницей температур. Поэтому лучше использовать стерилизаторы, оборудованные механическими устройствами, усиливающими циркуляцию воздуха в стерилизационной камере. Необходимо следить за тем, чтобы между предметами, а также между ними и стенками камеры оставались промежутки. Воздушный метод нельзя применять при стерилизации термолабильных материалов (изделий из текстиля, полимеров, резины).
Их укладывают в пакеты из крафт-бумаги (сильфитно-оберточная бумага) или в открытые емкости. Пакеты склеивают 10% раствором поливинилового спирта или 5% крахмальным клеем. После укладки стерилизуемого материала свободный край пакета трижды перегибают и закрепляют металлической скрепкой. В камере стерилизатора могут образоваться участки со значительной разницей температур. Поэтому лучше использовать стерилизаторы, оборудованные механическими устройствами, усиливающими циркуляцию воздуха в стерилизационной камере. Необходимо следить за тем, чтобы между предметами, а также между ними и стенками камеры оставались промежутки. Воздушный метод нельзя применять при стерилизации термолабильных материалов (изделий из текстиля, полимеров, резины). Химические методы позволяют стерилизовать оптические изделия, радио- и электронную аппаратуру, а также изделия из термонестойких материалов, металла, стекла. Стерилизация эффективна в том случае, когда химическое средство поглощается стерилизуемым объектом. Химические вещества в растворенном и особенно в газообразном состоянии обладают незначительной скоростью проникновения в стерилизуемый объект, что требует более длительной стерилизационной выдержки и очень тщательной предстерилизационной очистки пористых материалов. Недостатком метода является также необходимость нейтрализации или дегазации химических веществ, оставшихся в стерилизуемых объектах. Растворами химических препаратов нельзя стерилизовать изделия из влагонестойких материалов.
Химические вещества в растворенном и особенно в газообразном состоянии обладают незначительной скоростью проникновения в стерилизуемый объект, что требует более длительной стерилизационной выдержки и очень тщательной предстерилизационной очистки пористых материалов. Недостатком метода является также необходимость нейтрализации или дегазации химических веществ, оставшихся в стерилизуемых объектах. Растворами химических препаратов нельзя стерилизовать изделия из влагонестойких материалов.
 Для стерилизации формальдегидом используют 16% раствор формалина (по формальдегиду). С. осуществляют в течение 300 ± 5 мин при температуре 75 ± 5° и относительной влажности воздуха 96 ± 2%. С. окисью этилена и смесью ОБ выполняется в стационарных газовых стерилизаторах и микроанаэростате, формальдегидом — в стационарном формалиновом стерилизаторе. В качестве упаковочного материала используют полиэтиленовую пленку, пергамент, мешочную влагопрочную бумагу. Изделия, простерилизованные газовым методом, применяются после их выдержки в вентилируемом помещении (при скорости движения воздуха 20 м/с) в течение 1 сут. (изделия из стекла и металла), 5—13 сут. (изделия из полимерных материалов), 14 сут. (изделия, имеющие длительный, более 30 мин контакт с тканями, слизистой оболочкой и кровью), 21 сут. (изделия из полимерных материалов, используемые у детей). Для нейтрализации формальдегида изделия перед применением погружают на 1 ч в 23—25% раствор аммиака.
Для стерилизации формальдегидом используют 16% раствор формалина (по формальдегиду). С. осуществляют в течение 300 ± 5 мин при температуре 75 ± 5° и относительной влажности воздуха 96 ± 2%. С. окисью этилена и смесью ОБ выполняется в стационарных газовых стерилизаторах и микроанаэростате, формальдегидом — в стационарном формалиновом стерилизаторе. В качестве упаковочного материала используют полиэтиленовую пленку, пергамент, мешочную влагопрочную бумагу. Изделия, простерилизованные газовым методом, применяются после их выдержки в вентилируемом помещении (при скорости движения воздуха 20 м/с) в течение 1 сут. (изделия из стекла и металла), 5—13 сут. (изделия из полимерных материалов), 14 сут. (изделия, имеющие длительный, более 30 мин контакт с тканями, слизистой оболочкой и кровью), 21 сут. (изделия из полимерных материалов, используемые у детей). Для нейтрализации формальдегида изделия перед применением погружают на 1 ч в 23—25% раствор аммиака. Стерилизация растворами химических препаратов выполняется в закрытых емкостях, покрытых неповрежденной эмалью, а также сделанных из стекла или пластмассы. Стерилизуемые объекты погружают в раствор при температуре 18 ± 2°. Время стерилизационной выдержки в 6% растворе перекиси водорода — 60 ± 5 мин, дезоксоне-1 — 45—50 мин. После С. изделия промывают стерильной водой в асептических условиях.
Стерилизуемые объекты погружают в раствор при температуре 18 ± 2°. Время стерилизационной выдержки в 6% растворе перекиси водорода — 60 ± 5 мин, дезоксоне-1 — 45—50 мин. После С. изделия промывают стерильной водой в асептических условиях.
 Бактериологический метод контроля эффективности С. является наиболее специфичным и точным, позволяет констатировать достижение необходимой температуры и экспозиции С. на основании гибели спор высокорезистентных тест-микроорганизмов. Однако этот метод трудоемкий. При стерилизации паровым методом в качестве биотеста применяют пробы почвы (садовой земли), содержащей сапрофиты, которые выдерживают воздействие водяного насыщенного пара при температуре 120° в течение 3—5 мин. Для контроля воздушного метода С. используют бактериологические пробирки, инфицированные споровой суспензией сенной палочки, погибающей через 5 мин при температуре не ниже 180°. Контроль С. осуществляется также посевами микрофлоры с простерилизованных изделий. Библиогр.: Вашков В.И. Средства и методы стеризации, применяемые в медицине, М., 1973, библиогр.; Тимофеев Н.С. и Тимофеев Н.Н. Асептика и антисептика, с. 14, М., 1980.
Бактериологический метод контроля эффективности С. является наиболее специфичным и точным, позволяет констатировать достижение необходимой температуры и экспозиции С. на основании гибели спор высокорезистентных тест-микроорганизмов. Однако этот метод трудоемкий. При стерилизации паровым методом в качестве биотеста применяют пробы почвы (садовой земли), содержащей сапрофиты, которые выдерживают воздействие водяного насыщенного пара при температуре 120° в течение 3—5 мин. Для контроля воздушного метода С. используют бактериологические пробирки, инфицированные споровой суспензией сенной палочки, погибающей через 5 мин при температуре не ниже 180°. Контроль С. осуществляется также посевами микрофлоры с простерилизованных изделий. Библиогр.: Вашков В.И. Средства и методы стеризации, применяемые в медицине, М., 1973, библиогр.; Тимофеев Н.С. и Тимофеев Н.Н. Асептика и антисептика, с. 14, М., 1980.Лекарственные формы для инъекций
Практическое значение имеет изготовление и хранение раствора 0,1 н HCl. В аптеке
для удобства дозирования и хранения целесообразно
готовить 0,01 н раствора HCl по прописи 0,42
мл кислоты хлороводородной разведенной
на 100 мл воды. Приготовленный раствор
разливают по 10 мл во флаконы нейтрального
стекла и стерилизуют насыщенным паром
под давлением при температуре 120°С в течение
8 мин. Раствор используют в кратном количестве.
Срок хранения стабилизатора не более
5 суток.
В аптеке
для удобства дозирования и хранения целесообразно
готовить 0,01 н раствора HCl по прописи 0,42
мл кислоты хлороводородной разведенной
на 100 мл воды. Приготовленный раствор
разливают по 10 мл во флаконы нейтрального
стекла и стерилизуют насыщенным паром
под давлением при температуре 120°С в течение
8 мин. Раствор используют в кратном количестве.
Срок хранения стабилизатора не более
5 суток.
2.3.2. Стабилизация растворов солей слабых кислот и сильных оснований.
В водных растворах соли слабых кислот и сильных оснований легко гидролизуются, образуя слабощелочную реакцию среды, что приводит к образованию труднорастворимых осадков.
Для стабилизации таких растворов используется 0,1 н раствор гидроксида натрия, а иногда и натрия карбонат в количестве 2-4г вещества на 1 л раствора. К веществам стабилизируемым данным способом относятся такие вещества, как натрия тиосульфат, кофеина-натрия бензоат, теофелин и т.д.
2.3. 3. Стабилизация растворов легкоокисляющихся веществ.
3. Стабилизация растворов легкоокисляющихся веществ.
К легкоокисляющимся веществам относятся кислота аскорбиновая, адреналина гидротартрат, этиленморфина гидрохлорид, викасол, новокаиномед, производные фенофтивазина и др. лекарственные вещества. В процессе изготовления инъекционных растворов этих веществ в присутствие кислорода, содержащегося в воде и над раствором, происходит окисление. В результате в растворах образуются продукты окисления, часто более токсичные или физиологически неактивные. Окисление в значительной степени увеличивается под влиянием света, тепла, значения рН, кислорода.
Для стабилизации легкоокисляющихся
веществ используют антиоксиданты, с различными
механизмами действия. К ним относятся
вещества, содержащие серу низкой валентности
ронгалит, унитол, натрия метабисульфит и т.д, комплексоны,
связывающие тяжелые металлы ЭТДА, трилон
Б, тетацин кальция, высокомолекулярные
вещества полигликин, пропиленгликоль
и т.д. В настоящее время разрабатывается
возможность использования комплексных
стабилизаторов, проверяются на безопасность
новые антиоксиданты. Особого внимания
заслуживает стабилизация растворов глюкозы.
Ранее растворы глюкозы готовились со
стабилизатором Вейбеля, состоящего из
5,2 г натрия хлорида, 4,4 кислоты хлороводородной
разведенной 8,3% и воды до 1 л раствора.
Но в настоящее время в соответствии с
МУ Технология, контроль качества и срок
годности растворов глюкозы 5, 10 и 20% для
инъекций, изготовленных в аптеки утвержденных
МЗ РФ 19 июня 1997г. в дополнение к приказу
214, растворы глюкозы, выше указанной концентрации
готовятся без стабилизатора.
Особого внимания
заслуживает стабилизация растворов глюкозы.
Ранее растворы глюкозы готовились со
стабилизатором Вейбеля, состоящего из
5,2 г натрия хлорида, 4,4 кислоты хлороводородной
разведенной 8,3% и воды до 1 л раствора.
Но в настоящее время в соответствии с
МУ Технология, контроль качества и срок
годности растворов глюкозы 5, 10 и 20% для
инъекций, изготовленных в аптеки утвержденных
МЗ РФ 19 июня 1997г. в дополнение к приказу
214, растворы глюкозы, выше указанной концентрации
готовятся без стабилизатора.
2.4 Полный химический анализ
После изготовления раствора
для инъекций и до его
Кроме того, возможен дополнительный
опросный контроль после изготовления раствора.
Результаты контроля заносятся в журнал
форма, которого приведена в приложении
2 к Инструкции по контролю качества, утвержденных
приказом МЗ РФ 214 от 16 июля 1997г.
- Фильтрование и фасовка растворов.
Этот этап изготовления инъекционных растворов проводится только при удовлетворительных результатах полного химического анализа.
3.1 Фильтрование и розлив во флаконы, укупорка.
Фильтрование проводится для освобождения
инъекционных растворов от механических
включений. Для надежного выбора фильтровальной
системы желателен анализ следующей информации
о технологии очистки — характер фильтруемой среды наименование, ингредиенты,
плотность, вязкость, концентрация — характер
загрязнений размер частиц — требования
к фильтрату визуальная прозрачность
или другое – используемое оборудование
и фильтроэлементы с указанием типа, марки,
материала, основных эксплуатационных
характеристик по паспорту. Первые порции
фильтрата подвергаются повторному фильтрованию. Фильтрование раствора сочетается с одновременным
розливом его в приготовленные стеклянные
флаконы. Во время фильтрования и розлива
персонал не должен наклоняться над пустыми
или полными флаконами. Оптимален розлив
и укупорка в ламинарном потоке воздуха
с использованием соответствующего оборудования.
Фильтрование раствора сочетается с одновременным
розливом его в приготовленные стеклянные
флаконы. Во время фильтрования и розлива
персонал не должен наклоняться над пустыми
или полными флаконами. Оптимален розлив
и укупорка в ламинарном потоке воздуха
с использованием соответствующего оборудования.
Для фильтрования растворов для инъекций используют фильтровальные воронки со стеклянным фильтром размеры пор 3-10 мкм.
При этом используются установки двух конструкций
1. Аппарат штативного типа
2. Аппарат карусельного типа.
Кроме того, используют установки для фильтрования и розлива жидкостей УФЖ-1 и УФЖ-2 с их помощью можно фильтровать несколько растворов одновременно.
С ориентацией на фильтрование больших
количеств инъекционных растворов применяют
фильтры, работающие под вакуумом по принципу
грибка с использованием перевернутой
воронки Бюнхера. На дно воронки последовательно
один на другой укладывается фильтровальный материал,
чем достигается более тщательное фильтрование. В качестве фильтровального материала
применяются комбинированные фильтры
в сочетании с различным фильтрующим материалом:
фильтровальная бумага, марля, вата, ткань
хлопчатобумажная бязевой группы, бельтинг,
ткани из натурального шелка. Следует
обратить внимание на то, что в настоящее
время все чаще применяют метод микрофильтрации
через мембранные фильтры.
В качестве фильтровального материала
применяются комбинированные фильтры
в сочетании с различным фильтрующим материалом:
фильтровальная бумага, марля, вата, ткань
хлопчатобумажная бязевой группы, бельтинг,
ткани из натурального шелка. Следует
обратить внимание на то, что в настоящее
время все чаще применяют метод микрофильтрации
через мембранные фильтры.
Микрофильтрация — процесс мембранного
разделения коллоидных
1 капиллярный эффект
2 явление адсорбции
3 электростатические силы
4 Ван-дер-ваальсовые силы.
Наиболее часто используют фильтры зарубежных марок — МЕЛИПОР, САРТЕРИДЕ, СИНПОР и другие. Также часто используются фильтры отечественной марки ВЛАДИПОР, которые представляют собой мелкопористые ацетат целлюлозные пленки белого цвета, различной толщены. Фильтрование растворов с использование мембранных микрофильтров предполагает применение мембранных установок, которые представляют из себя комплексное устройства, состоящее из мембранодержателей и другого вспомогательного оборудования.
После розлива растворов с одновременной фильтрацией флаконы укупоривают резиновыми пробками и подвергают первичному визуальному контролю на отсутствие механических включений в соответствии с приложением 8 к Инструкции по контролю качества лекарственных средств, изготовляемых в аптеках, утвержденным приказом 214 МЗ РФ от 16 июля 1997г.
3.2 Первичный контроль на
Под механическими включениями понимают
постоянно подвижные не растворимые вещества,
кроме пузырьков газа, случайно присутствующих
в растворах. Первичный контроль осуществляется
после фильтрации и фасовки раствора.
Просмотру подлежит каждая бутылка или флакон с раствором.
При обнаружении механических включений
раствор повторно фильтруют и вновь просматривают,
укупоривают, маркируют и стерилизуют.
Для растворов подвергаемых мембранной
микрофильтрации допускается проведение
выборочного первичного контроля на отсутствие
механических включений. Контроль осуществляется
провизором-технологом с соблюдением
всех условий и методики проведения. Для
просмотра растворов должно быть специально
оборудованное рабочие место, защищенное
от попадания прямых солнечных лучей.
Проведение контроля осуществляется с
помощью Устройства для контроля раствора
на отсутствие механических включений
УК-2, допускается использование черно-белого
экрана, освещенного таким образом, чтобы
исключить попадания света в глаза проверяющего
непосредственно от его источника. Контроль
раствора осуществляется путем просмотра
невооруженным глазом на черном и белом
фонах, освещенных электрической матовой
лампой в 60 Вт или лампой дневного света
20 Вт для окрашенных растворов соответственно
100 Вт и 30Вт.
Первичный контроль осуществляется
после фильтрации и фасовки раствора.
Просмотру подлежит каждая бутылка или флакон с раствором.
При обнаружении механических включений
раствор повторно фильтруют и вновь просматривают,
укупоривают, маркируют и стерилизуют.
Для растворов подвергаемых мембранной
микрофильтрации допускается проведение
выборочного первичного контроля на отсутствие
механических включений. Контроль осуществляется
провизором-технологом с соблюдением
всех условий и методики проведения. Для
просмотра растворов должно быть специально
оборудованное рабочие место, защищенное
от попадания прямых солнечных лучей.
Проведение контроля осуществляется с
помощью Устройства для контроля раствора
на отсутствие механических включений
УК-2, допускается использование черно-белого
экрана, освещенного таким образом, чтобы
исключить попадания света в глаза проверяющего
непосредственно от его источника. Контроль
раствора осуществляется путем просмотра
невооруженным глазом на черном и белом
фонах, освещенных электрической матовой
лампой в 60 Вт или лампой дневного света
20 Вт для окрашенных растворов соответственно
100 Вт и 30Вт. Расстояние от глаз до просматриваемого
объекта должно быть 25-30 см, а угол оптической
оси просмотра к направлению света около
90°. Линия зрения должна быть направлена
книзу при вертикальном положении головы.
Провизор-технолог должен иметь остроту
зрения равную единице. При необходимости
корректируется очками. Поверхность проверяемых
бутылок или флаконов должна быть снаружи
чистой и сухой. В зависимости от объема
бутылки или флакона просматривают одновременно
от одной бутылки до 5 штук. Бутылки или
флаконы берут в одну или обе руки за горловины,
вносят в зону контроля, плавными движениями
переворачивают в положение вверх донышками
и просматривают на черном и белом фонах.
Затем плавными движениями, без встряхивания
переворачивают в первоначальное положение
вниз донышками и так же просматривают
на черном и белом фонах. Время контроля
соответственно составляет одна бутылка
вместимостью 100-500 мл — 20 сек две бутылки
вместимостью 50-100 мл — 10 сек от двух
до пяти бутылок вместимостью 5-50 мл — 8-10
сек.
Расстояние от глаз до просматриваемого
объекта должно быть 25-30 см, а угол оптической
оси просмотра к направлению света около
90°. Линия зрения должна быть направлена
книзу при вертикальном положении головы.
Провизор-технолог должен иметь остроту
зрения равную единице. При необходимости
корректируется очками. Поверхность проверяемых
бутылок или флаконов должна быть снаружи
чистой и сухой. В зависимости от объема
бутылки или флакона просматривают одновременно
от одной бутылки до 5 штук. Бутылки или
флаконы берут в одну или обе руки за горловины,
вносят в зону контроля, плавными движениями
переворачивают в положение вверх донышками
и просматривают на черном и белом фонах.
Затем плавными движениями, без встряхивания
переворачивают в первоначальное положение
вниз донышками и так же просматривают
на черном и белом фонах. Время контроля
соответственно составляет одна бутылка
вместимостью 100-500 мл — 20 сек две бутылки
вместимостью 50-100 мл — 10 сек от двух
до пяти бутылок вместимостью 5-50 мл — 8-10
сек. Указанное время контроля не включает
времени на вспомогательные операции.
Указанное время контроля не включает
времени на вспомогательные операции.
3.3. Укупорка и маркировка.
Флаконы с растворами для инъекций, укупоренные резиновыми пробками, после удовлетворительного контроля на отсутствие механических включений, обкатывают металлическими колпачками. Для этой цели используют аллюминевые колпачки типа К-7 с просечкой отверстием диаметром 12-14 мм. После обкатки у флаконов проверяют качество укупорки — металлический колпачок не должен прокручиваться при проверки вручную и раствор не должен выливаться при опрокидывании флакона. Затем бутылки и флаконы маркируют путем подписи, штамповки на крышке или с использованием металлических жетонов с указанием наименования раствора и его концентрации.
4. Стерилизация.
Стерилизация.
Стерилизация — полное уничтожение в
том, или ином объекте живых микроорганизмов
и их спор. Стерилизация имеет большое
значение при изготовлении всех лекарственных
форм и особенно инъекционных. В данном
случае следует стерилизовать посуду,
вспомогательный материал, растворитель
и готовый раствор. Таким образом, работа
по изготовлению растворов для инъекций
должна начинаться со стерилизации и стерилизацией
заканчиваться. ГФXI определяет стерилизацию
как процесс умерщвления в объекте или
удаление из него микроорганизмов всех
видов, находящихся на всех стадиях развития.
Сложность процесса стерилизации заключается,
с одной стороны, в высокой жизнестойкости
и большом разнообразии микроорганизмов,
с другой стороны — термолабильностью
многих лекарственных веществ и лекарственных
форм или невозможностью по ряду причин
использовать другие методы стерилизации.
Отсюда, исходят требования к методам
стерилизации сохранить свойства лекарственных
форм и освободить их от микроорганизмов. Методы стерилизации должны быть удобны
для использования в аптеке, особенно
в аптеках ЛПУ, в рецептуре которых инъекционные
растворы составляют до 60-80%.
Методы стерилизации должны быть удобны
для использования в аптеке, особенно
в аптеках ЛПУ, в рецептуре которых инъекционные
растворы составляют до 60-80%.
В технологии лекарственных форм используют разные методы стерилизации:
-термические методы,
-стерилизация фильтрованием,
-радиационная стерилизация,
-химическая стерилизация.
Термическая стерилизация. К термическим методам стерилизации относят стерилизацию паром под давлением и воздушную стерилизацию, стерилизация текучим паром исключена из ГФXI.
Воздушная стерилизация. Этот метод стерилизации осуществляется горячим воздухом в воздушном стерилизаторе при температуре 180-200°С . При этом погибают все формы микроорганизмов за счет пирогенетического разложения белковых веществ. Эффективность воздушной стерилизации зависит от температуры и времени. Равномерность прогрева объектов зависит от степени теплопроводности и правильности расположения внутри стерилизационной камеры для обеспечения свободной циркуляции горячего воздуха. Стерилизуемые объекты должны быть расфасованы в соответствующую тару или укупорены и свободно размещены в стерилизаторе. В связи с тем, что воздух обладает не высокой теплопроводностью, прогрев стерилизуемых объектов происходит довольно медленно, поэтому загрузка должна производится в не нагретые стерилизаторы или когда температура внутри них не превышает 60°С . Время, рекомендуемое для стерилизации, должно отсчитываться с момента нагрева в стерилизаторе до температуры 180-200°С. Воздушный метод стерилизации используется для стерилизации термостойких лекарственных веществ, масел, жиров, ланолина, вазелина, воска, а также изделий из стекла, металла, силиконовой резина, фарфора, установки для стерилизации фильтрованием с фильтрами, мелкие стеклянные и металлические предметы. Для стерилизации растворов этот метод не используют.
Паровая стерилизация. При этом методе стерилизации происходит комбинированное действие на микроорганизмы высокой температуры и влажности. Надежным методом стерилизации является стерилизация насыщенным паром при избыточном давлении, а именно давлении 0,11 мПа и температуре 120°С или давлении и температуре 132°С.
Насыщенный пар — это пар, находящийся в состоянии равновесия с жидкостью, из которой он образуется. Признаком насыщенного пара является строгая зависимость его температуры от давления. Стерилизацию паром под давлением проводят в паровых стерилизаторах.
Стерилизация паром при температуре 120°С рекомендуется для растворов термостабильных лекарственных веществ. Время стерилизационной выдержки зависит от физико-химических свойств веществ и объема раствора.
Объем, мл | Мин время выдержки, мин |
До 100 | 8 |
От 100 до 500 | 12 |
От 500 до 1000 | 15 |
Стерилизацию инъекционных лекарственных веществ проводят в герметично укупоренных, предварительно простерилизованных флаконах. Этим методом также стерилизуют жиры и масла в герметично укупоренных сосудах при температуре 120°С в течение 2 часов; изделия из стекла, фарфора, металла, перевязочный и вспомогательный материал, вату, марлю, бинты, халаты, фильтровальную бумагу, резиновые пробки, пергамент — время выдержки 45 мин при температуре 120°С или 20 мин при температуре 132°С. В исключительных случаях стерилизуют при температуре ниже 120°С. Режим стерилизации должен быть обоснован и указан в частных статьях ГФXI или другой нормативно-технической документации.
Контроль эффективности термических методов стерилизации осуществляется с помощью контрольно-измерительных приборов с термометрами, а также химическими и биологическими методами. В качестве химических тестов используют некоторые вещества, изменяющие свой цвет или физиологическое состояние при определенных параметрах стерилизации. Например, бензойная кислота температура плавления 122-124,5°С, сахароза 180°С и другие вещества. Бактериологический контроль осуществляется с помощью стерилизации объекта, осемененным тест-микробами, могут быть использованы пробы садовой земли. Данный метод стерилизации наиболее часто используется в аптечных учреждениях для стерилизации инъекционных растворов при этом надо учитывать следующие требования
Стерилизация нагреванием | Туттнауэр
Пламя: стерилизация в открытом пламени
Самый старый метод — это пламя, держа инструмент в открытом огне. Именно это и происходит, когда вы обжигаете кончик иглы, чтобы удалить шип. Этот метод существует с тех пор, как наши предки-охотники использовали пламя, чтобы мясо, на которое они охотились, было съедобным и вкусным. Им не требовалось никаких знаний об опасности бактерий, чтобы понять, что мясо, приготовленное на гриле, полезнее и вкуснее сырого.
Сжигание
Если вам нравится полное разрушение, этот метод для вас. При сжигании уничтожается все, а не только микроорганизмы. Сжигание применимо к материалам, используемым только один раз или когда уровень загрязнения настолько высок, что по соображениям безопасности его необходимо уничтожить. Радиоактивные материалы, конечно, не включены. Он превращает все в пепел, тем самым уменьшая объем загрузки на 90%.
Типичные области применения:
- Заключительный этап обращения с медицинскими отходами
- Обработка лабораторных отходов биологической опасности
Преимущества:
- Полное уничтожение при необходимости предотвращает повторное использование материалов
- Объем загрузки уменьшен на 90%
- Устранение биологических агентов
- Хорошо работает с большими партиями
- Выделяемая энергия используется для производства электроэнергии
Недостатки:
- Очень высокие затраты на строительство и монтаж
- Требуется дорогое топливо по сравнению с потребляемой мощностью автоклава
- Стоимость содержания очень высока
- Дорогая инфраструктура
- Для правильной работы требуется высококвалифицированный персонал
- Риск загрязнения: обычное засорение фильтров приводит к неполному сгоранию и выделению ядовитых газов.
- Для сжигания требуется двойная камера, первая — от 300 до 500 градусов, а вторая — от 800 до 1200. Если одна из камер не работает, что может случаться часто, процесс не завершен
- Обычно ремонт сложен и требует много времени; следовательно, это может вызвать скопление грузов, что, в свою очередь, может привести к загрязнению.
Сухой жар
При сухом тепле бактерии сжигаются или окисляются. Сухой горячий воздух гораздо менее эффективен для передачи тепла, чем влажный.Вот почему микроорганизмы гораздо лучше переносят тепло в сухом состоянии. Процесс стерилизации сухим жаром занимает много времени и проводится при высокой температуре (2 часа при 160 ° C). Общее время цикла, включая нагрев и охлаждение до 80 ° C, может занять около 10-11 часов, что не самое лучшее решение для активной клиники, которая нуждается в легкодоступных инструментах. При принудительном охлаждении время может быть сокращено до пяти часов.
Приложения:
Стерилизация сухим жаром особенно применима к материалам, которые повреждены высоким давлением или влажностью и могут выдерживать высокие температуры.Сухой жар не вызывает коррозии металлических инструментов; таким образом, он хорошо подходит для стерилизации металлических инструментов, но не может использоваться для стерилизации тканей, пластмассы или резиновых изделий. Он также подходит для стеклянной посуды в лаборатории. Последняя категория — это материалы, в которые пар не может проникнуть или которые должны оставаться сухими: сюда входят фармацевтические порошки, которые должны оставаться сухими, масла и вещества, в которые пар не проникает.
Преимущества:
- Подходит для стерилизации материалов и инструментов, которые нельзя автоклавировать
- Обычно дешевле автоклава
Недостатки:
- Для эффективности требуется очень высокая температура, 4 часа для стандартного цикла 160 градусов и 2 часа при 180 градусов
- Длительность цикла очень велика, следовательно, очень малый оборот
- Значительно более высокие энергопотребление и стоимость по сравнению с автоклавом, следовательно, гораздо более высокие эксплуатационные расходы.
- Сухой жар может повредить некоторые инструменты
- Нагревательные элементы ломаются быстрее, чем нагревательные элементы автоклава
В нашей следующей публикации мы обсудим стерилизацию паром, и мы объясним, почему это один из наиболее часто используемых методов, а также одна из областей нашей компетенции.Мы хотели бы услышать о других методах, преимуществах или недостатках, необычных или интересных приложениях, поэтому, пожалуйста, присоединяйтесь к разговору.
4 основных метода стерилизации | Организмы
Среди различных методов контроля микробной активности лучшим на сегодняшний день является стерилизация, поскольку она уничтожает все микробы. Стерилизация осуществляется следующими методами: 1. Физические методы 2. Радиационные методы 3. Ультразвуковые методы 4. Химические методы.
1.Физические методы:Физические методы стерилизации включают уничтожение микробов путем применения влажного тепла, например, пропаривания, или сухого тепла, как в духовке с горячим воздухом, или с помощью различных методов фильтрации для освобождения среды от микробов. Мы изучим каждый из них.
и. Физический контроль с помощью тепла :
Цитадель по роману А.Дж. Кронин, который следует за жизнью молодого британского врача, начиная с 1920-х годов. В начале рассказа врач Эндрю Мэнсон начинает свою практику в небольшом шахтерском городке в Уэльсе.Практически сразу он сталкивается с эпидемией брюшного тифа.
Когда его первый пациент умирает от болезни, Мэнсон ужасно обезумел. Однако он понимает, что эпидемию можно остановить, и в следующей сцене бросает все простыни, одежду и личные вещи пациента в огромный костер.
Убивающее воздействие тепла на микроорганизмы известно давно. Нагревание происходит быстро, надежно и относительно недорого, и оно не вводит химические вещества в вещество, как это иногда делают дезинфицирующие средства.Выше максимальных температур роста биохимические изменения в органических молекулах клетки приводят к ее гибели.
Эти изменения возникают из-за изменений в молекулах ферментов или химического разрушения структурных молекул, особенно в клеточных мембранах. Тепло также отталкивает воду, и, поскольку все организмы зависят от воды, эта потеря может быть смертельной.
Скорость уничтожения тепла может быть выражена как функция времени и температуры. Например, туберкулезные палочки уничтожаются за 30 минут при 58 ° C, но всего за 2 минуты при 65 ° C и за несколько секунд при 72 ° C.Каждый вид микробов имеет время термической смерти (TDT), время, необходимое для его уничтожения при заданной температуре. У каждого вида также есть точка термической смерти (TDT), температура, при которой он умирает в заданное время.
В этом методе поддерживается постоянная температура и определяется время, необходимое для уничтожения клеток. Термин «точка термической смерти» больше не используется. Поскольку определенная температура не может быть смертельной всегда и для всех видов микроорганизмов.
В последнее время тепловая чувствительность определяется с помощью термина D-значение.Значение D — это время воздействия при данной температуре, необходимое для уменьшения количества жизнеспособных организмов на 90%. Математически он равен обратной величине наклона кривой выживаемости или кривой выживаемости для прохождения одного логарифмического цикла. Значения D можно использовать для определения относительной тепловой чувствительности микроорганизмов к разным температурам расчетным путем.
Значение z — это изменение температуры, необходимое для уменьшения значения D на один логарифмический цикл, когда log D отображается в зависимости от температуры.Значение F — это значение D при 250 ° F. Эти измерения особенно важны в пищевой промышленности, где тепло используется для консервирования.
При определении времени и температуры для уничтожения микробов с помощью тепла необходимо учитывать некоторые факторы. Один из факторов — это тип убиваемого организма. Например, если материалы подлежат стерилизации, физический метод должен быть направлен на споры бактерий. Однако молоко не обязательно должно быть стерильным для употребления, поэтому нагревание направлено на наиболее устойчивые вегетативные клетки патогенов.
Другой фактор — это тип обрабатываемого материала. Порошок подвергается воздействию сухого тепла, а не влажного тепла, потому что влажное тепло сделает его сырым. Солевые растворы, напротив, можно стерилизовать влажным теплом, но их нелегко обработать сухим теплом.
Другими факторами являются наличие органических веществ и кислотная или основная природа материала. Органические вещества могут препятствовать проникновению тепла в микроорганизмы, в то время как кислотность или щелочность могут способствовать летальному исходу тепла.
ii. Прямое пламя :
Возможно, самый быстрый метод стерилизации — метод прямого пламени, используемый в процессе сжигания. Пламя горелки Бунзена используется для стерилизации бактериологической петли перед извлечением образца из культуральной пробирки и после приготовления мазка. Обжигание наконечника трубки также уничтожает организмы, которые случайно соприкасаются с наконечником, сжигая при этом ворсинки и пыль.
В общем, предметы должны быть одноразовыми, если для стерилизации используется пламя.Одноразовые больничные халаты и некоторые пластиковые устройства являются примерами материалов, которые можно сжигать. В прошлые века тела жертв болезней сжигали, чтобы предотвратить распространение эпидемии.
По-прежнему обычной практикой является сжигание трупов крупного рогатого скота, умерших от сибирской язвы, и поджигание зараженного поля, поскольку споры сибирской язвы не могут быть адекватно уничтожены другими способами. Британский закон даже предусматривает, что зараженных сибирской язвой животных нельзя вскрывать перед сжиганием.
iii. Стерилизатор горячим воздухом :
В стерилизаторе горячего воздуха для стерилизации используется излучение сухого тепла. Ее еще называют духовкой с горячим воздухом. Он состоит из трех стен и двух воздушных пространств. Наружные стены покрыты толстым асбестом, чтобы уменьшить тепловое излучение. Коллектор горелки проходит по обеим сторонам и сзади между внешней и промежуточной стенками. Конвекционные токи проходят полный контур через пространство стены и внутреннее пространство печи, а продукты сгорания выходят через отверстие в верхней части.
Стерилизатор горячего воздуха работает при температуре от 160 до 180 ° C. (От 320 до 356 ° F) в течение 1,5 часов. Если температура поднимется выше 180 ° C, существует опасность обугливания ватных пробок. Поэтому сначала необходимо внимательно следить за термометром, пока стерилизатор не установит желаемую температуру. Необходимости наблюдения за стерилизатором можно избежать, если снабдить духовку регулятором температуры.
Воздействие сухого тепла на микроорганизмы эквивалентно действию выпечки.Тепло изменяет микробные белки в результате реакций окисления и создает засушливую внутреннюю среду, тем самым медленно сжигая микроорганизмы. Важно, чтобы с материалов были удалены органические вещества, такие как масляные или жировые пленки, поскольку органические вещества изолируют от сухого тепла. Кроме того, время, необходимое для достижения температурой стерилизации, варьируется в зависимости от материала. Таким образом, этот фактор необходимо учитывать при определении общего времени воздействия.
Стерилизатор горячим воздухом используется для стерилизации всех видов лабораторной посуды, например, пробирок, пипеток, чашек Петри и колб.Кроме того, его можно использовать для стерилизации других лабораторных материалов и оборудования, которые не сгорают из-за высокой температуры стерилизатора. Ни при каких условиях нельзя использовать стерилизатор с горячим воздухом для стерилизации питательных сред, так как жидкости могут выкипеть досуха.
iv. Стерилизатор Arnold (кипящая вода) :
Погружение в кипящую воду — это первый из нескольких методов влажного тепла, которые мы рассмотрим. Влажное тепло проникает в материалы намного быстрее, чем сухое тепло, поскольку молекулы воды проводят тепло лучше, чем воздух.Следовательно, требуются более низкие температуры и меньшее время воздействия, чем при сухом нагреве.
Arnold использует струю пара в качестве стерилизующего агента. Стерилизатор имеет основу для быстрого пропаривания, в которую автоматически подается вода из открытого резервуара. Вода проходит из открытого резервуара через небольшие отверстия в паровую подставку, к которой подводится тепло. Поскольку основание содержит лишь тонкий слой воды, пар вырабатывается очень быстро. Пар поднимается через воронку в центре аппарата и проходит в стерилизационную камеру.
Влажное тепло убивает микроорганизмы, денатурируя их белки. Денатурация включает изменения химических или физических свойств белков. Он включает структурные изменения из-за разрушения химических связей, удерживающих белки в трехмерной форме.
Когда белки возвращаются к двумерной структуре, они коагулируют (денатурируют) и становятся нефункциональными. Яичный белок претерпевает аналогичную трансформацию при варке. Вы можете найти обзор химической структуры белков, который поможет вам понять этот процесс.Коагуляция и денатурация белков требует меньше энергии, чем окисление, и поэтому требуется меньше тепла.
Стерилизация осуществляется потоком пара с температурой около 100 ° C. (212 ° F) в течение 20 минут или дольше в течение трех дней подряд. Продолжительность периода нагрева будет зависеть от природы обрабатываемых материалов и размера контейнера. Например, агар необходимо сначала полностью растопить, прежде чем регистрировать начало периода нагрева.
Необходимо помнить, что температура 100 ° C. на 20 мин. недостаточно для уничтожения спор. Для полной стерилизации за одну операцию в течение относительно короткого периода воздействия требуется гораздо более высокая температура.
Принцип, лежащий в основе этого метода, заключается в том, что первый период нагрева убивает все присутствующие вегетативные клетки. По прошествии 24 часов. в благоприятной среде и при теплой температуре споры, если они есть, прорастут в вегетативные клетки.Второй нагрев снова уничтожит все вегетативные клетки.
Бывает, что до второго отопительного периода не все споры переходят в вегетативные формы. Таким образом, дополнительные 24 ч. дается период, чтобы убедиться, что все споры проросли в вегетативные клетки. Можно видеть, что до тех пор, пока споры не прорастут, метод не сможет стерилизовать.
v. Фракционная стерилизация:
В годы, предшествовавшие разработке автоклава, жидкости и другие предметы стерилизовали путем воздействия паром на свободном токе при 100 ° C в течение 30 минут в каждый из трех последовательных дней.Этот метод был назван фракционной стерилизацией, потому что фракция выполнялась каждый день. Ее также называли тиндаллизацией в честь ее разработчика, Джона Тиндалла, и периодической стерилизацией, потому что это была операция с остановкой и запуском.
Стерилизация дробным методом достигается интересной серией мероприятий. В течение первого дня воздействия пар убивает практически все организмы, кроме спор бактерий, и стимулирует их прорастание в вегетативные клетки. Во время инкубации в течение ночи клетки размножаются и погибают на второй день.
Опять же, материал охлаждают, и несколько оставшихся спор прорастают, чтобы погибнуть только на третий день. Хотя этот метод обычно приводит к стерилизации, возникают случаи, когда несколько спор не прорастают. Этот метод также требует, чтобы споры находились в подходящей среде для прорастания, такой как бульон.
Фракционная стерилизация приобрела важное значение в современной микробиологии с развитием высокотехнологичного оборудования и новых химических веществ. Часто эти материалы невозможно стерилизовать при температурах автоклава, длительных периодах кипячения или запекания или с помощью химикатов.В этих случаях используется инструмент, генерирующий свободный пар, такой как стерилизатор Arnold.
vi. Пастеризация :
Пастеризация — это не то же самое, что стерилизация. Его цель — уменьшить бактериальную популяцию жидкости, такой как молоко, и уничтожить организмы, которые могут вызвать порчу и болезни человека. Пастеризация не влияет на споры.
Один из методов пастеризации молока, называемый методом выдержки, включает нагрев до 62 ° C.9 ° C в течение 30 минут. Хотя термофильные бактерии процветают при этой температуре, они не имеют большого значения, поскольку не могут расти при температуре тела.
На протяжении десятилетий пастеризация была направлена на уничтожение Mycobacterium tuberculosis, долгое время считавшейся самой термостойкой бактерией. Однако в последнее время внимание переключилось на уничтожение Coxiella burnetii, возбудителя Ку-лихорадки, поскольку этот организм имеет более высокую устойчивость к теплу.
Два других метода пастеризации — это метод мгновенной пастеризации на 71.6 ° C в течение 15 секунд и метод ультрапастеризации при 82 ° C в течение 3 секунд.
vii. Осушение :
Помимо замораживания, многие продукты консервируются сушкой. Вода необходима для роста микробов. Хотя недостаток доступной воды предотвращает рост микробов, это не обязательно увеличивает уровень смертности микроорганизмов. Поэтому некоторые микроорганизмы можно сохранить путем сушки.
Можно легко купить активные сухие дрожжи для выпечки, и после добавления воды дрожжи начинают осуществлять активный обмен веществ.Сублимационная сушка или лиофилизация — распространенные способы удаления воды, которые можно использовать для сохранения микробных культур. Во время сублимационной сушки вода удаляется сублимацией. Этот процесс обычно исключает повреждение микробных клеток из-за расширения кристаллов льда.
В то время как некоторые микроорганизмы относительно устойчивы к высыханию, другие микроорганизмы не могут выжить в условиях высыхания даже в течение короткого периода времени. Например, Treponema pallidum, бактерия, вызывающая сифилис, чрезвычайно чувствительна к высыханию и почти мгновенно умирает на воздухе или на сухой поверхности.
Тот факт, что микроорганизмы не могут расти при низкой активности воды, может быть использован для сохранения многих продуктов. Соление было одним из первых способов консервирования продуктов и используется до сих пор. При добавлении соли в высоких концентрациях A w достаточно снижается, чтобы предотвратить рост большинства микроорганизмов.
Холст и другие текстильные изделия сохраняются в зонах умеренного климата из-за недостатка воды в воздухе, но в тропических зонах эти же материалы подвержены биологическому разложению, поскольку влажность достаточно высока для роста микробов.Открытые деревянные поверхности часто окрашивают, чтобы древесина оставалась достаточно сухой, чтобы предотвратить рост микробов. Многие пищевые продукты также сохраняются путем сушки.
Этот метод консервации зависит от содержания продукта в сухом состоянии, а воздействие высокой влажности может нейтрализовать фактор, ограничивающий рост микробов, и способствовать микробной порче пищевых продуктов, хранящихся таким образом. Если пищевые продукты можно поддерживать при значении A w 0,65 или меньше, вероятность порчи в течение нескольких лет маловероятна.Продукты, консервированные путем сушки, включают фрукты, овощи, яйца, крупы, зерно, мясо и молоко.
Физический контроль другими методами:
Фильтрация :
Тепло — ценный физический агент для борьбы с микроорганизмами, но иногда его важно использовать. Например, никто не предложит удалить микробную популяцию со столешницы с помощью горелки Бунзена, а термочувствительные растворы нельзя подвергать автоклаву.В таких случаях, как этот и многие другие, необходимо использовать метод без нагрева. В этом разделе описаны некоторые примеры.
Фильтры стали широко использоваться в микробиологии, когда в 1890-х годах возрос интерес к вирусам. Раньше фильтры использовались для улавливания переносимых по воздуху организмов и стерилизации бактериологических сред, но теперь они стали неотъемлемой частью технологии фильтрации — Чарльз Чемберленд, сотрудник Пастера. Его фарфоровый фильтр был важен для ранних исследований вирусов. Другим пионером был Юлиус Петри (изобретатель чашки Петри), который разработал песочный фильтр для отделения бактерий от воздуха.
Фильтр — это механическое устройство для удаления микроорганизмов из раствора. Когда жидкость проходит через фильтр, организмы попадают в поры фильтрующего материала. Раствор, капающий в приемную емкость, обеззараживают или, в некоторых случаях, стерилизуют. Фильтры используются для очистки таких вещей, как растворы для внутривенного введения, бактериологические среды, многие фармацевтические препараты и напитки.
Для использования в микробиологической лаборатории доступны несколько типов фильтров.
и. Фарфоровые или камерные фильтры :
Фарфоровые фильтры представляют собой полые неглазурованные цилиндры, закрытые с одного конца. Они состоят из водного силиката алюминия или каолина с добавлением кварцевого песка и нагреваются до достаточно низкой температуры, чтобы избежать спекания. Эти фильтры изготавливаются с градуированной степенью пористости от LI до LI3.
Цилиндры с самыми большими порами имеют маркировку LI; те, которые имеют самые маленькие поры, обозначаются LI3.Чем мельче поры, тем медленнее будет скорость фильтрации. Цилиндры LI и L2 — это фильтры предварительной очистки, предназначенные для удаления крупных частиц и крупных бактерий. Фильтр L3, вероятно, подходит для всех типов бактериальной фильтрации.
ii. Фильтры Berkefeld :
Кизельгур представляет собой отложение тонкого, обычно белого кремнистого порошка, состоящего в основном или полностью из остатков диатомовых водорослей. Его еще называют диатомитовой землей и инфузорной землей.
Фильтры Berkefeld производятся в Германии. Их получают путем смешивания тщательно очищенной диатомовой земли с асбестом и органическими веществами, прессования в цилиндрическую форму и сушки. Высушенные цилиндры нагревают в печи до температуры около 2000 ° C. чтобы связать материалы вместе. Затем обожженным цилиндрам придают необходимую форму и размер.
Цилиндры подразделяются на W (плотные), N (нормальные) и V (крупные), в зависимости от размера пор.Градация зависит от скорости потока чистой фильтрованной воды при определенном постоянном давлении.
iii. Мандлерные фильтры :
Эти фильтры аналогичны фильтрам типа Berkefeld, но производятся в этой стране. Они состоят из 60-80% диатомитовой земли, 10-30% асбеста и 10-15% гипса. Пропорции меняются в зависимости от размера желаемых пор. Ингредиенты смешивают с водой, подвергают воздействию высокого давления, а затем запекают в духовке при температуре от 980 до 1650 ° C.чтобы связать материалы вместе.
Готовые цилиндры испытывают путем подсоединения трубки к ниппелю фильтра, погружения в воду и пропускания сжатого воздуха внутрь. Манометр регистрирует давление, когда пузырьки воздуха впервые появляются на внешней стороне цилиндра в воде. На каждом баллоне указывается давление воздуха, полученное при реальных испытаниях.
Удобное расположение аппарата для фильтрации жидкостей через фильтр Мандлера или Беркфельда показано на рис.3.10. Пониженное давление отображается манометром. Отфильтровываемая жидкость выливается в мантию, а фильтрат собирается в градуированный сосуд, из которого он может быть извлечен в асептических условиях. Фильтрацию можно прервать в любой момент, остановив вакуумный насос и открыв запорный кран на баллоне-ловушке для выравнивания давления.
iv. Стеклянные фильтры :
Фильтры этого типа получают путем спекания тонко измельченного стекла в диск в подходящей форме.Измельченное стекло нагревается до температуры, достаточно высокой, чтобы частицы превратились в сплошную твердую массу без полного плавления и оставления диска пористым.
Затем диск осторожно превращают в стеклянную воронку и собирают в фильтровальную колбу с помощью резиновой пробки. Другой вариант — соединение фильтра с колбой через соединение из матового стекла, что исключает необходимость использования резиновой пробки.
Фильтры продаются с пятью степенями пористости: EC (очень грубая), C (грубая), M (средняя), F (тонкая) и UF (сверхтонкая).
Бактериологические фильтры обычно используются в условиях пониженного давления; Буш (1946) рекомендовал фильтрацию через стеклянные фильтры с использованием положительного давления. Положительное давление не только снижает или устраняет испарение фильтрата, но и значительно облегчает замену приемников, что особенно важно при бактериологической фильтрации, с которой необходимо обращаться с соблюдением правил асептики.
Удобное расположение показано на рис. 3.13. Основной корпус фильтра B содержит диск из фриттованного стекла.Щиток А защищает ресивер от пыли, а на напорном элементе находится запорный кран. Альтернативное давление позволяет удерживать напор. C ’содержит встроенный ртутный манометр. Запорный кран на C (C ’) позволяет сохранять давление после отсоединения устройства от источника сжатого воздуха.
Обычный резиновый баллон высокого давления подходит для создания давления до 450 мм. Меркурий. Если стыки матового стекла хорошо смазаны и детали удерживаются вместе прочными резиновыми лентами или пружинами, аппарат должен удерживать это давление в течение нескольких дней.
v. Асбестовые фильтры :
Самый известный фильтр, в котором в качестве фильтрующего материала используется асбест, — это фильтр Зейтца. Асбест спрессовывается в тонкие диски и плотно зажимается между двумя гладкими металлическими ободами с помощью трех винтовых зажимов. Жидкость, подлежащая фильтрации, наливается в металлический аппарат, в котором зажимается асбестовый диск, и раствор, всасываемый вакуумом, фильтрующие диски способны эффективно задерживать бактерии и другие твердые частицы.
В конце операции асбестовый диск извлекается, вставляется новый и стерилизуется собранный фильтр. Эта особенность делает фильтр Зейтца очень удобным в использовании, поскольку не требует предварительной очистки.
Модификация фильтра Зейтца, использующая центробежную силу вместо всасывания или давления, была предложена Бёрнером. Фильтр состоит из цилиндра и воронкообразной части со штоком, который удерживает фильтрующую прокладку, опирающуюся на диск из проволочной сетки.Цилиндр ввинчивается в воронку с зажатым между ними фильтрующим диском.
Собранный фильтр плотно помещается в верхнюю часть 15 мл. металлическая пробирка для центрифуги с рифленым воротником воронки, опирающимся на верхнюю часть металлической пробирки. Фильтрат собирается в стеклянной трубке внутри чашки. Фильтр также можно использовать для вакуумной фильтрации обычным способом, вставив шток через резиновую пробку, установленную на колбе фильтра.
vi. Фильтр Дженкинса :
Этот фильтр состоит из металлического кожуха, удерживающего мягкую резиновую втулку, и фарфорового фильтрующего блока.Фарфоровый блок удерживается в резиновой гильзе и становится водонепроницаемым путем скручивания двух металлических частей. Блок фильтра не хрупкий. Его моют после каждого использования, сушат и надевают на мантию. Мантия снабжена резиновой пробкой, завернута в бумагу и стерилизована в автоклаве.
Фильтр предназначен для стерилизации небольших количеств жидкостей.
vii. Ультрафильтр :
Ультрафильтрация обычно означает отделение коллоидных частиц от их растворителей и кристаллоидов с помощью желейных фильтров, известных как ультрафильтры.
Ранние желейные фильтры состояли из желатина и кремниевой кислоты, но они были заменены коллодием в форме мембраны или мешочка, или коллодием, нанесенным на пористую несущую структуру. Поддерживающей структурой может быть фильтровальная бумага в виде листа и наперстка, неглазурованные фарфоровые чашки и тигли, воронки Бюхнера, цилиндры фильтров и т. Д.
viii. Мембранный фильтр :
Мембранный фильтр — это третий тип фильтров, получивший широкое распространение.Он состоит из прокладки из органических соединений, таких как ацетат целлюлозы или поликарбоната, установленной в удерживающем устройстве. Этот фильтр особенно ценен, потому что бактерии размножаются и образуют колонии на фильтрующей подушке, когда подушку помещают на чашку с питательной средой.
Затем микробиологи могут подсчитать колонии, чтобы определить количество изначально присутствующих бактерий. Например, если образец жидкости объемом 100 мл был профильтрован и после инкубации на подушке появилось 59 колоний, можно было предположить, что в образце присутствовало 59 бактерий.
ix. Очистка фильтров :
Некоторые фильтры выбрасываются после каждого использования и устанавливаются новые; другие предназначены для очистки после каждой фильтрации и при надлежащем уходе могут использоваться повторно. Коллодиевые мембраны легко приготовить, а асбестовые диски Seitz относительно невысоки. Эти фильтры предназначены для однократного использования, а затем выбрасываются. С другой стороны, фильтры из фарфора, диатомита и фриттованного стекла слишком дороги, чтобы их можно было использовать только один раз, но их легко чистить.
Фарфоровые фильтры очищают, помещая их в муфельную печь и нагревая до красного каления. Это сжигает органические вещества в порах и восстанавливает фильтры до их первоначального состояния.
Фильтры типа Berkefeld и Mandler очищаются путем помещения цилиндров в специальный металлический держатель, соединенный с краном. Поток воды меняется на противоположный, проходя через цилиндр изнутри наружу. Так следует продолжать до тех пор, пока все посторонние предметы не будут вымыты из пор фильтра.
Белковые или аналогичные материалы, оставшиеся в порах фильтров, вероятно, коагулируют под воздействием тепла в процессе стерилизации, в результате чего фильтры забиваются. Фильтры в таком состоянии бесполезны для дальнейшей работы.
Засоренные фильтры можно очистить различными способами, но, вероятно, наиболее удобно путем непрерывного отсасывания полноразмерного Clorox или аналогичного раствора в течение 5–15 минут. Эта обработка быстро растворяет коагулированный материал и восстанавливает работоспособность фильтра.Для удаления последних следов окисляющего раствора необходима тщательная промывка.
Фильтры из фриттованного стекла можно очищать обработкой концентрированной серной кислотой, содержащей нитрат натрия. Сильная кислота быстро окисляет и растворяет органические вещества. Для удаления последних следов кислоты необходима тщательная промывка.
2. Радиационный метод:и. Стерилизация ультрафиолетовым светом :
Видимый свет — это вид лучистой энергии, обнаруживаемой чувствительными клетками глаза.Длина волны этой энергии составляет от 400 до 800 нанометров (нм). Другие типы излучения имеют длину волны длиннее или короче, чем у видимого света, и поэтому они не могут быть обнаружены человеческим глазом.
Один из видов лучистой энергии, ультрафиолетовый свет, полезен для борьбы с микроорганизмами. Ультрафиолетовый свет имеет длину волны от 100 до 400 нм, а энергия около 265 нм наиболее разрушительна для бактерий. Когда микроорганизмы подвергаются воздействию ультрафиолета, клеточная ДНК поглощает энергию, а соседние молекулы тимина соединяются вместе.
Связанные молекулы тимина не могут позиционировать аденин на молекулах информационной РНК в процессе синтеза белка. Более того, репликация хромосомы при бинарном делении нарушена. Поврежденный организм больше не может производить критически важные белки или воспроизводиться, и он быстро умирает.
Ультрафиолетовый свет эффективно уменьшает микробную популяцию там, где имеет место прямое воздействие. Он используется для ограничения воздушного или поверхностного загрязнения в больничной палате, морге, аптеке, туалете или в сфере общественного питания.Примечательно, что ультрафиолетовое излучение солнца может быть важным фактором в борьбе с микроорганизмами в воздухе и верхних слоях почвы, но не может быть эффективным против всех спор бактерий. Ультрафиолетовый свет не проникает в жидкости или твердые тела и может вызвать повреждение клеток кожи человека.
ii. Ионизирующее излучение :
Высокоэнергетическое коротковолновое излучение разрушает молекулы ДНК, а воздействие коротковолнового излучения может вызвать мутации, многие из которых смертельны.Воздействие гамма-излучения (короткие волны 10 -3 -10 -1 нанометров), рентгеновского излучения (длины волн 10 -3 -10 2 нм) и ультрафиолетового излучения (ультрафиолетовое излучение с длинами волн 100 -400 нанометров) увеличивает уровень смертности микроорганизмов и используется в различных процедурах стерилизации для уничтожения микроорганизмов. Вирусы, как и другие микроорганизмы, инактивируются под действием ионизирующего излучения.
Чувствительность к ионизирующему излучению разная.Устойчивость к ионизирующему излучению основана на биохимических составляющих данного микроорганизма. Невоспроизводящиеся (спящие) стадии микроорганизмов, как правило, более устойчивы к радиации, чем растущие организмы. Например, эндоспоры более устойчивы, чем вегетативные клетки многих видов бактерий.
Воздействие 0,3-0,4 Мрад (миллион единиц радиации) необходимо, чтобы вызвать десятикратное уменьшение количества жизнеспособных бактериальных эндоспор. Исключение составляет бактерия Micrococcus radiodurans, которая особенно устойчива к воздействию ионизирующего излучения.
Вегетативные клетки M. radiodurans выдерживают воздействие ионизирующего излучения до 1 Мрад без снижения количества жизнеспособных клеток. Похоже, что эффективные механизмы репарации ДНК ответственны за высокую степень устойчивости этой бактерии к радиации.
Ионизирующее излучение используется для пастеризации или стерилизации некоторых продуктов. Некоторые коммерчески производимые пластиковые чашки Петри стерилизуются воздействием гамма-излучения. В большинстве процедур стерилизации, связанных с облучением, используется гамма-излучение кобальта-60 или цезия-137.
Бекон, например, можно стерилизовать с помощью радаппертизации, процесса стерилизации пищевых продуктов воздействием радиации с использованием доз облучения 4,5-5,6 Мрад. Гадуризация, функционально эквивалентная пастеризации, используется для уничтожения неспорообразующих патогенов человека, которые могут присутствовать в пище. Радуризацию можно использовать для увеличения срока хранения морепродуктов, овощей и фруктов.
В отличие от гамма-излучения, ультрафиолетовый свет не обладает высокой проникающей способностью и полезен для уничтожения микроорганизмов только на поверхности прозрачных растворов или рядом с ними.Самая сильная бактерицидная длина волны 260 нанометров совпадает с максимумами поглощения ДНК, что позволяет предположить, что главный механизм, с помощью которого ультрафиолетовый свет оказывает свое смертельное действие, заключается в разрушении ДНК. Фактически, ультрафиолетовый свет вызывает образование ковалентно связанных димеров тимина в ДНК вместо обычных пар оснований с водородными связями тимина-аденина.
У микроорганизмов есть ферменты, которые могут восстанавливать изменения в ДНК, вызванные воздействием ультрафиолета.Ферменты фотореактивации требуют воздействия света в видимой области спектра. Воздействие ультрафиолетового света иногда используется для поддержания стерильности некоторых поверхностей. В некоторых больницах рабочие столы очищаются от бактерий, когда они не используются, с помощью ультрафиолетовой лампы.
Опасности, связанные с воздействием на человека избыточного ультрафиолетового излучения, включая слепоту при прямом просмотре ультрафиолетового света, привели к использованию альтернативных методов поддержания стерильности таких участков.
Подобно ультрафиолетовому излучению, длинноволновое инфракрасное излучение (103-105 нанометров) и микроволновое излучение (длины волн более 106 нанометров) имеют низкую проникающую способность. Инфракрасное и микроволновое излучение не убивает микроорганизмы напрямую. Однако поглощение такого длинноволнового излучения приводит к повышению температуры.
Таким образом, воздействие инфракрасного или микроволнового излучения может косвенно убить микроорганизмы, подвергая их воздействию температур, превышающих их максимальные температуры роста.Поскольку микроволны, как правило, не убивают микроорганизмы напрямую, в пищевой промышленности существует некоторая озабоченность по поводу того, что приготовление пищи в микроволновых печах может не убить в достаточной мере микроорганизмы, загрязняющие пищевые продукты.
3. Ультразвуковой метод:Ультразвуковые колебания :
Ультразвуковые колебания — это высокочастотные звуковые волны, выходящие за пределы диапазона человеческого уха. Направленные на поверхности окружающей среды, они не имеют большого значения, потому что частицы воздуха отклоняют и рассеивают колебания.Однако при распространении в жидкости ультразвуковые колебания вызывают образование микроскопических пузырьков или полостей, и вода кажется кипящей. Некоторые обозреватели называют это «холодным кипячением».
Полости быстро разрушаются и излучают ударные волны. Микроорганизмы в жидкости быстро разрушаются под воздействием внешнего давления. Формирование и сжатие полостей известно как кавитация.
Ультразвуковые колебания ценны в исследованиях для разрушения открытых клеток тканей и получения их частей для изучения.Устройство, называемое кавитроном, используется стоматологами для чистки зубов, а ультразвуковые аппараты доступны для чистки зубных пластин, украшений и монет. Крупная компания по производству бытовой техники также экспериментировала с ультразвуковой стиральной машиной.
В качестве стерилизующего агента ультразвуковым колебаниям уделялось минимальное внимание, поскольку требуется жидкость, а другие методы более эффективны. Однако многие исследовательские лаборатории используют ультразвуковые датчики для разрушения клеток, а больницы используют ультразвуковые устройства для очистки своих инструментов.При использовании с эффективным бактерицидным средством ультразвуковое устройство может обеспечить стерилизацию, но современная тенденция заключается в использовании ультразвуковых колебаний в качестве чистящего средства и последующей стерилизации в автоклаве.
4. Химический метод:и. Методы консервации :
На протяжении многих веков развивались различные физические методы борьбы с микроорганизмами в пищевых продуктах. Хотя эти процедуры полезны для предотвращения распространения инфекционных агентов, они используются в основном для предотвращения порчи и продления срока хранения пищевых продуктов, а не для стерилизации.
Сушка используется для консервирования различных металлов, рыбы, злаков и других продуктов. Поскольку вода является необходимым условием для жизни, отсюда следует, что там, где нет воды, практически нет жизни. Многие продукты в кухонной кладовой олицетворяют этот принцип. Один пример обсуждается в MicroFocus.
Консервация солением основана на принципе осмотического давления. Когда пища солится, вода диффундирует из микроорганизмов с более высокой концентрацией соли и более низкой концентрацией воды в окружающей среде.Этот поток воды, называемый осмосом, заставляет микроорганизмы сморщиваться и умирать.
То же явление наблюдается в продуктах с высоким содержанием сахара, таких как сиропы, джемы и желе. Однако грибковое заражение может оставаться на поверхности, потому что аэробные плесени переносят высокие концентрации сахара.
Низкие температуры холодильника и морозильника замедляют порчу продуктов за счет снижения скорости метаболизма микроорганизмов и, как следствие, уменьшения скорости их роста. Однако порча холодных продуктов не устраняется полностью, и многие микроорганизмы остаются живыми даже при температурах морозильной камеры.Эти организмы быстро размножаются при оттаивании пищи, поэтому рекомендуется быстрое приготовление.
Обратите внимание, что в этих примерах существуют значительные различия между уничтожением микроорганизмов, сдерживанием их и уменьшением их численности. Методы консервации называются бактериостатическими, поскольку они предотвращают дальнейшее размножение бактерий.
ii. Газовая стерилизация :
Тепловая стерилизация в основном нестабильна для термолабильных твердых лекарств и термолабильного оборудования, включая изделия из пластмасс, хрупкие резиновые изделия.Из-за высоких капитальных затрат и применения сложных мер предосторожности радиационный метод, который является одним из методов стерилизации, стал непопулярным.
Таким образом, стерилизация таких материалов химическим веществом в газообразном состоянии находит большее применение. Раньше формальдегид широко использовался, но в настоящее время оксид этилена является единственным соединением, имеющим выдающееся значение в фармацевтической и медицинской областях.
6.14A: Тепло — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Стерилизация влажным теплом
- Стерилизация сухим теплом
- Ключевые моменты
- Ключевые термины
Цели обучения
- Оценить тепло как средство микробиологического контроля
Нагревание бактериальных сред и посуды в исследованиях и медицине, а также для стерилизации пищевых продуктов является одним из наиболее распространенных методов контроля роста бактерий.Для стерилизации используются разные методы и инструменты.
Стерилизация влажным теплом
Влажное тепло вызывает разрушение микроорганизмов путем денатурации макромолекул, в первую очередь белков. Автоклавирование (приготовление под давлением) — очень распространенный метод влажной стерилизации. Он эффективен в уничтожении грибов, бактерий, спор и вирусов, но не обязательно устраняет прионы. При такой стерилизации образцы помещаются в паровую камеру. Камера закрывается и нагревается, так что пар вытесняет воздух из вентиляционных отверстий или выхлопов.Затем прикладывают давление, чтобы внутренняя температура достигла 121 ° C. Эта температура поддерживается от 15 до 30 минут. Эта повышенная температура и давление достаточны для стерилизации образцов любых обычно встречающихся микробов или спор. Затем камере дают возможность медленно остыть или за счет пассивного рассеивания тепла.
Стерилизация под давлением — преобладающий метод медицинской стерилизации термостойких инструментов. Он также используется для стерилизации материалов для микробиологии и других областей, требующих асептической техники.Чтобы облегчить эффективную стерилизацию паром и давлением, используется несколько методов проверки и индикации; к ним относятся меняющие цвет индикаторные ленты и биологические индикаторы. Для любого метода стерилизации влажным теплом обычно используются биологические индикаторы в качестве средства проверки и подтверждения. При использовании биологических индикаторов образцы, содержащие споры термостойких микробов, таких как Geobacillus stearothermophilis , стерилизуются вместе со стандартной загрузкой, а затем инкубируются в стерильных средах (часто содержащихся в образце в стеклянной ампуле, которую необходимо разбить после стерилизации).Изменение цвета среды (указывающее на продукцию кислоты бактериями; требуется, чтобы среда была составлена для этой цели) или появление помутнения (помутнение, указывающее на рассеяние света бактериальными клетками) указывает на то, что стерилизация не была достигнута и цикл стерилизации может нуждаться в пересмотре. или улучшение. Другими влажными методами являются кипячение образцов в течение определенного периода времени и тиндаллизация. Кипячение не помогает избавиться от спор. Тиндаллизация также инактивирует споры, но это более длительный процесс.
Рисунок: Автоклав : Большой автоклав, используемый для влажной стерилизации сред и оборудованияСтерилизация сухим жаром
Сухое тепло уничтожает микроорганизмы, вызывая коагуляцию белков. Процесс стерилизации сухим жаром осуществляется кондуктивным способом; именно здесь тепло поглощается внешней поверхностью предмета и затем передается внутрь следующему слою. В конце концов, все изделие достигает нужной температуры, необходимой для стерилизации.Время и температура стерилизации сухим жаром составляет 160 ° C в течение 2 часов или 170 ° C в течение 1 часа. Инструменты должны быть высушены перед стерилизацией, так как вода будет мешать процессу. Другие методы тепловой стерилизации включают в себя пламя и сжигание. Пламя обычно используется для стерилизации небольшого оборудования, используемого для асептических манипуляций с бактериями. Если оставить контуры переноса в пламени горелки Бунзена или спиртовой лампы до тех пор, пока они не загорятся красным, это гарантирует, что любой инфекционный агент будет инактивирован. Обычно это используется для небольших металлических или стеклянных предметов, но не для больших предметов (см. Сжигание ниже).Однако во время первоначального нагрева инфекционный материал может «разбрызгиваться» с поверхности проволоки до того, как он погибнет, загрязняя близлежащие поверхности и предметы. Поэтому были разработаны специальные нагреватели, которые окружают инокуляционную петлю нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять область. Другая проблема заключается в том, что газовое пламя может оставлять на объекте загрязнения, например углерод, если объект недостаточно нагрет. Вариант пламени заключается в том, чтобы окунуть объект в 70% этанол (или более высокую концентрацию) и просто прикоснуться им на короткое время к пламени горелки Бунзена, но не удерживать его в газовом пламени.Этанол загорится и сгорит через несколько секунд. 70% этанол убивает многие, но не все, бактерии и вирусы. Его преимущество в том, что он оставляет меньше остатков, чем газовое пламя. Этот метод хорошо подходит для стеклянных разносчиков бактерий в форме «хоккейной клюшки». Сжигание также сожжет любой организм дотла. Он используется для дезинфекции медицинских и других биологически опасных отходов, прежде чем они будут выброшены вместе с неопасными отходами.
Ключевые моменты
- Для стерилизации используются разные методы.Одним из наиболее распространенных является применение влажного тепла, которое включает автоклавирование (приготовление под давлением), кипячение и тиндаллизацию.
- Стерилизация сухим жаром осуществляется методом кондукции и широко используется для инструментов.
- Другие методы нагрева включают пламя и сжигание. Пламя обычно используется для стерилизации небольшого оборудования, используемого для асептических манипуляций с бактериями.
Ключевые термины
- стерилизация : Любой процесс, который устраняет или уничтожает все формы микробной жизни, присутствующие на поверхности, растворе или твердом соединении.
- Тиндаллизация : Тиндаллизация — это процесс трех последовательных паровых обработок для достижения стерилизации в течение трех дней. Это работает, убивая вегетативные клетки, позволяя прорастать выжившим спорам и убивая образовавшиеся вегетативные клетки, прежде чем они успеют сформировать новые споры.
Методы лабораторной стерилизации: 6 эффективных методов
Эффективные методы лабораторной стерилизации необходимы для работы с изолированными клеточными линиями.По очевидным причинам вы не хотите, чтобы в вашей хорошей культуральной среде росли насекомые из окружающей среды, и, в равной степени, культуры необходимо стерилизовать перед утилизацией. Если вы не используете микробиологические микроскопы для просмотра своих культур, вы можете не знать о каких-либо нежелательных микробах-гостях. Пришло время усовершенствовать различные методы лабораторной стерилизации и то, как они работают, чтобы ваши клетки оставались здоровыми, счастливыми и свободными от насекомых.
6 Общепринятых методов лабораторной стерилизации
1. Влажное тепло (автоклавирование)
В большинстве лабораторий наиболее предпочтительным методом стерилизации является автоклавирование: использование пара под давлением для нагрева стерилизуемого материала.Это очень эффективный метод, который убивает все микробы, споры и вирусы, хотя для некоторых конкретных ошибок требуются особенно высокие температуры или время инкубации.
Автоклавирование убивает микробы путем гидролиза и коагуляции клеточных белков, что эффективно достигается за счет интенсивного нагрева в присутствии воды.
Сильный жар исходит от пара. Пар под давлением имеет высокую скрытую теплоту; при 100 o C он удерживает в 7 раз больше тепла, чем вода при той же температуре.Это тепло выделяется при контакте с более холодной поверхностью стерилизуемого материала, что обеспечивает быструю доставку тепла и хорошее проникновение плотных материалов.
При такой температуре вода отлично гидролизует белки… так что у этих насекомых нет ни единого шанса.
2. Сухой жар (пламя, выпечка)
Сухой нагрев имеет одно важное отличие от автоклавирования. Вы уже догадались — воды нет, поэтому гидролиз белка не может происходить.
Напротив, сухое тепло убивает микробы за счет окисления клеточных компонентов.Это требует больше энергии, чем гидролиз белка, поэтому для эффективной стерилизации сухим жаром требуются более высокие температуры.
Например, стерилизация обычно достигается за 15 минут путем автоклавирования при 121 o ° C, тогда как для сухого нагрева обычно требуется температура 160 ° ° C для стерилизации за такое же время.
3. Фильтрация
Фильтрация — отличный способ быстро стерилизовать растворы без нагрева. Фильтры, конечно же, работают, пропуская раствор через фильтр с диаметром пор, который слишком мал для прохождения микробов.
Фильтры могут быть воронками из спеченного стекла, изготовленными из плавленых стеклянных частиц, или, что чаще всего в наши дни, мембранными фильтрами, изготовленными из сложных эфиров целлюлозы. Для удаления бактерий обычно используются фильтры со средним диаметром пор 0,2 мкм.
Но помните, что вирусы и фаги могут проходить через эти фильтры, поэтому фильтрация не является хорошим методом стерилизации в лаборатории, если это вызывает беспокойство.
4. Растворители
Этанол обычно используется в качестве дезинфицирующего средства, но изопропанол является лучшим растворителем жира и, вероятно, лучшим вариантом.
Оба растворителя работают, денатурируя белки посредством процесса, для которого требуется вода, поэтому для обеспечения эффективности их необходимо разбавить водой до 60–90%.
Опять же, важно помнить, что, хотя этанол и IPA хороши в уничтожении микробных клеток, они не влияют на споры.
5. Радиация
УФ, рентгеновские лучи и гамма-лучи — это все типы электромагнитного излучения, которые оказывают глубокое разрушающее воздействие на ДНК, поэтому они являются отличными инструментами для стерилизации.
Основное различие между ними с точки зрения их эффективности — их проникновение.
UV имеет ограниченное проникновение в воздух, поэтому стерилизация происходит только на довольно небольшой площади вокруг лампы. Однако он относительно безопасен и весьма полезен для стерилизации небольших участков, например вытяжек с ламинарным потоком. (Очень важно не забыть стерилизовать и свое оборудование.)
Рентгеновские лучи и гамма-лучи гораздо более проникающие, что делает их более опасными, но очень эффективными для крупномасштабной холодной стерилизации пластиковых предметов (например,грамм. шприцы) в процессе изготовления.
6. Газовая стерилизация
Окись этилена может использоваться для стерилизации оборудования, чувствительного к теплу или влаге, и часто используется для стерилизации медицинского оборудования, такого как катетеры и стенты. Оксид этилена по существу предотвращает клеточный метаболизм и репликацию путем алкилирования. Поскольку оксид этилена легко абсорбируется, оборудование необходимо проветрить после стерилизации для удаления любых остатков. Оксид этилена также очень токсичен и может представлять ряд рисков для здоровья.Поскольку он обычно используется для продуктов здравоохранения, вы вряд ли будете использовать его в лаборатории.
Итак, это некоторые из основных методов лабораторной стерилизации. Если мы что-то упустили, сообщите нам об этом в комментариях.
Первоначально опубликовано 28 марта 2012 г. Проверено и обновлено в феврале 2021 г.
Вам это помогло? Тогда поделитесь, пожалуйста, со своей сетью.
Некоторые из различных методов стерилизации и их преимущества
Дерек Принс 26 апреля 2018 г.
[mkd_button size = «large» type = «solid» text = «Свяжитесь с нами» custom_class = «» icon_pack = «font_awesome» fa_icon = «» link = «/ contact» target = «_ self» color = «» hover_color = » ”Background_color =” ”hover_background_color =” ”border_color =” ”hover_border_color =” ”font_size =” 15 ″ font_weight = ”700 ″ margin =” ”]
В наших отраслевых компаниях важно иметь множество методов стерилизации, чтобы можно было использовать широкий спектр продуктов и оборудования, включая различные устройства, среды, медицинские инструменты и продукты.
В медицине и здравоохранении нет ничего важнее правильной стерилизации. Существует подходящий способ стерилизации для каждого элемента фармацевтической промышленности и здравоохранения. Это верно в отношении медицинского оборудования, медицинских устройств и фармацевтических препаратов, имплантатов и инъекционных вакцинаций.
На самом деле, если он находится в медицинском или фармацевтическом учреждении и находится где-то рядом с пациентом, скорее всего, он проходит какую-то стерилизацию.Для этих целей используется несколько различных типов стерилизации.
Чаще всего для стерилизации этих продуктов используется тепло, чтобы достичь SAL 10 -6 . Существует два различных типа тепловой стерилизации: стерилизация влажным теплом и стерилизация сухим теплом.
Стерилизация влажным теплом — Этот тип стерилизации использует влажность, водяной пар или пар при высоких температурах. Стерилизация паром влажным теплом достигается в автоклаве , — закрытом устройстве, которое стерилизует продукты паром под давлением.Обычно автоклавы являются предпочтительным методом стерилизации влажным теплом.
Преимущества — Проникающая природа пара и высокая летальность благодаря его эффективным свойствам теплопередачи делают его отличным решением для уничтожения белков любого микроорганизма через определенное время. Он экологически безопасен, не содержит токсичных побочных продуктов. Он имеет долгую и подтвержденную репутацию успеха и безопасности.
Стерилизация сухим жаром — Стерилизация сухим жаром обычно достигается с помощью таких методов, как использование печи с горячим воздухом.Наиболее распространенный метод стерилизации сухим жаром в медицинской и фармацевтической промышленности — это метод горячего воздуха в печи.
Преимущества — Стерилизация сухим жаром предпочтительна для термостойких продуктов, чувствительных к влаге. Депирогенизация, форма стерилизации сухим жаром, является предпочтительным методом сертификации важнейших производственных компонентов (например, стеклянной посуды) как свободных от эндотоксинов. Это полезная альтернатива термостойким материалам, когда иначе нельзя использовать воду или пар.
Жидкая химическая стерилизация — Эта форма стерилизации обычно используется для устройств, инструментов и инструментов, которые чувствительны к нагреванию, но не чувствительны к жидкости. Объект, нуждающийся в стерилизации, погружается в стерилизующую жидкость на заданное время, а затем проходит валидацию стерилизации, чтобы оценить, был ли он полностью стерилизован. Для этого процесса используются надуксусная кислота, глутаральдегид или комбинированные продукты. Необходимо тщательно удалить эти химические вещества.
Преимущества — Жидкая химическая стерилизация чрезвычайно эффективна при уничтожении вегетативных организмов и спор.
Заключение
Это всего лишь несколько типов потенциальных процедур стерилизации, которые могут использоваться компаниями, производящими фармацевтическую продукцию или медицинское оборудование. Есть несколько других популярных методов, включая газовую и радиационную стерилизацию. Давно доказано, что эти формы стерилизации неадекватно уничтожают живые организмы, но также могут быть довольно опасными для людей и окружающей среды.
Выберите Prince Sterilization Services для стерилизации влажным теплом паром
В Prince Sterilization Services у нас есть полное и всестороннее понимание соответствующих процедур стерилизации, включая стерилизацию влажным теплом и стерилизацию сухим теплом и депирогенизацию.
Положитесь на Prince Sterilization Services, чтобы узнать, какой тип стерилизации подходит для каждого продукта. Свяжитесь с нами сегодня по телефону 877.315.5847, чтобы узнать, какие преимущества вы можете получить от наших услуг по стерилизации и многого другого.
[mkd_button size = ”large” type = ”solid” text = ”Поговорите с экспертом или запросите цитату” custom_class = ”” icon_pack = ”font_awesome” fa_icon = ”” link = ”/ contact” target = ”_ self” color = ”” Hover_color = ”” background_color = ”” hover_background_color = ”” border_color = ”” hover_border_color = ”” font_size = ”15 ″ font_weight =” 700 ″ margin = ””]
Стерилизация — принятые методы и мониторинг (руководство IACUC)
Допустимые методы стерилизации и мониторинг
Руководства: IACUC предоставил набор руководящих документов (Политики, Руководства и Информационные листы) для использования при планировании процедур с животными в Университете Айовы. Исключение из Руководства должно быть описано и обосновано в Протоколе о животных и утверждено в ходе обычного процесса проверки.
Назначение
Целью данного руководства является предоставление руководства по обычно используемым методам стерилизации хирургических инструментов и других материалов для использования в протоколах для животных, утвержденных IACUC, а также методам мониторинга процедуры стерилизации.
Допустимые методы полной стерилизации
- Предпочтительный
- Автоклав (высокое давление / температура)
- Другое
- Газообразный оксид этилена — для изделий, не выдерживающих высоких температур
- Химическая / холодная стерилизация — для предметов, которые нельзя стерилизовать другими методами
Принятый метод повторной стерилизации между животными с использованием метода асептического наконечника для грызунов
- Сухой жар (стерилизатор для сухих гранул)
- ПРИМЕЧАНИЕ: Инструменты ДОЛЖНЫ быть полностью стерилизованы другим методом между хирургическими вмешательствами
Стерилизация в автоклаве
- В автоклаве используется пар с высокой температурой и давлением, который должен проникать в упаковку для достижения стерилизации.
- Такие материалы, как муслин и ткань из крепированной бумаги, позволяют пару проникать внутрь упаковки
- Не следует использовать такие материалы, как алюминиевая фольга и вощеная бумага, поскольку пар не может проникнуть в них.
- Время выдержки в автоклаве зависит от типа автоклава.
- Для стерилизаторов с гравитационным вытеснением обычно требуется выдержка при 121 ° C (250 ° F) в течение не менее 30 минут.
- Для стерилизаторов с динамическим удалением воздуха обычно требуется выдержка при 132 ° C (270 ° F) в течение не менее 4 минут. [1]
- Для более крупных пакетов требуется больше времени для достижения необходимого уровня нагрева и давления
- Автоклавная упаковка должна храниться в сухом, непыльном, хорошо вентилируемом помещении, желательно в закрытом шкафу.
- Срок хранения не определен, если упаковка хранится надлежащим образом (шкаф, ящик) и не промокает, не разрывается или не имеет другого события, которое может нарушить ее целостность и стерильность
- Мониторинг
- Стерилизация в автоклаве должна регулярно контролироваться на предмет эффективности процедуры стерилизации
- Общие лабораторные автоклавы могут контролироваться каждой лабораторией или иметь назначенных ответственных лиц.
- В каждую упаковку поместите интегрирующую полоску, чтобы указать воздействие процесса стерилизации
- Пакеты должны быть заклеены автоклавной лентой
- Не реже одного раза в месяц используйте интегрирующий индикатор типа 5 для мониторинга критических переменных в процессе стерилизации.
- Интегрирующие индикаторы типа 5 контролируют все критические переменные в процессе стерилизации и имеют заявленные значения, которые соответствуют или превышают требования к рабочим характеристикам в серии ISO 11138 для биологических индикаторов [2] , [3]
- В качестве альтернативы, интегрирующие индикаторы типа 5 могут использоваться вместо стандартной интегрирующей полоски внутри каждой упаковки
- Примеры интегрирующих индикаторов типа 5:
- Не реже одного раза в год использовать биологический индикатор для контроля эффективности уничтожения микробов
- Биологические индикаторы используют устойчивые споры для контроля летальности процесса стерилизации [4]
- Требуется инкубация или использование ридера для определения результатов
- Может читать и задокументировать результаты самостоятельно или в партнерстве с OAR (плата, связанная с услугой), чтобы сделать это
- Например, OAR в настоящее время использует биологический индикатор 3M Attest Rapid Readout.Это требует использования специализированной машины для считывания результатов.
- Не реже одного раза в год использовать биологический индикатор для контроля эффективности уничтожения микробов
- Документация
- Интегрирующая полоска в упаковках
- Ежемесячная интеграторная полоска типа 5 (если не используется в каждой упаковке)
- Хранить журнал рядом с автоклавом или как часть хирургической документации
- Журнал будет проверяться во время полугодовых проверок
- Годовой биологический показатель
- Если партнер OAR, OAR будет вести журнал результатов
- В противном случае лаборатория несет ответственность за ведение журнала
- Журнал будет рассматриваться во время полугодовых осмотров хирургического участка
- Если партнер OAR, OAR будет вести журнал результатов
- Документация
Стерилизация оксидом этилена [5]
- ПРИМЕЧАНИЕ: Служба центральной стерилизации UIHC больше не выполняет стерилизацию оксидом этилена, и она не предоставляется в других местах на территории кампуса [6] , [7]
- Для стерилизации этим методом потребуется помощь внешнего поставщика
- Используется для изделий, чувствительных к нагреванию и / или влаге
- Эффективность зависит от концентрации газа, температуры, относительной влажности и времени воздействия
- Предметы можно стерилизовать в их окончательной упаковке, но эффективность зависит от способности газа свободно диффундировать через них
- Требуется аэрация для десорбции окиси этилена из камеры и предметов
- Некоторым материалам, таким как определенные биосовместимые полимеры и гели, может потребоваться несколько недель для полного удаления газа из химического вещества.
- Размещение любых материалов без достаточного времени и аэрации для десорбции может привести к реакции тканей и проблемам со здоровьем
- Недостатки
- Опасности — воспламеняющиеся, взрывоопасные, токсичные и канцерогенные
- Продолжительность цикла
- Стоимость
Химическая / холодная стерилизация
- Примеры обычных коммерческих стерилизаторов и их активных ингредиентов:
- ПРИМЕЧАНИЕ: Эта информация основана на имеющейся в настоящее время информации по состоянию на 27.05.20.Обратитесь к инструкциям производителя, чтобы узнать, как правильно приготовить и использовать.
- CIDEX ® Раствор активированного диальдегида [8]: глутаральдегид
- Активен до 14 дней после приготовления
- Для стерилизации при комнатной температуре требуется 10 часов выдержки
- Spor-Klenz ® : пероксид водорода и пероксиуксусная кислота.
- Концентрат холодного стерилизатора [9]
- Разбавить очищенной водой до концентрации 1% об. / Об.
- Использовать немедленно и не хранить
- Для стерилизации при комнатной температуре требуется 11 часов выдержки
- Готовый к использованию холодный стерилизатор [10]
- Можно использовать повторно до 14 дней
- 5.Для стерилизации при комнатной температуре требуется 5 часов выдержки
- Концентрат холодного стерилизатора [9]
- Спорицидин ® Раствор для стерилизации и дезинфекции [11]: глутаровый альдегид, фенол, фенат
- Активен в течение 14 дней после приготовления
- Для стерилизации при комнатной температуре требуется 12 часов выдержки
- При использовании этих средств необходимо соблюдать осторожность, чтобы гарантировать, что они используются с соответствующими мерами безопасности и что стерилизуемые предметы совместимы со стерилизующим средством
- Факторы эффективного и правильного использования холодной стерилизации:
- Химические вещества должны быть классифицированы как «стерилизующие средства».
- Обычно используемые дезинфицирующие средства, такие как спирт, йодофор, четвертичный аммоний и фенольные соединения, не являются эффективными стерилизующими средствами и неприемлемы для использования на предметах (например,g., катетеры, инструменты), предназначенные для использования в хирургических процедурах выживания
- Физические свойства стерилизуемых предметов должны быть гладкими и непроницаемыми для влаги
- Все поверхности, как внутренние, так и внешние, должны подвергаться воздействию стерилизующего вещества
- Стерилизующий раствор должен быть чистым и свежим.
- Дата приготовления должна быть указана на таре
- Химически стерилизованные инструменты необходимо тщательно промыть как изнутри, так и снаружи стерильным физиологическим раствором или стерильной водой перед использованием, чтобы избежать повреждения тканей.
- С инструментами необходимо обращаться в асептических условиях для поддержания стерильности (например, обращаться с инструментами в стерильных перчатках и помещать на стерильное поле).
- Химические вещества должны быть классифицированы как «стерилизующие средства».
- Стандартные рабочие процедуры (СОП) ДОЛЖНЫ быть вывешены в лаборатории при использовании методов химической стерилизации и должны содержать следующую информацию:
- Используемый агент (т.е. активный ингредиент)
- Как готовят стерилизующее средство
- Срок действия стерилизатора после приготовления (срок годности)
- Время воздействия, необходимое для стерилизации инструментов / принадлежностей
- Удаление стерилизатора перед использованием в асептических условиях Шаблон
- и пример СОП можно найти здесь: Стандартные рабочие процедуры (СОП) химической стерилизации
- Проконсультируйтесь с ветеринаром OAR, если есть какие-либо вопросы, касающиеся использования химических / холодных стерилизаторов.
Стерилизация сухих гранул
- Используется для стерилизации наконечников хирургических инструментов между несколькими операциями
- Инструменты ДОЛЖНЫ быть полностью стерилизованы другим методом между хирургическими вмешательствами.
- Хирургический сеанс включает операции, проведенные в тот же день
- Стерилизатор перед использованием должен быть активирован минимум на 20 минут для достижения соответствующей температуры [12]
- Весь биологический мусор (напр.грамм. кровь, ткань) должны быть удалены перед помещением инструментов в стерилизатор
- Инструменты должны быть помещены в стерилизатор как минимум на 15 секунд до достижения стерилизации [13]
- После извлечения инструментов из стерилизатора кончики станут ОЧЕНЬ ГОРЯЧИМИ
- Им нужно дать остыть перед использованием, чтобы не обжечь животное
- Стерилизованы только кончики инструментов, а ручки считаются загрязненными
- Инструменты следует использовать так, чтобы их кончики оставались стерильными.Подробную информацию о технике асептического наконечника см. В Руководстве по выживанию грызунов .
5 Общепринятых методов стерилизации лабораторий
Чтобы обеспечить максимальную безопасность лабораторий и персонала, мы предоставляем специальные услуги. В частности, обращение с биологическими образцами и опасными материалами представляет собой уникальную проблему безопасности. Такие услуги, как утилизация лабораторного оборудования, обслуживание и сертификация шкафов биобезопасности, — все это ключи к поддержанию чистоты и безопасности.
В дополнение к этому, такие процедуры, как дезактивация и стерилизация лабораторного оборудования, также способствуют гигиене и безопасности. Стерилизация необходима для поддержания чистоты и функциональности лабораторного оборудования, материалов и образцов. В этом посте мы обсудим пять методов лабораторной стерилизации, которые обеспечат безопасность вас и ваших материалов.
1. Влажное тепло (автоклавирование)
Автоклавирование — самый популярный метод лабораторной стерилизации. В этом процессе для нагрева предмета, требующего стерилизации, используется пар под давлением.Автоклавирование — невероятно эффективная процедура. Он эффективно убивает все микробы, споры и вирусы. Однако для некоторых конкретных уровней биобезопасности необходимы более высокие температуры пара или более длительные периоды инкубации.
Пар, вырабатываемый автоклавами, содержит в семь раз больше тепла, чем вода при той же температуре. Кроме того, когда он контактирует с материалом, он мгновенно выделяет тепло и может даже проникнуть через более плотную и толстую поверхность.
Скорость и эффективность автоклавирования при стерилизации материалов — вот что делает его наиболее популярным выбором.Поскольку они жизненно важны для повседневной работы лаборатории, важно регулярно обслуживать и ремонтировать автоклавы.
2. Сухой жар (запекание или пламя)
Стерилизация сухим жаром считается наиболее эффективным методом ухода за всем, что связано с жирами, маслами, порошками или материалами, подверженными ржавчине. По сути, основное различие между сухим жаром и автоклавированием заключается в отсутствии воды или пара при стерилизации сухим жаром. Некоторые лаборатории предпочитают стерилизовать шкафы биобезопасности сухим теплом.
Обычно стерилизация сухим жаром включает повышение температуры предмета до 325 градусов по Фаренгейту или выше при нормальном давлении воздуха. Мы используем стерилизацию сухим жаром ежедневно, а не только в лабораторных условиях. Когда мы готовим мясо или птицу в духовке, мы используем стерилизацию сухим жаром для удаления бактерий и микробов.
При сухом нагреве для правильной стерилизации предмета требуются более высокие температуры.
3. Фильтрация
Фильтрация — это метод лабораторной стерилизации, не требующий нагрева.Кроме того, это единственный метод стерилизации, который использует силу для отделения микробов или бактерий в жидкости, а не для уничтожения. Фильтры работают, пропуская жидкий раствор через фильтр, диаметр пор которого слишком мал для проникновения микробов. По сути, фильтр удаляет организмы из раствора.
Что касается надлежащей стерилизации, то обычно используются мембранные фильтры, изготовленные из сложных эфиров целлюлозы. Чтобы удалить бактерии, они обычно имеют средний диаметр пор 0.2um. Однако, если вас беспокоят вирусы или фаги, фильтры не подходят для стерилизации. Эти организмы обычно могут проходить даже через самые тонкие фильтры.
4. Химические вещества / растворители
Нагревание и фильтрация могут быть эффективными методами стерилизации и предотвращения заражения. Однако во многих случаях тепло может повредить материалы, которые необходимо стерилизовать. Здесь может пригодиться использование химикатов и растворителей.
Хотя химические вещества, используемые для стерилизации, опасны для человека, они не повредят предметы, которые необходимо стерилизовать.Даже газы являются растворителями, которые могут стерилизовать предметы. Они обеспечивают быструю стерилизацию, быстро проникая в материалы без использования ускоренного нагрева. Кроме того, они отлично подходят для дезинфекции мест с интенсивным движением людей, когда они в настоящее время не заселены.
Химические вещества и растворители стерилизуют путем денатурирования белков с помощью процедур, требующих воды. Чтобы они были эффективными, их необходимо разбавить водой на 60-90%.
Растворы перекиси водорода, диоксида азота и формальдегида являются одними из наиболее распространенных химических стерилизаторов.Хотя эти растворители отлично убивают микробные клетки, они не действуют на споры.
5. Радиация
Использование радиации может стать отличным методом стерилизации лаборатории. Ультрафиолетовый свет, рентгеновские лучи и гамма-лучи — это виды электромагнитного излучения, которые быстро измельчают ДНК.
В воздухе УФ имеет ограниченную проникающую способность. По сути, это означает, что стерилизация будет происходить только на относительно небольшой площади непосредственно внутри лампы. Однако это один из самых безопасных методов стерилизации.Его часто используют на небольших площадях, например, в вытяжных шкафах с ламинарным потоком.
Гамма и рентгеновские лучи обладают отличной проникающей способностью. Хотя это делает их по своей сути более опасными, это также означает, что они эффективны для стерилизации в гораздо большем масштабе.
Заключение
В S.E.P.S. мы сделали безопасность и гигиену лабораторий нашей практикой и нашим главным приоритетом. Стерилизация лабораторного оборудования абсолютно необходима для обеспечения безопасности и работоспособности лабораторий. Наши различные аккредитации и принадлежности являются свидетельством нашей неизменной приверженности безопасности и гигиене.Некоторые лабораторные среды могут представлять определенные риски, и мы ставим перед собой задачу их устранить.
.