Как разводить аламинол — Про Аламинол
Сегодня практически любая девушка, включая самых юных, хотя бы один раз посещала салон красоты, в частности, делала современный и красивый маникюр, к примеру, по случаю торжественных событий. В зависимости от уровня всего салона и мастера, который в нем трудится тоже, клиентам обязательно предоставляется должный уровень сервиса и обслуживания. Однако основным критерием, что должен стать краеугольным камнем всей концепции, можно считать полную безопасность клиента, за что полностью отвечает мастер. Существуют различные средства для дезинфекции и стерилизации маникюрных инструментов на современном рынке, о которых мы и поговорим сегодня более подробно.
Что к чему: дезинфицирующие средства для маникюрных инструментов
Во всех рекламных проспектах и предварительных обещаниях салонов красоты и маникюрных кабинетов можно услышать или прочесть слова о полной гарантии безопасности для всех без исключения клиентов.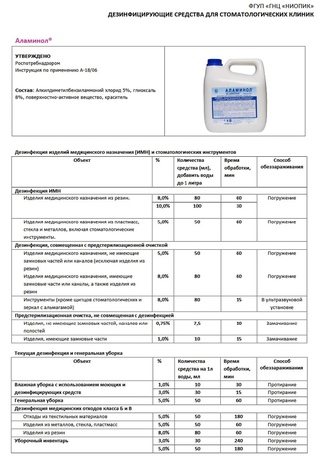
Специалисты считают, что львиную долю внимания нужно уделить правильному подбору и регулярному применению средств для обработки маникюрных инструментов, так как восемьдесят процентов всех инфекций передаются как раз через них. Причем прямая угроза может быть направлена как на самого мастера, так и на его клиента, а также тех людей, которые придут впоследствии, если стерилизация и дезинфекция будет произведена неверно или не будет проведена совсем.
Основные этапы дезинфекции и подготовки инструмента
Прежде чем начинать изучать разнообразные средства для обработки инструментов маникюрного плана, следует несколько слов сказать о правилах и очередности произведения действий при этом. Есть смысл для каждого этапа подобрать подходящие препараты и средства, чтобы максимально обезопасить как мастера, так и его клиентов от угроз заражения инфекционными заболеваниями.
Есть смысл для каждого этапа подобрать подходящие препараты и средства, чтобы максимально обезопасить как мастера, так и его клиентов от угроз заражения инфекционными заболеваниями.
- Подавление или полное уничтожение так называемой транзиторной, то есть временной, микрофлоры на руках мастера и клиента. Чаще всего в лучших салонах для данных целей используют спиртосодержащие средства, а также латексные перчатки для мастера.
- После проведения маникюра, все использованные при этом инструменты должны быть очищены должным образом. Средства для химической стерилизации инструментов более подробно мы обсудим ниже, причем в них обязательно должны быть введены антикоррозийные добавки.
- Дезинфекция инструмента для маникюра — это еще далеко не все, ведь после нее требуется стерилизация в сухожаровом шкафу или специальном автоклаве. Именно так, при помощи экстремально высоких температур можно полностью избавиться от болезнетворных микроорганизмов и бактерий.
- Последним этапом можно назвать хранение маникюрных инструментов надлежащим образом, иначе все приложенные до того усилия просто пойдут насмарку.
 Профессионалы рекомендуют всегда хранить инструмент в ультрафиолетовом стерилизаторе, в котором установлены специальные бактерицидные лампы.
Профессионалы рекомендуют всегда хранить инструмент в ультрафиолетовом стерилизаторе, в котором установлены специальные бактерицидные лампы.
Ни одним из этапов очистки нельзя пренебрегать, чтобы не подвергать себя и остальных людей опасности заражения, ведь клиент может не только умышленно не сказать об имеющейся проблеме, но и просто о ней не знать. Потому даже на курсах подготовки профессиональных мастеров говорят о том, что все клиенты, по умолчанию, должны считаться мастером потенциально условно-зараженными.
Лучшие средства дезинфекции инструментов для маникюра
Дать полную оценку всем существующим средствам для дезинфекции инструментов перед маникюром никак не получится, ведь современный рынок предлагает их колоссально огромное количество. Давайте просто расскажем о самых востребованных и популярных, а заодно и доступных, которые чаще всего применяют профессиональные мастера в своей работе.
«Аламинол»
Все салоны красоты и обычные маникюрные кабинеты подразумевают постоянный поток клиентов, что требует принятия радикальных мер по обеззараживанию и дезинфекции. Именно для таких целей прекрасно подходит средство «Аламинол», стоимость которого тоже вполне приемлема. В состав средства входят такие вещества, как хлорида алкилдиметилбензиламмоний и глиоксаль, что помогают качественно подавить активность возбудителей туберкулеза, вирусных инфекций, ВИЧ, герпеса, гепатита, энтеро и рота-вирусов, грибков класса Candida и прочих.
Именно для таких целей прекрасно подходит средство «Аламинол», стоимость которого тоже вполне приемлема. В состав средства входят такие вещества, как хлорида алкилдиметилбензиламмоний и глиоксаль, что помогают качественно подавить активность возбудителей туберкулеза, вирусных инфекций, ВИЧ, герпеса, гепатита, энтеро и рота-вирусов, грибков класса Candida и прочих.
Преимущества жидкости
- Препарат совершенно безвреден для человека, вплоть до испарений. То есть использовать его безопасно, а при попадании на кожу, его достаточно просто смыть водой.
- Эффективность «Аламинола» очень высока, но при этом он совершенно не имеет коррозийного действия на металл инструментария, то есть не способствует появлению на его поверхности ржавчины.
- Время полной процедуры довольно ничтожно, всего лишь шестьдесят минут и все готово, а готовый раствор для дезинфекции маникюрных инструментов можно применять несколько раз.
- Имея некоторые моющие свойства, данный раствор отлично справляется со спорами большинства грибков, что действительно актуально.

- Вещество разрешено хранить в темной емкости и темном прохладном месте до года, а вот разведенный состав используется до десяти дней, пока он не помутнеет.
Важно также разобраться, как разводить «Аламинол» для дезинфекции маникюрных инструментов перед самым применением и нужно ли делать вообще нечто подобное. Следует понимать, что работать с растворами подобного плана нужно обязательно в перчатках, во избежание непредвиденных травм, так как вещество имеет второй класс опасности. Это значит, что препарат является высокоопасным.
Правильные пропорции и эффективность
Разводить «Аламинол» для дезинфекции инструментов не трудно, тем более, что на упаковке обязательно должна быть напечатана инструкция, как, что и когда делать. Вещество продается в различной концентрации, в зависимости от нее и нужно будет разводить его очищенной водой, из расчета на один литр жидкости в том количестве, насколько «крепкий» вы желаете получить раствор. К примеру, для получения десятипроцентного состава нужно налить сто миллилитров концентрата в литр воды.
- Раствор в бутылке с содержанием действующего вещества в один или полтора процента предназначен для легкой дезинфекции, к примеру, для протирания рабочих поверхностей, к примеру, стола.
- Жидкость с трех или пятипроцентным содержанием, уже справится с вирусами и даже туберкулезом.
- Все растворы в восемь или десять процентов легко уничтожат не только бактерии и вирусы, но даже грибковые инфекции.
Разбираясь в тонкостях и нюансах работы с «Аламинолом» стоит помнить, что дезинфекция подобного рода — это только один из этапов комплексного обеззараживания, за которым следует стерилизация и прочее. То есть, всегда помните о том, что нужно производит все необходимые действия в свое время, чтобы максимально обезопасить себя и своих клиентов, что настоятельно рекомендуют профессиональные мастера.
«Эстилодез»
Отечественное средство «Эстилодез», производящееся компанией ООО «Полисепт», действительно является одним из самых востребованных на рынке, виду свой высокой эффективности и доступной стоимости.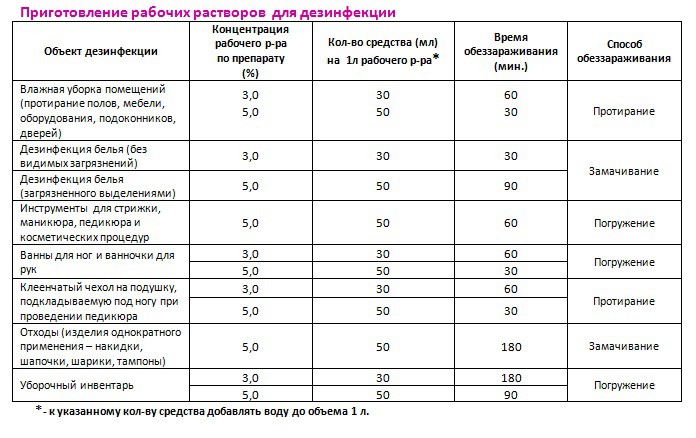 В его состав входит множество действующих веществ, к примеру, алкилдиметилбензиламмоний и дидецилдиметиламмоний хлорид, являющиеся поверхностно активными веществами (ПАВ), гуанидин, ЧАС и другие.
В его состав входит множество действующих веществ, к примеру, алкилдиметилбензиламмоний и дидецилдиметиламмоний хлорид, являющиеся поверхностно активными веществами (ПАВ), гуанидин, ЧАС и другие.
Этот препарат зачастую применяют не только в маникюрных салонах, но также и в медицинских учреждениях для дезинфекции инструмента и оборудования. Он не вызывает коррозийных эффектов у метала и активно борется с бактериями туберкулеза, гепатита, герпеса, ВИЧ, патогенных грибов и много с чем еще. Обрабатывать «Эстилодезом» можно инструменты, полотенца, салфетки и рабочие поверхности.
Правильные пропорции и эффективность
Разводить препарат нужно исключительно в эмалированных, стеклянных или керамических емкостях, чтобы избежать окисления нестойких металлов. Его просто добавляют в чистую питьевую воду в нужном количестве, причем кипятит ее предварительно не требуется. В зависимости от концентрации вещества будет зависеть время экспозиции инструмента в растворе.
- 0,1% предполагает не менее одного часа до достижения полной эффективности.
- 0,2% сократит время воздействия на маникюрные приспособления ровно вдвое, до тридцати минут.
- 0,4% уже предполагает всего пятнадцать минут обработки.
- 1%-ный раствор справится с задачей быстрее всего, всего за пять минут вы получите отличный результат, но вот с самой жидкостью нужно быть предельно осторожзными, ведь она является достаточно едкой.
В комплекте с данным дезинфектором предлагаются также специальные полоски, которые индицируют качество раствора. Перед применением есть смысл проверить таким тестером, тогда станет сразу же понятно, насколько концентрирован раствор и сколько времени потребуется на обработку.
«МультиДез»
Еще один, довольно востребованный, отечественный препарат для дезинфекции на рынке, это «МультиДез». Он тоже довольно популярен ввиду своей эффективности и низкой стоимости. Химический состав данного препарат довольно прост, он содержит только гуаниди и несколько видов ПАВ, чего вполне хватает для уничтожения бактерий, вирусов, грибков и микробов. Это средство не вызывает коррозии на металлах, не закрепляет биологический (органический) мусор, не боится замораживания и размораживания, а также имеет моющие свойства и качества.
Это средство не вызывает коррозии на металлах, не закрепляет биологический (органический) мусор, не боится замораживания и размораживания, а также имеет моющие свойства и качества.
Правильные пропорции и эффективность
Как и иные едкие вещества, «МультиДез» нужно аккуратно разводить обычной питьевой водой, кипячение которой не обязательно. Для стандартной формы выпуска нужно налить теплую воду в емкость, после чего добавить туда концентрированный дезинфицирующий раствор в пропорции ста к двум (2%).
Очередность действий лучше не менять, иначе средство может пениться. После погружения инструмента в емкость требуется выждать пятнадцать минут, после чего гибнет около восьмидесяти процентов бактерий и вирусов.
Эффективность препарата в борьбе с заражениями довольно высока, он уничтожает большинство возбудителей туберкулеза, гепатитов различных типов, герпеса, ВИЧ, патогенных грибов, вирусов гриппа и прочих. Применяется средство не только в индустрии моды и красоты, но в первую очередь в медицинских и оздоровительных заведениях и учреждениях, к примеру, стоматологии, пластической хирургии, а также точках общественного питания и занятий спортом.
«Оптимакс»
Для получения полной картины лучших предложений рынка, стоит отметить еще одно средство для дезинфекции маникюрного инструмента отечественного производства под названием «Оптимакс», стоимость которого доступна для каждого. Это тоже концентрат, который разводится обычной водопроводной водой в пропорции один к пятидесяти. Химический состав вещества основывается на растворе пятипроцентного N,N-бис(3-аминопропил)додециламина, неионогенных ПАВ и ингибиторе коррозии.
После разведения вещества в специальном боксе нужно погрузить туда инструмент и выдержать не менее одного часа. Когда обработка будет завершена, весь маникюрный инструмент должен быть аккуратно извлечен и промыт под проточной водой. Эффективность «Оптимакса» действительно высока, он поможет уничтожить грамположительные и грамотрицательные бактерии, в том числе туберкулез, герпес, гепатиты и многие грибки.
Видео-гайд о средствах для дезинфекции маникюрных инструментов
youtube.com/embed/Q0bRuvzLWbg» frameborder=»0″ allowfullscreen=»»/>
Для тех, кто заинтересовался вопросом, есть смысл посмотреть видео ролик о существующих средствах дезинфекции. Полезен он может быть как для профессиональных мастеров, так и для домашней дезинфекции.
Аламинол для дезинфекции маникюрных инструментов, Аламинол дезинфицирующее средство (дез средство)
Аламинол – это российское дезинфицирующее средство. Производится оно в виде концентрата, который обладает слабовыраженным запахом и имеет синий оттенок.
Дез средство Аламинол повсеместно используется для проведения дезинфицирующих мероприятий в больницах, поликлиниках, родильных домах, местах общественного питания, салонах индустрии красоты, а также там, где часто бывают дети.
Дезинфицирующее средство Аламинол не содержит хлора. Основные компоненты в составе – глиоксаль и алкилдиметилбензиламмоний хлорида – направлены на борьбу с бактериями (включая туберкулез), грибками рода “Candida”, герпеса и других вирусных инфекций. Как и другие химикаты, его нужно хранить в местах недоступных для детей и домашних животных. Неконтролируемое и неправильное потребление может привести к отравлению, долговременной потере трудоспособности и нанести непоправимый вред здоровью.
Основные компоненты в составе – глиоксаль и алкилдиметилбензиламмоний хлорида – направлены на борьбу с бактериями (включая туберкулез), грибками рода “Candida”, герпеса и других вирусных инфекций. Как и другие химикаты, его нужно хранить в местах недоступных для детей и домашних животных. Неконтролируемое и неправильное потребление может привести к отравлению, долговременной потере трудоспособности и нанести непоправимый вред здоровью.
Для чего применяется Аламинол
Сферы применения достаточно обширны:
- Очистка инструментария перед стерилизацией.
- Дезинфекция в косметических кабинетах, барбершопах, маникюрных салонах, парикмахерских, нейл-барах, броу-барах.
- Обработка использованных салфеток, тампонов, ватных турунд и ватных палочек перед их утилизацией.
- Обеззараживание во время распространения сезонных инфекций.
- Предотвращает размножение плесени.
Химпрепарат для обеззараживания инструментария используется в маникюре и педикюре. В салонах красоты, барбершопах, парикмахерских или, как стало сейчас популярно, на дому (этой услугой пользуются многие женщины и девушки). Важно при этом содержать рабочие принадлежности в чистоте, проводить предстерилизационную очистку с помощью Аламинола с последующей стерилизацией. Это позволит не допустить заражения клиента во время проведения процедуры. Устранение этих проблем обойдется намного дороже, чем покупка и использование дезсредства.
В салонах красоты, барбершопах, парикмахерских или, как стало сейчас популярно, на дому (этой услугой пользуются многие женщины и девушки). Важно при этом содержать рабочие принадлежности в чистоте, проводить предстерилизационную очистку с помощью Аламинола с последующей стерилизацией. Это позволит не допустить заражения клиента во время проведения процедуры. Устранение этих проблем обойдется намного дороже, чем покупка и использование дезсредства.
Положительные факты:
- Дезинфицирующее средство Аламинол для инструментов совершенно безопасно для человека, а при попадании его на кожу, достаточно промыть этот участок кожи из-под крана.
- Эффективность его действия доказана проведением многих экспериментов в государственных НИИ и учебных заведениях, выданы соответствующие заключения.
- Не имеет фиксирующего действия на органические соединения: кровь, слюна, иные биологические жидкости.
- Щадящее взаимодействие с металлом, нейтрален относительно высоколегированных медицинских сталей и нержавейки.

- Срок хранения дезраствора – до 10 дней при соблюдении условий хранения в закрытой таре. Если же он помутнел раньше, использовать его категорически запрещается.
- Есть два способа дезинфекции – замачивание (погружение) и протирание. Время обработки зависит от выбранного режима дезинфекции и концентрации рабочего дезраствора.
- Доступная цена. Товар сделан в России и на его цену не влияют курсовые колебания иностранных валют, санкций Запада и иных политических факторов.
- Дезсредство сохраняет свои дезинфицирующие характеристики в течение 1 года, если хранить его в прохладном месте без попадания солнечных лучей в плотно закрытой фабричной таре.
Не следует употреблять дезраствор внутрь. Если такой случай произошел, выпейте внутрь много воды и, как минимум, 10-15 таблеток активированного угля за один прием. Рекомендуем сразу же обратиться к врачу и рассказать о произошедшем.
Если смесь воды и химиката каким-то образом попал на кожу человека, в этом участке может возникнуть покраснение или раздражение. Это не опасно, просто обильно обмойте кожу холодной струей из-под крана в течение нескольких минут и смажьте увлажняющим кремом, например, Каппадерм или Дзетадерм. При попадании средства на слизистые оболочки, необходимо их также промыть Н2О и воспользоваться сульфацилом натрия. Это глазные капли, обладающие успокаивающим действием. Капаем по несколько капель в каждый глаз.
Это не опасно, просто обильно обмойте кожу холодной струей из-под крана в течение нескольких минут и смажьте увлажняющим кремом, например, Каппадерм или Дзетадерм. При попадании средства на слизистые оболочки, необходимо их также промыть Н2О и воспользоваться сульфацилом натрия. Это глазные капли, обладающие успокаивающим действием. Капаем по несколько капель в каждый глаз.
Аламинол для маникюрных инструментов (кусачек, пилок, маникюрных топориков и других) чаще всего применяется в 5 – или 8-процентной концентрации. Перед началом работы важно тщательно прочитать инструкцию, разработанную производителем — АО «НИОПИК», так как это химсредство и эффективность дезинфекции зависит от правильности употребления дезпрепарата. Работать с ним нужно только в резиновых, нитриловых или силиконовых перчатках с использованием закрытых емкостей. Рекомендовано хранить дезсредство отдельно от других препаратов и вдали от детей.
При нарушении правил использования средства на поверхности металлического инструментария могут возникать дефекты. В таком случае пользоваться инструментом уже запрещено. Его необходимо утилизировать безопасным для окружающей среды способом и купить новый.
В таком случае пользоваться инструментом уже запрещено. Его необходимо утилизировать безопасным для окружающей среды способом и купить новый.
Правила разведения: правильные пропорции
Как мы уже говорили выше, химпрепарат для инструментария производится в виде концентрата в специальных пластиковых емкостях. Поэтому перед потреблением его необходимо развести определенным количеством питьевой воды. По процентному содержанию готовый дезраствор может быть приготовлен в пропорциях 1%, 1,5%, 3%, 5%, 8% и 10%-м — это наиболее популярные пропорции. Конкретная доля концентрата в рабочей смеси зависит от метода обработки и сроков воздействия.
Легкие смеси воды и химсредства (1% и 1,5%) применяются для уничтожения бактерий и протирания рабочего места. Пропорция в 3% и 5% уничтожают различные вирусы, бактерии (в т.ч. и туберкулез). 8%- и 10%-е смеси направлены на уничтожение грибковых инфекций. Дезсредство разводится в зависимости от процента концентрата и добавления питьевой жидкости до получения 1 литра. Например, для получения 8% смеси потребуется 80 мл концентрированного химпрепарата и 920 мл H2O. Точную дозировку концентрата можно отмерять обычным медицинским одноразовым шприцом без иглы. Важно помнить, что для каждого препарата должен быть задействован новый шприц.
Например, для получения 8% смеси потребуется 80 мл концентрированного химпрепарата и 920 мл H2O. Точную дозировку концентрата можно отмерять обычным медицинским одноразовым шприцом без иглы. Важно помнить, что для каждого препарата должен быть задействован новый шприц.
Аламинол для дезинфекции инструментов: инструкция по применению
Самый важный документ для лица, которое готовится применить дезпрепарат – заводская инструкция по применению. Она была разработана химиками-технологами у производителя и вместе с самим химсредством проходила испытания на достоверность в ведущих НИИ дезинфектологии России. Ее нужно сохранить на весь период действия дезсредства и перечитывать каждый раз, когда возникают вопросы по применению препарата.
Для проведения дезинфицирующих мероприятий принято брать емкости, которые плотно закрываются и выполнены из химически нейтральных материалов. Использованные материалы для производства емкости – пластик или покрытый эмалью металл. Рекомендованная температура химраствора для правильного действия – не более 18 градусов.
Рекомендованная температура химраствора для правильного действия – не более 18 градусов.
Для погружения инструмента в раствор необходимо использовать резиновые, нитриловые или силиконовые перчатки. Без них процесс дезинфекции проводить не советуем – есть риск раздражения кожи. Для того, чтобы очистить труднодоступные места инструмента, выполните им несколько обычных движений в растворе со щеткой. Инструмент, который закрывается, обеззараживается в раскрытом виде, например, медицинские зажимы, парикмахерские и хирургические ножницы, секаторы, маникюрные и педикюрные кусачки. Медсестры и сестры-хозяйки очищают инструмент сразу после его использования, чтобы не допустить высыхания загрязнений. В таком случае предварительная очистка не потребует значительных усилий. Видимые невооруженным глазом загрязнения можно удалить при помощи салфеток, а затем дезинфицировать их в растворе. Использованные салфетки после процедуры опускают в отдельный раствор, а затем утилизируют.
Чем обрабатывать парикмахерские инструменты
Для чистоты инструментария парикмахера необходимы разные дезинфицирующие средства и специальные аппараты. Регулируются процедуры дезинфекции СанПиНом 2.1.2.2631-10. Еще несколько десятков лет назад мы даже не знали о существовании некоторых инфекций и болезней, которые можно легко получить, посещая спа-салоны и проводя процедуры с ногтями и ножками клиента.
Регулируются процедуры дезинфекции СанПиНом 2.1.2.2631-10. Еще несколько десятков лет назад мы даже не знали о существовании некоторых инфекций и болезней, которые можно легко получить, посещая спа-салоны и проводя процедуры с ногтями и ножками клиента.
Все необходимое для дезинфекции инструментов парикмахера можно приобрести в специализированных магазинах или на сайтах типа https://galser-parikmacher.ru, что гораздо быстрей и выгодней.
Процесс проведения дезинфекции инструментов
Условия соблюдения безопасности косметических процедур, стерилизации инструментов, которыми пользуется мастера салонов красоты сейчас остро
муссируется в печати, в разных телепередачах. Нормативная база регламентирует процедуры проведения очистки инструментов и проведения
процедур.
- Сделав стрижку или прическу необходимо промыть инструмент (расческу, щетку, ножницы) под струей воды, окунуть в дезинфицирующий раствор на
некоторое время, затем снова промыть чистой водой.
- Вспомогательные парикмахерские инструменты, такие как зажимы, шапочки, сетки, бигуди, после каждого использования промывают под струей воды.
- Ножи электрических машинок приводят в порядок с помощью специальных дезинфицирующих растворов, а несъемные части протирают этим же
раствором, после чего инструмент хранится в отдельном шкафу. - Специальную одежду очищают от остатков волос в специально отведенном месте, ни в коем случаи не сдувают феном, сбивают рукой в зале
парикмахерской. - Столешницу столика для маникюра, емкостей положено дезинфицировать после каждого клиента. Из емкости с заранее приготовленным дезраствором,
промаркированной, протирают рабочую поверхность стола. - После проведения процедуры педикюра подушку, которую подкладывают под ногу, ванночки обязательно подвергают дезинфекции.
Для того чтобы клиент не испытывал неудобств, когда инструменты дезинфицируются, а очередь становится все длинней, парикмахеру, мастеру
маникюра необходимо иметь в наличии два, а то и три комплекта специального инструмента.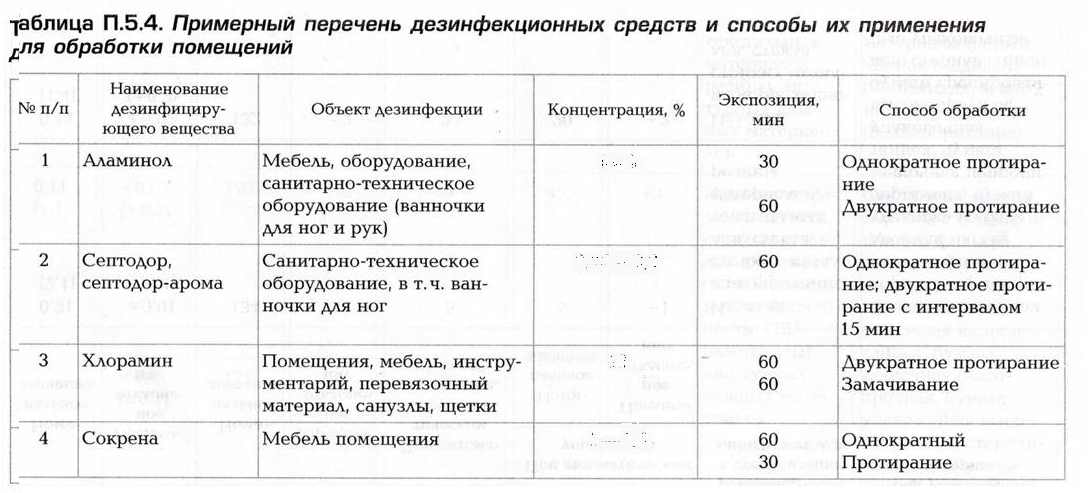
Что необходимо для качественной дезинфекции
Для проведения процедуры дезинфекции парикмахерского инструментария используют сухожаровой шкаф. В таком шкафу под воздействие высокой
температуры дезинфицируется инструменты и другой инвентарь.
Дезинфицируют инструмент с помощью ультрафиолетовых ламп. Лучи ультрафиолета направляют на инструмент и на его поверхности гибнуть
бактерии.
Вопрос чистоты инструментария важен для сохранения нашего здоровья. Во избегания распространения или заражения болезней, которые передаются через кровь, сейчас очень часто в салонах высоко и среднего класса используют одноразовый инструмент, который необходимо утилизировать сразу после единоразового использования.
Парикмахерский салон – место массового посещения, где оказываются услуги различного характера (стрижки, укладка прически, покраска, тонирование, услуги по уходу за волосами). Для каждого мастера визитной карточкой является соблюдение гигиенических норм с инструментом, а также содержание в идеальной чистоте рабочего места.
Для каждой категории инструмента, будь то ножницы, утюжок, машинка для стрижки и расчески имеется оптимальный способ обеззараживания.
Нормы СанПин 2020 по обработке парикмахерских инструментов
Нормы СанПин – это установленные надзорным органом рекомендации по дезинфекции парикмахерских инструментов. Они определяют перечень манипуляций, веществ и возможность физического, химического воздействия на орудие труда мастера. Химические составы для обеззараживания используются исключительно в разведенном виде, процентное соотношение основного средства определяется его характером и составом.
Применимо привлечение сторонних организаций по оказанию услуг дезинфекции специализированного инструмента парикмахера.
На смену утратившему силу в 2010г. старому СанПину 2.1.2.1199-03 сейчас действует новый СанПиН 2.1.2.2631-10. Нормы по обработке санитарных инструментов указаны в нем в главе 9.
Скачать СанПиН 2.1.2.2631-10.
Подробнее узнать о новом СанПине можно из видео:
youtube.com/embed/5FjOTr_kzyQ» frameborder=»0″ allowfullscreen=»» allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture»/>
Методы дезинфекции в парикмахерских
На практике парикмахер берет на себя большую часть обязанностей по дезинфекции инструмента и по уходу за ним. Рекомендуется проводить чистку и обработку после каждого посетителя.
Существенно облегчает труд специалиста наличие устройств по обеззараживанию, использование которых допустимо в условиях салона, а также имеющих небольшой интервал воздействия, что сократит простой организации.
Различают два основных метода дезинфекции оборудования и принадлежностей – физический и химический.
Физические и химические способы
Под термином физической обработки парикмахерского инструмента понимают применение термообработки, влияние высоких температурных значений. Метод подразумевает кипячение, прокаливание, а также проглаживание специальным утюгом.
Химическая обработка подразумевает использование растворов и составов, которые наносятся на рабочую поверхность, кресла, места пользования клиентами (столики, диваны ожидания, и пр.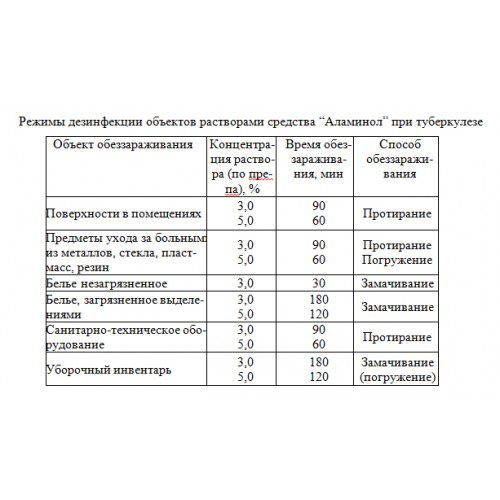 ).
).
Средства химической дезинфекции имеют комплексный спектр действия против патогенной микрофлоры, передающейся при непосредственном контакте.
Воздушный метод стерилизации
Воздушным методом называется стерилизация инструмента, помещаемого в специальную стерильную среду, с дальнейшим воздействием на принадлежности потоком воздуха. В камере соблюдается абсолютный режим обеззараживания.
Для каждого материала отводится актуальный промежуток обработки. К данному методу можно отнести специализированные установки по очищению воздуха (ионизаторы).
На этом видео можно подробнее узнать о дезинфекции инструментов:
Этапы обработки парикмахерских инструментов
Порядок обработки инструмента парикмахера заключается в следующих манипуляциях:
- первичной очистке от остатков волос, иных загрязнений путем погружения в предстерилизационную дезинфецирующую жидкость
- последующее погружение в предварительный состав дезинфекции, протирание раствором
- основная дезинфекция длительного действия (замачивание в химическом средстве, проглаживание утюгом, помещение принадлежностей в стерилизатор.

Для выполнения быстрого и качественного обеззараживания мастеру потребуется иметь в наличии достаточное количество наборов инструмента, а также специальное устройство стерилизации.
Техника безопасности при проведении дезинфекции
Во время проведения очищения инструмента от условной патогенной микрофлоры важно соблюдение мер безопасности.
При работе с острыми предметами (ножницы, расчески) нужно быть предельно внимательным. Процедуру рекомендуется проводить с использованием средств индивидуальной защиты (очки, перчатки, халат, фартук), во избежание контакта с использованными принадлежностями.
Во время кипячения, термообработки необходимо осторожно обращаться с инструментами, использовать специальные щипцы и прихватки.
Смотрите познавательное видео о дезинфекции инструментов парикмахера:
Предстерилизационная обработка
Непосредственно перед стерилизацией проводится очистка бактерицидными салфетками (в труднодоступных местах), а также предварительное замачивание в растворе. При помощи обдува ветром, применения пылесоса для парикмахерских принадлежностей удаляются остатки волос, пыль, загрязнения от красящих составов, однако необходимо выполнять обработку в закрытом пространстве (специальной камере для чистки).
При помощи обдува ветром, применения пылесоса для парикмахерских принадлежностей удаляются остатки волос, пыль, загрязнения от красящих составов, однако необходимо выполнять обработку в закрытом пространстве (специальной камере для чистки).
Далее допускается промывание специальным раствором, недолгое замачивание.
Промывание в проточной воде и сушка в профессиональном аппарате проводится строго после дезинфекции.
Процедура приведения предметов в рабочий позволяет поместить их в стерилизующий аппарат.
Стерилизация по нормам СЭС
Санитарно-эпидемиологический надзор регламентирует особые правила стерилизации парикмахерских инструментов. Таким образом, нормы СЭС распространяются на перечень химических веществ, возможных к применению в качестве дезинфектора. Для работы с подобными составами требуется ответственное изучение инструкций, а также рекомендаций производителя.
Не допускается очищение инструмента на рабочем месте путем встряхивания, либо иным методом, предполагающим потенциальное распространение остатков биологического материала в помещении.
Лицо, отвечающее за хранение и дозировку веществ, обязано вести специальный журнал учета выдачи химического средства, соблюдение правил техники безопасности.
Как правило, при проверке, ответственный сотрудник налаживает взаимодействие с представителями СЭС.
Виды стерилизации
К разновидностям стерилизации парикмахерского инструмента можно отнести паровой, сухожар, гласперленовый, низкотемпературный методы обработки. Для каждого из них свойственны особенности, предельные значения температур, материалы принадлежностей, допустимые к обеззараживанию.
В зависимости от масштабов салона парикмахерских услуг и проходимости, используются комбинированные или специализированные методы дезинфекции.
Необходимо отметить, что нормами СанПин регламентируется наличие стерилизатора, либо комплекса закрытого цикла для проведения обработки инструментария.
Какие инструменты и материалы в парикмахерской должны подвергаться стерилизации
Обязательными к проведению дезинфекции считаются все инструменты и принадлежности парикмахера, используемые в процессе работы.
В этот список входят съемные части машинок для стрижки и аппаратов укладки, завивки, абсолютно весь набор ручных инструментов, таких как – ножницы, расчески, фиксаторы, аксессуары для волос.
Организация работы парикмахерского салона подразумевает привлечение максимума одноразовых индивидуальных средств, где только это возможно, а также использование профессиональной линии инструментов из специального сплава металла. Данные меры предусматривают многократное проведение дезинфекционных мероприятий с основными средствами работы мастера.
Предпочтение отдается качественным и сертифицированным наборам, с сопроводительными документами о проведенных испытаниях, совместимости с автоматическими методами стерилизации.
Стерилизация расчесок
Стерилизацию расчесок проводят путем погружения в дезинфицирующий раствор. Для полностью металлических изделий, а также материалов высокой прочности и устойчивости возможно применение температурного воздействия.
Универсальные стерилизаторы также могут применяться для обеззараживания расчесок, при этом важно соблюдать определенный режим для каждого металла.
Перед обработкой расчески можно протирать специальными салфетками, промывать дезраствором, после чего их высушивают и подвергают стерилизации.
Смотрите на видео процесс дезинфекции расчесок:
Стерилизация парикмахерских ножниц
Ножницы стерилизуются наряду с расческами и иными мелкими принадлежностями мастера. Изделия из металла обрабатываются стандартными методами (нагрев, раствор, стерилизатор). Комбинированные ножницы помещают в оптимальные условия дезинфекции.
Дезинфекция парикмахерских машинок
Парикмахерская машинка для стрижки является сложным оборудованием, поэтому стерилизация данного инструмента проводится поэтапно. Съемные части подвергают обеззараживанию вместе с аксессуарами для волос и ножницами, предварительно очищая от остатков волосяной пыли в дезинфицирующей жидкости.
Корпус оборудования протирают раствором, либо антибактериальными салфетками.
Возможно применение совместимых типов стерилизаторов.
Также смотрите видео о дезинфекции машинок для стрижки волос:
Дезинфекция маникюрных инструментов
Специально для маникюрных принадлежностей, где преобладают металлические инструменты, используют оборудование закрытого типа для дезинфекции. В ограниченном пространстве происходит полное очищение инструмента от патогенной микрофлоры.
Прежде чем поместить в стерилизатор инструмент, его погружают в дезраствор минимум на 60 мин.
Подробнее об обработке маникюрного инструмента по СанПин смотрите на видео:
Дезинфекция бритвы
В некоторых случаях, для бритья используются одноразовые станки, что исключает потребность в их повторном применении и стерилизации.
Что касается автоматической машинки для бритья, металлических станков и лезвий, то их обработка проводится по аналогии с парикмахерской машинкой для стрижки.
Для начала снимается насадка, ее отправляют в раствор, сам аппарат протирают бактерицидным средством.
Металлические и пластиковые детали прибора помещают в стерилизатор.
Дезинфекция парикмахерского белья
В условиях парикмахерского салона используются текстильные изделия (белье). В некоторых случаях, например, при мытье головы, использовать одноразовые бумажные полотенца не представляется возможным.
Часто мастера отдают предпочтение именно тканевым полотнам. Стандартно, после каждого клиента изделие замачивают в дезодорирующем растворе, после чего стирают при высокой температуре в автоматической стиральной машине. Стерилизуют ткани путем глажения.
Обработка полотенец
Полотенца в парикмахерской используются для каждого посетителя индивидуально. Поэтому их количество должно быть достаточным для обслуживания числа клиентов салона, и иметь запас.
Использованный текстиль помещают в дезинфицирующий раствор, после чего подвергают стирке согласно этикетке изделия. Далее следует глажка при высокой температуре специальным утюгом.
Правила утилизации волос
Законодательно запрещается выбрасывать биологические отходы (волосы) парикмахерскими вместе с общими бытовыми отходами. Волосы относятся к 4 классу вредности отходов (опасности для экологической системы планеты), и обязательно должны подвергаться утилизации.
Ввиду необходимости обеспечения определенных условий по утилизации, салон обязан иметь договор со специализирующейся компанией на оказание услуг, а также обеспечить сбор и передачу биологических отходов в установленном порядке.
Куда девают волосы из парикмахерских? Смотрите на видео:
Как обработать парикмахерские инструменты после вшей
Иногда случаются и такие неприятности, когда инструмент был использован для стрижки клиента с педикулезом. Хотя такие явления встречаются крайне редко, знание о методах дезинфекции после вшей не будет лишним.
Хотя такие явления встречаются крайне редко, знание о методах дезинфекции после вшей не будет лишним.
Обеззараживание в данном случае проводится по стандартной процедуре, для пущего эффекта возможно двукратное проведение процедуры с привлечением специальных веществ против педикулеза. Последние можно приобрести в любой розничной аптечной сети, либо в сети реализации стандартных дезинфекторов.
Растворы, материалы и средства для дезинфекции
Существует утвержденный надзорным органом СЭС список разрешенных препаратов и химических веществ для дезинфекции парикмахерского оборудования и принадлежностей.
Субстанция выпускается в герметичном флаконе, канистре, в виде концентрированного состава, с детальной инструкцией к применению. Обычно, подобного рода средства подлежат разведению водой в процентном соотношении.
Оптимакс — как разводить и как пользоваться?
В оригинале средство Оптимакс имеет 100% концентрацию. Поэтому, для получения раствора меньшего процента потребуется выбрать равное соотношение, из расчета 1:1000, где 1 – это вещество, 1000 – вода.
Для получения 1% раствора понадобится 999 мл воды и 1 мл вещества.
Аламинол — как разводить и обработка им
Дезинфицирующее средство Аламинол используют для наружного обеззараживания предметов и поверхностей. Препарат имеет в составе мощный антисептик глиоксаль, химический состав которого беспощаден к бактериальной флоре.
Рекомендуется растворить 50 мл средства в 950 мл воды, таким образом получая раствор 5% концентрации основного вещества.
Разбавлять Аламинол для обработки парикмахерских и маникюрных инструментов следует в указанной пропорции.
Раствор годен к применению до 10 дней, после чего необходимо обновить содержание емкости дезинфекции инструментов.
Спреи для обработки
Существуют готовые средства во флаконе-распылителе в виде спрея, использование его не требует определенных условий и возможно в процессе работы.
Спрей используется парикмахером не только для наглядности перед клиентом, а и для большей уверенности, что все инструменты готовы к работе.
Емкости с антибактериальным распылителем выпускаются в компактных флаконах, для удобства использования.
Применение спрея не исключает основные процедуры по обеззараживанию инструмента.
Спиртом
Спирт по своему составу способен дезинфицировать поверхности, так как обладает выраженным бактерицидным действием.
Используют спирт в качестве средства для протирания, а также в него погружаются принадлежности мастера для дезинфекции.
Приобрести спирт для обработки можно у специализирующихся компаний, фарм-представителей по дистрибуции медицинского оснащения.
Ультрафиолетом
Ультрафиолетовые в определенной концентрации способны разрушительно влиять на патогенную микрофлору.
Для дезинфекции ультрафиолетом используются специальные лампы-излучатели направленного действия, либо закрытые боксы с высокой концентрацией УФ-излучения.
Применение УФ-оборудования заключается в помещении в отсек инструмента, после чего включается режим необходимой интенсивности прогрева.
Хлорамин Б
Хлорамин Б – хорошо зарекомендовавшее себя средство дезинфекции, и представляет собой органическое соединение хлора. Раствор пригоден к использованию в течение 15 дней.
0.2% раствор вещества является активным дезинфектором, для его получения средство разводят в воде комнатной температуры из расчета от 2 г. хлорамина на 1 л. жидкости. Для увеличения концентрации увеличивается значение пропорции средства (0.5% — 5 грамм; 1% — 1 грамм; 2% — 2 грамм соответственно).
Средство Пюржавель
Состав вещества содержит натриевую соль дихлоризоциануровой кислоты (80.52%). Пюржавель впервые выпущен во Франции, где и происходит его массовое производство.
Антимикробное средство обладает хорошим дезинфицирующим эффектом. Для приготовления рабочего раствора 0.3% понадобится 2 таблетки на 10 л. воды.
Оборудование и аппараты для стерилизации
Специальное оборудование для стерилизации принадлежностей парикмахера или мастера по маникюру реализуется через официальные точки продажи, сети.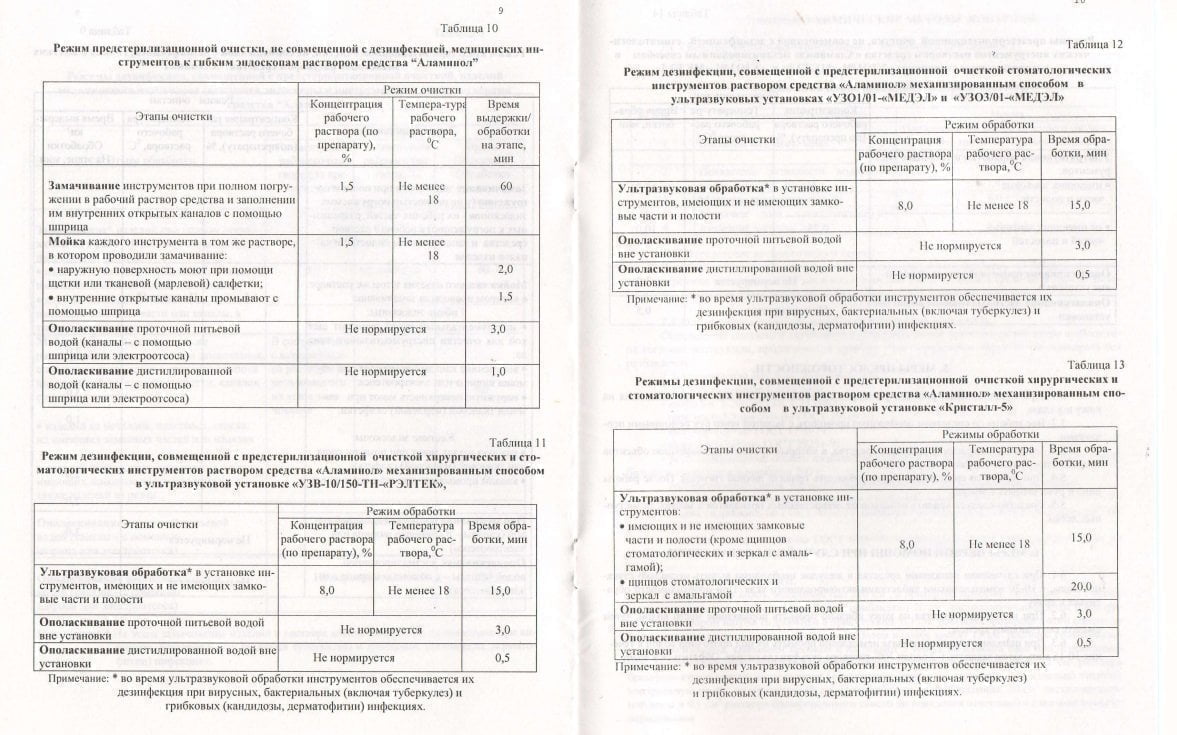 Аппараты представлены в широком ряде изделий разной мощности и производительности.
Аппараты представлены в широком ряде изделий разной мощности и производительности.
Оборудование подбирается по пропускной способности салона и характеристикам инструментов, их количеству.
Автоклав
Автоклавом называется аппарат, в котором происходит нагрев под давлением, в разы превышающем значение атмосферного.
Температура в автоклаве достигает высоких отметок, что позволяет угнетать патогенную микрофлору и проводить стерилизацию помещенных в него предметов.
Подходит исключительно для принадлежностей из твердых сплавов металла.
Сухожаровой шкаф
Сухожаровой шкаф по сути представляет собой увеличенный вариант бытовой духовки, только с более высокими показателями температур на выходе.
Актуален для стерилизации инструментов из металлических и неплавящихся составов.
Принцип работы заключается в нагреве до заданного значения температуры.
Емкости, ванночки, контейнеры для дезинфекции
Емкости для проведения процедуры дезинфекции должны соответствовать нормам безопасности и из материалов, не вступающих в реакции с растворами (химическими веществами обеззараживания).
Рекомендуется применение специальных ванночек и контейнеров, с сертификацией качества.
Лампа для стерилизации
Лампа для стерилизации представляет собой прибор, из которого распространяется антимикробное свечение. Удобство устройства заключается в исключении замены раствора, а только в соблюдении режима дезинфекции.
Лампу можно использовать в отведенное время, либо в перерывах.
Продолжительность стерилизации для разных способов
Если рассматривать продолжительность стерилизации и дезинфекции, то следует отталкиваться от характеристик используемого устройства.
Еще один фактор материалы, из которых изготовлены инструменты. Для металлических и комбинированных изделий предусматривается более актуальный принцип, учитывая самый уязвимый состав принадлежностей.
График стерилизации
Проведение обеззараживания производится строго по графику. Его утверждают на уровне руководства, и каждый сотрудник обязан следовать распорядку.
Положения режима стерилизации предусматривают время и периодичность, обязательные предварительные меры, ведение отчетности о проделанной работе.
В независимости от того, использовались ли инструменты, стерилизация по графику проводится в штатном режиме.
Дезинфекция рабочего места парикмахера и помещения
Дезинфекция рабочего места парикмахера заключается в протирании поверхностей раствором, в том числе кресла для клиента.
В помещении дезинфекцию проводят во время ежедневной и генеральной уборки. Для каждого зала вывешивается график, назначается ответственное лицо (если по штату не предусмотрен уборщик).
Дезинфекция рук парикмахера
Руки мастера дезинфицируют антисептическим средством, отсутствие аллергической реакции к которому проверяется заблаговременно. В течение дня после мытья рук теплой водой и мылом применяется антимикробный состав (наносится на кожу рук).
Дезинфекция воздуха
Безусловно, обработать все поверхности в помещении не всегда представляется возможным.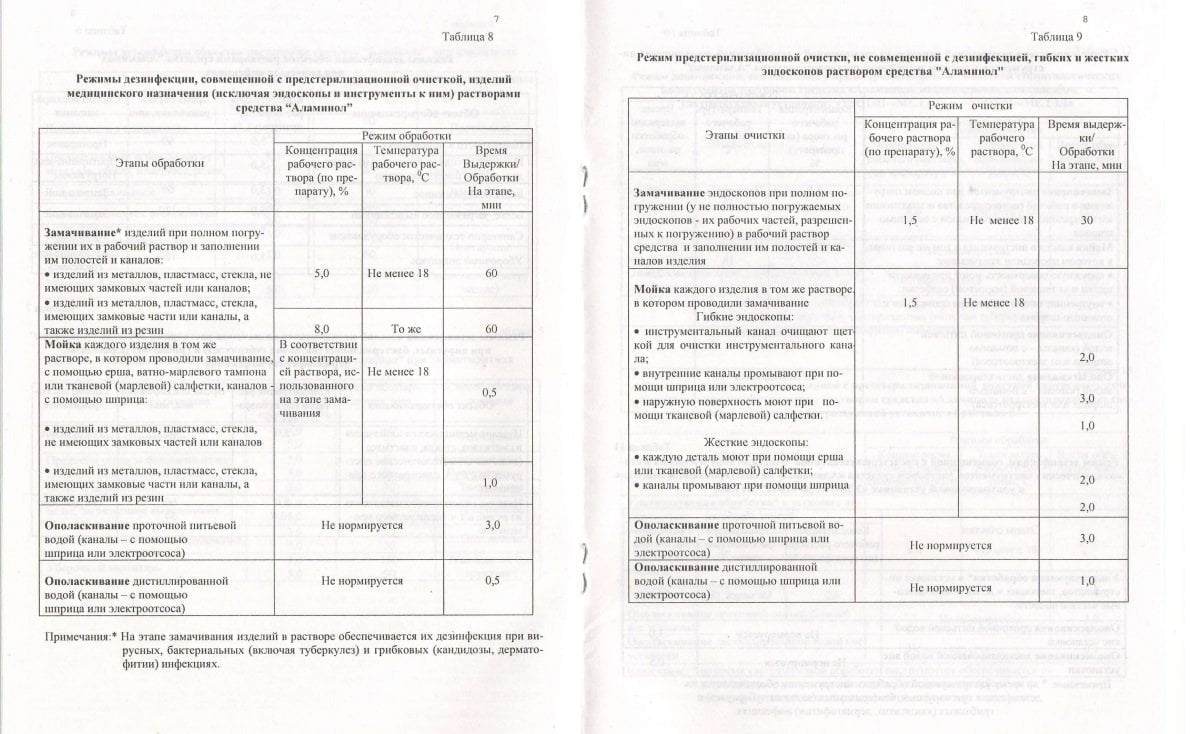 Для решения задачи по общей дезинфекции зала используют специальное оборудование.
Для решения задачи по общей дезинфекции зала используют специальное оборудование.
Ионизаторы воздуха способны работать в течение всего рабочего дня, а также в круглосуточном режиме. Выбор прибора осуществляется в зависимости от площади помещения.
Дезинфекция пола
Пол в парикмахерской дезинфицируется в течение дня несколько раз по графику, а также при любой необходимости проведения влажной уборки. Для этого в качестве основной жидкости используется раствор с антимикробным средством. Применение последнего совместимо с бытовыми химическими средствами по уходу за напольным покрытием.
Журнал дезинфекции парикмахерских инструментов — что это, как ведется, образец журнала
Журнал дезинфекции ведется ежедневно, в нем указывается дата, наименование и концентрация раствора, процентное соотношение, вид выполненной работы (время), ФИО проводившего процедуру.
Примерный образец представлен на фото ниже.
Обработка раны при порезе в парикмахерской
Принципы обработки порезов в парикмахерской заключаются в стандартном перечне действий, где рекомендуется промыть рану, обработать антисептическим средством, продезинфицировать спиртом (иным составом), наложить стерильную повязку.
Допустим прием лекарственных препаратов по назначению врача (при наличии).
В зависимости от характера пореза рассматривается необходимость посещения травмпункта, узкого специалиста в медицинском учреждении. В дальнейшем место пореза подвергается антимикробной терапии.
В каждом учреждении массового посещения обязательно наличие аптечки с установленным содержимым надлежащего качества.
Твитнуть
как выбрать антисептик против короновируса
В условиях распространения коронавирусной инфекции Роспотребнадзор неустанно повторяет, что чистые руки залог здоровья и взрослых, и детей. В условиях, когда нет возможности помыть руки, целесообразно использовать кожные антисептики, санитайзеры. В нынешних условиях появилось много новых дезинфицирующих средств и большинство препаратов раскупают стремительно. Простота использования и большое разнообразие на полках магазинов сделали их очень популярными и востребованными, особенно в период эпидемии коронавируса. На какие важные моменты нужно обратить внимание при подборе лучшего средства для дезинфекции от патогенной флоры? Действуют ли средства для дезинфекции от коронавируса? Давайте разбираться.
На какие важные моменты нужно обратить внимание при подборе лучшего средства для дезинфекции от патогенной флоры? Действуют ли средства для дезинфекции от коронавируса? Давайте разбираться.При выборе дезинфицирующего средства всегда нужно обращать внимание на спектр действия антисептика, состав, класс опасности, сфера применения, а также внимательно изучить инструкцию для того, чтобы понимать сколько времени его нужно втирать в кожу и в каком количестве использовать.
Спектр действия антисептиков
Если вы выбрали средство только с антибактериальным действием, то нужно иметь в виду, что в период распространения ОРВИ, гриппа и других респираторных заболеваний, он может и не помочь, так как эффективность этого средства изучалась в отношении штаммов бактерий. В таком случае лучше выбрать кожный антисептик с широким спектром действия, который сможет уничтожить и бактерии, и вирусы. В инструкции по применению стоит обратить внимание на время обработки и количество средства, которое необходимо для однократной обработки рук.
Внимание на состав дезинфицирующих средств
Роспотребнадзор дал указания по поводу того, какие действующие вещества особенно неприятны для коронавируса. Это, во-первых, изопропиловый или этиловый спирт в концентрации не менее 60 процентов, а во-вторых, хлор. На патогенную флору могут воздействовать и хлоргексидин, и натуральные компоненты, важно процентное содержание. Об этом мы расскажем в другом обзоре.
Класс опасности
У дезинфицирующих средства есть классы опасности, всего их четыре: 1-й класс — чрезвычайно опасные; 2-й класс — высоко опасные; 3-й класс — умеренно опасные; 4-й класс — малоопасные. Эти классы определяют уровень токсичности средства, например, средства 1-го класса опасности используют лишь в экстремальных условиях, средства 2-го класса – в защитных костюмах и противогазах, средства 3-го класса, к которым в нашем списке относятся хлорсодержащие средства, – в перчатках, а вот средства 4-го класса могут свободно применяться для наружного использования.
Объем средства
При покупке того или иного антисептика нужно представлять себе, что вы собираетесь обрабатывать, как часто и в каких объемах.Сфера применения
Перед тем, как натирать те или иные поверхности выбранным средством, прочитайте рекомендации на упаковке. Некоторые дезинфекторы могут при взаимодействии с определенными материалами давать нежелательный эффект – обесцвечивать их, к примеру. Обычно сфера применения прописана на этикетке.
Лучше купить готовый антисептик
Если есть возможность помыть руки, лучше использовать специальные косметические средства для дезинфекции рук. Это различные жидкие мыла и гели с активными действующими компонентами. В таких продуктах содержится максимальное количество хлоргексидина 0,3%, разрешенное и рекомендованное ВОЗ в косметическом изделии, что является высокоэффективным средством для защиты кожи рук и тела от бактерий и вирусов. Например, мыло Антибактериальное Ecolatier (460 мл) обеспечит чистоту рук и защиту от бактерий, микробов и некоторых видов вирусов, т.к. содержит хлоргексидин. Очищает и дезинфицирует кожу, не вызывая ее повреждения и сухости даже при частом применении. Содержит натуральные масла и экстракты, которые питают и защищают кожу рук.
Например, мыло Антибактериальное Ecolatier (460 мл) обеспечит чистоту рук и защиту от бактерий, микробов и некоторых видов вирусов, т.к. содержит хлоргексидин. Очищает и дезинфицирует кожу, не вызывая ее повреждения и сухости даже при частом применении. Содержит натуральные масла и экстракты, которые питают и защищают кожу рук.
Дополнительные меры
Кроме того, во время эпидемии коронавируса врачи рекомендуют постоянно проветривать комнаты в квартире. Телефоны, дверные ручки нужно обрабатывать, к примеру, спиртовой салфеткой или любым антисептиком и дезинфицирующим средством. Ежедневно протирать пыль с поверхностей влажной тряпкой. Раз в неделю менять постельное белье. Раз в два дня мыть полы (водой достаточно), тряпку желательно менять постоянно или обрабатывать в дезинфекционном растворе. Подошву ботинок мыть каждый раз после посещения улицы. Не ходить по квартире в верхней одежде.Рынок средств дезинфекции огромен, в России зарегистрированы и разрешены к применению более 1000 препаратов на различных химических основах, предназначенные для использования в медицинских учреждениях, на предприятиях пищевой промышленности и общественного питания, применения населением в быту.
 Официальным источником информации о зарегистрированных средствах дезинфекции является интернет-портал «Реестры Роспотребнадзора России». Их списки постоянно пополняются и дают краткую информацию: наименование, производитель, номер свидетельства о государственной регистрации, инструкции по применению.
Официальным источником информации о зарегистрированных средствах дезинфекции является интернет-портал «Реестры Роспотребнадзора России». Их списки постоянно пополняются и дают краткую информацию: наименование, производитель, номер свидетельства о государственной регистрации, инструкции по применению.Роспотребнадзор рекомендует использовать средства на основе хлора только при специальной обработке, где живет больной человек. В быту потребители предпочитают спиртовые антисептики, как более безвредные. Но надо знать, что все спиртовые антисептики легко воспламенимы. Другой общий недостаток всех спиртовых дезсредств – резкий запах спирта, кроме того, они очень сушат и травмируют кожу рук при частом использовании. Приводим некоторые из дезинфицирующих средств.
Дезинфицирующее средство «Аламинол» представляет собой синюю жидкость с легким запахом хлора. Выпускается он в форме концентрата, а значит его необходимо растворить в воде перед применением. Спектр действия «Аламинола» – уничтожение бактерий, грибков и возбудителей острых респираторных инфекций. Он имеет класс опасности 4 (малоопасный) при нанесении на руки и класс опасности 3 (умеренно опасное) при попадании в желудок. Так что при использовании его на кухне поверхности потом нужно будет тщательно помыть водой.
Он имеет класс опасности 4 (малоопасный) при нанесении на руки и класс опасности 3 (умеренно опасное) при попадании в желудок. Так что при использовании его на кухне поверхности потом нужно будет тщательно помыть водой.
Еще одно средство для дезинфекции от коронавируса на основе хлора Хлорамин Б. Выпускается он в виде белого или слегка желтоватого порошка со слабым запахом хлора. Однако важно знать, что Хлорамин Б относится к 3 классу опасности – его используют только со средствами защиты кожи и когда рядом нет людей, так что увлекаться им не стоит.
Многоцелевое антисептическое средство PRO-BRITE CLF на основе спирта подходит как для обработки рук, так и для дезинфекции поверхностей в квартире. Он быстро высыхает и не требует смывания водой. Однако, если вы обрабатываете им поверхности, которые контактируют с пищей: разделочные доски, посуду, кухонные столы — тогда производитель советует смыть антисептик. Pro-Brite CLF легко воспламеняется, так что не стоит пользоваться им возле открытого огня.
Антисептик для рук и поверхностей «Адисепт»
Еще один спиртовой антисептик. Производитель этого дезсредства отмечает, что оно обладает пролонгированным бактерицидным действием, а значит протирать им поверхности каждый час не придется. Как и все спиртовые антисептики, он легко воспламеним и его нужно хранить на расстоянии не менее метра от нагревательных приборов.
Актерм Антисепт – Антисептическое средство
Жидкое антисептическое средство «Актерм Антисепт» тоже производится на основе изопропилового спирта и глицерина – необходимых компонентов для средств дезинфекции от коронавируса. Он убивает как бактерии, так и вирусы, и другие возбудители инфекций. Производитель утверждает, что действие «Актерм Антисепт» длится до 5 часов. Из других достоинств – антисептик легко смывается водой, если это необходимо (например, при дезинфекции посуды).
Компактный вариант для дезинфекции поверхностей в условиях эпидемии — салфетки. Дезинфицирующие салфетки «Септолит» – спиртовые, каждая из них помещена в индивидуальную упаковку. Все они пропитаны спиртосодержащим раствором. С их помощью можно обработать не только руки, но и ручки дверей, пульт от телевизора или выключатель. Как и средства выше, эти салфетки обладают противомикробной, противовирусной и противогрибковой активностью. Для достижения необходимого эффекта обрабатывать поверхность салфеткой нужно в течение 30 секунд.
Неспиртовое средство в нашей подборке – «Анолит АНК СУПЕР». Это дезинфицирующее средство уничтожает широкий спектр бактерий, вирусов и грибков. На сайте производителя сообщается, что «Анолит АНК СУПЕР» представляет собой бесцветную прозрачную жидкость с легким запахом хлорсодержащих оксидантов. В основе действия — смесь высокоактивных хлоркислородных и гидропероксидных соединений.
Несмотря на то, что санитайзеры являются наиболее часто используемыми антисептическими средствами, всегда нужно помнить, что самым результативным и безвредным методом профилактики на сегодняшний день остается мытье рук с обычным мылом или жидким антибактериальным мылом с хлоргексидином Ecolatier®. Поэтому мы рекомендуем использовать антисептические средства не как единственный, а скорее как дополнительный метод профилактики.
Будьте здоровы!
МИКРОЦИД (инструкция)
Средство предназначено для обеззараживания труднодоступных небольших по площади непористых гладких поверхностей . Готово к применению.
ИНСТРУКЦИЯ № 1/2008
по применению средства дезинфицирующего
«Микроцид®РФ ликвид» производства фирмы
Шюльке и Майр ГмбХ, Германия
Инструкция разработана в ФГУН НИИД Роспотребнадзора
Авторы: Цвирова И.М., Пантелеева.Л.Г., Левчук Н.Н., Панкратова Г.П.,
Новикова Э.А.
1 ОБЩИЕ СВЕДЕНИЯ
1.1 Средство представляет собой готовую к применению прозрачную бесцветную жидкость с характерным запахом отдушки и спирта, содержащую 1-пропанол – 22,0% и 2-пропанол – 40,0% в качестве действующих веществ, а также вспомогательные компоненты и воду – до 100,0%.
Плотность средства при 200С – 0,878-0,884, г/см3, показатель преломления при 200С – 1,3700-1,3760.
Срок годности средства – 5 лет. Средство выпускается в полиэтиленовых высокого давления флаконах вместимостью 250,1000, и 5000 мл.
Как все средства, содержащие в своем составе спирты, может повреждать поверхности, не устойчивые к его воздействию (покрытые лаком, некоторыми видами красок, плексиглас).
1.2 Средство обладает антимикробной активностью в отношении бактерий (включая микобактерии туберкулеза), вирусов (ротавирусы, вирусы парентеральных гепатитов, ВИЧ) и грибов рода Кандида.
1.3 Средство по степени воздействия на организм по ГОСТ 12.1.007-76 относится к 4 классу мало опасных веществ при введении в желудок и нанесении на кожу; при ингаляционном воздействии в насыщающих концентрациях (пары) высоко опасно (2 класс) согласно классификации ингаляционной опасности по степени летучести; не обладает местно-раздражающим действием на кожу, вызывает раздражение слизистых оболочек глаз и не оказывает сенсибилизирующего эффекта.
ПДК в воздухе рабочей зоны: 1-пропанол и 2-пропанол – 10 мг/м3
1.4 Средство предназначено для обеззараживания труднодоступных небольших по площади непористых гладких поверхностей в помещениях, предметов обстановки, приборов, оборудования при инфекциях бактериальной (включая туберкулез), вирусной (ротавирусные гастроэнтериты, парентеральные гепатиты, ВИЧ-инфекция) и грибковой этиологии в лечебно-профилактических учреждениях (включая стоматологические кабинеты, клинические, микробиологические и др. лаборатории), машинах скорой помощи, а также при проведении профилактической дезинфекции в медицинских кабинетах учреждений образования, пенитенциарных, учреждениях социального обеспечения, детских учреждениях.
2 ПРИМЕНЕНИЕ СРЕДСТВА
2.1 Средство применяют для обеззараживания небольших по площади непористых гладких поверхностей (пластик, стекло, металл и др.) не более 1/10 или 1/20 от площади всего помещения (например: в помещении общей площадью 10 м2 обеззараживаемая поверхность должна составлять не более 1 м2 или 0,5 м2) способом орошения.
Не обрабатывать поверхности, покрытые лаком, низкосортными красками, из акрилового стекла и других материалов, неустойчивых к действию спирта.
2.2 Поверхности в помещениях, приборов, оборудования, предметов обстановки орошают средством с помощью распыливающего устройства типа «Росинка» (одно нажатие – около 1 мл средства) до полного смачивания с расстояния 30 см при норме расхода – 50 мл/ м2 обрабатываемой поверхности на одну обработку. Двукратное орошение проводят с интервалом 15 мин с проветриванием после первой обработки.
2.3 Режимы обеззараживания поверхностей средством при проведении дезинфекции в лечебно-профилактических учреждениях представлены в таблице 1.
2.5 Профилактическую дезинфекцию поверхностей в медицинских кабинетах учреждений образования, социального обеспечения и детских учреждений проводят по режимам, представленными в таблице 2.
Таблица 1 – Режимы дезинфекции поверхностей средством «Микроцид®РФ ликвид» в лечебно-профилактических учреждениях
Объект обеззараживания | Вид инфекции | Время обеззараживания, мин | Способ обеззараживания |
Небольшие по площади непористые гладкие поверхности в помещениях, предметы обстановки, приборы, оборудование | Бактериальные (кроме туберкулеза), вирусные (ротавирусные гастроэнтериты, парентеральные гепатиты, ВИЧ-инфекция), кандидозы | 5 | Орошение |
Туберкулез | 30 | Двукратное орошениие с интервалом 15 мин | |
45 | Орошение |
Таблица 2– Режимы профилактической дезинфекции поверхностей
средством «Микроцид®РФ ликвид»
Объект обеззараживания | Время обеззараживания, мин | Способ обеззараживания |
Дверные ручки, телефонные трубки, журнальные столики, туалетные полочки, ручки кранов и сливных бачков, сиденье унитаза в туалетных комнатах и т.п. | 5 | Орошение |
3 МЕРЫ ПРЕДОСТОРОЖНОСТИ
3.1 Избегать попадания средства в глаза и на кожу.
3.2 Персонал проводит обработку малых по площади поверхностей способом орошения в отсутствии пациентов:
— при соотношении обработанной площади к площади помещения 1:10 с использованием средств индивидуальной защиты органов дыхания универсальными респираторами типа РПГ-67 или РУ 60М с патроном марки А и глаз герметичными очками;
— при соотношении обработанной площади к площади помещения 1:20 можно не использовать средства индивидуальной защиты органов дыхания.
3.3 Помещение следует проветривать в течение 15-30 мин.
3.4 При дозировании средства из распыливающего устройства типа «Росинка», следует учитывать, что одно нажатие выпускает на поверхность около 1 мл препарата.
3.5 Не орошать нагретые поверхности и не распылять средство вблизи огня и включенных приборов.
3.6 Средство легко воспламеняется!
3.7 Не принимать средство внутрь!
4 МЕРЫ ПЕРВОЙ ПОМОЩИ
4.1 При несоблюдении мер предосторожности при работе со средством возможно проявление раздражающего действия на органы дыхания, слизистые оболочки глаз.
4.2 При попадании средства на кожу смыть его водой.
4.4 При попадании средства в глаза следует немедленно промыть их под струёй воды в течение 10-15 минут, при появлении гиперемии закапать 30 % раствор сульфацила натрия. При необходимости обратиться к окулисту.
4.5 При попадании средства в желудок следует выпить несколько стаканов воды с 10-20 измельченными таблетками активированного угля, промыть желудок. При необходимости обратиться к врачу.
4.6 При появлении раздражения верхних дыхательных путей вывести пострадавшего на свежий воздух или в другое проветриваемое помещение, прополоскать носоглотку, дать теплое питье. При необходимости обратиться к врачу.
5 ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
5.1 Транспортируют средство всеми видами наземного транспорта в соответствии с правилами, гарантирующими сохранность препарата в закрытой оригинальной упаковке производителя.
5.2 Средство хранят закрытых складских помещениях с хорошей вентиляцией в невскрытой упаковке при температуре от минус 50С до плюс 400С, в местах, защищенных от солнечных лучей, вдали от нагревательных приборов, отдельно от продуктов питания, в местах, недоступных детям.
5.3 В аварийных ситуациях следует использовать защитную одежду — халат или комбинезон, резиновый фартук, резиновые сапоги, резиновые перчатки и универсальные респираторы марки РУ-60М или РПГ-67 с патроном марки А и герметичные очки.
При уборке пролившегося средства следует адсорбировать его удерживающим жидкость веществом (песок, земля, силикагель) и направить на утилизацию. Остатки смыть большим количеством воды.
5.4 Меры защиты окружающей среды: не допускать попадания неразбавленного средства в сточные/поверхностные или подземные воды и в канализацию.
6 ФИЗИКО-ХИМИЧЕСКИЕ И АНАЛИТИЧЕСКИЕ МЕТОДЫ
КОНТРОЛЯ КАЧЕСТВА
6.1 Согласно спецификации средство должно соответствовать показателям качества, указанным в таблице
Таблица 3– Показатели качества и нормы средства
Наименование показателя | Нормы |
Внешний вид и запах | Прозрачная бесцветная жидкость с запахом спирта и отдушки |
Плотность при 20оС, см3 | 0,878 – 0,884 |
Показатель преломления nD20 | 1,3700 – 1,3760 |
Массовая доля 2-пропанола, % | 38,0 – 42,0 |
Массовая доля 1-пропанола, % | 20,9 — 23,1 |
6.2 Определение внешнего вида
Внешний вид определяют просмотром пробы в количестве 25-30 мл в пробирке из бесцветного стекла с внутренним диаметром 30-32 мм в проходящем свете.
6.3 Определение массовой доли 1-пропанола и 2-пропанола
Определение массовой доли 1-пропанола и 2-пропанола основано на методе капиллярной газовой хроматографии с применением пламенно-ионизационного детектирования, хроматографирования пробы в режиме программирования температуры и использованием внутреннего эталона.
6.3.1 Приборы и реактивы
Аналитический газовый хроматограф типа НР GC 6890, снабженный пламенно-ионизационным детектором или хроматограф другого типа.
Капиллярная хроматографическая колонка типа НР – Рlot Q (длина 30 м, внутренний диаметр 0,53 мм, толщина слоя неподвижной фазы 40 мкм).
Неподвижная фаза полистирол-дивинилбензол.
Микрошприц вместимостью 1 мкл.
Весы лабораторные общего назначения высокого (2) класса точности, с наибольшим пределом взвешивания 200 г.
Колбы мерные вместимостью 25 мл.
Пипетки вместимостью 5 мл.
1-Пропанол х.ч. – аналитический стандарт.
2-Пропанол х.ч. – аналитический стандарт.
1-Бутанол х.ч. – вещество-внутренний эталон.
Вода дистиллированная.
Газ-носитель: азот из баллона
Водород из баллона или от генератора водорода.
Воздух из баллона или от компрессора.
6.3.2 Приготовление градуировочной смеси
В мерную колбу вместимостью 25 мл приливают 5 мл воды и последовательно добавляют, взвешивая с точностью до четвертого десятичного знака, около 1,4 г 1-бутанола (вещество – внутренний эталон), 1,5 г 1-пропанола, 2,26 г 2-пропанола и добавляют воду до калибровочной метки. После перемешивания вводят в хроматограф 0,5 мкл градуировочной смеси не менее двух раз. Из полученных хроматограмм определяют время удерживания и высоту хроматографических пиков пропиловых спиртов и вещества — внутреннего эталона в градуировочной смеси. Для каждого определяемого спирта вычисляют градуировочный коэффициент относительно 1-бутанола.
6.3.3 Условия хроматографирования градуировочной смеси и анализируемой пробы.
Расход газа-носителя 7 мл/мин.
Деление потока 1:5.
Температура колонки, программа: 130оС à 190 оС; 10оС/мин.
Температура испарителя 180оС, детектора 210 оС
Объем вводимой дозы 0,5 мкл.
Расход водорода и воздуха в соответствии с инструкцией по эксплуатации хроматографа.
Время выхода хроматограммы около 6 мин.
6.3.4 Выполнение анализа
В мерную колбу вместимостью 25 мл дозируют с помощью пипетки 5 мл воды и последовательно добавляют, взвешивая с точностью до четвертого десятичного знака, около 1,4 г 1-бутанола (вещество – внутренний эталон) и 3,2г средства, приливают воду до калибровочной метки и после перемешивания вводят в хроматограф 0,5 мкл раствора средства. Из полученных хроматограмм определяют площади хроматографических пиков пропиловых спиртов и вещества — внутреннего эталона в анализируемом растворе.
6.3.5 Обработка результатов
Градуировочный коэффициент К для каждого из определямых спиртов вычисляют по формуле:
m х Sвн.эт.
К = ——————
mвн.эт х S
где S – площадь хроматографического пика определяемого спирта в
градуировочной смеси;
Sвн.эт .– площадь хроматографического пика 1-бутанола (внутреннего
эталона) в градуировочной смеси;
m – масса определяемого спирта, внесенного в градуировочную
смесь, г;
mвн.эт – масса 1-бутанола, внесенного в градуировочную смесь, г.
Массовую долю определяемого спирта (Х, %) в средстве вычисляют по формуле:
К х S х m вн эт. х 100
Х = ——————————-
S вн.эт. х m
где S и S.вн.ст. – площадь хроматографического пика определяемого
спирта и 1-бутанола (внутреннего эталона) в анализи-
руемом растворе средства;
mвн.ст..– масса 1-бутанола (внутреннего эталона), внесенного в
анализируемый раствор средства, г;
К – градуировочный коэффициент для определяемого спирта.
m – масса средства, взятая на анализ, г.
За результат анализа принимают среднее арифметическое значение двух параллельных определений, абсолютное расхождение между которыми не превышает допустимое расхождение, равное 2%.
Антивирусные подъезды
В многоквартирных домах с конца октября по требованию Роспотребнадзора снова проходит дезинфекция подъездов. Причем управляющие компании должны проводить ее ежедневно.Обработку контролирует Управление городского хозяйства администрации.
— Проверки проходят регулярно, — рассказал первый заместитель главы по ЖКХ Алексей Сергейкин. — Уже прошло 37 рейдов, составлено десять актов по нарушениям.
В отношении тех управляющих компаний, которые в кратчайшие сроки не отреагируют на замечания, вынесут соответствующие предписания. В целом, в масштабах города, по словам замглавы, с дезинфекцией нет больших трудностей и проблем.
У муниципальной УК «Горэлектросеть» в управлении находится около 250 домов. И дезинфекцию в них проводят шесть человек. Этого количества достаточно, утверждают на предприятии.
— Мы с конца октября раз в день обрабатываем контактные поверхности в подъездах: двери, почтовые ящики, перила, подоконники, кнопки и кабины лифтов, мусоропроводы, выключатели, — объяснил заместитель директора по жилищно-коммунальному хозяйству МП «Горэлектросеть» Сергей Швайковский.- Применяем средство «Дез-Хлор». В первую волну дезинфекции привлекали подрядную организацию, теперь справляемся своими силами.
Хлорсодержащим средством пользуются и некоторые частные УК. Но их сотрудники честно признаются, что встречаются жильцы, которые недовольны фактом, что их подъезды обрабатываются таким составом. У кого-то из жильцов аллергия на хлор, другие переживают за лапы домашних питомцев. Выходят УК из положения по-разному. Кто-то из рабочих честно признается, что приходится уменьшать концентрацию активного вещества, разбавлять спецсредство. Другие управляющие компании используют для обработки менее агрессивные жидкости, в частности «Аламинол» и дважды в день проводят влажную уборку.
Если появились сомнения в качестве работы вашей УК по дезинфекции подъездов, об этом можно сообщить в Управление городского хозяйства администрации ЗАТО Железногорск по телефону 76-55-73.
Применение дезинфицирующих средств, дератизация помещений учебное пособие по ботанике и сельскому хозяйству
АЛЬДЕГИДЫ, ИХ СОЕДИНЕНИЯ И ДРУГИЕ ДЕЗИНФИЦИРУЮЩИЕ СРЕДСТВА Цель занятия — ознакомить студентов с химическими свойствами формальдегида, формалина, параформа (параформальдегида), окиси этилена, бромистого метила, озона, хлора и другими дезсредствами, способами получения и применения их в дезинфекции при различных формах микроорганизмов Из газообразных химических веществ часто применяется формальдегид, бесцветный газ с резким запахом, сильно раздражающий слизистые оболочки глаз и дыхательных путей, хорошо растворимый в воде; 40%-ный водный раствор формальдегида называется формалином. Формалин — прозрачная жидкость с резким запахом формальдегида, с нейтральной рН реакцией. На холоде он полимеризуется, приобретая молочно-белый цвет, консистенция становится густоватой. Однако это не снижает дезинфицирующее качество формалина, при комнатной температуре он приобретает прежний цвет. Высушенный полимеризованный изомер формалина, содержащий не менее 95 % формальдегида, называется пара- формальдегид или параформ. Промышленный формалин выпускается в стеклянной таре и деревянных бочках, парафом — в полиэтиленовых мешках. При хранении в формалине и параформе содержание формальдегида (АДВ) снижается. Поэтому перед приготовлением соответствующих дезинфицирующих растворов необходимо определить процентное содержание формальдегида в формалине и параформе. Бактерицидное действие формальдегида основано на его способности вступать в реакцию со многими составными веществами микробов, вызывая денатурацию их. Формальдегид для дезинфекции применяется в водных растворах и в газообразном состоянии. Орошение животноводческих помещений и других объектов проводится растворами из расчета 1 л на 1 м2 соответствующих концентраций: при дезинфекции споровых форм микробов применяется раствор с содержанием 5 %-го формальдегида, вегетативных форм — 2-3 %- ный, вирусов-1-2 %-ый с экспозицией не менее трех часов; при некоторых инфекционных заболеваниях, у которых возбудители менее устойчивы во внешней среде, растворы формальдегида могут быть использованы в меньшей концентрации. Растворы формальдегида применяют температурой 20—25 ° С. Газообразным формальдегидом дезинфицируют животноводческие 0 0 1 Fпо мещения и спецодежду (в пароформалиновых камерах). Перед проведением дезинфекции газообразным формальдегидом животноводческие помещения подготавливаются. Они должны быть (относительно) герметичными. Для этого заделывают все отверстия на стенах, потолках, окнах и дверях, вентиляционную систему отключают, вытяжные и приточные трубы закрывают. Кроме того помещения должны быть очищены от навоза и загрязнений (при необходимости все поверхности смывают сильной струей теплой воды), относительная влажность помещения должна быть в пределах 80—95%, если она меньше, то помещение предварительно азрозолируют водой или применяемым для дезинфекции формалином, разбавленным водой до 20 — 30%-ного содержания в нем формальдегида. И, наконец, температура помещения должна быть не менее 10° С. Газообразный формальдегид из формалина может быть получен химическим путем безаппаратным способом и методом выпаривания — нагреванием. Химический метод получения формальдегида основан на быстрой химической экзотермической реакции формалина с марганцовокислым калием, хлорной известью, скипидаром или с другими несовместимыми химическими веществами. Место проведения дезинфекции. Подготовить помещение. Провести расчет кубатуры воздуха помещения. На каждый 1 mj воздуха берется 25 или 30 мл формалина, содержащего 40% формальдегида, столько же Для влажной дезинфекции используют при бактерийных — 3 %-ный и вирусных инфекциях — 4%-ный растворы температурой 50—60°С. После обработки раствором помещение закрывают на 3 часа и более, затем поилки, кормушки промывают водой, после чего размещают животных. Аэрозольная дезинфекция проводится 40%-ным раствором парасода или фоспара из расчета 20 мл на 1 м3 воздуха помещения. Можно применять в виде направленных аэрозолей 5%-ным раствором препаратов из расчета 250 мл на 1 м поверхности с экспозицией 6 часов при бактерийных (кроме бациллярных), вирусных инфекциях и профилактической дезинфекции. При дезинфекции с использованием фоспара и парасода животных из помещения удаляют. Окись этилена (ОЭ) — бесцветная летучая жидкость с резким запахом, температура кипения около +11° С. Удельный вес жидкости 0,887, газа 1,85, при температуре + 15 С хорошо растворяется в воде, при нагревании образуется этиленгликоль. Так ОЭ в смеси с воздухом от 4,3 — 60,4% легко воспламеняется. ОЭ промышленность выпускает в стальных баллонах, для предотвращения полимеризации, к нему добавляют 30%-ный пергидроль от 0,15 до 0,25%. ОЭ обладает большой инсектицидной и бактерицидной активностью. В связи с высокой огне- и взрывоопасностью он применяется в смеси с бромистым метилом. Бромистый метил (БМ) — (метилбромид, бромметил) бесцветная жидкость, со слабым эфирным запахом, температура кипения 4 3,6 °С, замерзания минус 93,7 °С. Удельный вес жидкой фазы 1,732, газовой — 3,7. Жидкий БМ не горит, растворимость в воде при 20 ° равна 1,8 %. Жидкий БМ растворяет жиры, разрушает каучук, краску, асфальт, не оказывает вредного действия на ткани, древесину, цветные металлы, сталь, не коррозирует железо. Пары БМ в смеси с воздухом в любых соотношениях не взрывоопасны. БМ выпускают в стальных баллонах, стабилен при хранении, не изменяется под действием света, влаги и тепла. В настоящее время БМ является одним из основных инсектицидов, используемых для фумигации грузов на карантинных пунктах и уничтожения насекомых-вредителей. БМ по степени бактерицидности значительно уступает активности ОЭ. Поэтому, учитывая высокую бактерицидность ОЭ и то, что газы БМ в смеси с воздухом невзрывоопасны, в ветеринарной практике рекомендуется применять их смесь. В нашей стране эта смесь была предложена для дезинфекции В.Т. Осиняном в 1961 г. Газ ОКЭБМ состоит из одной весовой части ОЭ и 2,5 весовых частей БМ и выпускается отечественной химической промышленностью в стальных баллонах. Смесь ОКЭБМ представляет собой стойкую, однородную, прозрачную жидкость с резким эфирным запахом, кипит при температуре + 8,5 ° С, переходя а газообразное состояние. Газ ОКЭБМ при смешивании с воздухом в любых отношениях неогнеопасен. Кроме того, он не портит кожаные и меховые изделия, ткани; сырье растительного и животного происхождения, полированные и окрашенные изделия. Газ ОКЭБМ обладает высокой проницательной способностью, особенно ввиду большого удельного веса он рекомендован для обеззараживания глубоких слоев почвы, сибиреязвенных скотомогильников нагнетанием газа под пленку покрытой почвы. Для этого пробуривают в почве шурфы глубиной 1 м в шахматном порядке на расстоянии 6—7 м друг от друга. На территории скотомогильника размещают емкости также в шахматном порядке в 10—15 м друг от друга, затем всю площадь вместе с емкостями покрывают пленкой. В пленке проделаны отверстия для резинового шланга, через который вес емкости заливают жидким ОКБМ из расчета 3 кг/м2. Края пленки должны быть хорошо вделаны в канавы и загерметизированы грунтом. Газ ОКЭБМ используется также для дезинфекции ульев и сотов, вощины, пчеловодного инвентаря и оборудования. Дезинфекция проводится под пленной исходя из следующего расчета: при спорообразующих возбудителях 3 кг/м3 с экспозицией 10 суток, при других болезнях — 2 кг/м 3 — 3 суток. При работе с названными веществами необходимо соблюдать меры предосторожности: к работе допускаются только специально обученные люди, и они должны работать в противогазах. Озон (О з) — газ, светло-голубого цвета со специфическим запахом, ощущаемый при концентрации его в воздухе выше 0,015 мг / м3. Озон нестоек, быстро превращается в молекулярный кислород, выделяя тепло. Озон в жидкую фазу превращается при минусовых температурах ниже 180°, и его можно хранить длительное время. Озон широко распространен в природе. Он образуется в воздухе во время грозы, фотохимически — в хвойном лесу, при окислении смолистых веществ, при испарении воды с больших поверхностей и пр. Окисляет озон все металлы, кроме золота и платины, активно вступает во взаимодействие с компонентами микробной клетки, приводя их к окислению, поэтому является высокоэффективным микробоцидным веществом среди других дезинфицирующих средств. В концентрации в воздухе 0,005 мг/м3 действует бактерицидно, 2 мг/л — в воде на неспорообразующие в течение 1 мин. и на спорообразующие — 5 мин. Получение озона. Озон можно получить методом электросинтеза в специальных генераторах. Для этого необходимы следующие условия: температура воздуха не должна быть выше 40° (в среднем 15—25°). относительная влажность не выше 70 % (лучше меньше), высокое содержание кислорода в воздухе. Аппаратура: Озонатор ОВ-1 воздушного типа, озонатор РГО-1 (рефрижераторный генератор озона), озонатор ЛГО-15, озонатор «Озон-1», озонатор «Озон-2М». Высокую производительность имеют озонаторы ОПГ-1, ПГО-8, 1ТГО-16. Озон широко применяется для дезинфекции инкубационных яиц. Лучшие результаты дает влажная дезинфекция: инкубационные яйца орошают или омывают в потоке жидкости с температурой 40—45°С, насыщенной озоном до концентрации 3—5 мг/л. Озон является хорошим дезинфицирующим средством для обеззараживания сточных вод животноводческих помещений, предприятий по переработке животноводческой продукции и сырья, инфицированных 20—множитель для выражения в процентах, так как титрование брали 5 мл или в 20 раз меньше 100. Например: на титрование израсходовано 38,2 мл раствора гипосульфита, тогда: X = (100—38,2) х 0,0015 х 20 х 20 — 37,08 % Необходимо приготовить 1000 л раствора, содержащего 4% формальдегида, из формалина с содержанием его 37,08 или округлено 37 %. Для этого нужно брать 40 кг формальдегида, а в 100 кг формалина его содержится 37 кг, то есть, отразив в пропорции, мы получаем: 100 кг формалина содержит 37 кг формальдегида: 100—37 Х-40 Х= 100×40 =108 кг 37 Отсюда для приготовления 1000 л 4%-ного раствора формальдегида нужно взять 108 кг формалина (содержащего 37% формальдегида) и 892 л воды. Студенты приготавливают 2, 3, 4 и 5% растворы формальдегида с учетом содержания его в определенном формалине в количестве 100 мл. Безаппаратные методы получения формальдегида (опыты проводить в вытяжном шкафу): 1. В фарфоровую ступку взять 3 мл формалина, к нему добавить 3 мл воды, 3 г марганцовокислого калия, размешать стеклянной палочкой, при этом смесь закипает и активно выпаривается формальдегид. 2. Смешать в фарфоровой ступке равные количества (5—10 г) формалина и хлорной извести. Смесь сама нагревается, испаряется формальдегид и улетучивается активный хлор. АДВ в хлорной извести (активный хлор) должен быть не менее 25 %, а формальдегида в формалине 36—40 %. Задача № 1. Рассчитать потребность дезинфицирующих средств, для обеззараживания следующих объектов: 1. Коровник — длина 82 м, ширина 12м, высота 2,8 м, поверхность кормушек составляет 2/5 кв. метров. 2. Телятник приспособленный — длина 72 м, ширина 14 м, высота 2,8 м, общая поверхность перегородок равна 526 м. Провести дезинфекцию при туберкулезе в двух помещениях после удаления из них положительно реагирующих на туберкулин животных Для дезинфекции применяют щелочной раствор формальдегида (3 % едкого натрия и 3 % формальдегида). Для дезинфекции щелочной раствор формальдегида применять из расчета: 1 литр в типовом и 1,5 литра в приспособленном помещении на 1 кв. метр поверхности. Задача № 2, Провести расчет количества дезинфицирующих средств необходимых для обеззараживания следующих объектов: 1. Птичник типовой, длина — 76 м, ширина — 12 м и высота 3,6 м. Помещение разделено на 2 секции, в середине имеется отсек для вентиляторного калориферного оборудования длиной 6 м (на всю ширину птичника). 2. Птичник типовой — длина 82 м, ширина 18 м, высота 3,6 м, разделенные на 2 половины в середине длиной 12 м на всю ширину птичника, где имеются бытовые комнаты и калориферная установка. Для дезинфекции применять 2 % — ный раствор формальдегида из расчета 1 литр на 1 кв. метр поверхности. В хозяйстве имеется формалин, содержащий 38 % формальдегида. Расчет потребности препарата для приготовления растворов различной концентрации Приготовлени е раствора с содержанием АДВ, % Содержание АДВ в препарате 16 18 20 22 24 26 28 30 32 34 36 38 Необходимое количество препарата в г на 100 мл воды 0,1 0,67 0,6 0,5 0,5 0,4 0,4 0,4 0,3 0,3 о,з 0,3 0,3 о,з 1,8 1,7 1,5 1,4 1,3 1,2 1,1 1,0 0,9 0,9 0,8 0,8 0,5 3,1 2,8 2,5 2,3 2,1 1,9 1,8 1,7 1,6 1,5 1,4 1,3 0,7 4,4 3,9 3,5 3,2 2,9 2,7 2,5 2,3 2,2 2,1 1,9 1,8 1,0 6,7 5,6 5,0 4,5 4,2 3,8 3,6 з,з 3,1 2,9 2,7 2,6 1,5 8,3 8,3 7,5 6,8 6,3 5,8 5,4 5,0 4,7 4,4 4,2 4,2 2,0 12,5 11,1 10,0 9,1 8,3 7,7 7,2 6,7 6,3 5,9 5,6 5,3 2,5 15,7 13,9 12,5 11,4 10,4 9,6 8,9 8,3 7,8 7,4 6,9 6,6 3,0 18,8 16,7 15,0 13,6 12,5 11,5 10,7 10,0 9,4 8,8 8,3 7,9 3,5 21,8 19,4 17,5 15,9 14,6 13,5 12,5 11,7 10,9 10,3 9,7 9,2 4,0 25,0 22,2 20,0 18,2 16,7 15,4 14,3 13,3 12,5 11,8 11,1 10,5 4,5 28,2 25,0 22,5 20,5 18,8 17,3 16,1 15,0 14,1 13,3 12,5 11,8 5,0 31,3 27,8 25,0 22,7 20,8 19,2 17,9 16,7 15,6 14,7 13,9 13,2 касторового или солярового масла, либо вазелином или легкой копотью. Предметное стекло помещают горизонтально на струе аэрозоля или же резким движением руки проносят стекло через облако аэрозоля и немедленно измеряют величину (диаметр) капелек под малым увеличением микроскопа, затем выводят их среднюю арифметическую величину. Используются так же приборы, основанные по использованию инерционных сил осаждения — импакторы. Дезинфекция помещений бактерицидными аэрозолями Дезинфекция зараженных объектов методом орошения (опрыскивания) является вполне надежным способом, однако он имеет ряд существенных недостатков: трудоемкость обработки, большой расход дезсредств, очень продолжительная работа во вредных условиях под влиянием паров горячих дезрастворов, отсутствие дезинфекции воздуха. Исследования, направленные на совершенствование методов дезинфекции, на снижение трудоемкости, расхода дезинфицирующих средств и на повышение качества дезинфекции являются актуальными. Перспективным направлением в разрешении этой проблемы является разработка методов применения дезинфицирующих средств в аэрозольном состоянии. Получение аэрозолей и проводимая ими дезинфекция менее трудоемки, чем приготовление растворов и использование их методом орошения. Бактерицидный эффект от применения аэрозолей достигается при меньшем расходовании химических средств. При аэрозольном способе обеззараживаются поверхности стен, потолка, пола и воздух данного помещения. При проведении аэрозольной дезинфекции необходимо соблюдать определенные условия: 1) герметичность помещения; 2) температура среды; 3) влажность воздуха. В хорошо закрытом помещении долго удерживается нужная концентрация аэрозолей дезинфицирующего препарата в воздухе и увеличивается отложение его на поверхностях. При обработке ветхих со сквозняками помещений происходит настолько быстрое выдувание аэрозолей и снижение концентрации дезсредства, что даже трехкратное увеличение дозировки препарата не обеспечивает надежного обеззараживания. Следует учесть, что в отдельных местах помещения (около окон, дверей, плохо прикрытых вентиляционных каналов) могут образоваться потоки воздуха, которые препятствуют оседанию частиц аэрозоля, способствуют их выдуванию. Поэтому перед проведением аэрозольной дезинфекции необходимо как можно тщательнее заделывать все отверстия. Температура помещения во время дезинфекции также является важным фактором. При низкой температуре ухудшаются условия взаимодействия между микробной клеткой и химическим дезинфицирующим средством. Практически ни одно дезинфицирующее вещество неактивно при температуре ниже 0° С. Это объясняется понижением диффузии и замедлением реакции между дезинфицирующим химическим веществом и микроорганизмом. Кроме того, при минусовой температуре частицы водного раствора аэрозоля превращаются в кристаллики льда и выпадают в осадок. По мере увеличения температуры среды увеличивается и бактерицидность дезсредств. Температура в помещении для аэрозольной дезинфекции должна быть не ниже 10°С. Чем выше температура воздуха, тем больше можно создать концентрацию и плотность аэрозольных частиц в воздухе. Эффективность действия аэрозольной дезинфекции зависит не только от температуры воздуха, но и от температуры поверхностей пола, потолка и стен. Желательно, чтобы температура поверхностей была несколько ниже, чем температура воздуха, тогда оседание аэрозольных частиц на поверхностях будет лучше. Влажность воздуха помещения также отражается на эффективности аэрозольной дезинфекции. Оптимальной степенью относительной влажности воздуха в дезинфицируемом помещении следует считать 60—80%. При низкой влажности рекомендуется перед проведением дезинфекции распылять воду в количестве, равном количеству дезсредства. При дезинфекции формалином можно его разбавить водой 1:1 и ввести в аэрозоль без предварительного распыления воды. Хуже обеззараживаются сильно увлажненные поверхности, так как при этом концентрация активно 0 0 1 Fдей ствующего вещества сильно снижается. Способы получения аэрозолей Аэрозоли можно получить механическим, пневматическим, пневмомеханическим и экзотермическим способами. Для этого используются генераторы: струйный аэрозольный генератор (САГ), дисковый аэрозольный генератор (ДАГ), пневматический аэрозольный генератор (ПАГ), АГ-УД-2, а также специальные форсунки с распылителями 3-х типов: 1. Форсунки, в которые жидкость подается под давлением и распыляется с большой скоростью через небольшое отверстие (механический способ). Пневматические (газовые) форсунки, в которых жидкость распыляется током воздуха (ПВАН— пневматическая вихревая аэрозольная насадка, ПТГ1 — насадка турбулентная пневматическая и др.). Дисковые распылители, в которых жидкость разбрызгивается, срываясь с кромки быстро вращающегося диска. Пневматические форсунки или насадки дают возможность получить аэрозоли с частицами величиной 20—50 микрон с производительностью 3 л в минуту. Их можно использовать для дезинфекции аэрозольным методом, применяя на установках типа ЛСД, ДУК, ВДМ и АДСА. В ветеринарной дезинфекции аэрозоли можно применять для одновременной дезинфекции воздуха и поверхностей в помещениях для животных (стен, пола, потолка, перегородок кормушек и других предметов, находящихся в помещениях) сильнодействующими ядовитыми препаратами, а также для дезинфекции воздуха помещений в присутствии животных, с использованием слабоядовитых препаратов, но обладающих достаточно хорошей бактерицидностью. алюминиевой пудрой в присутствии влаги возгорается, чтобы не произошло воспламенения, сюда же примешивают хлористый аммоний. Компоненты для смеси берут в следующих соотношениях: 0,8 г кристаллического йода, 0,07 г алюминиевой пудры и 0,1 г хлористого аммония. Необходимое количество указанных препаратов раскладывают в чашки по 20—100 г в каждую. Чашки устанавливают на расстоянии друг от друга 8—10 метров на 1—1,5 метра ниже уровня потолка. Для возгорания смеси в них добавляют несколько капель воды. Такую дезинфекцию можно проводить в присутствии птицы при респираторных заболеваниях. Самостоятельная работа студентов Цель занятия: ознакомить студентов с методами получения аэрозолей из жидких и твердых веществ. Показать приборы и аппаратуру дли получения аэрозолей из жидких дезинфицирующих веществ (ДАТ, САГ и ПАТ и насадки различных систем — ИВАН, НТП и др.). Место проведения занятия: аудитория кафедры. Обеспечение занятия: ДАТ, САГ, ПАГ (при отсутствии этой аппаратуры демонстрируют их схемы, принцип работы). Для определения величины аэродисперсных частиц используют пульверизатор с жидким дезинфицирующим средством, предметные стекла, кусочек резины (для сжигания) или касторовое масло, микроскоп с окулярной измерительной линейкой. Преподаватель показывает аппаратуру для получений аэрозолей, объясняет ее устройство и технические данные. Затем студенты самостоятельно получают аэрозольные частицы простейшими способами и определяют величину их. Определение степени дисперсности аэрозолей гравитационным осаждением. 1. Подготавливают аппаратуру (пульверизатор) для получения аэрозолей. 2. Подготавливают предметное стекло, для этого его смазывают легким слоем касторового масла или же наносят легкий слой копоти путем сжигания черной резины. 3. Производят аэрозоли. Резким движением руки предметное стекло проносят через аэрозольную струю на расстоянии 20—30 см от сопла распылителя, затем его просматривают под микроскопом и измеряют величину частиц аэрозолей. Измеряют не менее 100 частиц, после чего выводят среднюю величину. Определяют монодисперсность и полидисперсность. МЕХАНИЗАЦИЯ ДЕЗИНФЕКЦИОННЫХ РАБОТ Цель занятия: ознакомить студентов с механизированными дезинфекционными агрегатами и принципом их работы. Техника, применяемая для дезинфекции, подразделяется на ручную или переносимую, перевозимую, передвижную и стационарную. Переносимые (ручные) дезинфекционные аппараты бывают 2-х видов: ранцевые и напольные. Они предназначены для дезинфекции небольших объектов. По принципу действия дезинфекционные аппараты подразделяются на гидравлические и пневматические. В пневматических жидкость выбрасывается под давлением воздуха, нагнетаемого насосом в резервуар с дезраствором, в гидравлических — дезраствор нагнетается при помощи жидкостного насоса. Гидравлические дезинфекционные аппараты 1. Ветеринарный гидропульт типа «Костыль» дает хорошую, распыленную струю длиной 7 м, компактную струю 13м. Давление жидкости при работе гидропульта на полную мощность равно 2,5 атм, при уменьшенном расходе жидкости человек средней силы может свободно развить давление до 6 атм. Производительность гидропульта при дезинфекции нанесением 1 л жидкости на 1 кв. м составляет 6 кв. м в минуту. После работы гидропульт необходимо тщательно промыть чистой водой и залить техническим вазелином или автолом. Опрыскиватель ОС- 2 1М «Север» по производительности соответствует гидропульту типа «Костыль». Гидропульт шланговый (медицинский) ГШ-2 представляет собой полую цилиндрическую трубку-корпус, служащую резервуаром для засасываемой и выбрасываемой дезинфицирующей жидкости. Внутри корпуса расположено клапанное устройство, обеспечивающее движение жидкости в сторону выбрасываемого шланга. По производительности он значительно уступает гидропульту «Костыль» и опрыскивателю «Север» и используется главным образом в медицинской практике. трубу в вертикальное положение, присоединяют напорный рукав к штутцеру, включают двигатель и затапливают топку. При достижении требуемой температуры раствора начинают дезинфекцию. Поток жидкости при этом идет из резервуара в змеевик топки, затем через насос в напорный шланг. После работы всю трубную систему нужно промыть чистой теплой водой. 2. Моечно-дезинфицирующая установка ОМ-5359-01 предназначена для проведения санитарной очистки производственных животноводческих помещений с использованием струй воды высокого давления. Она состоит из сварной рамы (1900×940) 2×1 метр на 4 обрезанных колесах, на раме установлены топливный бак, емкость для концентрированного раствора и насоса высокого давления. Вода используется из водопроводной сети через шланг или из какой-либо емкости. Вода или дезраствор в теплообменнике нагревается, проходя через змеевик. Нагретый до нужной температуры раствор (вода) поступает в насос высокого давления, МПа (кг/см2) 10 (100), расход воды иди раствора 1 м3/час. Длина шланга 50 метров. Имеются аналогичные моечно-дезинфицирующие прицепные установки типа ОМ — 22614 с рабочим давлением МПа (кг/см ) 14,0 (140). Рабочий расход раствора при дезинфекции 1 м3/час. Передвижные дезинфекционные установки 1. Дезинфекционная установка системы Н.М. Комарова (ДУК), смонтирована на шасси грузового автомобиля ГАЗ-53 (ДУК-1 и ДУК-2), а также на шасси других современных автомобилей. Она состоит из цистерны для рабочего раствора емкостью 800 или 1000 литров, резервуаров— бачков для исходных концентрированных дезосредств, подогревателей (котел со змеевиком) системы газовых и жидкостных трубопроводов, напорных (по 20 м — 2 шт.), приемных (10 м — 1 шт.) шлангов, ящиков для шлангов, принадлежностей, инструментов и дополнительной кабины для обслуживающего персонала. Всасывание жидкости в цистерну происходит путем создания вакуума за счет всасывания цилиндров двигателя автомашины, а для создания давления в цистерне используются выхлопные газы двигателя, которые нагнетаются в цистерну, Для облегчения работы двигателя по созданию рабочего давления в цистерне применен автомобильный компрессор, который установлен на блоке цилиндров двигателя. Воздух из компрессора подается в рессивер-емкость, где создается давление до 3,5—4 атм. Сжатый воздух через редуктор направляется в цистерну, в ней поддерживается постоянное давление в 2 атм. Производительность ДУК (по данным автора) при работе горячим раствором одним шлангом составляет 2500 кв. м, двумя шлангами —до 4000 кв. м, за 6 часов (за рабочий день). 2. Моторный опрыскиватель смонтирован на грузовом мотороллере ТТ-200. Опрыскиватель состоит из двигателя внутреннего сгорания типа «Дружба-59», шестеренчатого насоса, манометра, всасывающего и напорных шлангов с форсунками, с распылителями и емкостью для дезраствора на 200 литров. Насос шестеренчатый может обеспечивать давление в распылительных шлангах до 10—15 атм., что позволяет получить очень мелкое распыление жидкости. Опрыскиватель одновременно может работать на трех форсунках, расходуя от 10 до 30 л раствора в минуту. Этот опрыскиватель обслуживает 1 человек, удобно применять на отгонном животноводстве, в оленеводческой практике для дезинфекции и дезинсекции. В последнее время для дезинфекции и дезинсекции рекомендуется использовать механизированные агрегаты для получения аэрозолей. Аэрозольный способ дезинфекции является прогрессивным и экономически выгодным. Получение аэрозолей в настоящее время возможно на основе использования совершенной техники и механизации. Установка дезинфекционная передвижная (УДП) предназначена для проведения влажной дезинфекции и гидроочистки в промышленных животноводческих комплексах. Она оборудована на трубчатой сварной раме на трех пневматических колесах, состоит из трех поршневого насоса, создающего рабочее давление 2 МПа, привод насоса осуществляется от электродвигателя. Емкость основного резервуара 220 литров, имеет две канистры по 20 литров для концентрированного раствора, длина электрокабеля 40 метров, рабочие шланги 2 шт. по 20 метров. Расход жидкости через распылитель при гидросмыве 60 л/мин, при дезинфекции — 20 л/мин. За рабочую смену с помощью УДП можно продезинфицировать до 8000 м2 поверхности. Установка дезинфекционная самоходная (УДС) предназначена для дезинфекции и гидроочистки животноводческих помещений. Она смонтирована на электрокаре, имеющем пневмоколесный ход. Каждый электрокар снабжается портативным зарядным устройством с автоматизированным режимом. УДС состоит из насоса, привод которого осуществляется от электродвигателя, имеет основной резервуар на 900 литров и два бака по 55 л для концентрированных растворов дезосредств. Длина электрокабеля 40 м, рабочих шлангов 2 по 40 м. За рабочую смену с помощью УДС можно продезинфицировать до 8000 м поверхностей, давление в основном резервуаре создается до 2 МПа, расход дезраствора 20 л/мин. Туманно-дымообразующий агрегат (ТДА), разработанный Сибирским отделением АН СССР для дезинфекции лесных массивов аэрозолями дезинсектантов. Этот аэрозольный агрегат обладает очень высокой производительностью — 10—15 тыс. гектаров площади в открытой природе. Автомобильный дезинфекционно-санитарный агрегат (АДСА) позволяет провести влажную дезинфекцию холодными и горячими растворами дезосредств, аэрозольную дезинфекцию и дезинсекцию с использованием пневмомеханической и механической аэрозольных насадок, камерную дезинфекцию спецодежды и инвентаря и вакуумную чистку поверхности одежды, тела животных с удалением пыли в изолированный контейнер. При помощи АДСА можно проводить опрыскивание и обмывание животных теплым раствором дезосредств. АДСА смонтирован на кузове автобуса вагонного типа, на шасси автомашины ГАЗ-63. Салон автобуса разделен на отсеки: для водителя, машинное отделение, кабина для размещения дезинфекционной бригады и БАКТЕРИОЛОГИЧЕСКИЙ КОНТРОЛЬ КАЧЕСТВА ДЕЗИНФЕКЦИИ Контроль качества проведенной дезинфекции животноводческих помещений должен проводиться после профилактической, текущей и заключительной дезинфекции при заболеваниях, возбудители которых относятся к неспорообразующим микробам и вирусам. По наличию кишечной палочки определяется качество профилактической и вынужденной (текущей и заключительной) дезинфекции при сальмонеллезе, роже свиней, бруцеллезе, ящуре (текущей дезинфекции), чуме свиней и птиц. По наличию стафилококка определяется качество дезинфекции при оспе овец и птиц, лептоспирозе, туберкулезе, вирусном гепатите утят и при ящуре -— после заключительной дезинфекции. Для бактериологического исследования после проведенной дезинфекции пробы берут с 10 — 20 различных участков (с поверхностей полов, стен, кормушек, стойл и проходов и т. п.) стерильными ватными тампонами, смоченными в стерильном нейтрализующем растворе. При применении для дезинфекции растворов щелочей в качестве нейтрализующего раствора берут раствор уксусной кислоты, при дезинфекции формалином — раствор нашатырного спирта, при дезинфекции окислителями (хлорная известь) раствор гипосульфита, при дезинфекции щелочным раствором формальдегида — раствор, состоящий из уксусной кислоты и нашатырного спирта. Нейтрализующие растворы готовят в концентрации в 10 раз меньшей, чем концентрации дезинфицирующего раствора. При применении для дезинфекции других средств, в качестве нейтрализующего раствора используют обычную стерильную воду. После проведения профилактической дезинфекции пробы берут через 2 —3 часа после проведения дезинфекции, и после проведения текущей дезинфекции — по истечении срока экспозиции, как указано в инструкциях по дезинфекции при отдельных заболеваниях. Пробы, взятые для исследования, каждую в отдельности отмывают во флаконах в 20 мл стерильной нейтрализующей жидкости или воды путем нескольких погружений и отжатий тампона. Отжатые тампоны удаляют, а жидкость центрифугируют при 3000—3500 об/мин, в течение 20—30 мин. Затем надосадочную жидкость сливают, к осадку в пробирку доливают равное количество стерильной воды, содержимое смешивают и снова центрифугируют в течение 20 мин. После этого надосадочную жидкость снова сливают, а осадок высевают на соответствующие питательные среды. Для индикации кишечной палочки пробы высевают на модифицированную среду Хейфеца по 0,5 мл центрифугата на 5 мл среды. Посев выдерживает в термостате при температуре 43°С в течение 12—18 часов. Наличие кишечной палочки в посеве характеризуется изменением малинового цвета среды на зеленый или салатный с помутнением среды и газообразованием. Другие цветовые изменения (желтоватый, розовый, сероватый), возникающие при росте посторонних микробов, не учитываются. Для индикации стафилококков высевают по 0,5 мл, центрифугата в 5 мл 50-процентного сахарного мясопептонного бульона. Через 24 часа после инкубирования в термостате при 37°С делают пересевы на 8,5%-ный солевой мясопептонный агар. Посевы также выдерживают в термостате 24 часа при температуре 37°С. Выросшую культуру исследуют под микроскопом. Проведенная дезинфекция признается удовлетворительной, если нет роста тест микробов в исследуемых пробах: профилактическая — во всех пробах; текущая — не менее чем в 90% проб; заключительная — во всех пробах. Питательные среды, используемые при контроле качества дезинфекции 1. Модифицированная среда Хейфеца. К 1 л дистиллированной воды добавляют 10 г пептона, 5 г хлористого натрия и 4 г лактозы. Смесь доводят до кипения, затем фильтруют и после остывания определяют рН, который должен быть в пределах 7,4—-7,8. Затем к среде добавляют в качестве индикатора 1 мл 5%-ного спиртового раствора розоловой кислоты и 2,3 мл 0,1%-ного водного раствора метиленовой сини. Среду разливают в пробирки но 5 мл и стерилизуют в автоклаве при 0,5 атм. 15 минут. Исходный цвет среды— красновато-сиреневый. 2. Сахарный мясопептонный бульон. К обычному мясопептонному бульону с рН 7,2—7,6 добавляют 50% сахарозы и подогревают до полного ее растворения. После этого сахарозный бульон разливают в пробирки по 5 мл и стерилизуют при 0,5 атм. 20 минут. 3. Солевой мясопептонный агар. К мясопептонному агару добавляют 8,5% хлористого натрия, затем среду стерилизуют при 1,5 атм. 30 минут. Перед использованием среду расплавляют и разливают в чашки Петри 0 0 1 Fс со блюдением стерильности. Самостоятельная работа студентов (2 часа) Цель занятия: научить студентов методам проверки качества дезинфекций Место занятия: аудитория кафедры. Обеспечение занятия: исходная суточная бульонная культура кишечной палочки, дощатые и кирпичные объекты (поверхности кирпича и доски), 1 и 2%-ные растворы едкого натрия, 0,1 и 0,2%-ные растворы уксусной кислоты, ватные тампоны, центрифуга с пробирками, стерильные пинцеты, кипяченая (стерильная) вода, платиновые петли, спиртовки, питательные среды Хейфица. Ход занятия: лаборанты кафедры предварительно инфицируют поверхность (двух досок и кирпичей) суточной бульонной культурой кишечной палочки, после высыханий поверхности досок (кирпичей) проводят дезинфекцию одной доски (кирпича) 1%-ным, а другой доски (кирпича) 2%-ным горячим (70—80°) раствором едкого натрия из расчета 1 л раствора на 1 кв. м поверхности. Методика бактериологического контроля качества дезинфекции По истечении двух часов после проведения дезинфекции студенты берут пробы с 10—20 мест путем протирания поверхности доски (кирпича) другие растения в садах и лесах. Кроме того, грызуны болеют сибирской язвой, сальмонеллезами, туляремией, туберкулезом, проказой, рожей, бруцеллезом и некоторыми другими инфекционными болезнями, поэтому являются резервуаром возбудителя, к тому же на грызунах обитают накожные паразиты (блохи, клещи, вши), которые в свою очередь так же могут быть носителями и распространителями возбудителей болезней. В некоторых случаях грызуны и их накожные паразиты могут быть механическими распространителями возбудителей инфекционных болезней (некробактериоз, пастереллез, ящур и др.). Меры борьбы с мышевидными грызунами слагаются из проведения профилактических и истребительных мероприятий. Профилактические мероприятия направлены: 1) на лишение грызунов пищи и воды; 2) нарушение условий размножения; 3) защиту животноводческих объектов от проникновения грызунов. Не нужно оставлять концентрированные корма и продукты питания в доступных для грызунов местах. Ворота и двери помещений должны плотно закрываться, глубину твердого фундамента строить не менее 1 метра. На полях разрушать норы грызунов путем глубокой вспашки, а на путях движения их к животноводческим объектам и кормохранилищам устраивать преграды (канавы, бетонные барьеры и фундаменты). Лучше строить кормохранилища на сваях с металлическим козырьком, высотой пола на 70—80 см от земли. При обнаружении на полу нор грызунов немедленно их заделывать. Истребительные меры Средства, применяемые для дератизации, подразделяются на 0 0 1 Fмеханиче ские, химические, биологические, биохимические. К механическим средствам дератизации относятся различные виды 0 0 1 Fло вушек: 1) капканы различных номеров; 2) верши различных объемов; 3) ловушки с перевертывающимися площадками. Химические средства дератизации подразделяются на остродействующие препараты: фосфит цинка, углекислый барий, хлористый барий, фтористый натрий, уксуснокислый талий, мышьяковистый ангидрат, монофторин, различные ядовитые газы и препараты кумулятивного действия: зоокумарин, натриевая соль зоркумарина. дифенацин (ратиндан-1), фентолацин (ратиндан-2), пенолацин. С указанными химическими средствами готовят приманки. В качестве приманок нужно использовать хорошо поедаемые грызунами корма и пищевые продукты. Для того, чтобы приманки хорошо поедались грызунами, нужно вначале 3—4 дня их подкармливать продуктами без добавления ядов. По количеству съеденных приманок судят о примерной численности грызунов. После того, как грызуны привыкнут к данному виду пищевых или кормовых приманок и охотно их поедают, им кладут отравленные приманки. Полное поедание грызунами приманок указывает на значительное заселение ими данного объекта. Для приманок можно использовать такие пищевые продукты, как хлеб, различные каши, вареный картофель, свежий мясной и рыбный фарш, концентрированные корма, постоянно используемые в этом помещении животными. Приманки должны быть доброкачественными и привлекательными по запаху. Крыс привлекает запах растительного масла, копченых колбас, свежего мяса, некоторые крысы поедают сухие сладкие корма, другие — жидкие и сладкие, поэтому приманки желательно разнообразить. Приманку нужно готовить только для текущей потребности. Фосфид цинка — порошок серовато-стального цвета с запахом фосфора, содержит 26% фосфора и 74% цинка. Он хорошо растворяется в слабых кислотах и щелочах, плохо — в воде. Смертельная доза для взрослой крысы 15-30 мг или 75—150 мг/кг, для мышей 150—200 мг/кг, для сусликов 20— 24 мг/кг живой массы. К приманке добавляют 3% препарата. Фосфид цинка во влажных приманках может разлагаться. Яд острого действия. Грызуны, получившие смертельную дозу, погибают в течение 1 суток. При попадании фосфида цинка в желудок под влиянием желудочного сока происходит выделение фосфористого водорода, который, всасываясь в кровь, приводит к параличу нервных центров. Фторанетат натрия или бария — кристаллический сероватого цвета порошок плохо растворяется в воде. Летальная доза для крыс 1 мг/кг, мышей 12 мг/кг живой массы. Смерть наступает через несколько часов. К приманкам его добавлять 1—3%. Монофторин — кристаллическое вещество серовато-розового цвета. Летальная доза для крыс и мышей 15 мг/кг живой массы. Наиболее чувствительны к монофторину кошки и собаки, летальная доза для собак 1,25 мг/кг, для кошек 2,2 мг/кг живой массы. Уксуснокислый таллий, углекислый и хлористый барий к приманкам добавляют 1—3%. Препараты кумулятивного действия нужно задавать многократно, не менее трех дней подряд. Они обладают антикоагулятивньш свойством, тормозят образование в организме животного протромбина, что замедляет свертываемость крови и одновременно повреждает стенки периферических кровеносных сосудов, в результате происходят множественные кровоизлияния. Смерть наступает от геморрагического диатеза, главным образом от кровоизлияния в мозге. Зоокумарин содержит действующего яда (оксикумарин) 1% и 99% наполнителя (костная пыль, тальк или крахмал). Белый или сероватый порошок, растворимость в воде зависит от наполнителя. Летальная кумулятивная доза для мышей и крыс 0,25 мг на прием. Поедая в приманках 3-5 раз такое количество яда, крысы погибают в течение 3-15 суток. Многократная смертельная доза для домашних животных намного выше: для кур 200 — 300 мг на прием, телят — 60-100 мг на прием, овец — 300 -500 мг на прием. Свиньи чувствительны так же, как и крысы, для них летальная доза составляет 1-2 мг на кг живой массы. К приманкам добавляют 5% зоокумарина. Его можно использовать для опыления нор. При отравлении или колбасный фарш 1000 масло растительное 30 №8 № 3 ратиндан 30 ратиндан 30 хлебная крошка или каша 800 мука или отруби 950 мясной или рыбный фарш 200 № 4 № 9 ратиндан 30 ратиндан 30 хлебная крошка 950 крошка хлебная масло растительное 20 сухарная 900 вода 100 № 5 С дифенацином также ратиндан 30 мука или отруби 700 вода 300 С фосфидом цинка 0 0 1 FПрименять с особой осторожностью (сильно ядовит для животных и лю дей) № 1 № 2 Фосфид цинка 30Фосфид цинка 30 хлебная крошка 910Зерно дробленое 930 масло растительное 60масло растительное 50 № 3 № 4 Фосфид цинка 30 Фосфид цинка 30 хлебная крошка 900 хлебная крошка 500 мясной или мясной или рыбный фарш 100 рыбный фарш 470 Бактокумарин — препарат, содержащий живые бактерии мышиного тифа (вирулентные для грызунов штаммы, полученные Исаченко и Прохоровым) и натриевую соль зоокумарина на зерновой питательной среде. В готовом для использования препарате бактокумарина содержится 0,012 — 0,015% натриевой соли зоокумарина, который не теряет при стерилизации токсических свойств и не влияет отрицательно на бактериальную культуру. Однократное скармливание препарата в дозе 1—2 г крысам и 0,2 г мышам вызывает их гибель в течение 4—10 суток даже при наличии у них иммунитета к тифу. Бактокумарин может сохранить свои дератизационные свойствам в течение 2—3 месяцев при хранении в стерильной упаковке с температурой + 1—+5°. Меры личной профилактики при работе с ядовитыми дератизационными средствами 1. Работать в специально отведенном для этого помещении в спецодежде (комбинезон, фартук, халат, резиновые перчатки, 3—4-х слойная марлевая повязка на рот и нос или респиратор). 2. Во время работы курить, пить и принимать пищу не разрешается. 3. После приготовления приманок всю посуду, столы и другие предметы, бывшие в контакте с ядом, хорошо очищают и моют 2%-ным раствором соды. 4. Дератизационные препараты хранятся как препараты списка «А» с надписью на флаконах «ЯД». Учет эффективности дератизации приводят через 2—3 недели после обработки животноводческих объектов путем подсчета вновь открытых нор или пробной приманки. Пример 1. До обработки объекта жилых нор было 200, после обработки их осталось 16: 200:16=12,5; 100:12,5 = 8; Таким образом, эффективность обработки составила 100-8 = 92% Пример 2. Крысы съедали пробной приманки до обработки 190 г, а после обработки 65 г: 195:65 = 30; 100:30 = 3,3%. Эффективность равна 100—33,3 =66,7%. Помещения, в которых после дератизации приманка осталась нетронутой, не обнаружено жилых нор и следов жизнедеятельности грызунов, считают свободными от них. Дезинсекция Это комплекс мероприятий, направленных на уничтожение насекомых и клещей (членистоногих, пастбищных и крупных клещей, оводов, комаров, мокрецов, пухопероедов, блох, вшей) — резервуаров и переносчиков инфекционных и инвазионных болезней. Цель занятия: ознакомить студентов со средствами уничтожения насекомых. Научить практическому применению их на животноводческих объектах и на пастбищах. Обеспечение занятия: макет с различными видами насекомых; дезинсектанты контактные фумиганты —флорофос, гиподерминхлорофом, ДДВФ (дихлофос), амидофос, тролен, азунтол, трихлорметафом, байтекс, фосфамид, фтолофос, севин, гексахлорциклогексан, нафтализол, накотин- сульфат. пиретрум, кишечно-мышьяковистокислый натрий. Кровососущие насекомые (гнус) распространены на всей территории России, но концентрация их больше в болотистых и лесных местах, благоприятных для выплода. Слепни обладают большой плодовитостью: одна самка за лето откладывает 500—1000 яиц, прикрепляя их к теневой стороне листьев. Через 10-11 дней (в зависимости от погоды до 1 месяца) из них выходят личинки, которые могут жить во влажном песке или иле до года, 6 раз линяют и превращаются в куколку, из которой через 6—25 дней появляется взрослое насекомое. Часто слепни, не насытившись, т. е. не закончив сосать кровь одного животного, перелетают на другое. Зарегистрировано нападение слепней на свежие трупы. Перелет с одного животного на другое и нападение Приложение 1 Перечень дезинфекционных средств, разрешенных Минздравом РФ для применения на территории России А А10 / А20 / Аламинол / Антисептика комби инструментен дезинфекцией/ Антисептика комби шпрей / Амоцид / АФБЦ Б Белизна -3 / Бианол / Биор — 1 / Биор — 1 (гранулы и жидкий концентрат)/ Бромосепт 50% раствор В В 20 / Велтолен * / Велтосепт / Г Гексидис плюс / Гермасепт плюс (Эвербайт Экстра) / Гигасепт ФФ / Ги-похлорит натрия, по ТУ 48-040-01-130-97/ Глутарал Д Дезоформ / Дезэффект Деконекс 50плюс / Деконекс 50ФФ / Деконекс 53 ИН / Деконекс соларсепт / Деохлор-таблетки / Диаско-1000 / Дивосан форте / Доместос / ДП-2Т / Дюльбак макси / Дюльбак растворимый / Дюльбак сервис доз / Ж Жавелион (Новелти-хлор) / Жавель солид * / И Индцидур / Инцидур спрей / Инкрасепт-ЮА */ К Катамин АБ */ Катасепт / Катрил-Д * / Клорилли / Клорокс / Клорсепт / Комет / Корзолин ИД / Корзолин ФФ Л Лайна / Лизафин / Лизоформин специаль М МД-1* / МДС (вид Б) * / Микробак форте / МСТА (вид А) * / Н Нейтральный анолит АНК*/ Неодишер септо 2000 нью / Неосептал кват*/ Неосептал ПЕ * / Ника-2 * / Нью Альфа Аэрозоль / ОП Оксония-Актив * / Полисепт / С Санифект-128 */ Саносил супер 25 / Септабик / Септанол-П / Септакси-лин * / Септодор / Септопол / Т Тепсихлор 70 А / X Халамид/ Хлорамин Б/ Хлорэффект Примечания: • отмечены препараты, разрешенные к использованию для дезинфекционных работ в мясной и молочной промышленности это осушение болот и мелких водоемов, удаление кустарников и расчистка леса. Приложение 2 АКТ о проведении ДЕЗИНФЕКЦИИ (ДЕЗИНСЕКЦИИ, ДЕРАТИЗАЦИИ) «» 20 г. (наименование хозяйства) Мы, нижеподписавшиеся (должность, Ф.И.О. ветврача, проводившего обработку) в присутствии (указать, кто из администрации хозяйства присутствовал) за период с по 20 г. произвели (профилактическую, текущую или заключительную дезинфекцию) по поводу неблагополучия по помещений (указать заболевание) (какихи сколько кв.м гшошаци помещений или территории вокруг помещений обработано) предметов ухода , жижесборников и проч. (каких, сколько) (какой емкости) Дезинфекция (дезинсекция, дератизация) проведена (указать каким методом, средством) концентрация вещества; температура воздуха в помещении _ температура дезраствора количество дезраствора на 1 кв.м площади (аэрозоля на 1 куб. м) После дезинфекции помещения оставлены закрытыми на часов После проветривания кормушки, перегородки промыты водой. Всего обработано: помещений кв. м. выгулов кв. м. территории ___ кв. м. предметов ухода кв. м. Всего израсходовано (каких, сколько исходных средств) Навоз (указать метод обеззараживания, что сделано)
инструкция по применению, аналоги и отзывы
Как правильно применять препарат «Аламинол» (дезинфицирующее средство)? Инструкции по использованию этого решения приведены ниже. Также вам предоставят информацию о том, как поднять это средство и в каких случаях оно используется.
Форма выпуска, состав
Что представляет собой препарат «Аламинол» (дезинфицирующее средство)? В инструкции указано, что такой раствор можно приобрести в виде прозрачного и жидкого концентрата зеленовато-синего или синего цвета, имеющего слабый запах.Он содержит хлорид алкилдиметилбензиламмония и глиоксаль, а также поверхностно-активные вещества, краситель, концентрат pH и воду. В продаже этот товар поступает во флаконах или полимерных канистрах.
Фармакологическое действие
Как действует препарат «Аламинол» (дезинфицирующее средство)? В инструкции сообщается, что входящие в состав этого концентрата глиоксаль и алкилдиметилбензиламмоний хлорид способны проявлять вирулицидные, бактерицидные, туберкулоцидные, моющие и фунгицидные свойства. Благодаря такому действию рассматриваемый раствор широко применяется для предстерилизационной очистки и дезинфекции в парикмахерских, стоматологических кабинетах, детских, профилактических и лечебных учреждениях, гостиницах и столовых.
Согласно инструкции, при дезинфекции препарат «Аламинол» проявляет высокую активность в отношении ВИЧ-инфекций, герпеса, ОРВИ, а также других вирусов, в том числе энтеро-, рота- и полиовирусов. Также следует отметить, что данное средство губительно действует на микобактерии туберкулеза, грибы рода Candida, возбудителей вирусных парентеральных гепатитов, дерматофитов и возбудителей других инфекций, в том числе внутрибольничных.
Нельзя не сказать, что в разбавленном виде «Аламинол» не проявляет сенсибилизирующих свойств, но оказывает местно-раздражающее действие.
Показания к применению
Маникюрный инструмент Препарат «Аламинол» очень хорошо дезинфицирует. Также этот инструмент используется в следующих случаях:
- при утилизации медицинских отходов, таких как бинты, салфетки, марля и др., Которые использовались против пациентов с вирусной, бактериальной или грибковой инфекцией;
- для контроля форм; №
- для предстерилизационной очистки эндоскопов, а также дезинфекции медицинских инструментов и других металлических изделий; №
- для дезинфекции поверхностей в помещениях, различных предметов и сантехнического оборудования, уборочного инвентаря, белья и другой атрибутики, предназначенной для ухода за больными людьми.
Нельзя не сказать, что дезинфекция «Аламинолом» часто проводится во время генеральной уборки помещений коммунального хозяйства, столовых и медицинских учреждений.
Правила разведения
Как выращивать «Аламинол»? Подробные инструкции по применению этого средства разработаны НИИ дезинфектологии.
Перед непосредственным использованием концентраты следует смешать с обычной питьевой водой. Желательно проводить этот процесс в эмалированной, пластиковой или стеклянной таре.Очень важно использовать плотные резиновые перчатки, а также избегать попадания жидкости в глаза, на кожу или внутрь.
Итак, как развести «Аламинол»? При использовании этого средства для антисептической обработки его разводят до 1-10% раствора. Для получения 10% жидкости в 1 л обычной питьевой воды заливается около 100 мл концентрата. Для получения 8% раствора используют 80 мл средства и так далее.
Ввиду того, что раствор «Аламинол» можно применять несколько раз в течение 10 дней, очень важно следить за тем, чтобы тара, в которой он содержится, была плотно закрыта и хранилась отдельно от других лекарственных средств и пищевых продуктов.
После проведения работ с применением данного препарата производитель рекомендует вымыть руки и лицо водой с мылом.
Способ применения
Как продезинфицировать маникюрные инструменты, медицинское оборудование и другие предметы с помощью раствора «Аламинол»? Согласно инструкции, необходимо тщательно пропитать тряпку готовым изделием, после чего необходимо тщательно протереть всю поверхность, требующую обработки.
В отдельных случаях готовый раствор «Аламинола» используют для замачивания посуды, а также для мытья и ополаскивания.Выполняйте эту обработку только в резиновых перчатках.
Побочные действия
Какие негативные реакции может вызвать препарат «Аламинол» (дезинфицирующее средство)? В инструкции сказано, что при попадании этого раствора на кожу он вызывает раздражение и покраснение. В этом случае дезинфицирующее средство следует немедленно смыть, а затем обработать пораженный участок кожи любым смягчающим кремом.
При попадании «Аламинола» в органы зрения их также требуется промыть, а затем закапать 30% -ный сульфацил натрия в количестве 1-2 капель.
Если вы получили раствор или концентрат в желудке, немедленно примите 10-25 толченых таблеток активированного угля и запейте их большим количеством воды.
Особая информация
Если раствор, о котором идет речь, пролился на разлитую часть агента, необходимо добавить большое количество обычной воды или адсорбировать ее абсорбирующими веществами (например, песком, опилками, силикагелем или ветошью). а затем отправить на утилизацию. Очень важно надевать резиновые перчатки, ботинки, фартук, универсальный респиратор и очки.
Сливать раствор в канализацию можно только после его разбавления.
Подобные инструменты и отзывы
Чем можно заменить концентрат «Аламинол»? Для инструментов хорошо подходят такие инструменты, как Precept, нейтральный анолит, Vircon и Sepapic.
По мнению специалистов, «Аламинол» — эффективное дезинфицирующее средство. Этот концентрат очень прост в использовании, но требует соблюдения всех правил техники безопасности. Также к преимуществам этого инструмента можно отнести его доступность и широкий спектр действий.
Инструкция по применению «Аламинола» к маникюрному инструменту (12 фото) Как правильно посадить средство и правильно им пользоваться?
Содержимое
- Объекты
- правила разведения
- Как пользоваться?
- Меры предосторожности
- Отзывы
Инструменты для обработки маникюра очень важны. Обращаться с инструментами можно самыми разными средствами. В этой статье подробно рассказывается о том, как использовать для этой цели препарат «Аламинол».
объектов
«Аламинол» содержит в своем составе компоненты, способные оказывать негативное воздействие на болезнетворные вирусы и бактерии.Обладает также туберкулоцидным действием. Производители говорят, что это означает, что он также обладает моющим и фунгицидным действием. Этот препарат имеет жидкую консистенцию. Цвет жидкости может быть разным — с голубоватым или зеленоватым оттенком. У препарата есть и запах, но не слишком раздражающий. Многие говорят, что в разбавленном состоянии для них пахнет косметическим парфюмом.
Применять «Аламинол» из-за его достаточно широкого спектра действия можно не только в ногтевых кабинетах и салонах красоты, но и в больницах и даже на предприятиях государственной энергетики. Обработка средства этим препаратом позволяет существенно снизить риск заражения человека патогенными микробами.
Следует отметить, что это средство довольно эффективно помогает от самых разных грибковых инфекций.Можно использовать не только для обработки инструмента, но и для обработки рабочих поверхностей. Эта обработка помогает защитить предметы от появления на этих формах.
правила разведения
Разбавлять средство следует в соответствии с инструкцией по применению.Его необходимо прикрепить к препарату. Важно отметить, что несоблюдение рекомендованной дозировки разведения может привести к снижению эффекта. Чтобы снизить риск повреждения кожных покровов, прием препарата следует проводить в защитных перчатках. Раствор дезинфицирующего средства перед использованием смешивают с обычной водой.
Важно тщательно перемешивать ингредиенты, не допуская попадания смеси на слизистые оболочки глаз или рук.
Это приведет к химическому повреждению и появлению неблагоприятных симптомов.
Применяемый к инструменту маникюрный инструмент может быть в концентрации от 1 до 10%. Например, чтобы приготовить 7% раствор, необходимо в 930 мл воды растворить 70 мл препарата. Если требуется раствор с концентрацией 5%, то 950 мл воды растворяет уже минимальное количество дезинфицирующего средства — всего 50 мл. Аналогичным образом производится разведение и других необходимых концентраций.
Приготовленный раствор можно хранить. Не рекомендуется делать это более 10 дней.Раствор следует хранить в отдельной плотно закрытой таре.
В этом случае нужно избегать ударов по другим компонентам внутри. Это может привести к потере дезинфицирующих свойств жидкости. После использования инструмента рукой, даже если необходимо вымыть защитные перчатки. Лучше в этом случае промыть их водой с мылом. Обладателям такой нежной кожи после мытья рук лучше смазать их питательным кремом.Это поможет снизить риск возможного пересушивания кожи.
Как пользоваться?
Использовать «Аламинол» довольно просто. В емкость с концентрированным дезинфицирующим средством, разведенным до нужной концентрации, необходимо аккуратно переложить использованные инструменты и оставить их там на 1 час. По истечении этого времени их следует вытащить, промыть водой и тщательно просушить. А раствор (желательно в концентрации 1-2%) можно использовать для обработки поверхностей. Это поможет снизить риск грибковых инфекций и других патологий, вызванных патогенными микробами.
Обработанная поверхность тканью. Многие мастера маникюра отмечают, что после такой обработки в офисе появляется особый запах, который ассоциируется с их чистотой.
Меры предосторожности
К сожалению, на практике бывает, что даже осторожное использование этого средства может вызвать самые разные раздражения кожи. Обычно это происходит, если при обработке разных предметов порваны перчатки. В этой ситуации дезинфицирующий препарат может проникнуть под кожу и вызвать появление покраснения. Если при обработке товаров возникла такая «внештатная» ситуация, то в этом случае необходимо выполнить дальнейшие действия:
- Сначала необходимо снять поврежденные перчатки с рук;
- затем промыть кожу обильным количеством теплой воды — необходимо полностью смыть остатки дезинфицирующего средства для кожи;
- Мыть руки необходимо 4-6 минут;
- Если на коже появилось покраснение, то в этом случае лучше обработать специальную лечебную мазь.
Важно! Если такое повреждение не проходит в течение нескольких дней, всегда следует обращаться к врачу.
Случай раствора «Аламинол» редкий, но встречается. Если использование средства способствовало тому, что оно попало на слизистые оболочки глаз, то промыть глаз нужно немедленно. Растирать руки не стоит, так как это может только усилить покраснение. Если вызванные побочные эффекты не исчезают после промывания глаз, и даже были нарушения зрения, то необходимо обратиться за неотложной медицинской помощью.
Разбавленный раствор может попасть в рот. Если такая ситуация возникнет, то в этом случае важно принять немедленные меры. В этом случае требуется прием сорбента. В качестве такого средства можно использовать активированный уголь. Если даже после приема данного препарата появилась резкая боль внизу живота, то в таком случае требуется срочное обращение за медицинской помощью.
Важно! При осторожном использовании дезинфицирующего средства развитие неблагоприятных симптомов происходит крайне редко.
Следование инструкции по применению средства и соблюдение мер предосторожности способствуют тому, что никаких непредвиденных негативных последствий для здоровья от его применения не будет.
Обзоры
Раствор «Аламинол» используется во многих салонах красоты ногтевых и тумбочки для обработки инструментов и рабочих поверхностей. Многие владельцы таких заведений говорят, что средство им нравится, так как имеет достаточно доступную цену и его легко купить. И они отмечают, что этот препарат относительно долго может дольше храниться в восстановленном состоянии без потери своих дезинфицирующих свойств.
Есть отрицательные отзывы об этом объекте. Например, некоторые маникюрные мастера отмечают, что после регулярной обработки этих инструментов дезинфицирующие средства замечают изменение их свойств.Поэтому они предпочитают использовать альтернативный дезинфицирующий маникюрный инструмент.
Используйте это средство не только в салонах красоты, но и дома. Некоторые женщины иногда обрабатывают свои личные маникюрные инструменты, чтобы защитить себя от заражения вредными микробами. Они отмечают, что использование этого средства помогает им чувствовать себя уверенно и не бояться заразиться микробами во время маникюра даже в домашних условиях.
О том, как правильно дезинфицировать маникюрный инструмент «Аламинолом», читайте ниже.
(PDF) Реология и физико-химические характеристики растворов лекарственных средств
предметов при температуре + 42 ° С.Микроструктура гноя после взаимодействия его с водой, растворами
0,9% хлорида натрия, фурацилина (при разведении 1: 5000) или 1,5% перекиси водорода свидетельствовала о примерно
делении однородной массы гноя полупрозрачной мутной жидкости на кратное « острова ». В карманах
гной в большей части сохранял микроструктуру в виде относительно однородной умеренно прозрачной межклеточной среды
, в которой редко распространялись недифференциальные клеточные элементы.
Островки неизмененного гноя имели разнообразную неправильную форму, неправильные, частично размытые края и выглядели
изолированно друг от друга из-за того, что вокруг них неравномерно и неравномерно располагались
ислоев полупрозрачной жидкости. Слои жидкости выглядели как множество разделяющихся и сливающихся потоков
, окружающих со всех сторон осколки густого гноя из исходной микроструктуры.
При этом через 15 минут после взаимодействия с гноем растворы «Ахдез 3000», 4%
«Аламинол», 1,5% «Лизоформин 3000», 2% «Тефлекс», 2% «Пюрджавел», 0,4% «Экор-Форте», или 4%
двухосновной соли гипохлорита кальция, помимо указанных выше изменений гноя, появляются разрушенные
клеточных элементов иучастков разрушенной структуры внеклеточной среды.На участках
выявлена неравномерная инфильтрация толстого, гнойного субстрата, влияющего растворов в виде скоплений.
Проведенная нами идентификация показателей кислотности воды и растворов показала, что все из них
, за исключением растворов 10% и 20% сульфацила натрия, имеют pH ниже 7,0. В частности, вода
и готовый раствор «Ахдез 3000» имеют pH около 5,0, растворы 4% «Аламинол» и 1,5%
«Лизоформин 3000» имеют pH 6.5, 2% раствор «Пюрджавел» имеет pH около 6,8, а раствор
0,4% «Экор-Форте» имеет pH около 7,0.
В следующей серии экспериментов in vitro мы изучали вязкость и микроструктуру густого гноя после
15 минут его инфильтрации водой и водными растворами лекарств при комнатной температуре (+ 24 ° C) в
искусственном понижении pH. до 2,0 путем введения соляной кислоты или при повышении pH до 12,0
путем введения гидроксида натрия.Установлено, что подкисление не позволяет, а подщелачивание
позволяет снизить вязкость плотных гнойных масс. Так, через 15 минут взаимодействия
густая гнойная масса воды или раствора, содержащего одно из следующих лекарственных средств:
раствор 0,9% и 10% натрия хлорида, 10% и 20% сульфацил-натрия 0,02%. фурацилин, 0,4%
«Экор-Форте», 3% «Аламинол», 0,25% «Лизоформин — 3000», «Ахдез 3000» (раствор, готовый к применению)
или раствор «Пюрджавел» ( раствор приготовлен растворением 1 «игристой» таблетки «Пюрджавел» в 1 литре
воды) при pH 2.0 гнойные массы остаются густыми, вязкими, липкими и вязкими, при этом после взаимодействия
с этими же растворами, но при pH 12,0 вязкость нагноительной массы уменьшается в несколько раз,
и вязкий густой гнойстановятся жидкими и приобретают хорошую текучесть.
Параллельно мы изучали способность воды и растворов лекарственных средств разжижать густой гной и удалять
его наружу в условиях механического перемешивания сред посредством стандартизированного встряхивания модели
полости, заполненной соизмеримым количеством гноя и исследуемых растворов.Показано, что
подщелачивание до pH 12,0 вода для инъекций, растворы 0,9% и 10% натрия хлорид, 10% и 20%
сульфацил натрия, 0,02% фурацилин, «Ahdez 3000», 0,4%. «Экор-Форте», 3% «Аламинол», 0,25%
«Лизоформин» и 2% «Пюрджавел» при температуре + 24 ° С и + 42 ° С с ускорением процесса разбавления
и удаление густого гноя в 4 и 5 раз соответственно по сравнению с их исходной моющей активностью
.Однако активное встряхивание в течение 30 минут модели полостей, содержащих
сравнимых количеств густого гноя и вышеуказанные растворы, не приводит к абсолютно полному растворению всех сгустков
гноя.
Затем мы исследовали состояние плотного гноя через 15 минут его нахождения при температуре
+ 24 ° С в растворах 2,4% и 24% аминофиллина (выпускается в лекарственной форме «растворы для
инъекций. »С pH около 9,0 и 12,0 соответственно в соответствии с требованиями статьи
Фармакопеи) растворы 4% и 10% бикарбоната натрия (имеют значение pH 8.0), либо в
растворах 5% и 20% глюкозы (выпускается в лекарственной форме «раствор для инъекций» с pH около
3,5 в соответствии с требованиями статьи Фармакопеи). Установлено, что после 15
минут взаимодействия толстой гнойной массы с кислыми растворами 5% и 20% глюкозы реология
внешний вид и микроструктура гнойных масс практически не меняется, а через 15 минут взаимодействия
гнойных масс с щелочные растворы 2.4% и 24% аминофиллина или 4% и 10% натрия
1-я Международная конференция по реологии и моделированию материалов (IC-RMM1) IOP Publishing
Journal of Physics: Conference Series 602 (2015) 012043 doi: 10.1088 / 1742- 6596/602/1/012043
Границы | Роль йодида и тироглобулина в модуляции функции иммунных клеток человека
Введение
Йод — важный минерал, необходимый для биосинтеза гормонов щитовидной железы и последующего правильного функционирования метаболических путей всех органов тела (1).Заболевания, вызванные дефицитом или недостаточностью йода, являются глобальной проблемой, от которой страдают около двух миллиардов человек, включая детей школьного возраста (2, 3). Потребность в достаточном количестве йода распространяется на все этапы жизни (2, 4). Во-первых, во время беременности требуется повышенный уровень йода, а снижение его количества приводит к выкидышам и репродуктивным нарушениям (5–8). Частично это связано с ролью йодсодержащих гормонов щитовидной железы, тироксина (T 4 ) и трийодтиронина (T 3 ) для оптимального развития мозга плода (9, 10).Во-вторых, врожденный гипотиреоз, определяемый снижением гормонов щитовидной железы, приводящим к задержке умственного и физического развития в раннем детстве, вызван недостаточным потреблением йода (2–4, 11). У взрослых неоптимальное потребление йода вызывает гипотиреоз и образование зоба, которые можно обратить вспять с помощью увеличения потребления йода или приема добавок (2, 4, 12, 13). Следовательно, йод необходим на всех этапах жизни, и его пониженное усвоение приведет к потенциально опасным для жизни состояниям и / или серьезному снижению качества жизни.
Производство гормонов щитовидной железы начинается с транспорта йодида в фолликулярные клетки щитовидной железы через симпортер йодида натрия (NIS) (14, 15). Затем молекулы йодида перемещаются через другой рецептор, ПЕНДРИН, в коллоид / просвет щитовидной железы. Ферменты, связанные с мембраной тироидной пероксидазы (ТПО), окисляют йодид до йода, реакция, необходимая для возможной конъюгации или организации йода в тирозильные соединения, присутствующие на большом димерном белке тиреоглобулин (TG).Эти биохимические пути являются источником йодированных тирозинов, которые в конечном итоге образуют гормоны щитовидной железы T 4 и T 3 . T 4 образует 80–90% всех биологически активных гормонов, производимых щитовидной железой, и хранится в TG (15–17). TG эндоцитируется фолликулярными клетками и подвергается протеолитической деградации, высвобождая в основном T 4 и относительно небольшие количества T 3 в периферическую кровь. Активность связанных с тканями ферментов дейодиназы превращает Т 4 в более биологически активный гормон Т 3 (15, 18).В конечном итоге гормоны щитовидной железы влияют на метаболические процессы клеток, которые включают глюконеогенез, гликогенолиз, термогенез и метаболизм белков (15).
Интересно, что гормоны щитовидной железы могут напрямую влиять на несколько ветвей иммунной системы, усиливая противоопухолевый иммунитет дендритных клеток, дифференциацию В-клеток, фагоцитоз, цитотоксичность естественных киллеров, индуцируя более высокую экспрессию цитокинов и увеличивая частоту Т-клеток памяти (19–23). ). Воздействие гормонов щитовидной железы на иммунные клетки частично связано с активацией передачи сигналов протеинкиназы С (20).Кроме того, иммунные клетки способны производить ТТГ и использовать ТТГ для повышения уровня Т 3 (24, 25). Таким образом, до сих пор не было выявлено никаких значительных источников de novo T 4 , которые могли бы повлиять на уровни гормонов в тканях или крови, кроме щитовидной железы. Однако интригующие открытия Nagao et al. и другие продемонстрировали вероятность экстратироидного синтеза T 4 у тиреоидэктомированных крыс (26, 27). Другие показали наличие низких внутриклеточных уровней тироксина в кардиомиоцитах, использующих радиоактивный йодид 125 I, и присутствие «тироксиноподобных» соединений в 131 I-импульсных лейкоцитах (28, 29).Перспектива экстратироидного производства T 4 усиливается экспериментами, демонстрирующими присутствие йодированных тирозинов и механизмов биосинтеза щитовидной железы (NIS, TG и TPO) во многих тканях, включая эндометрий, плаценту, молочные железы, тимус, яички, печень и т. Д. почки (30–34). Эти исследования отражают возможность поступления йодида в эти ткани. В целом источники экстратироидного тироксина остаются неясными.
Прямое влияние неорганического йода или йодида на клеточную активность иммунных клеток, помимо гормонов щитовидной железы, остается относительно неизученным.Доказательства возможной прямой роли йода в иммунных клетках были продемонстрированы Marani et al. при этом у школьников с дефицитом йода иммунные ответы были снижены, несмотря на нормальный уровень гормонов щитовидной железы (35–37). Дальнейшие исследования клеток рака груди человека продемонстрировали влияние раствора Люголя, состоящего из молекулярного йода (I 2 ) и йодида калия (KI), на транскрипционную активность этих клеток (38). Были идентифицированы другие ткани, концентрирующие йод, включая яичники, слюнные железы и тимус (39, 40).Аналогичным образом, исследование Stolc в 1971 году показало, что 131 I-импульсных лейкоцитов могут концентрировать йодид внутриклеточно (28). Xiaoyi et al. изучили цитотоксические эффекты молекулярного йода в иммунных клетках мыши и обнаружили увеличение выживаемости лимфоцитов, незначительное снижение соотношения CD4 / CD8 и увеличение соотношения IFNγ / IL4 при активации. Тем не менее, влияние и механизмы йодида, а также молекулярного йода на функции иммунных клеток остаются малоизученными. Иммунная система не только защищает от чужеродных патогенов, опухолей и аутоиммунных реакций, но также может модулировать и обеспечивать среду роста во время восстановления тканей и беременности за счет продукции факторов роста и ангиогенеза (41–43).На этапах беременности баланс между провоспалительными и противовоспалительными факторами необходимо активно балансировать за счет выработки множества цитокинов и иммунных агентов (41, 44).
Из-за важности йода и гормонов щитовидной железы при беременности и модулирующей роли иммунной системы в этом процессе мы стремились изучить взаимодействие между молекулами, связанными с щитовидной железой, и иммунной системой. В этом исследовании мы изучили влияние неорганического йода / йодида на клеточную функцию и оценили, могут ли иммунные клетки секретировать гормоны щитовидной железы.С этой целью мы проанализировали экспрессию транспортеров йодида в нормальных донорских периферических иммунных клетках и определили, вызывает ли йодид функциональные изменения активности этих клеток. Наши исследования показывают выраженный индуцированный йодидом транскрипционный и цитокиновый ответ лейкоцитов периферической крови человека, который не был связан с синтезом новых гормонов щитовидной железы. Интересно, что при инкубации лейкоцитов с ТГ, полученным из тироидной железы, высвобождались значительные количества гормонов щитовидной железы. В целом, эти наблюдения демонстрируют новое понимание эффектов йодида на иммунные клетки человека и выделяют лейкоциты как потенциальный источник T 4 в местных тканях и периферической крови.
Материалы и методы
Очистка и культура лейкоцитов человека и клеточной линии Jurkat E6.1
Лейкоциты человека были получены из образцов крови, взятых с гепарином натрия, если доноры дали согласие на сдачу крови. Процесс получения согласия и документации, связанный с этими донорами, был одобрен IRB для Университета медицины и науки Розалинд Франклин. Лейкоциты экстрагировали стандартным методом фиколла-пака. Клетки культивировали при 37 ° C и 5% CO 2 в полном RPMI 1640 (среда RPMI с добавлением 10% FBS, 50 Ед / мл пенициллина, 50 мкг / мл стрептомицина и 2 мМ l-глутамина) (Gibco) .Линия Т-клеток Jurkat E6.1 была приобретена непосредственно из ATCC (TIB-152) и культивирована при 37 ° C и 5% CO 2 в полной среде RPMI.
Для подсчета клеток или анализа жизнеспособности 5 × 10 6 лейкоцитов высевали в 1 мл полной среды RPMI с 1 мМ NaI (383112, Sigma) или PBS (контроль) в течение 3 дней. Клетки подсчитывали с помощью автоматического счетчика клеток BIO-RAD TC20. Жизнеспособность определяли с помощью стандартного анализа исключения трипанового синего (T8154, Sigma), анализируемого с помощью программного обеспечения счетчика клеток TC20.
Извлечение РНК из лейкоцитов
5 × 10 6 лейкоцитов суспендировали в 1 мл полной среды RPMI, а затем оставляли нестимулированными или активированными с помощью PMA (25 нг / мл) и иономицина (1 мкМ) в течение 18 часов, а затем общую РНК экстрагировали из лейкоцитов с использованием метода Qiagen. мини-комплекты RNeazy. Для нацеленного RNASeq лейкоциты инкубировали с или без 1 мМ NaI или PBS (контроль) в течение 48 часов.
ПЦР с обратной транскрипцией / Количественная ПЦР (qPCR)
Обратную транскрипцию выполняли с 400 нг тотальной РНК с использованием системы кДНК первой цепи транскриптора (Roche).4 мкл кДНК амплифицировали в течение 35 циклов с помощью набора для ДНК-полимеразы Amplitaq (Life Technologies). Следующие праймеры были использованы для ПЦР-амплификации со всеми праймерами, перечисленными в направлении 5 ‘→ 3’ (NIS F 287 п.н .: CTCTTCATGCCCGTCTTCTAC, NIS R: GACAACCCAGAAGCCACTTA), (PENDRIN F 320 п.н .: TCCTGTCGGATATTATGTCTCTAC, PENCTDRCC: F 274 п.н .: GGAAGCAGATGAAGGCTCTG, TPO R: AGTGCACAAAGTCCCCATTC) и (GAPDH F 440 п.н .: ACATCATCCCTGCCTCTACT, GAPDH R: CTCTCTTCCTCTTGTGCTCTTG).
Для количественной ПЦР в реальном времени 2 мкл кДНК амплифицировали с помощью TaqMan Fast Advanced Master Mix (Applied Biosystems) и считывали с помощью прибора для ПЦР в реальном времени StepOnePlus (Applied Biosystems).Утвержденная смесь праймеров TaqMan была получена от Invitrogen следующим образом: NIS: Hs00950365_m1, PENDRIN: Hs01070627_m1, TG: Hs00174974_m1 и B2M: Hs00187842_m1. Экспрессию гена нормализовали по внутренней амплификации B2M.
Целевой RNASeq
через Секвенирование следующего поколения (NGS)Подготовка библиотеки секвенирования следующего поколения была проведена с использованием панелей Qiagen RNASeq Human Inflampting & Immunity Transcriptome , содержащих зонды для 475 генов.Целевой RNASeq является более количественным и специфичным, чем обычная кПЦР, благодаря специфическому секвенированию транскриптов и уникальному молекулярному штрих-кодированию каждого транскрипта, обнаруженного с помощью биоинформатики, перед амплификацией ПЦР. Таким образом, молекулярное штрих-кодирование обходит систематическую ошибку ПЦР, которая может повлиять на обычные результаты КПЦР в результате неэффективных праймеров и / или плохой подготовки образцов. Вкратце, кДНК была сделана из 400 нг лейкоцитарной РНК, а затем уникальные молекулярные 12 нуклеотидные метки были включены в общую сумму 20 нг кДНК посредством удлинения праймера, специфичного для гена .После очистки ПЦР с использованием магнитных шариков кДНК со штрих-кодом амплифицировали с использованием специфичных для генов праймеров. Очищенную ДНК снова амплифицировали посредством второй реакции ПЦР для вставки индексных последовательностей, уникальных для каждого образца. Этот шаг позволяет объединить несколько образцов в одной пробирке для последующего секвенирования. Завершенную библиотеку загружали в картридж с реагентами Illumina (150 циклов v3) со стандартной проточной ячейкой и заказным праймером для секвенирования, предоставленным Qiagen. NGS выполнялся на приборе Illumina MiSeq в соответствии с рекомендациями производителя.Контроль качества секвенирования, включая плотность кластеров, общее количество считываний и процент считываний, достигших Q30, находился в оптимальных диапазонах, предоставленных Illumina. Кроме того, вторичный контроль качества, обеспечиваемый целевым программным обеспечением Qiagen RNASeq, которое считывает и количественно определяет файлы секвенирования, находился в допустимых пределах. Файлы FASTQ, полученные в результате секвенирования, были загружены в службу Qiagen GeneRead DNAseq, вызывающую версию . Затем данные были экспортированы в формат, который обеспечивает общее количество считываний уникальных последовательностей молекулярных штрих-кодов для каждого гена.Все считывания / образцы были нормализованы по 10 генам внутреннего контроля после отрицательного скрининга на загрязнение геномной ДНК. Затем был проведен статистический анализ нормализованных данных, которые были количественно определены как кратное изменение по сравнению с соответствующими контролями.
Иммуноферментный анализ (ELISA)
5 × 10 6 лейкоцитов инкубировали в полной среде RPMI с PBS (контроль) или 1 мМ NaI в течение 72 часов, а затем собирали супернатант. В качестве альтернативы клетки обрабатывали 500 мкМ раствора йода Люголя (32922, Sigma).Цитокины определяли количественно с использованием наборов ELISA Invitrogen в соответствии с протоколом, рекомендованным производителем (Invitrogen IFNγ: 88-7316; IL6: 88-7066; IL8-CXCL8: 88-8086; IL10: 88-7106; CCL2: 88-7399). Планшеты для ELISA считывали с использованием спектрофотометрического устройства для чтения планшетов при длине волны 450 нм.
Проточная цитометрия
5 × 10 6 лейкоцитов промывали в PBS и затем инкубировали в 500 мкл PBS с 10% козьей сывороткой (S-1000, Vector Laboratories) в течение 30 минут для блокирования неспецифического связывания.Клетки ресуспендировали в 100 мкл PBS с 10% козьей сыворотки в течение 1 ч при комнатной температуре с первичными или без (контрольными) кроличьими антителами против SLC5A5 / NIS (SAB2102220, Sigma) или SLC26A4 / PENDRIN (MBS61, MyBioSource). . Клетки промывали и затем окрашивали в течение 30 мин вторичным козьим антикроличьим F (ab ‘) 2 (Invitrogen, A21246) в разведении 1: 100 и CD45 Krome Orange (Beckman Coulter, A96416) в разведении 1:20 при комнатная температура. Другие эксперименты включали окрашивание CD14 FITC (BD Pharmingen, 555397) для идентификации моноцитов.Клетки промывали, ресуспендировали в оболочковой жидкости IsoFlow (Beckman Coulter), а затем загружали на BD FACSCanto II, где 25000 событий были собраны в воротах лимфоцитов. Полученные данные и средняя интенсивность флуоресценции (MFI) были проанализированы с использованием программного обеспечения FlowJo.
Обнаружение гормонов щитовидной железы
с помощью иммуноанализаДля обнаружения гормонов T 4 или T 3 , 5 × 10 6 лейкоцитов были промыты и ресуспендированы в 800 мкл полной RPMI или среды DMEM F-12 с добавками (DMEM F-12 с 50 Ед / мл пенициллина, 50 мкг / мл стрептомицина, заменимые аминокислоты и раствор витамина MEM) (Gibco).Клетки инкубировали с нативным человеческим ТГ (609312, Sigma) или без него в концентрации 20 мкг / мл в течение 3 дней. Затем супернатанты клеточной культуры загружали в прибор Vitros ECiQ Immunodiagnostics (Орто-молекулярная диагностика) и анализировали с помощью реагентов Vitros (общий T 4 : 874468; общий T 3 : 1322528; свободный T 4 : 1387000; свободный Т 3 : 1315589).
Статистический анализ
Анализ и графики / графики всех данных были выполнены с помощью призмы GraphPad и программного обеспечения Microsoft Excel с использованием двустороннего теста t при условии равной дисперсии.Уровни значимости p <0,05 и p <0,005 представлены как * и ** соответственно.
Результаты
Человеческие лейкоциты экспрессируют и регулируют тироид-связанные соединения
Предыдущая работа проиллюстрировала способность лейкоцитов концентрировать радиоактивный йодид (28). Однако неясно, как йодид транспортируется в иммунные клетки, и действительно ли лейкоциты по-разному экспрессируют один или оба известных транспортера йодида. С этой целью лейкоциты человека были экстрагированы от разных доноров, а затем уровни транскриптов молекул, связанных с щитовидной железой, были амплифицированы с помощью ПЦР с обратной транскрипцией.Анализ ДНК-гель-электрофореза показал, что лейкоциты экспрессируют транскрипты NIS и PENDRIN ожидаемого размера (рис. 1А). Активация лейкоцитов с помощью PMA и иономицина (PMA-IO) вызвала значительное повышение уровней мРНК PENDRIN, но не NIS (рис. 1A). КПЦР с зондами TaqMan подтвердила отсутствие значительных изменений в экспрессии NIS, но примерно восьмикратное увеличение мРНК PENDRIN после активации лейкоцитов (рис. 1B). Хотя мы не смогли найти проверенных зондов TaqMan, которые могли бы амплифицировать ТПО, гель-анализ выявил транскрипты ТПО ожидаемого размера, которые увеличивались при активации лейкоцитов (рис. 1А).Далее, транскрипты TG были ранее обнаружены в лимфоцитах периферической крови, но неясно, регулирует ли активация клеток экспрессию мРНК этого белка (45). Поскольку лейкоциты активировали PENDRIN и TPO, мы стремились исследовать экспрессию большого димерного белка TG во время активации лейкоцитов. Соответственно, анализ мРНК подтвердил экспрессию ТГ в лейкоцитах, но эта активация значительно снизила экспрессию его мРНК (рис. 1В).
Рисунок 1 .Иммунные клетки человека экспрессируют и регулируют переносчики йодида, тиреоглобулин и пероксидазу щитовидной железы. (A) Лейкоциты оставались нестимулированными (US) (-) или активированными (+) с помощью PMA и иономицина в течение 18 часов, общая РНК была извлечена, а затем кДНК из образцов была амплифицирована с помощью ПЦР. Показаны изображения двух репрезентативных доноров, полученные электрофорезом ДНК. (B) МРНК лейкоцитов амплифицировали с использованием количественной ПЦР в реальном времени, а затем каждый ген нормализовали по внутреннему контролю B2M.Увеличение кратности по сравнению с контролем в США было отображено на графике ± SEM девяти независимых доноров. (C) Лейкоциты не окрашивались антителами (контроль), антителами NIS или PENDRIN. Затем клетки окрашивали вторичным Alexa-647 и первично-конъюгированными антителами CD45 Krome-orange. Подмножества лейкоцитов (гранулоциты, моноциты и лимфоциты) были стробированы на основе характеристик CD45 и бокового рассеяния. Гистограммы стробированных подмножеств показаны как количество клеток и интенсивность окрашивания антител, представляющих шесть доноров. (D) Значения средней интенсивности флуоресценции (MFI) из панели (C) вычитали из фонового окрашивания и затем отображали на графике ± SEM от шести до семи независимых доноров.
Чтобы определить, экспрессируются ли NIS или PENDRIN по-разному в субпопуляциях лейкоцитов периферической крови, мы использовали проточный цитометрический анализ лейкоцитов, зондированных антителами против NIS или PENDRIN. Субпопуляции лейкоцитов были разделены на основе бокового рассеяния и интенсивности CD45 (рисунок S1A в дополнительном материале), а затем были исследованы уровни переносчиков йодида.NIS и PENDRIN были экспрессированы во всех популяциях лейкоцитов, при этом самая сильная экспрессия обнаружена в популяциях гранулоцитов и моноцитов и минимальная экспрессия в лимфоцитах (рис. 1C). Количественный анализ MFI показал незначительное, но незначительное увеличение MFI по сравнению с фоном на лимфоцитах, но сильную и значительную экспрессию на гранулоцитах и моноцитах (рис. 1D). В целом эти результаты демонстрируют, что лейкоциты, особенно моноциты и гранулоциты, экспрессируют и регулируют соединения, связанные с щитовидной железой.
Йодид индуцирует транскрипционную модификацию лейкоцитов человека в генах, связанных с иммунитетом
На данный момент нет исследований, которые установили, могут ли йод или йодид напрямую влиять на транскриптом иммунных клеток. Поскольку обработка раствором Люголя, содержащим йод / йодид, может изменить транскрипционные изменения в клеточных линиях рака молочной железы, а лейкоциты экспрессируют переносчики йода (рис. 1), мы спросили, может ли йодид влиять на связанные с иммунитетом транскрипционные события в иммунных клетках человека (38).Сначала мы исследовали, оказывает ли йодид какое-либо токсическое действие на лейкоциты человека. Предыдущие исследования клеточных линий рака груди не выявили токсических эффектов при использовании 1 мМ раствора Люголя (38). Чтобы подтвердить эти исследования на первичных иммунных клетках, мы инкубировали лейкоциты с 1 мМ NaI в течение 3 дней. В целом, мы не обнаружили значительных изменений в общем количестве клеток или жизнеспособности при лечении йодидом (рис. 2А).
Рисунок 2 . Целевой анализ RNASeq лейкоцитов , обработанных йодидом, с помощью секвенирования нового поколения . (A) Анализ жизнеспособности лейкоцитов, обработанных йодом — 5 × 10 6 лейкоцитов оставались необработанными (контроль — PBS) или инкубировались с 1 мМ NaI в течение до 3 дней. Количество клеток и их жизнеспособность с использованием исключения трипанового синего определяли с помощью автоматического счетчика клеток TC20. (B) Целевые RNASeq — лейкоциты оставались нестимулированными PBS или инкубировались с 1 мМ NaI в течение 48 часов, вся РНК была извлечена, а затем были созданы целевые библиотеки RNASeq для всего 475 генов. Библиотеки были проиндексированы (мультиплексированы), а затем загружены в секвенатор Illumina MiSeq.Данные были демультиплексированы, и уникальные молекулярные метки были идентифицированы с использованием программного обеспечения для биоинформатики RNASeq от Qiagen. Общее количество молекулярных меток нормализовали до количества 10 генов домашнего хозяйства, а затем количественно определяли на основании кратности экспрессии по отношению к каждому необработанному контролю. Среднее увеличение кратности было получено от 5 до 10 независимых доноров. Гены, которые были значительно увеличены или уменьшены ( p <0,05), были отобраны и отображены на гистограмме ± SEM по крайней мере пяти независимых доноров.См. Таблицу S1 в дополнительных материалах для количественной оценки и значений p .
Чтобы определить, оказывает ли лечение йодидом какое-либо влияние на транскрипционную активность лейкоцитов человека, мы использовали NGS в контексте целевого RNASeq. Этот метод позволяет количественно определять сотни генов, связанных с иммунитетом, в образце. С этой целью лейкоциты инкубировали в течение 2 дней с 1 мМ NaI или контролем PBS, а затем экстрагировали РНК. Были созданы препараты библиотеки NGS, а затем контрольные или обработанные NaI лейкоциты были проверены на изменения в 475 генах воспаления и иммунитета.Мы обнаружили, что иммунные клетки, обработанные йодидом, имели значительные изменения в 29 генах, из которых 24 были активированы (рисунок 2B; таблица S1 в дополнительных материалах). Хотя все представленные изменения транскрипции были статистически значимыми, значение IL6 и основного белка про-тромбоцитов имеет тенденцию к значению p , близкую к значимой (0,085 и 0,076, соответственно), из-за вариабельности, несмотря на наблюдаемое кратное увеличение во всех группах лечения (Таблица S1 в Дополнительной таблице). Материал). Гены, которые были активированы, включали модуляторы, которые могли влиять на выживаемость или пролиферацию, такие как IL2, IL24 и CSF2.Интересно, что мы наблюдали повышенную экспрессию различных цитокинов, которые считаются про- и / или противовоспалительными, включая IFNγ, IL6, IL1β и IL13 (рис. 2B). Однако хемокины составляли значительную долю от общего количества измененных генов и в целом показали наибольшее кратное увеличение при увеличении транскриптов CCL7, CXCL5 и CXCL6 более чем в 10 раз в группах, получавших йодид (Рисунок 2B; Таблица S1 в дополнительных материалах). . Другие наблюдаемые увеличения транскрипции были в киназе SRC LYN и комплементе C3.Затем лечение йодидом значительно снизило экспрессию как фактора роста инсулина-1, так и лептина, что указывает на способность йодида влиять на гормональный баланс. В целом наши данные иллюстрируют молекулярное иммуномодулирующее действие йодида на иммунные клетки человека.
Иммунные клетки увеличивают секрецию цитокинов после лечения йодидом
Повышение базального уровня транскриптов хемокинов и цитокинов после обработки йодидом свидетельствует о том, что иммунные клетки могут, следовательно, увеличивать высвобождение белка.Соответственно, мы исследовали количество выбранных цитокинов, сравнивая контрольные лейкоциты и лейкоциты, обработанные йодидом. Базовые уровни про- и противовоспалительных цитокинов, включая IFNγ, IL6 и IL10, были существенно увеличены в присутствии йодида в культуре клеток через 3 дня после лечения (рис. 3A). На продукцию IL6 больше всего повлияло более чем пятикратное увеличение высвобождения белка в среднем (рис. 3A). Аналогичным образом, хемокины IL8 (CXCL8) и CCL2 были повышены после лечения йодидом. Однако изменения в CCL2 были вариабельными: 3 из 11 доноров не показали изменений или незначительного снижения уровней цитокинов (рис. 3A).
Рисунок 3 . Повышенное высвобождение цитокинов и хемокинов лейкоцитами, обработанными йодом. (A) 5 × 10 6 лейкоцитов были оставлены нестимулированными (УЗИ) PBS или обработаны 1 мМ NaI в течение 72 часов. Собирали супернатанты и анализировали уровни белков цитокинов / хемокинов, используя иммуноферментный анализ. (B) То же, что и в панели (A) , но вместо этого лейкоциты инкубировали с 500 мкМ йода Люголя в течение 72 часов, а затем супернатант анализировали на уровни цитокинов.Обнаруженные диапазоны секреции цитокинов: (IFNγ: 5–1005 пг / мл, IL6: 10–2 500 пг / мл, IL10: 26–482 пг / мл, IL8-CXCL8: 0,3–230 нг / мл и CCL2: 15– 65 нг / мл). Концентрации цитокинов были нормализованы на основе кратных изменений по каждой паре УЗИ, а затем были усреднены и нанесены на график как кратное увеличение ± стандартная ошибка среднего по меньшей мере семи доноров.
Чтобы определить, могут ли другие формы йода влиять на высвобождение базальных цитокинов, мы инкубировали лейкоциты с 500 мкМ йода Люголя. То есть вместо NaI клетки будут инкубироваться со смесью KI и I 2 .Подобно нашим наблюдениям с NaI, лейкоциты, подвергшиеся воздействию йода Люголя, имели еще большее увеличение высвобождения белка в IL6, IL10 и CXCL8 (рис. 3B). Однако мы были удивлены, обнаружив, что йод Люголя значительно снижает высвобождение IFNγ (в 0,47 раза) по сравнению с контролем. Затем, хотя и не статистически значимо, секреция CCL2 показала аналогичный образец для клеток, обработанных NaI, где у пяти из девяти доноров были пониженные уровни (рис. 4B). Незначительные различия между NaI и препаратами Люголя можно объяснить различными производными йода между двумя видами лечения.Эти данные предполагают, что йод может влиять на функциональную активность иммунных клеток человека.
Рисунок 4 . Тироглобулин (ТГ) используется лейкоцитами для повышения уровня гормонов щитовидной железы. (A) 5 × 10 6 лейкоцитов не стимулировали PBS или обрабатывали 1 мМ NaI в течение 72 часов, а затем определяли уровни общих и свободных гормонов щитовидной железы в среде с использованием диагностического иммуноанализа ECiQ. Показаны усредненные концентрации шести доноров ± SEM. (B) 5 × 10 6 лейкоцитов инкубировали с TG, полученным из ткани щитовидной железы человека, в концентрации 20 мкг / мл в течение 3 дней в бессывороточной среде, а затем уровни гормонов щитовидной железы (T 4 и T 3 ) в средах детектировали с помощью диагностического иммуноанализа ECiQ. Данные усреднялись после вычитания фона сигнала ТГ. Показаны усредненные концентрации шести доноров ± SEM. (C) То же, что и на панели (B) , но вместо этого лейкоциты инкубировали с тироксином (T 4 ) на 2.4 мкг / мл в течение 2 дней в бессывороточной среде. Уровни T 3 анализировали с использованием диагностического прибора для иммуноанализа ECiQ. Данные усредняли после вычитания фона сигналов Т 4 . Показанные данные представляют собой усредненные количественные оценки ± SEM для шести доноров.
Индуцированные йодом цитокины и изменения транскрипции не являются следствием
De Novo Синтез или дейодирование тироидных гормоновГормоны щитовидной железы важны для метаболической функции всех клеток, но также обладают способностью влиять на цитокиновый и хемокиновый профили, фенотипы и функцию иммунных клеток (20, 22, 23, 46).Одной из возможных причин индуцированного йодидом повышения мРНК и высвобождения цитокинов в лейкоцитах может быть увеличение синтеза de novo T 4 и / или известная способность иммунных клеток дейодировать T 4 , присутствующий в среде, в Т 3 (18, 47–49). Поэтому мы проанализировали супернатанты лейкоцитов, подвергнутых импульсному воздействию NaI, на предмет возможных колебаний гормонов щитовидной железы. Используя инструмент для иммунодиагностического иммуноанализа ECiQ, мы не смогли обнаружить каких-либо существенных различий в свободных и общих формах гормонов щитовидной железы между контрольными и обработанными NaI лейкоцитами (рис. 4A).Затем мы попытались подвергнуть лейкоциты различным экспериментальным условиям, чтобы выявить потенциальный синтез и высвобождение de novo T 4 . С этой целью лейкоциты инкубировали в бессывороточной среде (для удаления гормонов сыворотки), дополненной аминокислотами с добавленными витаминами и минералами вместе с 1 мМ NaI и / или 500 мкМ раствором Люголя. Эти эксперименты не смогли произвести никаких детектируемых T 4 или T 3 в супернатанте (данные не показаны). Кроме того, стимуляция лейкоцитов с помощью PMA-10 или антител против TCR в присутствии NaI или йода Люголя не могла обеспечить обнаруживаемые уровни T 4 или T 3 в супернатанте (данные не показаны).Эти наблюдения показывают, что повышенная специфическая транскрипция и высвобождение цитокинов йодом Люголя и лейкоцитами, обработанными NaI, не вызываются новым синтезом T 4 или T 3 .
Иммунные клетки используют ТГ для повышения уровня гормонов щитовидной железы T
4 и T 3Во время дефицита йода содержание триглицеридов в крови существенно увеличивается, что приводит к его потенциальному взаимодействию с клетками и тканями (50–52). Таким образом, пока нет сообщений о том, могут ли ТГ также использоваться иммунными или другими типами клеток.Поскольку гормоны щитовидной железы влияют на иммунную систему, мы спросили, могут ли лейкоциты человека использовать тиреоидные триглицериды для повышения окружающих уровней T 4 и T 3 (20, 22, 23, 53, 54). С этой целью мы инкубировали лейкоциты с TG в течение 3 дней в бессывороточной среде, чтобы избежать влияния на гормоны, присутствующие в сыворотке, а затем определяли уровни T 4 и T 3 . Интересно, что лейкоциты, инкубированные с TG, высвобождали значительные количества T 4 и T 3 , при этом гормоны не были обнаружены в необработанных клетках (фигура 4B).Мы были удивлены, обнаружив, что этот эффект не был перенесен на линию Т-клеток Jurkat, что свидетельствует о неопосредованном Т-клетками механизме (рис. 4В). Эти результаты предполагают, что субпопуляция лейкоцитов, вероятно, фагоцитов, может эндоцитозировать TG, высвобождать T 4 и затем продуцировать T 3 посредством дейодирования. Далее, согласно оценкам, щитовидная железа содержит гормоны, состоящие из 80–90% T 4 и примерно 10–20% T 3 , хранящихся в основном в TG (15–17). Таким образом, мы предполагаем, что повышенные уровни Т 3 после инкубации ТГ обусловлены дейодированием Т 4 иммунными клетками.Чтобы подтвердить, что лейкоциты человека могут дейодировать Т 4 , клеткам вместо этого давали Т 4 , а затем анализировали уровни Т 3 . Подтверждая ранее опубликованные наблюдения, лейкоциты могут продуцировать значительные количества T 3 посредством дейодирования (рис. 4C) (47–49, 55). Наши данные отражают взаимодействие между иммунными клетками человека и ТГ, и что иммунные клетки потенциально могут повышать уровни T 4 и T 3 в тканях и периферической крови.
Обсуждение
В этом исследовании мы определили иммуномодулирующее действие йодида на иммунные клетки человека. Мы продемонстрировали, что в присутствии йодида иммунные клетки человека претерпевают специфические молекулярные изменения определенных цитокинов и хемокинов, и что этот эффект транслируется в более высокое высвобождение белка (рис. 5А). Эти события вызваны не повышенным синтезом гормонов щитовидной железы, а неясным механизмом, специфичным для йодида. Однако наше исследование возможности синтеза тироидных гормонов лейкоцитами выявило способность иммунных клеток обрабатывать ТГ и высвобождать тироидные гормоны T 4 и T 3 (Рисунки 4B и 5B).
Рисунок 5 . Текущая модель — иммунные клетки регулируют свою функцию с помощью йодида и повышают уровень гормонов щитовидной железы, обрабатывая тиреоидный производный тиреоглобулин (ТГ). (A) Иммунные клетки экспрессируют поверхностные транспортеры йодида (NIS и PENDRIN), которые активируются во время клеточной активации. Клетки способны накапливать йодид, который может изменять транскрипцию множества иммунных медиаторов и, возможно, других генов. Изменения являются функциональными, поскольку более высокие уровни мРНК коррелируют с повышенным высвобождением цитокинов в базальном состоянии.Эффект носит системный характер и не поляризован ни на провоспалительные, ни на противовоспалительные гены. Во время иммунного ответа присутствие достаточного количества йодида обеспечивает «примированное» состояние клеток, которые готовы к пролиферации после активации. Воздействие йодида на иммунные клетки может повлиять на раннее зачатие, когда иммунные клетки могут выделять больше факторов для поддержки кровеносных сосудов и оптимальной беременности. (B) В состоянии дефицита йода, ТТГ секретируется, вызывая увеличение в основном Т 4 и некоторого количества Т 3 щитовидной железой.Щитовидная железа реагирует повышением поверхностной экспрессии NIS и PENDRIN и выработкой большего количества ТГ, часть которого попадает в кровоток. Увеличение степени йодной недостаточности соответственно приводит к повышению уровня триглицеридов в крови. Основываясь на наших выводах, мы предполагаем, что лейкоциты могут поглощать ТГ из крови или тканей и высвобождать T 4 , что в конечном итоге повысит уровни T 3 за счет активности дейодиназы. Это имеет системный эффект, поскольку увеличивает уровень гормонов в местных тканях и / или в крови, что способствует усилению метаболизма.Известно также, что высвобождаемые гормоны щитовидной железы влияют на иммунную систему, увеличивая экспрессию цитокинов и изменяя фенотипы иммунных клеток.
Анализ экспрессии йодидного рецептора на субпопуляциях лейкоцитов показал, что фагоциты, моноциты и гранулоциты несут самую высокую экспрессию транспортеров йодида (Рисунки 1C, D). В более ранних исследованиях сообщалось о взаимодействии между миелопероксидазой лейкоцитов и H 2 O 2 , с хлоридом и йодидом галогенидов (56–58).Авторы иллюстрируют антибактериальный эффект йодирования, опосредованного миелопероксидазой, которое было более эффективным в уничтожении бактерий, чем хлорид. Наблюдаемое увеличение постактивации иммунных клеток PENDRIN, переносчика, специфичного как для хлорида, так и для йодида, предполагает, что оба иона важны для механизмов уничтожения моноцитов и гранулоцитов (рисунки 1A, B) (57). Следовательно, вполне вероятно, что механизм внутриклеточного транспорта йодида будет использоваться фагоцитами для устранения инфекций.Идея регуляции йодидных рецепторов не нова, поскольку действие гормонов и цитокинов на транспортеры йодида было проиллюстрировано ранее (59–61). Мы не можем подтвердить, было ли увеличение ПЕНДРИНА и ТПО в наших экспериментальных условиях результатом внутриклеточной активации PMA-10 или вторичным по отношению к высвобождению цитокинов лейкоцитами после активации. Увеличение экспрессии PENDRIN и TPO после стимуляции PMA-10 означает, что лейкоцитам может потребоваться повышенное поглощение йодида при активации во время иммунного ответа.Эта гипотеза подтверждается нашими результатами, согласно которым повышенное содержание йодида существенно повышает уровень секреции множества цитокинов. Удивительно, но лимфоциты показали относительно минимальную экспрессию NIS и PENDRIN (Фигуры 1C, D). Однако это не означает, что лимфоциты нечувствительны к йодиду, поскольку было четко продемонстрировано, что воздействие йодида вызывает увеличение синтеза иммуноглобулина лимфоцитами при даже более низких дозах йодида, использованных в этом исследовании (62).
Оценка связанных с иммунитетом генов с помощью нацеленных RNASeq в обработанных йодидом лейкоцитах выявила значительные транскрипционные изменения в 29 из 475 проанализированных генов.Изменения транскрипции, наблюдаемые в лейкоцитах, не были поляризованными, а вместо этого представляли собой смесь цитокинов, которые были провоспалительными и противовоспалительными, включая IFNγ, IL6 и IL13. Факторы дифференцировки и выживания, такие как IL2, IL24 и CSF2, также были увеличены на посредством стимуляции йодидом. Однако эффекты йодида были поразительными в отношении хемокинов и их рецепторов, которые составляли 11 из 29 измененных генов (рис. 2B). Наиболее существенные изменения кратности транскрипции были связаны с хемокинами CCL7 (22.5), CXCL5 (13.9) и CXCL6 (11.3) (рисунок 2B; таблица S1 в дополнительных материалах). Идея о том, что йод / йодид вызывает изменения транскрипции, не нова, поскольку было показано, что стимуляция йодом вызывает множественные транскрипционные изменения в линиях рака груди человека и трофобластических клеток (38, 63). Поэтому очень вероятно, что неиммунные изменения транскрипции будут происходить в лейкоцитах в присутствии йода / йодида. Подобно раку груди и клеточным линиям трофобласта, эти изменения могут включать гены, связанные с метаболизмом эстрогенов, циклины и факторы транскрипции (38, 63).Далее, хотя мы проанализировали короткий список цитокинов с помощью ELISA , профиль высвобождения цитокинов не был искажен ни в сторону про-, ни в противовоспалительную, а вместо этого, по-видимому, носит системный характер, имитируя наблюдаемые транскрипционные изменения. Неясно, как йодид вызывает эти изменения, но, вероятно, это комбинация механизмов, таких как усиление метаболических путей или внутриклеточное превращение йодида в йод (рис. 5A) (64, 65). Мы также предполагаем возможность влияния йода на транскрипцию путем прямой или косвенной активации факторов транскрипции или изменения последовательностей энхансера / промотора в геноме.В этом случае йод будет отражать роль, аналогичную цинку, который может активировать факторы транскрипции для увеличения экспрессии цитокинов, а также напрямую взаимодействовать с ДНК (66–68).
Одним из ограничений нашего исследования является то, что мы использовали смешанную популяцию лейкоцитов, и поэтому неясно, какая клеточная популяция вносит вклад в изменения транскрипции. Более того, некоторые типы клеток (например, гранулоциты) недолговечны и могут не отражать транскрипционные изменения, представленные в этом исследовании.Точно так же моноциты прилипают к планшетам для культивирования клеток и могут быть потеряны во время фазы экстракции из планшетов для культивирования. С этой целью мы сравнили популяции лейкоцитов в день экстракции и через 2 дня после культивирования клеток с помощью проточной цитометрии . Не было значительных различий в процентном соотношении популяций моноцитов или лимфоцитов через 2 дня после культивирования клеток (рисунки S1B, C и таблица S2 в дополнительных материалах). Однако популяция моноцитов имела увеличенный боковой разброс, но сохраняла исключительную экспрессию CD14, как и в день 0.Обработка клеток в течение 2 дней 1 мМ NaI не вызвала значительных изменений процентного содержания субпопуляций лейкоцитов. Однако анализ фракции гранулоцитов показал значительное снижение процентного содержания клеток через 2 дня после культивирования клеток. Таким образом, наши анализы в этом исследовании представляют лимфоциты, моноциты и относительно небольшое количество гранулоцитов. Важно отметить, что в наших экспериментальных условиях популяции лейкоцитов, используемые в целевом RNASeq, имели сходную жизнеспособность и были в целом сопоставимы по процентному соотношению с начальным днем экстракции (Рисунок 2A; Рисунки S1B, C в дополнительном материале).
Целью этого исследования было определить, могут ли лейкоциты продуцировать de novo гормонов щитовидной железы, которые потенциально могут влиять на системные и / или местные уровни гормонов. Предыдущие эксперименты с радиоактивным йодом позволили понять синтез низкого внутриклеточного T 4 кардиомиоцитами (29). Авторы утверждают, что низкий уровень внутриклеточного Т 4 будет влиять только на синтезирующие кардиомиоциты, а не на окружающие клетки (29). Точно так же присутствие «тироксиноподобных» соединений в лейкоцитах, подвергнутых импульсному I 131 , предполагает возможность синтеза тироидных гормонов экстратироидными тканями (28).В наших экспериментальных условиях мы не смогли обнаружить никакого увеличения T 4 или T 3 , когда клетки инкубировали с 1 мМ NaI в течение 72 часов в полной среде (рис. 4A). Аналогичным образом, добавление йода Люголя или NaI к лейкоцитам в бессывороточной среде с добавлением аминокислот и витаминов с активацией клеток или без нее не приводило к обнаруживаемым уровням T 4 или T 3 в супернатанте (данные не показаны). Однако мы не можем исключить возможность внутриклеточного синтеза de novo T 4 лейкоцитами или очень низких уровней T 4 ниже диапазона чувствительности нашего прибора иммуноанализа.С другой стороны, мы наблюдали заметное увеличение T 4 и T 3 в культуральной среде после инкубации лейкоцитов с TG (рис. 4B). Эти гормоны уже присутствовали в TG, поскольку он был получен из щитовидной железы человека, который в нормальных условиях должен содержать 80–90% T 4 . Эти наблюдения показывают, что иммунные клетки могут выполнять последние два из трех следующих шагов, выполняемых щитовидной железой для синтеза гормонов: (1) организация йода в ТГ, (2) эндоцитоз ТГ, содержащего гормоны щитовидной железы, и (3) высвобождение Т 4 и некоторое количество Т 3 в периферическую кровь.Затем, в процессе высвобождения Т 4 , лейкоциты были способны деиодинировать производный ТГ Т 4 в Т 3 , тем самым увеличивая уровни активного гормона щитовидной железы Т 3 (Рисунок 4C). Взаимодействие иммунных клеток с ТГ физиологически важно, поскольку ТГ присутствует в крови и значительно увеличивается при дефиците йода (51, 52). В целом, эти результаты проливают свет на долгожданный вопрос о том, могут ли ткани, отличные от щитовидной железы, влиять на кровь или местные уровни T 4 , и демонстрируют, что по крайней мере иммунные клетки могут потенциально влиять на уровни гормонов щитовидной железы в крови.
В этом исследовании мы использовали концентрацию 1 мМ NaI (~ 125 мкг / мл йодида), которая была нетоксичной для первичных иммунных клеток человека. Фактически, хотя и не значимо, клетки, обработанные NaI, имели немного большее количество клеток (рис. 2А). Более того, эта доза была нетоксичной при использовании на клеточных линиях рака груди человека (38). По этим причинам мы решили использовать эту концентрацию для целевого секвенирования РНК и функциональных исследований в первичных иммунных клетках человека. Наблюдаемые уровни неорганического йода в плазме населения (т.например, негормональный йод) относительно низки с общим йодом в диапазоне 50–130 мкг / л и диапазоном неорганического йода 5–15 мкг / л (69). По сравнению с уровнем йодида в плазме клетки щитовидной железы подвергаются воздействию неорганического йодида в 50–400 раз (69). Вполне вероятно, что резидентные иммунные клетки ткани, включая клетки кишечника или тимуса, могут подвергаться воздействию значительно более высоких уровней йода по сравнению с уровнями, наблюдаемыми в плазме (37). Уровни йода в крови отражают недавнее поступление йода внутрь и обычно не используются для определения долгосрочного уровня йододостаточности частично из-за кинетики метаболизма неорганического йода, когда он либо абсорбируется и накапливается тканями, либо быстро выводится почками (69, 70) .Это наблюдается у людей с достаточным уровнем йода, когда обычно тест на йодную нагрузку с мочой показывает выведение 90% или более проглоченного йода в течение 24 часов и гораздо меньше у людей с дефицитом йода (71, 72). Фактически, исследования, посвященные оценке долгосрочных уровней йодного статуса, предполагают, что биомаркеры, такие как ТГ или йод в моче, являются более чувствительными маркерами уровня йода (50–52, 73, 74). Таким образом, проглоченный йод либо быстро всасывается щитовидной железой и тканями, экспрессирующими транспортеры йода, которые широко распространены, либо выводится с мочой в количествах, обратно связанных с достаточностью для всего тела (28, 69, 72).Прежде всего, оптимальные уровни достаточности йода для всего тела неизвестны, и текущие рекомендации RDA представлены в первую очередь как профилактика образования зоба (2, 69). Дальнейшие клинические исследования необходимы для определения безопасного суточного количества йода, необходимого для достаточного количества экстратироидной ткани.
Далее, йод необходим для успешной здоровой беременности, и его потеря приводит к выкидышам, репродуктивным сбоям, аномальному развитию мозга и врожденному гипотиреозу (3, 9, 10).Эпидемиологические исследования и обзоры Всемирной организации здравоохранения демонстрируют, что дефицит йода наблюдается во всем мире, в том числе у женщин репродуктивного возраста (2, 5, 7, 75, 76). Недавние результаты Национального исследования здоровья и питания показали, что до 35% женщин репродуктивного возраста страдают йодной недостаточностью (75, 76). Проблема йодной недостаточности во время беременности усугубляется из-за более высоких потребностей в йоде во время беременности и кормления грудью (2, 7).Основываясь на наших выводах и роли иммунной системы в регулировании процесса беременности, мы предлагаем продолжить исследование между дисфункцией иммунных клеток в женских репродуктивных органах и возможностью дефицита йода у женщин с репродуктивными нарушениями неизвестной этиологии.
В заключение, мы представили доказательства иммуномодулирующего действия йодида на иммунные клетки периферической крови человека. Йодид изменяет транскрипционную иммунную сигнатуру этих клеток и вызывает более сильные цитокиновые и хемокиновые ответы.Соответственно, уровни йода / йодида, которые оптимально насыщают клетки, должны, следовательно, укреплять иммунную систему и улучшать передачу, избавление от инфекций и поддерживать процесс размножения. Наконец, мы идентифицируем иммунные клетки как потенциальный источник экстратироидных гормонов щитовидной железы, способных выполнять функции, обычно известные как специфические для щитовидной железы.
Заявление об этике
Представленное здесь исследование было выполнено в соответствии с принципами, указанными в Хельсинкской декларации.Процесс получения согласия и документации, связанный с донорами, использованными в этом исследовании, был одобрен IRB для Университета медицины и науки Розалинд Франклин.
Авторские взносы
MB задумал, спроектировал и провел эксперименты; интерпретировал данные; и написал рукопись при участии всех других авторов. SD, JK-K, AG-S и KB внесли свой вклад в дизайн исследования и анализ данных.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу http://www.frontiersin.org/article/10.3389/fimmu.2017.01573/full#supplementary-material.
Рисунок S1 . Популяции лейкоцитов и их жизнеспособность после лечения йодидом. (A) Лейкоциты окрашивали первично конъюгированными антителами CD45 Krome-orange. Подмножества лейкоцитов (гранулоциты, моноциты и лимфоциты) были стробированы на основе характеристик CD45 и бокового рассеяния. (B) Лейкоциты окрашивали CD45 Krome Orange и CD14 FITC в день выделения или через 2 дня культивирования на 12-луночных чашках для культивирования с 1 мМ NaI или без него. Показан репрезентативный донор с цветными диаграммами разброса, иллюстрирующими гранулоциты, моноциты и лимфоциты. (C) Процент популяции лейкоцитов из панели (B) были усреднены и нанесены на график. Показанные данные представляют собой усредненные количественные оценки ± стандартное отклонение шести доноров. См. Таблицу S2 в дополнительных материалах для количественной оценки и значений p .
Список литературы
1. Руссе Б., Дюпюи С., Миот Ф., Дюмон Дж. Синтез и секреция гормонов щитовидной железы. В: De Groot LJ, Chrousos G, Dungan K, Feingold KR, Grossman A, Hershman JM, Koch C, Korbonits M, McLachlan R, New M, Purnell J, Rebar R, Singer F, Vinik A, редакторы. Эндотекст . (Глава 2), Южный Дартмут, Массачусетс (2000). п. 2–3. Доступно по адресу: http://www.thyroidmanager.org/wp-content/uploads/chapters/chapter-2-thyroid-hormone-synthesis-and-secretion.pdf
Google Scholar
2.Benoist BD, Andersson M, Egli I, Takkouche B, Allen H. Iodine Status Worldwide . Женева: Всемирная организация здравоохранения (2004 г.).
Google Scholar
4. Ахад Ф, Гани С.А. Пересмотр йода, йодного обмена и йододефицитных расстройств. Indian J Endocrinol Metab (2010) 14 (1): 13–7.
PubMed Аннотация | Google Scholar
8. Сукходжайвараткул Д., Махачоклертваттана П., Пумтхаворн П., Панбурана П., Чайлуркит Л.О., Хларит П. и др.Влияние добавок йода матери во время беременности и кормления грудью на йодный статус и неонатальный тиреотропный гормон. J Perinatol (2014) 34 (8): 594–8. DOI: 10.1038 / jp.2014.62
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Фароа П., Баттфилд И. Х., Хетцель Б.С. Неврологические повреждения плода в результате тяжелого дефицита йода во время беременности. Int J Epidemiol (2012) 41 (3): 589–92. DOI: 10.1093 / ije / dys070
CrossRef Полный текст | Google Scholar
11.Лаурберг П., Андерсен С.Л. Следите за йодом и щитовидной железой и спасите мозг. Horm Res Paediatr (2014) 81 (6): 361–2. DOI: 10.1159 / 000360700
CrossRef Полный текст | Google Scholar
12. Вильдерс-Трущниг М.М., Варнкросс Х., Леб Г., Лангстегер В., Эбер О., Тиран А. и др. Влияние лечения левотироксином или йодом на размер щитовидной железы и стимулирование роста щитовидной железы иммуноглобулинов у пациентов с эндемическим зобом. Clin Endocrinol (Oxf) (1993) 39 (3): 281–6.DOI: 10.1111 / j.1365-2265.1993.tb02367.x
CrossRef Полный текст | Google Scholar
13. Dumont JE, Ermans AM, Maenhaut C, Coppee F, Stanbury JB. Большой зоб как нарушение адаптации к йодной недостаточности. Clin Endocrinol (Oxf) (1995) 43 (1): 1–10. DOI: 10.1111 / j.1365-2265.1995.tb01886.x
CrossRef Полный текст | Google Scholar
14. Spitzweg C, Heufelder AE, Morris JC. Транспорт йода в щитовидной железе. Щитовидная железа (2000) 10 (4): 321–30. DOI: 10.1089 / твой.2000.10.321
CrossRef Полный текст | Google Scholar
15. Barrett EJ. Синтез гормонов щитовидной железы. В: Boron WF, Boulpaep EL, редакторы. Медицинская физиология — клеточный и молекулярный подход . 2-е изд. Филадельфия, Пенсильвания: Saunders Elsevier (2012).
Google Scholar
16. Лаурберг П. Механизмы, регулирующие относительные пропорции тироксина и 3,5,3’-трийодтиронина в секреции щитовидной железы. Метаболизм (1984) 33 (4): 379–92. DOI: 10.1016 / 0026-0495 (84)
-8PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Мортоглу А., Кандилорос Х. Соотношение трийодтиронина и тироксина (Т3 / Т4) в сыворотке при различных заболеваниях щитовидной железы и после заместительной терапии левотироксином. Гормоны (Афины) (2004) 3 (2): 120–6. DOI: 10.14310 / горм.2002.11120
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Клеча А.Дж., Хенаро А.М., Горелик Дж., Баррейро Аркос М.Л., Сильберман Д.М., Шуман М. и др.Интегративное исследование взаимодействия гипоталамуса, гипофиза, щитовидной железы и иммунной системы: модуляция активности лимфоцитов, опосредованная тироидными гормонами, через сигнальный путь протеинкиназы С. J Endocrinol (2006) 189 (1): 45–55. DOI: 10.1677 / joe.1.06137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Ходкинсон К.Ф., Симпсон Е.Е., Битти Дж. Х., О’Коннор Дж. М., Кэмпбелл Д. Д., Стрейн Дж. Дж. И др. Предварительные данные о модуляции иммунной функции гормонами щитовидной железы у здоровых мужчин и женщин в возрасте 55–70 лет. J Endocrinol (2009) 202 (1): 55–63. DOI: 10.1677 / JOE-08-0488
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Де Вито П., Инцерпи С., Педерсен Дж. З., Лули П., Дэвис Ф. Б., Дэвис П. Дж.. Гормоны щитовидной железы как модуляторы иммунной активности на клеточном уровне. Щитовидная железа (2011) 21 (8): 879–90. DOI: 10.1089 / th.2010.0429
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Аламино В.А., Монтесинос М.М., Рабинович Г.А., Пеллизас К.Г.Гормон щитовидной железы трийодтиронин оживляет дендритные клетки и усиливает противоопухолевый иммунитет. Онкоиммунология (2016) 5 (1): e1064579. DOI: 10.1080 / 2162402X.2015.1064579
CrossRef Полный текст | Google Scholar
24. Bagriacik EU, Zhou Q, Wang HC, Klein JR. Быстрое и временное снижение циркулирующих гормонов щитовидной железы после системного прайминга антигенов: последствия для функционального сотрудничества между дендритными клетками и щитовидной железой. Cell Immunol. (2001) 212 (2): 92–100.DOI: 10.1006 / cimm.2001.1846
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Чаба Г., Паллинджер Э. Регулирование концентрации трийодтиронина (Т (3)) в иммунных клетках тиротропным гормоном (ТТГ). Inflamm Res (2009) 58 (3): 151–4. DOI: 10.1007 / s00011-008-8076-8
CrossRef Полный текст | Google Scholar
26. Обрегон М.Дж., Маллол Дж., Эскобар дель Рей Ф., Морреале де Эскобар Г. Присутствие L-тироксина и 3,5,3’-трийод-L-тиронина в тканях тиреоидэктомированных крыс. Эндокринология (1981) 109 (3): 908–13. DOI: 10.1210 / эндо-109-3-908
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Nagao H, Imazu T, Hayashi H, Takahashi K, Minato K. Влияние тиреоидэктомии на метаболизм тироксина и скорость обновления у крыс. J Endocrinol (2011) 210 (1): 117–23. DOI: 10.1530 / JOE-10-0484
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Штольц В. Стимуляция образования йодопротеидов и тироксина в лейкоцитах человека путем фагоцитоза. Biochem Biophys Res Commun (1971) 45 (1): 159–66. DOI: 10.1016 / 0006-291X (71)
-7
CrossRef Полный текст | Google Scholar
29. Meischl C., Buermans HP, Hazes T., Zuidwijk MJ, Musters RJ, Boer C., et al. Кардиомиобласты H9c2 вырабатывают гормон щитовидной железы. Am J Physiol Cell Physiol (2008) 294 (5): C1227–33. DOI: 10.1152 / ajpcell.00328.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Ullberg S, Ewaldsson B. Распределение радиоактивного йода, изученное с помощью авторадиографии всего тела. Acta Radiol Ther Phys Biol (1964) 2: 24–32. DOI: 10.3109 / 0284186640
CrossRef Полный текст | Google Scholar
31. Шпицвег С., Джоба В., Эйзенменгер В., Хойфельдер А.Э. Анализ экспрессии гена симпортера йодида натрия человека в экстратироидных тканях и клонирование его комплементарных дезоксирибонуклеиновых кислот из слюнной железы, молочной железы и слизистой оболочки желудка. J Clin Endocrinol Metab (1998) 83 (5): 1746–51. DOI: 10.1210 / jcem.83.5.4839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Wapnir IL, van de Rijn M, Nowels K, Amenta PS, Walton K, Montgomery K, et al. Иммуногистохимический профиль симпортера натрия / йодида в карциномах щитовидной железы, молочной железы и других карциномах с использованием тканевых микроматриц высокой плотности и обычных срезов. J Clin Endocrinol Metab (2003) 88 (4): 1880–8. DOI: 10.1210 / jc.2002-021544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Ди Космо С., Фанелли Дж., Тонакчера М., Феррарини Е., Димида А., Агретти П. и др. Экспрессия симпортера йодида натрия в ткани плаценты на разных сроках беременности: иммуногистохимическое исследование. Clin Endocrinol (Oxf) (2006) 65 (4): 544–8. DOI: 10.1111 / j.1365-2265.2006.02577.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Каталано Р. Д., Кричли Х. О., Хейкинхеймо О., Бэрд Д. Т., Хапангама Д., Шервин Д. Р. и др. Отмена прогестерона, вызванная мифепристоном, выявляет новые регуляторные пути в эндометрии человека. Mol Hum Reprod (2007) 13 (9): 641–54. DOI: 10,1093 / мольчр / gam021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Марани Л., Вентури С., Масала Р. Роль йода в замедленном иммунном ответе. Isr J Med Sci (1985) 21 (10): 864.
Google Scholar
38. Stoddard FR II, Brooks AD, Eskin BA, Johannes GJ. Йод изменяет экспрессию генов в линии клеток рака молочной железы MCF7: доказательства антиэстрогенного действия йода. Int J Med Sci (2008) 5 (4): 189–96. DOI: 10.7150 / ijms.5.189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Вентури С., Вентури М.Йод в эволюции слюнных желез и здоровье полости рта. Nutr Health (2009) 20 (2): 119–34. DOI: 10.1177 / 026010600
0204
CrossRef Полный текст | Google Scholar
40. Riesco-Eizaguirre G, Leoni SG, Mendiola M, Estevez-Cebrero MA, Gallego MI, Redondo A, et al. НИС опосредует поглощение йодида женскими репродуктивными путями и является плохим прогностическим фактором при раке яичников. J Clin Endocrinol Metab (2014) 99 (7): E1199–208. DOI: 10.1210 / jc.2013-4249
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Мор Г., Карденас И., Абрахамс В., Гуллер С. Воспаление и беременность: роль иммунной системы в месте имплантации. Ann N Y Acad Sci (2011) 1221: 80–7. DOI: 10.1111 / j.1749-6632.2010.05938.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Биман К.Д., Нтвалалас Э., Маллерс Т.М., Джайсвал М.К., Квак-Ким Дж., Гилман-Сакс А. Иммунная этиология повторного невынашивания беременности и ее диагностика. Am J Reprod Immunol (2012) 67 (4): 319–25. DOI: 10.1111 / j.1600-0897.2012.01118.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Биман К.Д., Дамбаева С., Катара Г.К., Кульшреста А., Гилман-Сакс А. Иммунный ответ при беременности и раке активен и поддерживает рост плацентарных и опухолевых клеток, а не их разрушение. Gynecol Oncol (2017) 145 (3): 476–80. DOI: 10.1016 / j.ygyno.2017.04.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Боуэн Дж. М., Чамли Л., Килан Дж. А., Митчелл, Мэриленд.Цитокины плаценты и экстраплацентарных оболочек: роль и регуляция во время беременности и родов у человека. Плацента (2002) 23 (4): 257–73. DOI: 10.1053 / plac.2001.0782
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Амакава М., Като Р., Камеко Ф., Маруяма М., Тадзири Дж. Экспрессия мРНК тиреоглобулина в лимфоцитах периферической крови здоровых субъектов и пациентов с заболеванием щитовидной железы. Clin Chim Acta (2008) 390 (1-2): 97-103. DOI: 10.1016 / j.cca.2008.01.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Holm AC, Lemarchand-Beraud T, Scazziga BR, Cuttelod S. Связывание лимфоцитов человека и дейодирование гормонов щитовидной железы в связи с функцией щитовидной железы. Acta Endocrinol (Copenh) (1975) 80 (4): 642–56.
PubMed Аннотация | Google Scholar
48. Смекенс Л., Гольштейн Дж., Ванахелст Л. Измерение превращения тироксина в трийодтиронин с использованием лимфоцитов человека.Полезный и простой лабораторный метод. J Endocrinol Invest (1983) 6 (2): 113–7. DOI: 10.1007 / BF03350582
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Bianco AC, Nunes MT, Marone MS, Correa PH. Превращение тироксина (T4) в T3 и rT3 в суспензии лейкоцитов человека: его применение в клинических исследованиях. Endocrinol Exp (1985) 19 (1): 53–61.
PubMed Аннотация | Google Scholar
50. Pezzino V, Vigneri R, Squatrito S, Filetti S, Camus M, Polosa P.Повышенный уровень тиреоглобулина в сыворотке крови у пациентов с нетоксическим зобом. J Clin Endocrinol Metab (1978) 46 (4): 653-7. DOI: 10.1210 / jcem-46-4-653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Вейбьерг П., Кнудсен Н., Перрилд Х., Лаурберг П., Карл А., Педерсен И.Б. и др. Тиреоглобулин как маркер йодного питания населения в целом. Eur J Endocrinol (2009) 161 (3): 475–81. DOI: 10.1530 / EJE-09-0262
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52.Bath SC, Pop VJ, Furmidge-Owen VL, Broeren MA, Rayman MP. Тироглобулин как функциональный биомаркер йодного статуса в когортном исследовании беременных женщин в Соединенном Королевстве. Щитовидная железа (2017) 27 (3): 426–33. DOI: 10.1089 / th.2016.0322
CrossRef Полный текст | Google Scholar
57. Klebanoff SJ. Антибактериальная система миелопероксидаза-галогенид-перекись водорода. J Bacteriol (1968) 95 (6): 2131–8.
PubMed Аннотация | Google Scholar
58.Клебанофф SJ, Чайник AJ, Розен H, Винтерборн CC, Nauseef WM. Миелопероксидаза: передовой защитник от фагоцитированных микроорганизмов. J Leukoc Biol (2013) 93 (2): 185–98. DOI: 10.1189 / jlb.0712349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Uyttersprot N, Pelgrims N, Carrasco N, Gervy C., Maenhaut C., Dumont JE, et al. Умеренные дозы йодида in vivo подавляют пролиферацию клеток и экспрессию мРНК тиреопероксидазы и Na + / I- симпортера в щитовидной железе собаки. Mol Cell Endocrinol (1997) 131 (2): 195–203. DOI: 10.1016 / S0303-7207 (97) 00108-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Шпицвег С., Джоба В., Моррис Дж. К., Хойфельдер А. Е.. Регулирование экспрессии гена симпортера йодида натрия в клетках щитовидной железы крысы FRTL-5. Щитовидная железа (1999) 9 (8): 821–30. DOI: 10.1089 / th.1999.9.821
CrossRef Полный текст | Google Scholar
61. Дохан О., Де ла Вьеха А., Пародер В., Ридель С., Артани М., Рид М. и др.Симпортер натрия / йодида (NIS): характеристика, регулирование и медицинское значение. Endocr Rev (2003) 24 (1): 48–77. DOI: 10.1210 / er.2001-0029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Weetman AP, McGregor AM, Campbell H, Lazarus JH, Ibbertson HK, Hall R. Йодид усиливает синтез IgG лимфоцитами периферической крови человека in vitro. Acta Endocrinol (Copenh) (1983) 103 (2): 210–5.
PubMed Аннотация | Google Scholar
63.Olivo-Vidal ZE, Rodriguez RC, Arroyo-Helguera O. Йод влияет на процесс дифференцировки и миграции в трофобластических клетках. Biol Trace Elem Res (2016) 169 (2): 180–8. DOI: 10.1007 / s12011-015-0433-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Чепмен Н.М., Передача сигналов Chi H. mTOR, Treg и иммунная модуляция. Иммунотерапия (2014) 6 (12): 1295–311. DOI: 10.2217 / imt.14.84
CrossRef Полный текст | Google Scholar
66.Айдемир ТБ, Лиуцци Дж.П., Макклеллан С., Казинс Р.Дж. Переносчик цинка ZIP8 (SLC39A8) и цинк влияют на экспрессию IFN-гамма в активированных Т-клетках человека. J Leukoc Biol (2009) 86 (2): 337–48. DOI: 10.1189 / jlb.1208759
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Клуг А. Открытие цинковых пальцев и их применения в регуляции генов и манипулировании геномом. Annu Rev Biochem (2010) 79: 213–31. DOI: 10.1146 / annurev-biochem-010909-095056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Ришер Дж. Ф., Кейт С. Йод и неорганические йодиды: аспекты здоровья человека . Женева: Всемирная организация здравоохранения (2009).
Google Scholar
70. Vought RL, London WT, Lutwak L, Dublin TD. Надежность оценок сывороточного неорганического йода и суточной экскреции йода с фекалиями и мочой из единичных случайных образцов. J Clin Endocrinol Metab (1963) 23: 1218–28. DOI: 10.1210 / jcem-23-12-1218
CrossRef Полный текст | Google Scholar
72. Хаап М., Рот Х. Дж., Хубер Т., Диттманн Х., Валь Р.Йод в моче: сравнение простого метода его определения в микропланшетах с измерением с помощью масс-спектрометрии с индуктивно связанной плазмой. Sci Rep (2017) 7: 39835. DOI: 10.1038 / srep39835
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Ershow AG, Goodman G, Coates PM, Swanson CA. Необходимы исследования для оценки потребления йода, йодного статуса и воздействия добавок йода матери. Am J Clin Nutr (2016) 104 (Дополнение 3): 941S – 9S.DOI: 10.3945 / ajcn.116.134858
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Колдуэлл К.Л., Махмудов А., Эли Е., Джонс Р.Л., Ван Р.Я. Йодный статус населения США, Национальное обследование здоровья и питания, 2005–2006 и 2007–2008 годы. Щитовидная железа (2011) 21 (4): 419–27. DOI: 10.1089 / th.2010.0077
CrossRef Полный текст | Google Scholar
«Термодинамическое исследование комплексообразования в водном растворе. | NI. | PT» Джей Уолтер Рратхолл
Название
Термодинамическое исследование комплексообразования в водном растворе.+ при 0, 10, 20, 30 и 40 ° C. 2. Постадийное образование бис-аламино-меди (II) и бис-фенилаланино-меди (II) при 0, 10, 20, 30 и 40 ° C. 3. Поэтапное образование трис-ацетилацетонато железа (III) при 30 ° C. Изменения энтальпии и энтропии были рассчитаны для реакций в 1 и 2 выше, исходя из температурной зависимости констант равновесия. Были проведены измерения и получены данные для реакций в 3 при нескольких различных ионных силах, концентрациях ионов металлов и значениях pH. Было обнаружено, что добавление фенильной группы к аланину снижает рК диссоциации обоих протонов от кислотных разновидностей аминокислоты.Это объясняется притяжением, которое фенильная группа имеет к электронам. Тот же эффект привел к тому, что log K первого ступенчатого хелата меди (II) был ниже с фенилаланином, чем с аланином. Однако второй ступенчатый хелат меди (II) с фенилаланином имеет более высокое значение log K, чем эквивалентный хелат аланина. Это показывает, что фенильная группа влияет на электроотрицательность иона меди (II) в первом хелате. Рассчитанные константы образования трис-ацетилацетонато железа (III) не зависели от концентрации иона металла и ионной силы, но увеличивались по мере уменьшения измеряемого pH.-, что указывает на то, что между перхлорат-ионом и ионом металла происходит окислительно-восстановительная реакция. Ранее считалось, что разбавленная хлорная кислота не является окислителем. Большая часть вычислений, необходимых для обработки полученных данных, была запрограммирована для компьютера IBM 650.
Ученые BYU Архивное цитирование
Wrathall, Джей Уолтер, «Термодинамическое исследование комплексообразования в водном растворе. | NI. | P Медь (II) -аланин и медь (II) -фенилаланин системы.| nII. | p Система железо (III) -ацетилацетон »(1959). Дис. и дисс. . 8500.
https://scholarsarchive.byu.edu/etd/8500
Мандат Байдена по вакцинации не включает нелегальных иммигрантов
NEWТеперь вы можете слушать статьи Fox News!
Президент Байден объявил о широкомасштабном плане, который может заставить миллионы непривитых американцев сделать прививку от COVID-19, но не указал вакцину для нелегальных иммигрантов, пересекающих границу.
Байден объявил в четверг, что все работодатели с более чем 100 сотрудниками будут вынуждены либо требовать от своих сотрудников вакцинации против COVID-19, либо требовать еженедельное тестирование на вирус.
Президент также объявил, что оставшиеся 17 миллионов медицинских работников, занятых в учреждениях, получающих федеральные программы Medicare или Medicaid, также должны будут пройти полную вакцинацию. Вместе эти две группы представляют около 100 миллионов американцев.
ПРЕДЛОЖЕНИЕ ОБЪЯВЛЕНИЯ МАНДАТА ВАКЦИНЫ ДЛЯ КОМПАНИЙ, КОТОРЫЕ СОТРУДНИЧЕНЫ БОЛЕЕ 100
«Мы проявили терпение, но наше терпение истощается», — сказал Байден о примерно 80 миллионах американцев, которым еще предстоит сделать прививку.«Хотя Америка находится в гораздо лучшей форме, чем семь месяцев назад, когда я вступил в должность, я должен сообщить вам второй факт: мы находимся в трудном положении, и это может продолжаться некоторое время».
Но Байден не стал вводить обязательную вакцину для нелегальных иммигрантов, пытающихся пересечь границу Америки, хотя около 30% иммигрантов, содержащихся в федеральных следственных изоляторах, отказываются от вакцинации — и у них есть возможность отказаться.
Между тем, более чем 18% семей мигрантов, недавно пересекших границу, дали положительный результат на COVID до того, как их выпустила пограничная служба.Еще 20% несовершеннолетних без сопровождения взрослых дали положительный результат на вирус.
НАЖМИТЕ ЗДЕСЬ, ЧТОБЫ ПОЛУЧИТЬ ПРИЛОЖЕНИЕ FOX NEWS
Новые правила Байдена для работодателей с числом сотрудников более 100 будут изданы Министерством труда, сказал президент. Президент также пригрозил крупными штрафами работодателям, которые не соблюдают мандат.
«У нас есть инструменты для борьбы с вирусом, если мы объединимся, чтобы использовать эти инструменты», — сказал Байден.
| ФИО | Степень | Название | Год |
| Доэрти, Брайан | Ph.Д. | Разработка вычислительных средств для исследования ионных жидкостей и глубоких эвтектических растворителей | 2019 |
| Лоуренс, Рэнди | к.э.н. | Фотопереключаемые материалы для каталитической модуляции наночастиц | 2019 |
| Мунро, Екатерина | к.э.н. | Влияние аминокислотных и пептидных мутаций на морфологию материалов и катализ | 2019 |
| Муциопулу, Анжелики | Ph.Д. | Дизайн биолюминесцентных белковых конъюгатов с биоортогональной химией для применения в биомедицине | 2019 |
| Чжоу, Ицюнь | к.э.н. | Углеродные точки: от лабораторного синтеза до уникальных приложений | 2019 |
| Энтони Радж, Мохан Радж | к.э.н. | Управление фотопроцессами в замкнутом пространстве: переключатели, триггеры и перенос электронов | 2018 |
| Иглесиас, Вивиан | Ph.Д. | Исследования супрамолекулярного комплексообразования электроактивных гостей с помощью хозяев кукурбит [n] урила | 2018 |
| Шарма, Шив | к.э.н. | Химия поверхности и спектроскопические исследования ферментативных, неферментативных молекул и их применения | 2018 |
| Коли, Энтони | к.э.н. | Флуорофоры в ограниченном пространстве: от нацеливания на молекулярные переносчики до инкапсуляции с помощью органических наноконтейнеров | 2018 |
| Данао, Ашвини | Ph.Д. | Исследования фотофизических свойств ароматических углеводородов и красителей в изотропном растворителе и в ограниченном пространстве | 2018 |
| Ji, Yiwen | к.э.н. | Синтез и применение углеродных точек | 2018 |
| Каматам, Нарешбабу | к.э.н. | Клеточные молекулы, высвобождаемые из капсул: фотохимические и фотофизические исследования триггеров кумарина | 2018 |
| Ли, Хиджин | Ph.Д. | Разработка ингибиторов включающих флуоресцентных киназ | 2018 |
| О’Доннелл, Лорен | к.э.н. | Новые методы повышения разрешения в жидкостной и твердотельной спектроскопии ядерного магнитного резонанса | 2018 |
| Пол, Томас Дж. | к.э.н. | Компьютерное понимание структур, механизмов и химических свойств комплексов металлов, ферментов и биомолекул | 2018 |
| Сансалоне, Лоренцо | Ph.Д. | Фотонные стратегии для биоимиджинга и модуляции биологических систем | 2018 |
| Tang, Sicheng | к.э.н. | Активируемые флуорофоры в сочетании с амфифильными полимерными носителями для биоимиджинга | 2018 |
| Veerakanellore, Giri Babu | к.э.н. | Фотодимеризация цис-коричных кислот и цис-коричных кислот в кристаллическом состоянии и водном растворе | 2018 |
| Гусман, Кармен X. | к.э.н. | Увеличенное время жизни носителей заряда в иерархических донорно-акцепторных супрамолекулярных полимерных пленках | 2017 |
| Хан, Сюй | к.э.н. | Исследование естественной сборки для биомедицинского применения | 2017 |
| Нгуен, Мишель А. | к.э.н. | Функциональные наноматериалы для защиты окружающей среды и биосборки | 2017 |
| Thapaliya, Ek Raj | Ph.Д. | Механизмы фотоактивации флуоресценции и стратегии супрамолекулярной доставки в приложениях для биовизуализации | 2017 |
| Вайдели, Эрик | к.э.н. | Спектроскопические подходы к обнаружению ионов, альфа-L-фукозидазы и синглетного кислорода | 2017 |
| Юй, Сяовэнь | к.э.н. | Биолюминесцентные сенсорные системы для обнаружения цитокинов и биомаркеров рака | 2017 |
| Чжан, Ян | Ph.Д. | Фотоактивируемые BODIPY для приложений биовизуализации | 2017 |
| Hoffmann, Zachary | M.S. | 2016 | |
| Маджумдар, Субходжит | к.э.н. | Термодинамическое и кинетическое исследование переноса атома кислорода на фосфины, фосфид металлов и комплексы ванадия (III): различия в механизмах и влияние аксиальной координации оснований на связи халькогенов металлов. | 2016 |
| Питтер, Демар Р.Г. | к.э.н. | Синтез и оптические свойства новых включающих флуоресцентных красителей ядер с совместимостью с живыми клетками | 2016 |
| Briggs, Beverly D. | к.э.н. | Пептидные наночастицы для катализа и сборки | 2015 |
| Cheng, Beijun | к.э.н. | Взаимодействие связывания хозяина и гостя под влиянием электрохимических реакций | 2015 |
| Гиллеспи, Меган Мари | Ph.Д. | Улучшение восприятия за счет создания рекомбинантных белков | 2015 |
| Гринстед, Кристен Мари | к.э.н. | Мутанты экворина с сайт-специфически включенными неприродными аминокислотами для биомедицинских применений | 2015 |
| Хант, Эрик А. | к.э.н. | Разработка новых биолюминесцентных сенсорных систем нуклеиновых кислот для клинического анализа | 2015 |
| Jagadesan, Pradeepkumar | Ph.Д. | Исследование влияния супрамолекулярного ограничения на фотохимию органических молекул-гостей. | 2015 |
| Merrill, Николас А. | к.э.н. | Стабильность, структура и реакционная способность наночастиц металлов, созданных на основе биотемпелей | 2015 |
| Рамасами, Элампарути | к.э.н. | Образование и интеркаляция супрамолекулярных капсульных ансамблей на поверхности и их свойства в возбужденном состоянии | 2015 |
| Вестфолл, Натаниэль | М.С. | 2015 | |
| Кроуфорд, Николас Франклин | к.э.н. | Межфазные и спектроскопические исследования биомакромолекул и квантовых точек CdSe (ZnS) | 2014 |
| Дхугуру, Джьоти | к.э.н. | Разработка «включающих» флуоресцентных имитаторов нуклеобаз в качестве ингибиторов кииназ | 2014 |
| Johnson, Sheba | к.э.н. | Химия поверхности и спектроскопия монослоя Ленгмюра человеческого инсулина | 2014 |
| Кнехт, Лесли | Ph.Д. | Генетически разработанные бактериальные биосистемы для экологического и биомедицинского применения | 2014 |
| Коппака, Анджанеюлу | к.э.н. | Активация малых молекул на центрах никеля и платины, содержащих объемные лиганды радикалов олова и темпа | 2014 |
| Li, Шанхао | к.э.н. | Анализ взаимодействия оксида графена с биомолекулами и фибрилляции белков с использованием химии поверхности и спектроскопии | 2014 |
| Лопес, Кристофер Дж. | к.э.н. | Часть I. ЯМР-исследования агрегации в органических красителях и солях Часть II. Разработка релаксационных и диффузионных селективных импульсов | 2014 |
| Mondal, Barnali | к.э.н. | Управление фотореакциями в кристаллах и удержанием в водорастворимых супрамолекулах | 2014 |
| Нарцисс, Морис | к.э.н. | Асимметричный катализ перициклических реакций через хиральные доноры водородных связей | 2014 |
| Пэн, Чжили | Ph.Д. | Разработка спиральных хиральных катализаторов и их применение в асимметричном катализе | 2014 |
| Сенлер, Санем | к.э.н. | Разработка и синтез новых систем кукурбитурила и новых гостей для кукурбитурилов | 2014 |
| Swaminathan, Subramani | к.э.н. | Фотоактивация флуоресценции на основе 2-нитробензильных производных | 2014 |
| Тутунчи, Мохаммад Хоссейн | Ph.Д. | Кукурбитурилы в микроскопических комплексах и кооперативных системах хозяин-хозяин | 2014 |
| Чжан, Тинтин | к.э.н. | Вычислительные методы понимания механизмов и структур металлоферментов, расщепляющих пептидные связи, и их синтетических аналогов | 2014 |
| Аджайе-Менса, Эдвард | к.э.н. | Спектроскопическое исследование внутри- и межмолекулярных взаимодействий донорно-акцепторных пи-систем | 2013 |
| Бхандари, Рохит | Ph.Д. | Влияние матрицы пептидов на синтез и реакционную способность сетей металлических наночастиц | 2013 |
| Цай, Сяочэнь | к.э.н. | Термодинамические, кинетические и механистические исследования связывания и активации молекулярного кислорода и мезитилнитрилоксида | 2013 |
| Коппейдж, Райан | к.э.н. | Выяснение эффектов пептидной последовательности, которые контролируют активность, размер и функцию наночастиц | 2013 |
| Cusido, Janet | Ph.Д. | Освещение молекул светом: активация флуоресценции фотохромными оксазинами | 2013 |
| Гупта, Шипра | к.э.н. | Понимание влияния ограничения на свойства возбужденного состояния малых органических молекул | 2013 |
| Озбил, Мехмет | к.э.н. | Комплексные теоретические и вычислительные подходы к изучению гидролиза и агрегации биомолекул | 2013 |
| Пакардо, Деннис Киен Балаонг | Ph.Д. | Каталитическое применение наноматериалов на основе биологических материалов | 2013 |
| Qiu, Yanhua | к.э.н. | Исследования молекулярной инкапсуляции и получения новых клеточных молекул | 2013 |
| Саха, Сумит | к.э.н. | Синтез и характеристика высокоядерных биметаллических кластерных комплексов переходных металлов группы 8-группы 10 | 2013 |
| Чжан, Даохун | Ph.Д. | На пути к обнаружению нуклеиновых кислот на месте для мониторинга патогенов | 2013 |
| Бармен, Аргья | к.э.н. | Механические и структурные исследования протеаз, пептидаз и бета-амилоидного пептида: комплексный вычислительный подход | 2012 г. |
| Чоудхури, Раджиб | к.э.н. | Структура и динамика малых молекул в водорастворимых хозяевах: термодинамическое, ядерно-магнитное спектроскопическое и вычислительное исследование | 2012 |
| Impellizzeri, Стефания | Ph.Д. | Разработка наночастиц для переключения люминесценции | 2012 |
| Хименес, Андреина Агуадо | к.э.н. | Разработка новых каталитических методов с использованием доноров водородных связей и их применение в реакции Дильса-Альдера нитроалкенов | 2012 |
| Куласекхаран, Ревати | к.э.н. | Динамика и реактивность гостей в водорастворимых хозяевах и синтез катионных водорастворимых кавитандов | 2012 |
| Ли, Вэй | Ph.Д. | Исследование комплексообразования включения между производными ферроцена и кукурбитурилами | 2012 |
| Патель, Рави | M.S. | Морфологическое исследование наноматериалов и биомолекул с помощью атомно-силовой микроскопии. | 2012 |
| Порел, Минту | к.э.н. | Понимание внутренних характеристик кавитанда с глубокой полостью и его роли в модуляции фотофизических процессов органических молекул | 2012 |
| Саманта, Шампа | Ph.Д. | Управление фотохимическим и фотофизическим поведением органических молекул внутри водорастворимого хозяина | 2012 |
| Yempally, Veeranna | к.э.н. | Синтез и характеристика комплексов переходных металлов с объемными лигандами олова для применения в активации малых молекул | 2012 |
| Йи, Сун | к.э.н. | Исследование супрамолекулярных систем с нитроксильными спиновыми зондами | 2012 |
| Zhu, Xiaoxia | Ph.Д. | Компьютерное понимание механизмов и структур металлопептидаз и агрегации бета-амилоидных пептидов | 2012 |
| Bagale, Sharanappa | M.S. | Синтез флуоресцентных аналогов нейромедиаторов | 2011 |
| Эрхан, Дениз | к.э.н. | Переключение флуоресценции фотохромными оксазинами | 2011 |
| Исроу, Дерек | Ph.Д. | Электронная ненасыщенность металлоорганических комплексов, обусловленная стерически требовательными лигандами | 2011 |
| Li, Шанхао | M.S. | Теоретическое понимание механизмов естественных и искусственных металлопротеазов | 2011 |
| Орбулеску, Джони | к.э.н. | Противопоставление асфальтенов и сердечного тропонина I человека: химия поверхности и перспектива спектроскопии | 2010 |
| Тхакур, Гарима | Ph.Д. | Химия поверхности и спектроскопический подход к изучению нейродегенеративных заболеваний | 2010 |
| Ванной, Чарльз Х. | к.э.н. | Поведенческие эффекты функционализированных квантовых точек CdSe / ZnS в самоорганизации и фибрилляции белков | 2010 |
| Банашак, Тайлер | к.э.н. | Фотохромные полимеры на основе оксазина | 2009 |
| Cui, Lu | Ph.Д. | Водородная связь и комплексообразование кукурбитурила как механизмы самосборки | 2009 |
| Фортман, Джордж К. | к.э.н. | Термодинамическое и кинетическое исследование реакции комплексов низковалентной группы 6 с N-донорными лигандами | 2009 |
| Кешвани, Малик М. | к.э.н. | Протеинкиназа-1 рибосомы1S6 человека p70 (S6K1): механизм субстратного катализа, активации и ингибирования | 2009 |
| Партасарати, Ананд | Ph.Д. | Фотохимические реакции в водорастворимой супрамолекулярной системе: влияние ограничения на реакционную способность гостя и селективность продукта | 2009 |
| Подкосельный, И. Дагмара | к.э.н. | Инкапсуляция активных окислительно-восстановительных центров кавитандами с глубокими резонаторами | 2009 |
| Поупджой, Уильям | M.S. | 2009 | |
| Ray, Shuvasree | к.э.н. | Чувствительные люминесцентные зонды на основе полупроводниковых квантовых точек и органических хромофоров | 2009 |
| Маддипатла Венката, Шрирама Н. | к.э.н. | Влияние замкнутых сред на фотофизические и фотохимические превращения органических гостевых молекул: водорастворимые супрамолекулы как замкнутые среды | 2008 |
| Сундаресан, Арун Кумар | к.э.н. | Фотохимические превращения в водорастворимой супрамолекулярной сборке: пространственные и временные эффекты на селективность продукта | 2008 |
| Ван, Вэй | Ph.Д. | Самосборка дендримеров и комплексов кукурбит [n] урила | 2008 |
| Лин, Юнхуа | к.э.н. | Молекулярные свойства распознавания кукурбитуральных рецепторов | 2007 |
| Сивасубраманян, Картик | к.э.н. | Управление селективностью фотохимических реакций посредством удерживающего и несвязывающего взаимодействия | 2007 |
| Арумугам, Селванатан | Ph.Д. | Контроль фотохимии в полимерных и олигомерных органических хозяевах | 2006 |
| Чен, Вэйчжун | к.э.н. | Различные реакции на соединениях Ru2: в сторону супрамолекул и дендримеров | 2006 |
| Декан, Майкл | к.э.н. | Соединения дирения, содержащие N, N’-мостиковые бидентатные лиганды | 2006 |
| Гао, Синьсинь | к.э.н. | Человеческая фосфоинозитид-зависимая протеинкиназа-1 (PDK1): механизм аутоактивации и субстратный катализ | 2006 |
| Найстат, Дэвид | Ph.Д. | Двумерный биомиметический подход к амилойдогенезу | 2006 |
| Паттабираман, Махеш | к.э.н. | Контроль фотохимии органических молекул с использованием водорастворимых хозяев | 2006 |
| Сунь, Хао | к.э.н. | Самосборка дендримеров и димеров ферроцена с сильными связями посредством водородных связей | 2006 |
| Чжао, Лян | Ph.Д. | Фосфорорганическая гидролаза: анализ вторичной структуры в растворе и пленке Ленгмюра-Блоджетт и прямая конъюгация квантовых точек CDS для обнаружения диизопропилфторфосфата | 2006 |
| Zheng, Jiayin | к.э.н. | Спектроскопические свойства фосфорорганической гидролазы (OPH) и ангидролазы фосфорорганической кислоты (OPAA) | 2006 |
| Баркер, Джулия | к.э.н. | Гомогенное оксигенация сульфидов через катализаторы MN и Ru и взаимодействие между [Cu2 ([18] aneN6)] 4+ и фосфатами | 2005 |
| Цзи, Сяоцзюнь | Ph.Д. | Полупроводниковые квантовые точки: химия поверхности, модификация поверхности и приложения | 2005 |
| Li, Чанцин | к.э.н. | Исследование функциональных пептидов и пептидолипидов: подход к химии поверхности | 2005 |
| Макдонаф, Джеймс | к.э.н. | Термодинамические и кинетические исследования связывания лиганда, окислительного присоединения и переноса атома / группы, а также комплексов металлов VI группы. | 2005 |
| Филип, Айви Э. | к.э.н. | Нековалентная инкапсуляция окислительно-восстановительных активных соединений резорцином [4] аренами | 2005 |
| Собрасинг, Дэвид | к.э.н. | Дендритные и металические наноузлы | 2005 |
| Tomasulo, Massimiliano | к.э.н. | Фотохромные молекулы | 2005 |
| Альварадо, Роберт Джон | Ph.Д. | Электрохимия фуллеренов краун-эфира, межмолекулярная передача сигналов и перенос электронов на электродах, модифицированных дикатионами 4,4′-бипиридиния | 2004 |
| Berbeci, Lidia Strimbu | к.э.н. | Влияние комплексообразования на новый катализатор и тиол-дисульфидное равновесие | 2004 |
| Cejas, Mabel Alamino | к.э.н. | Флуоресцентные покрытия для химической чувствительности | 2004 |
| Константин, Селеста A | Ph.Д. | Поверхностная иммобилизация фосфорорганической гидролазы для спектроскопического обнаружения фосфорорганического производного на основе биосенсора | 2004 |
| Джордани, Сильвия | к.э.н. | Цифровая обработка и коммуникация на молекулярном уровне | 2004 |
| Кляйн, Розалин | к.э.н. | Из α-аминоорганостаннанов в α-аминоорганолитий: кинетические, механистические и структурные исследования | 2004 |
| Moon, Квангул | Ph.Д. | Молекулярная капсула и окислительно-восстановительные эффекты инкапсулированных гостей | 2004 |
| Pacsial, Eden Joy V | к.э.н. | Синтез и электрохимия пленок, содержащих структурные элементы бипиридиния и тетратиафульвалена | 2004 |
| Сантьяго, Марселина | к.э.н. | Исследование жестких α-аминоорганолитов: I. добавление S, N-ацеталей альдегидов; II. Структура раствора α-аминоорганостаннанов и 1-азааллильного аниона в реакциях с хиральными амидами лития | 2004 |
| Сюй, Гуолинь | Ph.Д. | Синтезы и характеристика металлайнов дирутения и подвижность заряда в них | 2004 |
| Cao, Xihui | к.э.н. | Свойства Ленгмюра, Ленгмюра-Блоджетт и послойные ультратонкие пленки амфифильных молекул и фосфорорганической гидролазы (OPH), а также тонкопленочный биоанализ OPH фосфорорганического соединения (параоксон) | 2003 |
| Grindstaff, Джоди | M.S. | Исследования периферической модификации и связывания несимметричных дендримеров виологенов | 2003 |
| Сукчароенфон, Кенгкай | Ph.Д. | Активация N-гетероциклических тиолов и дисульфидов металлоорганическими комплексами VI группы: кинетическое и термодинамическое исследование | 2003 |
| Уильямс, Маргарет Б. | к.э.н. | Кинетические и механистические исследования окисления восстановленных сульфидов, инициированного ОН | 2003 |
| Келе, Петр | к.э.н. | Синтез и прикладные исследования новых производных кумарина | 2002 |
| Ким, Чанг-Сик | Ph.Д. | Электронное воздействие на циклизацию Бергмана и синтез новых аналогов ендиина как потенциальных молекул для селективного расщепления ДНК для противораковых агентов | 2002 |
| Мичич, Миодраг | к.э.н. | Исследования поверхностной и супрамолекулярной химии выбранных сшитых макромолекулярных систем | 2002 |
| Онг, Уинстон | к.э.н. | Молекулярная и дендритная инкапсуляция виологенов | 2002 |
| Пьеро, Дени | Ph.Д. | Термодинамические исследования с использованием формализма Питцера: расширение модели и ее приложения | 2002 |
| Sui, Guodong | к.э.н. | Молекулярная ориентация в пленках Ленгмюра и Ленгмюра-Блоджетт дискообразных молекул, включая амфифильные дендримеры и жидкокристаллические производные перилендиимида | 2002 |
| Занарди Ламардо, Элиете | к.э.н. | Молекулярная масса и оптические характеристики фракционированного по размерам РОВМ в переходной зоне от реки к морю | 2002 |
| Чжэн, Юйцзюнь | Ph.Д. | Фотосшивающие ПЭГ-гидрогелевые и пептидные флуоресцентные сенсоры для ионов меди | 2002 |
| Kong, Sue | к.э.н. | Теоретические исследования влияния растворителей и кислотного катализа Льюиса на реакции Дильса-Альдера | 2001 |
| Macias, Alba Teresa | к.э.н. | Теоретические исследования структурных и энергетических свойств макромолекул и их межмолекулярных взаимодействий | 2001 |
| Мохика Прието, Франсиско Хавьер | М.С. | Исследование констант диссоциации угольной кислоты в морской воде | 2001 |
| Ni, Юйхуа | M.S. | протяженные металлаины на основе [Ru2 (ap) 4] в результате реакций перекрестного и гомосочетания в условиях Хэя | 2001 |
| Орбулеску, Джони | M.S. | Монослойные исследования Ленгмюра амфифильных октадецильных производных | 2001 |
| Alvarez, Julio C | Ph.Д. | Влияние переноса протона на окислительно-восстановительные свойства биядерных и многоядерных ферроценовых аминов | 2000 |
| Баллестеро, Синтия | M.S. | Синтез новых ендииновых аминокислот, предназначенных для включения в пептидные гормоны | 2000 |
| Campagna, Silvio A | к.э.н. | Исследования диполь-стабилизированных и нестабилизированных альфа-аминоорганолитов | 2000 |
| Чой, Накьен | Ph.Д. | Дизайн, синтез и исследование циклизации Бергмана новых аналогов ендиина | 2000 |
| фрау, Ана | M.S. | Контроль размера металлических наночастиц путем пассивации многодентатным стабилизатором или путем инкапсуляции в золь-гелевую матрицу | 2000 |
| Катипамула, Нандини | M.S. | Исследование алкокси и хлорсиланов на пленке Ленгмюра: сравнительное исследование | 2000 |
| Роман Вела, Эстебан | Ph.Д. | Получение [n] кавитандов и электрохимически активных кавитандов, функционализированных бипиридинием | 2000 |
| Ван, Юнь | к.э.н. | Исследования комплексообразования хозяин-гость в водном растворе и на границе раздела электрод-раствор | 2000 |
| Кэппс, Кеннет Брайант | к.э.н. | Термодинамические и кинетические исследования металлов VI группы с соединениями серы и / или оксидом азота | 1999 |
| Кардона, Клаудиа Мария | Ph.Д. | Новые электроактивные и флуоресцентные дендримеры | 1999 |
| Дзири, Лейла | к.э.н. | Конформационные исследования ацетилхолинэстеразы на границах раздела воздух-вода и воздух-твердое тело и разработка оптического волокна для обнаружения фосфорорганических соединений | 1999 |
| Го, Чжэнмао | к.э.н. | Разработка и синтез ингибиторов цистеиновых протеаз с использованием механизма S-нитрозирования | 1999 |
| Хо, Цюнь | Ph.Д. | Разработка, синтез и применение молекулярных рецепторов, направленных на водородные связи, и супрамолекулярных самосборок | 1999 |
| Li, июнь | к.э.н. | Синтез, конформационный анализ и применение биоактивных олигосахаридов | 1999 |
| Лю, Цзянь | к.э.н. | Химия хозяина и гостя на поверхности наночастиц золота | 1999 |
| МакГилл, Андреа Дионн | Ph.Д. | Разработка, синтез и использование соединений N-нитрозоанилина в качестве переносчиков оксида азота | 1999 |
| Мендоса Диас, Сандра О | к.э.н. | Электрохимия гемикарцеплексов, гемикарцеплексов и комплексов включения | 1999 |
| Pyo, Soomi | к.э.н. | Электрохимия молекулярных диад, содержащих фуллерены, порфирины или фталоцианины, и электрокристаллизация комплексов переходных металлов | 1999 |
| Раджамани, Рамкумар | М.С. | Теория катализа перициклических реакций ионными растворами | 1999 |
| Рамирес, Джонни E | к.э.н. | Новые доноры оксида азота и биосенсоры гликолипидов | 1999 |
| Schulze-Fiehn, Brita G | к.э.н. | Теоретическая оценка глобальных и локальных движений монооксимиоглобина углерода и их функциональное значение | 1999 |
| Verma, Deepali | М.С. | Взаимодействие хозяина и гостя в 2-D на границе раздела воздух-вода: исследование Ленгмюра | 1999 |
| Ван, Шаопэн | к.э.н. | Молекулярное распознавание на границе раздела: исследование фильмов Ленгмюра и Ленгмюра-Блоджетт | 1999 |
| Мирзоян, Армен | к.э.н. | Эффекты растворителя и окислительно-восстановительный контроль феномена связывания хозяина и гостя | 1998 |
| Ариас, Франсиско | Ph.Д. | Электрохимия фуллеренов и производных фуллеренов | 1997 |
| Кастро, Рене | к.э.н. | Нековалентные взаимодействия в супрамолекулярных комплексах | 1997 |
| Годинес-Мора-Товар, Луис Артуро | к.э.н. | Комплексообразование с циклодекстрином нескольких гостей в воде и смесях вода-мочевина и исследования адсорбции органических молекул на голых и модифицированных золотых электродах | 1997 |
| Gomez-Kaifer, Marielle Elise | Ph.Д. | Конформационные, связывающие и электрохимические исследования окислительно-восстановительных каликсаренов | 1997 |
| Лоусон, Рафаэль Каджо | к.э.н. | Спектроэлектрохимия нитроксидных бирадикалов и исследования повышения связывания катионов краун-соединений антрахинона | 1997 |
| Джу, Телвин Доминик | к.э.н. | Термодинамические и кинетические исследования окислительного присоединения тиолов и дисульфидов к Cr (CO) 3C5Me5 и W (phen) (CO) 3 (EtCN) | 1996 |
| Таверас, Даниэль Висенте | Ph.Д. | Исследование процессов внутримолекулярного переноса электрона в растворе под высоким давлением | 1996 |
| Кордова Моралес, Эмилио | к.э.н. | От ротаксанов к молекулярным челнокам: новые ротаксаны, основанные на комплексообразовании фенильных и бифенильных гостей циклобисом (паракват-п-фениленом): экспериментальное и теоретическое исследование | 1995 |
| Лэнг, Рассел Фрэнсис | к.э.н. | Реакционная способность дисульфидов и тиолов с двумя трис-карбонильными системами вольфрама: W (CO) 3 (phen) (EtCN) и W (CO) 3 (P-i-Pr3) 2 | 1995 |
| Li, Chensheng | Ph.Д. | Синтез и исследование молекулярных рецепторов, содержащих ферроценовую группу | 1995 |
| Кастрюля, Вэй | к.э.н. | Влияние боковых цепей на электронную связь между металлическими центрами в простых модельных системах | 1995 |
| Zhang, Qianhui | к.э.н. | Изучение альфа-аминогруппы лития: I. Конфигурационная стабильность, II. Алкилирование, III. Сигматропные перегруппировки и диастереоселективности присоединения хиральных литиотиазолидинов к альдегидам | 1995 |
| Рохас Гитарт, Мария Тереза | Ph.Д. | Управление реакционной способностью электрода: применение в миметиках биомембран, молекулярных и ионных сенсорах | 1994 |
| Се, Циншань | к.э.н. | 23Na-ЯМР-исследования транспорта Na +, опосредованного синтетическими носителями, через мембраны везикул и фуллериды фуллеренов и фуллероидов: ESR и электрохимическое исследование | 1994 |
| Гуднау, Тимоти Т | к.э.н. | Электрохимические и спектральные свойства катенанов, ротаксанов и циклофанов на основе виологенов | 1993 |
| Поцелуй, Габор | Ph.Д. | Термохимические исследования [M ([Eta] 5-C5H5) (CO) 3] 2 (M = Cr, Mo, W) и их производных комплексов | 1993 |
| Li, Chaei | к.э.н. | Синтез аналогов миристиновой кислоты: изучение субстратной специфичности MyristoylCoA: протеин N-миристоилтрансферазы, характеристика связывающего кармана фермента и лечение вирусных, а также грибковых инфекций | 1993 |
| Ли, Ци | к.э.н. | Синтез аналогов миристиновой кислоты — изучение субстратной специфичности миристоилкоа: протеин N-миристоилтрансфераза; характеристика связывающего кармана фермента; и лечение вирусных и грибковых инфекций | 1993 |
| Li, Yi | Ph.Д. | Кинетика катионообмена и механизмы макроциклических катионных комплексов простого полиэфира и хиральное распознавание триазол-краун-лигандами | 1993 |
| Ниен, Чиа-фу Джефф | к.э.н. | Реакции газофазного окисления атомов щелочных и щелочноземельных металлов | 1993 |
| Schall, Отто Франц | к.э.н. | Нековалентные силы в молекулярном распознавании: способы взаимодействия и свойства самосборки новых молекулярных рецепторов | 1993 |
| Чжан, Пиншэн | Ph.Д. | Исследования асимметричного присоединения тетрагидроизохинолина Гриньяра к альдегидам, опосредованного оксазолином, и его применения в синтезе оптически чистых алкалоидов изохинолина и направленном металлировании / перегруппировке бензиловых карбаматов по Сниккусу | 1993 |
| Иснин, Рахима | к.э.н. | Переключаемое бимодальное комплексообразование с циклодекстрином производных ферроцена для супрамолекулярных ансамблей | 1992 |
| Медина, Хулио C | Ph.Д. | Новые роли производных ферроцена в молекулярном распознавании | 1992 |
| Чен, Чжихун | к.э.н. | Липофильные лиганды с переключением окислительно-восстановительного потенциала: от усиленного связывания катионов и транспорта к молекулярным ансамблям | 1991 |
| Чоу, Шоу Цзяу | M.S. | Синтез и термодинамика металлоорганических соединений хрома, молибдена и вольфрама | 1991 |
| Гарсия, Нэнси Мария | Ph.Д. | Структурные и иммунологические проявления рацемизации пептидов основного белка миелина | 1991 |
| Гонсалес, Альберто Альфонсо | к.э.н. | Синтетические, кинетические и термодинамические исследования комплексов (PCY3) 2M (Co) 3 M = Cr, Mo и W | 1991 |
| Эрнандес, Жанетт Коромото | к.э.н. | Синтезы лариатных эфиров-ионных носителей: их катионосвязывающая способность и свойства транспорта катионов; и синтезы стероидных эфиров лариата: их амфифильное поведение и свойства самосборки | 1991 |
| Хубингер, Скотт | Ph.Д. | Предпочтение сайта связывания и изомеризация в изомерах связи пентаамминкобальта (III) | 1991 |
| Ким, Хёнсук | к.э.н. | Исследования электрохимически переключаемых краун-эфиров антрахинона и подандов и синтез флуоресцентных зондов | 1991 |
| Ли, Дана М | M.S. | Влияние взаимодействия исключенного объема на образование шпилечной петли в РНК | 1991 |
| Мукерджи, Шакти Лалит | Ph.Д. | Термохимические исследования металлов VI группы методом растворной калориметрии | 1991 |
| Рейн, Кэтлин Сью | к.э.н. | Оксазолины как медиаторы асимметричного алкилирования и гидроксиалкилирования тетрагидроизохинолинов и оксазолидинонов как медиаторы ациклической стереоселекции в синтезе первичных аминов | 1991 |
| Трафтон, Джон Эдвард | к.э.н. | Селективность и механизм взаимодействия катион-макроцикл | 1991 |
| Echegoyen, Lourdes Echeverria | Ph.Д. | Эфиры лариата: от электрохимически усиленного транспорта катионов до супрамолекулярных ансамблей | 1990 |
| Парра-Диас, Деннис | к.э.н. | Магнитно-резонансные и молекулярно-механические исследования эфиров лариат и кальций-связывающих белков | 1990 |
| Чжан, Кай | к.э.н. | Кинетические и термодинамические исследования металлоорганических комплексов хрома, молибдена и вольфрама | 1990 |
| Миллер, Стивен Росс | Ph.Д. | Синтезы, связывание катионов и структурные свойства азотсодержащих эфиров лариата | 1989 |
| Смит, Грегори Энтони | к.э.н. | Асимметричный синтез алкалоидов тетрагидроизохинолина с использованием оксазолина, производного от аминокислоты, в качестве хирального медиатора | 1989 |
| Альмиралл, Хосе Рафаэль | M.S. | Исследование электронно-спинового резонанса новых соединений циклооктатетраен-краун-эфир | 1988 |
| Арнольд, Кристин Энн | Ph.Д. | Исследования связывания катионов лариатными эфирами и термодинамики процесса комплексообразования | 1988 |
| Харт, Джорджина C | к.э.н. | Металлирование-алкилирование пиперидинооксазолинов, производных валина, через дипольно-стабилизированные анионы | 1988 |
| Келл-Андерсон, Карон | M.S. | Алюминий способствует рацемизации аспарагиновой кислоты в белке мозга: молекулярная основа нейротоксичности, вызванной алюминием | 1988 |
| Обенг, Яу Самуэль | Ph.Д. | Неконтинуальные вклады в энергетику оптически индуцированного внутримолекулярного переноса электрона | 1988 |
| Payan, Iris Llovanni | к.э.н. | Дефектные остатки аспартила в белках головного мозга человека | 1988 |
| Бойет, Скотт Мартелл | к.э.н. | Кажущаяся молярная теплоемкость разбавленных растворов метанола от 298 до температур, приближающихся к критической температуре | 1987 |
| Chemburkar, Radhika | М.С. | Химические изменения, включающие рацемизацию и сшивание пищевых белков во время их обработки | 1987 |
| Chemburkar, Sanjay R | к.э.н. | Образование и циклизация ионов нитрилия из амидов и синтез хиральных аминов | 1987 |
| Delgado, Milagros | к.э.н. | Спиновое распределение и связывающие свойства макроциклических комплексов полиэфир-металл и производных циклоктатетраена: E.S.R. Исследования | 1987 |
| Ghosal, Сасвати | M.S. | Новые реакции алкинов, алкенов и аренов под действием медных, никелевых и ртутных реагентов | 1987 |
| Goicoechea-Pappas, Marta Elena | Д.А. | Хиральные оксазолины как вспомогательные вещества для стереоселективного алкилирования 1,2,3,4-тетрагидроизохинолинов | 1987 |
| Густовски, Дебора Энн | Ph.Д. | Влияние катионов на электрохимию краун-эфиров, лариат-эфиров и подандов | 1987 |
| Ким, Мин Сук | к.э.н. | Исследования, направленные на изготовление синтетических катионпроводящих каналов | 1987 |
| Ньевес, Хайме Энрике | к.э.н. | ЭПР-исследования распределения спинов и связывания катионов в органических и биологических системах | 1987 |
| Нолан, Стивен Патрик | Ph.Д. | Термохимические исследования растворов органо-молибденовых комплексов | 1987 |
| Белый, Банита Дошия | к.э.н. | Синтезы, связывание катионов и структурные свойства азотсодержащих эфиров лариата | 1986 |
| Холл, Джон Харви | к.э.н. | Реакции изомеризации по связям комплексов кобальта (III) | 1985 |
| Ланкфорд, Джеймс I, младший | Ph.Д. | Термодинамические свойства электролитов в метаноле и диметилсульфоксиде | 1985 |
| Лиан, Норман Д. | M.S. | Протокол чистоты, выщелачивание и набухание гидрогелей 2-гидроксиэтилметакрилата / метакриловой кислоты в воде, электролитах и органических растворителях | 1985 |
| Lopez de la Vega, Ramon | к.э.н. | Нуклеофильная атака на органонитрильные комплексы пентаамминкобальта (III) | 1985 |
| Salimon, Jumat Bin | М.С. | Влияние металлов на переход форбида в порфирин в диагенезе хлорофилла | 1985 |
| Триай, Инес Рамона | к.э.н. | Метод оценки кинетических параметров гетерогенного переноса электрона с использованием методов интегралов свертки | 1985 |
| LeGault, Майкл | M.S. | Измерение коэффициента теплового расширения полистирольных суспензий | 1983 |
| Ланг, Валери Илона | М.С. | Газофазный фотолиз 2-метил-1,3-бутадиена при 123,6 нм | 1982 |
| Браун, Честер Вал | M.S. | Калориметрические и дилатометрические исследования структурных свойств и релаксации вицинальной воды | 1981 |
| Cianci, J Jeffrey | M.S. | Температурные аномалии в вицинальной воде, исследованные методом ДСК (дифференциальная сканирующая калориметрия) | 1981 |
| French, Raymond N | Ph.Д. | Объемы и теплоемкости неэлектролитов и органических электролитов в метаноле при 25 | 1981 |
| Снелл, Кеннет Д. | к.э.н. | Хлоридное ингибирование электроокисления этанола на платиновом электроде в кислых и нейтральных водных растворах | 1981 |
| Термин, Энрико Джон | к.э.н. | Прямые и перегруппированные катионные циклизации алкенилоксимов | 1981 |
| Трусделл, Джоэл Уильям | М.С. | Влияние адсорбции серосодержащих полимеров на коррозию низкоуглеродистой стали в соленой воде | 1981 |
| Викториано Мария Елена | к.э.н. | Кинетические исследования электронного переноса изомерных комплексов кобальта (III): изомеры связи и геометрические изомеры | 1981 |
| Эллис, Вальтер Роберт | M.S. | Реакции координированных нитрилов | 1980 |
| Линь, Энь-чжу | М.С. | Анодное окисление гидразонов | 1980 |
| Палмер, Мигель | M.S. | Реакция Меервейна-Понндорфа-Верлея диметилсульфоксида | 1980 |
| Дикнайдер, Труди Энн | к.э.н. | Этилбензол-a-D: синтез, оптическое вращение и перенос протона в газовой фазе; синтез селективно дейтерированных алкилсульфоксидов | 1979 |
| Дордик, Роберт Стюарт | Ph.Д. | О вязкости водных растворов электролитов: отдельных солей и их смесей | 1979 |
| Ferrer-Vinent, Игансио Хавьер | к.э.н. | Электрохимические исследования электродов металл-оксид металла переходного ряда в плавленом нитрате калия | 1979 |
| Хендрикс, Льюис Роу | M.S. | Анализ кислородсодержащих углеводородов в сложных газовых смесях методом газовой хроматографии: технико-экономическое обоснование | 1979 |
| Пендлтон, Танис S | Ph.Д. | Фотолиз транс- и цис-1,2-диметилциклопропана в вакууме ультрафиолетом | 1979 |
| Barrio, Gladys A | к.э.н. | Термодинамические свойства электролитов в этиленгликоле и других неводных растворителях | 1978 |
| Etzler, Frank M | к.э.н. | Роль воды в биологических процессах | 1978 |
| Lage, Gladys A Barrio | Ph.Д. | Термодинамические свойства электролитов в этиленгликоле и других неводных растворителях | 1978 |
| Pappatheodorou, София | к.э.н. | Директивное действие добавок реактива Гриньяра к конъюгированным карбонильным соединениям | 1978 |
| Викториано Мария Елена | M.S. | Исследование газофазного изотопного эффекта отрыва протонов из монодейтерированных толуолов | 1978 |
| Delgado, Эйлин Виктория | Ph.Д. | Нуклеофильные реакции гемин-мицеллярных систем: кинетическое, спектральное и равновесное исследование | 1977 |
| Диас, Заида | к.э.н. | Вакуумный ультрафиолетовый фотолиз тетрагидрофурана и 1,2-бутадиена | 1977 |
| Гудман, Полетт Энн | к.э.н. | Окисление ферропротопорфирина IX, растворенного в мицеллах ПАВ | 1977 |
| Уртадо, Рикардо Марсель | М.С. | Ионная селективность вицинальной воды в порах силикагеля | 1977 |
| Мартин, Роберто | к.э.н. | Флуоресценция бензойной кислоты | 1977 |
| Зелмер, Памела Пакстон | к.э.н. | Реакции элиминирования аминокислот: реакция дегидрохлорирования комплекса B-хлораланин-медь (II), вызванная основанием | 1977 |
| Bordeaux, William Harllee, Jr | Д.A | Использование методов органического анализа потребительских товаров: проект | 1976 |
| Крамер, Дэвид Аллан | к.э.н. | Кинетика коррозии меди в водных растворах аминокислот и карбоновых кислот | 1976 |
| Маенпа, Фрэнсис Чарльз | к.э.н. | Нуклеофильные реакции гемин-мицеллярных и гем-мицеллярных систем: кинетическое, спектральное и равновесное исследование | 1976 |
| Pasztor, Andrew J | Ph.Д. | Кажущаяся мольная теплоемкость и кажущийся мольный объем электролитов в безводном метаноле при различных температурах | 1976 |
| Шин, Чарльз Чун-Хо | к.э.н. | Парциальные мольные теплоемкости бромидов тетраалкиламмония в воде и метаноле при различных температурах | 1976 |
| Уильямсон, Томас R | к.э.н. | Электродная система Pt / PtO / CO {98} 32- / CO {98} 2 в расплавленном щелочно-нитратном растворителе | 1976 |
| Оатис, Джон Эдвард | Ph.Д. | Влияние заместителей на константы взаимодействия азот-15-водород в оксимах / синтез стирилхиноксалинов | 1975 |
| Allaway, Джеймс Реддинг | к.э.н. | Эффекты и ориентация изотопов дейтерия в реакциях бимолекулярного элиминирования | 1974 |
| Боган, Майкл Дин | M.S. | Параметры, влияющие на измерение потенциалов, возникающих при замерзании разбавленных водных растворов электролитов | 1974 |
| Чемблесс, Уильям Генри, младший | Ph.Д. | Исследования альфа-аминоалкансульфоновых кислот и родственных соединений, содержащих геминальный азот и серу на углероде | 1974 |
| Фернандес, Карлос Грегорио | к.э.н. | Медь-оксидно-медный электрод в плавленых щелочно-нитратных расплавах | 1974 |
| Морено, Генри Рене | к.э.н. | Синтезы некоторых 2-, 6- и / или 7-замещенных хиноксалиновых соединений в качестве потенциальных противомалярийных средств | 1974 |
| Оганян, Майкл Грегори | Ph.Д. | Электропроводность и термодинамические параметры перхлората аммония | 1974 |
| Швенцер, Кэтрин Сара | к.э.н. | Кинетическое, спектральное и равновесное исследование гемин-мицеллярных систем с различными нуклеофилами | 1974 |
| Уэбб, Чарльз Алан | к.э.н. | Исследование поляризационного сопротивления кинетики коррозии меди в водных растворах хлоридов и аминокислот | 1974 |
| Кантильо, Адриана Иоланда | М.С. | Спектры поглощения воды в растворах и кристаллах в ближней инфракрасной области | 1973 |
| Фишер, Джордж Гарольд, младший | к.э.н. | Синтез и стереохимия замещенных тетрагидрохиноксалинов | 1973 |
| Юнгк, Джон Р | к.э.н. | Олигомеризация мононуклеотидов в безводной, водной и гипогидросодержащей среде: экспериментальный поиск аналогов протобиогенеза нуклеиновых кислот | 1973 |
| Лопес, Энкарнасьон | Ph.Д. | Вакуумно-ультрафиолетовый (ВУФ) фотолиз этилциклопропана и винилциклопропана | 1973 |
| Радак, Стивен | к.э.н. | Спектры неорганических кристаллогидратных систем | 1973 |
| Вебер, Артур L | к.э.н. | Аминоацилирование гомополирибонуклеотидов N- (аминоацил) имидазолами | 1973 |
| Бинкевич, Джозеф Барнард | M.S. | Газофазный фотолиз 1,1-диметилциклопропана при 253,7 нм, 147,0 нм, 123,6 нм и 106,7 нм | 1972 |
| Ту, Чингкуанг | к.э.н. | Вакуумный ультрафиолетовый фотолиз циклопентена и метиленциклобутана ниже и выше их потенциала ионизации | 1972 |
| Чиу, Тай-Ву | к.э.н. | Исследование образования кислотно-основных комплексов Льюиса в растворе с помощью диэлектрических измерений | 1971 |
| Феррер, Игнасио Хавьер | М.С. | Спектры комплексов меди, никеля и кобальта в тройной нитратной эвтектике и в расплавах нитрата аммония | 1971 |
| Гольдштейн, Марк К | к.э.н. | Компьютерное моделирование дефектов перхлората аммония | 1971 |
| Миклус, Майкл Джон | к.э.н. | Стереохимия восстановления циклических кетонов Меервейна-Понндорфа-Верлея | 1971 |
| Zapico, Silvia C | М.С. | Стереоселективные реакции комплексов Cu (II) -аминокислот | 1971 |
| Богданский, Симон | к.э.н. | Спектральные свойства комплексов медь (II) — аминокислоты | 1970 |
| переулок, Уильям Бартлетт, | к.э.н. | Шкала кислотности плавленого нитрата калия | 1970 |
| Мастроянни, Мартин | к.э.н. | Парциальные мольные теплоемкости выбранных электролитов в воде и метаноле при различных температурах | 1970 |
| Зигмунд, Роберт Фред | Ph.Д. | Кинетика термического разложения перхлората аммония | 1970 |
| Чанг, Сянь-Синь | M.S. | Реакции окисления и элиминирования эфиров арилсульфоновой кислоты в диметилсульфоксиде | 1969 |
| Папас, Энтони Джон | к.э.н. | Координационные соединения замещенных пиридин-1-оксидов с солями ртути (II) | 1969 |
| Villa, Хуан Франциско | Ph.Д. | Взаимодействие солей металлов с органическими изоцианатами и изотиоцианатами | 1969 |
| Франко, Николас Бенджамин | к.э.н. | Синергетический катализ разложения нитрата аммония | 1968 |
| Гендлер, Пол L | M.S. | Окисление нитробензолсульфонатов диметилсульфоксидом | 1968 |
| Герчаков, Шломо М | к.э.н. | Синтезы некоторых N- (2-хиноксалоил) -аминокислот и N- (2-хиноксалоил) -дипептидов, относящихся к хиноксалиновым антибиотикам | 1968 |
| Цо, Ман-Инь Вонг | М.С. | Термодинамические свойства ионов с высокой плотностью заряда в N-замещенных формамидах | 1968 |
| Brockington, James W | M.S. | Синергетический катализ разложения нитрата аммония ионами меди и хлорида | 1967 |
| Даути, Раймонд Алан | к.э.н. | Синтез и дезаминирование цис- и транс-3-изопропилциклобутиламина | 1967 |
| Морехон, Клара Баез | М.С. | Сравнение физических свойств N-метил-, N-триметилсилилацетамида и N, O-бис (триметилсилил) ацетамида | 1967 |
| Tso, Wung Wai | M.S. | Газофазное взаимодействие алкилгалогенидов и алкиламинов | 1967 |
| Waldinger, Ronda White | M.S. | Колебания кислотности и содержания воды при катализируемом хлоридом разложении нитрата аммония | 1967 |
| Wilcox, Floyd L, Sr | М.С. | Электрометрические измерения в плавленых нитратах щелочных металлов | 1967 |
| Фефер, Энрике | M.S. | Термодинамические свойства некоторых гидроксидов алкил- и фторалкилртути (II) | 1966 |
| Notz, Karl Joseph, Jr | к.э.н. | Электрометрические измерения в плавленом нитрате аммония | 1966 |
| Сото, Аида Рафаэла | к.э.н. | Реакции сульфонатных эфиров в диполярных апротонных растворителях, промотированные основанием | 1966 |
| Папас, Энтони Джон | М.С. | Взаимодействие пиридин-N-оксида с галогенидами ртути (II) | 1965 |
| Pappatheodorou, София | M.S. | Исследование образования олефинов из спиртов и солей платины | 1965 |
| Villa, Хуан Франциско | M.S. | Взаимодействие пиридин-N-оксида с солями ртути (II) | 1965 |
| Fearnow, Philip W | M.S. | Исследования индукционного периода разложения нитрата аммония под действием хлоридов | 1964 |
| Колвин, Клер Иван | Ph.Д. | Исследования механизма разложения нитрата аммония, катализируемого хлоридом | 1963 |
| Айенгар, Р. Доресвами | к.э.н. | Разложение закиси азота на катализаторах хрома на оксиде алюминия | 1963 |
| Брилл, Эрл | к.э.н. | Стереоспецифический синтез цис- и транс-dl-декагидрохиноксалинов | 1962 |
| Димитриад, Василий | Ph.Д. | Термическое разложение нитрата аммония и его катализ хлоридом натрия | 1962 |
| Granito, Charles E | M.S. | Получение алкилфенилкетонов и родственных соединений | 1962 |
| Кирби, Джон A | M.S. | Исследования ферроцена | 1962 |
| Брилл, Эрл | M.S. | Декагидрохиноксалин-2-он | 1958 |
| Brisker, Morton Sherman | М.С. | Разделение полисульфированных фталоцианинов | 1958 |
| Burnham, Daniel A | M.S. | Плотности, вязкости, показатели преломления и поверхностное натяжение бинарной жидкой системы гексаметилдисилоксан-бензол | 1958 |
| Розенталь, Герман Аллан | M.S. | Инфракрасные спектры серии триметил-н-алкилсилазанов | 1958 |
| Суассон, Дональд Джуд | М.С. | Синтез 3-метил-6-карбэтоксихиноксалинола-2 и 3-метил-7-карбэтоксихиноксалинола-2 | 1958 |
| Scheuplein, Роберт Джон | M.S. | Облучение разбавленных растворов цистеина | 1956 |
| Хостеттлер, Джеймс Б. | M.S. | Исследование водосорбционных характеристик силикагеля, активированного оксида алюминия и безводного сульфата кальция | 1955 |
| Хубингер, Генри | М.С. | Исследование получения 2-гидрокси-3-метил-6-карбоксихинолина | 1955 |
| Руп, Уолтер Э | M.S. | Электроосаждение молибдена | 1955 |
| Райт, Ширли Джин | M.S. | Сольволиз бутилбромида в смесях метанол-вода | 1955 |
| Генс, Теодор А | M.S. | Хиноксалиновый аналог птероилглутаминовой кислоты | 1953 |
| Голдвебер, Мортон I | М.С. | Синтез и исследование 2-гидрокси-3-алкилхиноксалинов | 1953 |
| Циммерман, Аарон Х. | M.S. | Получение галогенового промежуточного продукта для синтеза аналогов птероевой кислоты | 1953 |
| Мур, Эрл Филлип, младший | M.S. | Физические свойства некоторых пропил- и изопропилсилазанов | 1952 |
| Мунк, Мортон E | M.S. | Получение несимметрично замещенных хиноксалинов: синтез 1,2,3,4-тетрагидро-2,6-диметилхиноксалина и 1,2,3,4-тетрагидро-2,7-диметилхиноксалина | 1952 |
| Блэкберн, Уильям A | М.С. | Исследования получения 2-гидрокси-3-метил-6- и 7-карбоксихиноксалина | 1951 |
| Макгуайр, Джон М. | M.S. | Характеристика пористого стекла как хроматографического сорбента | 1951 |
| Паттон, Роберт Гувер | M. |
 Профессионалы рекомендуют всегда хранить инструмент в ультрафиолетовом стерилизаторе, в котором установлены специальные бактерицидные лампы.
Профессионалы рекомендуют всегда хранить инструмент в ультрафиолетовом стерилизаторе, в котором установлены специальные бактерицидные лампы.