Тесты: Санитарно — противоэпидемиологический режим
Раздел: Санитарно — противоэпидемиологический режим
1. Пути передачи внутрибольничной инфекции:
а) парентеральный
б) контактный
в) воздушно-капельный
г) фекально-оральный
д) биологический
е) химический
2. Санитарно-противоэпидемиологический режим означает проведение комплекса мероприятий:
а) по профилактике экзогенных интоксикаций
б) направленных на пропаганду «Здорового образа жизни»
в) по профилактике внутрибольничной инфекции
3. Срок наблюдения за контактными при менингите:
а) 10 дней
б) 7 дней
в) 35 дней
г) 1 месяц
4. Срок наблюдения за контактными при брюшном тифе:
а) 21 день
б) 35 дней
в) 6 месяцев
5. При подозрении на дифтерию мазок берется:
а) из слизистой зева и носа
б) только из слизистой носа
в) только из слизистой зева
6.
а) 1% раствором хлорамина
б) 3% раствором хлорамина
в) только 5% раствором хлорамина
7. Камерная дезинфекция белья, одежды пациента проводится при:
а) обнаружении вшей
б) общем загрязнении
в) госпитализации пациента
8. Срок наблюдения за контактными с больным дизентерией:
а) 10 дней
б) 7 дней
в) 21 день
9. Сухую хлорную известь используют для обработки:
а) туалетов
б) оформленного кала
в) жилых помещений
г) рвотных масс и испражнений
10. Контактным с больными вирусным гепатитом вводится:
а) гамма — глобулин
б) интерферон
в) сыворотка
11. Факторы передачи при гепатите «В»:
а) кровь
б) сперма
в) медицинский инструментарий
г) продукты питания
д) воздух
12. Инкубационный период гепатита «В»:
а) 35 дней
б) 6 месяцев
в) 2 месяца
13. Постельные принадлежности пациента вирусным гепатитом подлежат:
Постельные принадлежности пациента вирусным гепатитом подлежат:
а) камерной дезинфекции
б) стирке в прачечной
в) дезинфекции в 2% растворе соды
14. Факторы передачи гепатита «А»:
а) пищевые продукты, загрязненные выделениями больного
в) шприцы, медицинский инструментарий
15. Пути передачи гепатита «В»:
а) половой
б) парентеральный
в) фекально-оральный
г) аспирационный
16. Источник инфекции при гепатите «В»:
а) медицинский инструментарий
б) больной гепатитом
в) вирусоноситель
г) кровь
17. Предметы ухода за пациентами вирусным гепатитом можно обеззараживать:
а) путем двукратного протирания ветошью, смоченной в 3% растворе хлорамина
б) однократным протиранием ветошью, смоченной в 3% растворе хлорной извести
18. Пути передачи гепатита «А»:
б) парентеральный
в) фекально-оральный
19. Инкубационный период гепатита «А»:
Инкубационный период гепатита «А»:
а) 35 дней
б) 6 месяцев
в) 1 год
20. Текущая уборка процедурного кабинета проводится:
а) не менее 2 раз в сутки
б) перед началом работы, 1 раз в день
21. Смена халата медицинской сестры процедурного кабинета должна проводиться:
а) ежедневно
б) 2 раза в неделю
в) 1 раз в неделю
22. Стерильный стол в процедурном кабинете накрывается:
а) перед началом работы, на одну смену
б) накануне вечером
23. При повреждении кожи рук медсестры, во время манипуляции проводимой ВИЧ-инфицированному, необходимо:
а) выдавить кровь из раны, обработать рану 5% спиртовым раствором йода
б) обработать рану 5% спиртовым раствором йода
в) обработать рану 0,05% раствором марганцовокислого калия
24. Изделия однократного применения подлежат дезинфекции в растворе:
а) 5% хлорамина
б) 6% перекиси водорода
в) 0,5% нейтрального гипохлорида калия
г) 3% хлорамина
25. После забора крови, медицинская сестра промыла инструменты под проточной водой:
После забора крови, медицинская сестра промыла инструменты под проточной водой:
а) действие медсестры правильное
б) действие медсестры неправильное
а) дезоксон — 1 (1%) в течение 45 минут
б) глютаровый альдегид 2,5% при температуре 18°-20°С в течение 6 часов
в) 3% перекись водорода — 6 часов
27. Срок хранения стерильных изделий в асептических условиях без упаковки:
а) 6 часов
б) 3 суток
в) 20 суток
28. Срок хранения изделий в упаковке из бумаги мешочной влагопрочной:
а) трое суток
б) двадцать суток
в) одни сутки
29. Раствор Дезоксона-1 для стерилизации можно применять:
а) в течение 24 часов
б) однократно
в) до изменения окраски раствора
30. Наименование объектов при химическом методе стерилизации:
а) шприцы, иглы, хирургические инструменты
в) изделия из металла, стекла
г) резина, полимерные материалы
д) хлопчатобумажная ткань
31. Срок хранения стерильности изделий простерилизованных в биксах без фильтра:
Срок хранения стерильности изделий простерилизованных в биксах без фильтра:
а) 3 суток
б) 1 день
в) 20 суток
32. Срок хранения стерильности изделий простерилизованных в двойной мягкой упаковке из бязи:
а) 3 суток
б) 1 день
в) 20 суток
33. Срок хранения стерильности изделий простерилизованных в бумаге мешочной влагопрочной:
а) 3 суток
б) 6 суток
34. Химический контроль стерилизации- при режиме 132°С — 20 минут — 2 атмосфер:
а) мочевина
б) никотинамид
в) ТВИИС — 132°С
г) бензойная кислота
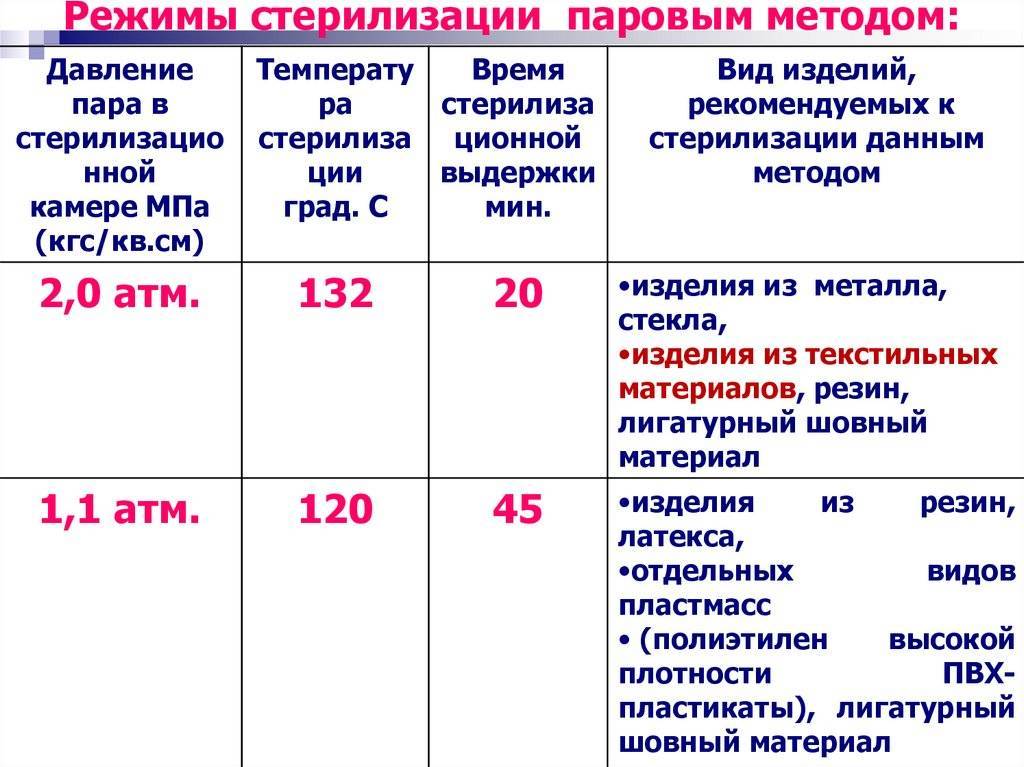
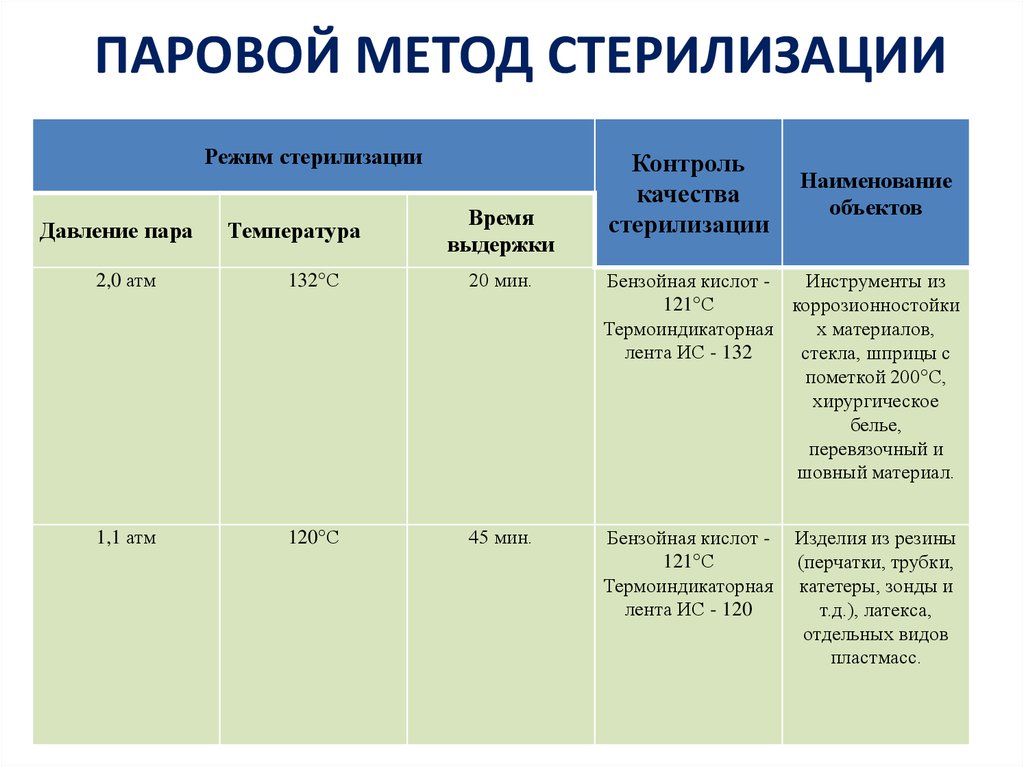
35. Режимы при паровом методе стерилизация:
а) 2 атм. 132°С — 20 минут
б) 1,1 атм. — 120°С — 45 минут
в) 160°С — 2,5 часа
г) 180°С — 1 час
36. Объекты стерилизации при паровом методе стерилизации:
а) изделия из металла, стекла
б) резиновые перчатки
в) текстильный материал
г) изделия из полимерных материалов
д) только изделия из хлопчатобумажной ткани
37. Медсестра простерилизовала шприцы воздушным методом в открытом виде. Тактика медсестры:
Медсестра простерилизовала шприцы воздушным методом в открытом виде. Тактика медсестры:
а) правильная
б) неправильная
38. Воздушный метод стерилизация проводится в:
а) автоклаве
б) сухожаровом шкафу
в) в специальном помещении при t=100°С
39. Изделия, простерилизованные без упаковки используются:
а) непосредственно после стерилизации
б) в течение суток, в асептических условиях
40. Методы стерилизации:
а) паровой
б) воздушный
в) химический
г) газовый
д) механический
41. Воздушный метод стерилизации применяется для изделий из:
а) металла
б) хлопчатобумажной ткани
в) стекла
г) силиконовой резины
42. Азопирамовая проба, ставится:
а) на горячих инструментах
б) при температуре окружающей среды свыше 30°С
в) при комнатной температуре
43. Пригодность рабочего раствора азопирама проверяют нанесением:
а) 2-3 капель раствора на кровяное пятно
б) 2-3 капель раствора на стерильный ватный шарик
44. Для постановки фенолфталеиновой пробы готовят:
Для постановки фенолфталеиновой пробы готовят:
а) 1% спиртовой раствор фенолфталеина
б) 5% спиртовой раствор фенолфталеина
45. Рабочий раствор азопирама готовят:
а) непосредственно перед постановкой пробы
б) накануне, за день до постановки пробы
46. Рабочий раствор азопирама готовится смешиванием равного количества:
а) азопирама
б) 3% перекиси водорода
в) 5% спиртового раствора амидопирина
47. Рабочий раствор азопирама может быть использован в течение:
а) 1-2 часов
б) 24 часов
в) 7 дней
48. Мойка каждого изделия в моющем растворе проводится в течение:
а) 0,5 минут (30 секунд)
б) 1 минуты (60 секунд)
49. Ополаскивание инструментов проточной водой после моющего средства «Биолот» проводится
а) 3 минуты
б) 5 минут
в) 10 минут
50. Ополаскивание изделий медицинского назначения под проточной водой после моющих средств «Лотос», «Лотос -автомат» проводится в течение:
а) 10 минут
б) 3 минуты
в) 5 минут
51. При предстерилизационной очистке мед. инструментария замачивание в моющем средстве проводится:
При предстерилизационной очистке мед. инструментария замачивание в моющем средстве проводится:
а) при полном их погружении в раствор
б) в зависимости от вида моющего средства
52. Режим предстерилизационной очистки при применении моющего средства «Лотос»:
а) 50°С — 15 минут
б) 40°С — 15 минут
в) 60°С — 10 минут
53. Моющий раствор подлежит замене:
а) при изменении его окраски
б) каждые три часа
в) при снижении температуры ниже 50°С
54. Температура моющего раствора во время замочки инструментария:
а) поддерживается в пределах 40°-50°С
б) не поддерживается
в) поддерживается в зависимости от вида моющего средства
55. Ополаскивание шприцев и игл под проточной водой от моющего раствора проводится:
а) в зависимости от вида моющего средство от 3 до 10 минут
б) в течение 10 минут
56. Наличие остатком моющих средств на инструментах проверяется с помощью:
а) фенолфталеиновой пробы
б) азопирамовой или амидопириновой пробы
57. Положительная реакция на наличие скрытой крови дает:
Положительная реакция на наличие скрытой крови дает:
а) розовое окрашивание
б) сиренево-фиолетовое окрашивание
58. Для приготовления моющего раствора из средства «Биолот»:
а) используется 3%перекись водорода
б) перекись водорода не используется
59. Азопирамовая проба проводится для определения остатков:
а) крови
б) гноя
в) хлора
г) моющего средства
60. Для приготовления 1 литра моющего средства «Зифа» необходимо:
а) 5 гр. порошка и 995 мл воды
б) 50 гр. порошка и 950 мл воды
61. Моющий раствор с использованием средства «Зифа» может быть использован:
а) дважды в течение рабочей смены, если его внешний вид не изменился
б) до 6 раз, если внешний вид раствора не изменился
62. Срок годности моющего раствора из средства «Зифа»:
а) рабочая смена (6 часов)
б) 12 часов
в) 24 часа
63. Дезинфекция шпателей проводится кипячением в:
а) 2% содовом растворе — 15 мин.
б) дистиллированной воде — 30 мин
в) 1% хлорамине — 15 минут
64. Дезинфекция медицинских термометров проводится в растворе:
а) 0,5% хлорамина — 30 минут
б) 2% хлорамина — 5 минут
в) 2,5% раствор хлоргексидина — 30 минут
г) 6% перекиси водорода — 60 минут
65. Дезинфекция резиновых грелок, пузырей для льда проводится:
а) двухкратным протиранием ветошью, смоченной 1% хлорамином с интервалом 15 минут
б) однократным протиранием ветошью, смоченной 3% хлорамином
66. Наконечники для клизм обеззараживаются в растворе:
а) 3% хлорамина — 60 мин
б) 2% питьевой соды — кипячением в течение 15 мин
в) 0,05% нейтрального анолита 30 мин
г) 4% перекиси водорода — 90 минут
д) 3% перекиси водорода — 15 минут
67. После дезинфекции наконечники промываются и подвергаются:
а) предстерилизационной очистке
б) стерилизации
68. Нейтральный анолит, Виркон, Лизетол можно использовать:
а) для дезинфекции и предстерилизационной очистки
б) только для дезинфекции
69. Химический метод дезинфекции изделий медицинского назначения:
Химический метод дезинфекции изделий медицинского назначения:
а) 70% спирт — 30 мин.
б) 6% перекись водорода — 60 минут
в) 70% спирт — 60 минут
г) 3 % перекись водорода- 60 минут
70. Концентрация раствора и время дезинфекции при применении «Деохлор»:
а) таблетка на 10 литров воды — 60 мин
б) 1 таблетка на 1 литр воды — 30 мин
71. «Деэоформ» и «Бланизол» могут быть применены для:
а) одновременной дезинфекции и предстерилизационной очистки
б) одномоментного проведения всех этапов обработки медицинского инструментария
72. Режим дезинфекции изделий медицинского назначения дезинфицирующим агентом «Пресепт»:
а) 0,1% — 90 минут
б) 0,5% — 90 минут
в) 1% — 60 минут
73. Дезинфекция медицинского инструментария средством «Сайдекс» проводится при режиме:
а) 2% — 15 минут
б) 2% — 60 минут
в) 2% — 20 минут
74. Инструменты из металла, изделия из стекла можно дезинфицировать:
а) сухим горячим воздухом при режиме 120°С — 45 минут
б) сухим горячим воздухом при режиме 160°С — 2,5 часа
75. Дезинфекция инструментария сухим горячим воздухом проводится:
Дезинфекция инструментария сухим горячим воздухом проводится:
а) без упаковки (на лотках), в воздушном стерилизаторе
б) только в упаковке из бязи, в воздушном стерилизаторе
76. Химический метод дезинфекции медицинского инструментария проводится в:
а) закрытых емкостях из стекла, пластмассы
б) открытых емкостях, покрытых эмалью
в) закрытых емкостях, покрытых эмалью
77. Инструменты из металла, изделия из стекла, резины можно дезинфицировать:
а) кипячением
б) замачиванием в моющем средстве Лотос, Биолот
78. Уничтожение болезнетворного начала на различных объектах внешней среды — это:
а) дезинфекция
б) стерилизация
в) асептика
г) антисептика
79. Влажная уборка помещений стационара должна проводиться не менее:
а) 2 раз в сутки с применением дезинфицирующих средств
б) 3 раз в сутки с применением моющих средств
в) одного раза с применением дезинфицирующих средств
80. 3% раствор хлорной извести готовится из трех литров маточного раствора из:
3% раствор хлорной извести готовится из трех литров маточного раствора из:
а) воды до 10 литров
б) воды до 3 литров
81. Источник инфекции при сыпном тифе:
а) зараженные вши
б) постельное белье пациента
в) больной человек
г) выделения больного
82. Контактные с больным гепатитом «В» подлежат наблюдению в течение:
а) 6 месяцев
б) 35 дней
83. Источником инфекции при гепатите «А» является:
а) больной человек
б) столовая посуда
в) предметы ухода
84. Столовая и чайная посуда больного вирусным гепатитом обеззараживается путем:
а) кипячения в 2% растворе пищевой соды в течении 15 минут
б) замачивания в 3% растворе хлорамина на 30 минут
в) замачивания в 3% растворе хлорамина на 60 минут
85. Остатки пищи, больного гепатитом засыпают сухой хлорной известью в соотношении:
а) 1:5
б) 1:2
86. Генеральная уборка процедурного кабинета проводится:
а) 1 раз в неделю
б) 1 раз в 10 дней
87. Генеральная уборка процедурного кабинета проводится:
Генеральная уборка процедурного кабинета проводится:
а) 5% раствором хлорамина
б) 6% перекисью водорода с добавлением 5 гр. моющего средства на 1 литр перекиси водорода
в) 3% раствором хлорамина
88. Выбор метода стерилизации зависит от:
а) особенностей стерилизуемого изделия
б) степени загрязненности изделия
89. Моющий раствор может подогреваться до 6 раз при использовании порошка:
а) Лотос, Лотос — автомат
б) Айна, Астра, Маричка
в) Зифа
г) Луч
Стерилизация. Виды, методы — презентация онлайн
1. Стерилизация. Виды, методы. Преподаватель: Малайчина О.В.
2. Нормативный документ
ОСТ 42-21-2-85Стерилизация и дезинфекция
изделий медицинского
назначения.
Методы, средства и режимы.
3. Стерилизация
– полное уничтожение всехвидов микроорганизмов и их
спор на поверхности и внутри
различных предметов, а также
в жидкостях и воздухе.
Стерилизации должны подвергаться все
предметы, соприкасающиеся с раневой
поверхностью, контактирующие с кровью
или инъекционными препаратами, а также
отдельные виды диагностической
аппаратуры, которые в процессе
эксплуатации соприкасаются со слизистыми
оболочками и могут вызвать их повреждение.

Стерилизация изделий медицинского
назначения в МО– сложный
многоступенчатый процесс, состоящий
из нескольких этапов, каждый из которых
определяет качество стерилизации:
• предварительная дезинфекция и
обработка изделий на местах
использования (в процедурных,
операционных, перевязочных и пр.)
• предстерилизационная
очистка изделий
ЦСО
• стерилизационная упаковка
• стерилизация
6. Структура централизованного стерилизационного отделения (ЦСО)
Биксы стерильныеВ современных МО организованы
централизованные стерилизационные
отделения (ЦСО), в которых проводят:
Предстерилизационную обработку
медицинского инструментария
Стерилизацию:
изделий медицинского назначения
белья и перевязочного материала
10. Задачи ЦСО
• обеспечение лечебных отделений(МО) стерильными
медицинскими изделиями
• внедрение в практику
современных эффективных
методов предстерилизационной
обработки и стерилизаци
ЦСО должно иметь две зоны:
нестерильную и стерильную.

В нестерильную зону входят «грязная»
и «чистая».
«Грязная» зона включает:
помещения для приема и разборки
медицинских изделий
моечную – помещение предназначено для
проведения ПСО изделий
вспомогательные помещения – гардероб,
комната отдыха и приема пищи персонала,
душевые
«Чистая» зона – это зона, где
производятся:
сушка
контроль качества очистки
разбор, сортировка, составление
наборов
упаковка и подготовка к стерилизации
изделий
13. Стерильная зона
включает в себя:разгрузочную сторону паровых,
суховоздушных и других
стерилизаторов
склад стерильных материалов
При планировании помещений
целесообразно предусмотреть
организацию двух потоков обработки:
• 1-й поток – обработка и стерилизация
инструментов, резиновых изделий.
• 2-й поток – подготовка и стерилизация
белья и перевязочного материала.
ЦСО оборудуют приточно – вытяжной
вентиляцией и бактерицидными
лампами.

16. Предстерилизационная очистка (ПСО) изделий медицинского назначения Второй этап обработки инструментов
ПСО служит для очистки изделиймедицинского назначения от
белковых, жировых, кровяных,
лекарственных и прочих
загрязнений.
Качество ПСО напрямую влияет на
качество стерилизации.
17. Этапы ПСО (ручной способ):
• Замачивание инструментов медицинскогоназначения в моющем растворе 15 минут
• Механическая обработка с помощью ерша,
ватного тампона (каждый по 30 сек.) не
вынимая из раствора, иглы чистить
мандреном
• Промывание под проточной водой при
использовании СМС «Биолот» — 5 мин., другие
7-10 минут («Астра», «Прогресс»)
• Промывание в дистилированной воде 30
секунд
• Высушивание в сухожаровом шкафу (85 0) до
полного исчезновения влаги
• Контроль ПСО
Качество предстерилизационной
очистки проводят пробами:
на остатки крови, дезинфектантов, СМС,
ржавчины
— азопирамовая — универсальная
— фенолфталеиновая – на наличие
остатков СМС
— амидопириновая — на остатки крови
— судан 3 — на наличие жировых и
белковых остатков
19.
 Оценка результата • На контролируемое изделие наносят 2-3 капли реактива и
Оценка результата • На контролируемое изделие наносят 2-3 капли реактива ипротирают его тампоном. При положительной азопирамовой пробе
возникает фиолетовое окрашивание, быстро, в течение нескольких
секунд, переходящее в розово- сиреневое и буроватое. Окрашивание,
наступившее позже чем через 1 минуту, не учитывается. Буроватое
окрашивание появляется при наличии ржавчины и
хлорсодержащих окислителей, в остальных случаях окрашивание
розово- сиреневое.
• Фенолфталеиновая проба при наличии неотмытых компонентов
синтетических моющих средств дает розовое окрашивание.
• При положительной амидопириновой пробе возникает синезеленое окрашивание.
• При положительных пробах вся партия контролируемых
изделий подлежит повторной обработке до получения
отрицательных результатов.
• Результаты контроля отражают по форме №366/У, утвержденной
приказом МЗ СССР 04.10.1980г. №1030 «Журнал учета качества
предстерилизационной обработки».

Контролю подлежат: в ЦСО – 1% от
каждого наименования изделий, но не
менее 3-5 единиц.
В случае положительной пробы
(изменение цвета реактива) всю
партию изделий подвергают
повторной очистке. Результаты
контроля фиксируют в журнале.
В качестве стерилизационной
упаковки Минздравом
разрешено использование
определенных видов
материалов.
Задачи упаковки, содержащей медицинское
изделие:
• Обеспечение прохождения
процесса стерилизации
• Защита от физических
воздействий и
механических
повреждений
стерилизуемого объекта
• Сохранение стерильности
до момента использования
Вскрывать упаковку
необходимо с учетом
правил асептики,
антисептики
• стерилизационные коробки
(биксы) без фильтра –внедренные в
практическое здравоохранение еще в начале
прошлого века. Данный тип имеет
небольшой срок сохранения стерильности –
72 часа
• стерилизационные коробки
(биксы) с антибактериальным
фильтром, стерильность в которых
сохраняется до 20 дней
• одноразовые упаковочные пакеты
(КРАФТ- пакеты)– бумажные (плоские
и со складками), комбинированные бумажноламинатные (пленочные).

Крафт — пакет
• Крафт – пакет заклеенный – срок
стерильности 30 суток;
• Крафт – пакет на скрепах – срок
годности 3 суток
Прозрачные рулоны и пакеты разработаны и
производятся как для упаковки отдельных
небольших инструментов и комплектов, так и
для больших тяжелых инструментов,
комплектов белья. Срок стерильности 1 год
Самоклеющаяся комбинированный
бумажно-ламинатный –
срок стерильности — 6 месяцев.
29. Двойная мягкая упаковка из бязи
Срок стерильности 3 суток• Бумажные и нетканые
оберточные листы
31. Бумажные и нетканые оберточные листы
• Стерилизационныеупаковки из нетканого
материала или бумаги
являются наиболее
подходящими для
больших по объему
лотков с инструментами
для белья. Нетканые
материалы, обладающие
повышенной
прочностью, идеально
подходят для
обертывания тяжелых и
острых изделий.
Импульсный
термосварочный
аппарат
Используют упаковку
комбинированные
бумажно-ламинатные
(пленочные) – срок
стерильности 1 год
35.
 Импульсный термосварочный аппарат Выбор адекватного метода
Импульсный термосварочный аппарат Выбор адекватного методастерилизации зависит от физикохимических и биологических
особенностей стерилизуемого
объекта.
В практике медицинских
организаций наиболее широко
распространены физические
методы стерилизации.
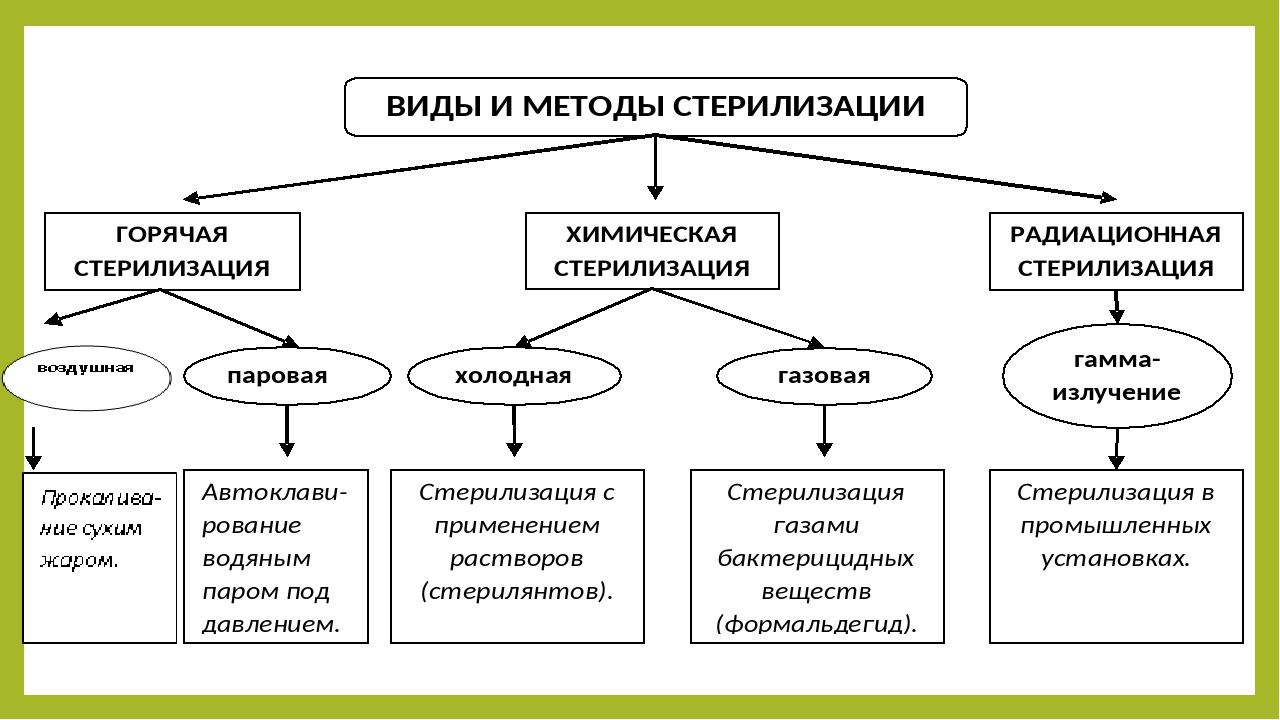
37. Методы стерилизации
ФизическийПаровая
Воздушная
Гласперленовая
Инфракрасная
Химический
• Применение
растворов
химических
средств
• Газовая
стерилизация
Холодная
стерилизация
(промышленная)
• Радиационная
• Плазменная
• Озоновая
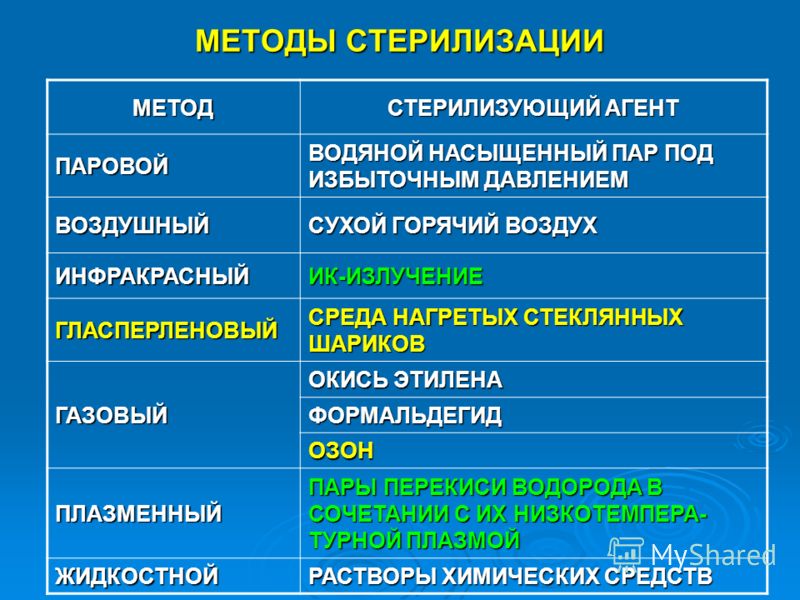
38. Методы стерилизации, разрешенные для применения в МО
Тип методаМетод
Стерилизующий агент
Паровой
Водяной насыщенный пар под избыточным давлением
Воздушный
Сухой горячий воздух
Инфракрасный
Инфракрасное излучение
Гласперленовый
Среда нагретых стеклянных шариков
Газовый
Окись этилена или ее смесь с другими компонентами
Окись этилена или ее смесь с другими компонентами
Окись этилена или ее смесь с другими компонентами
Физический
(термический)
Химический
Плазменный
Пары перекиси водорода в сочетании с их
низкотемпературной плазмой
Жидкостный
Растворы химических средств (альдегид-, кислород- и
хлорсодержащие)
39.
 Физические методы
Физические методы40. Паровой метод
Компактныйпереносной
автоклав
• Для достижения температур выше
точки кипения воды пользуются
автоклавом. Автоклав представляет
собой установку для стерилизации
паром под давлением. Температура
насыщенного пара зависит от
давления.
• Режимы работы автоклава:
132 °C — 2 атмосферы— 20 минут —
основной режим. Стерилизуют все
изделия (стекло, металл, текстиль,
КРОМЕ РЕЗИНОВЫХ).
120 °C — 1,1 атмосфера — 45 минут —
щадящий режим. (стекло, металл,
резиновые изделия, полимерные
изделия — согласно паспорту)
110 °C — 0,5 атмосферы — 180 мин —
особо щадящий режим(нестойкие
препараты, питательные среды)
41. Паровой метод стерилизации
Стерилизующий агент – горячий парпод
давлением.
Для
этого
метода
используют автоклав.
Упаковки: биксы, крафт-пакеты, бумагаламинат, бязь.
Материалы: полимеры, стекло, латекс,
ткань,
коррозийностойкие
металлы,
текстиль.

Достоинства: высокая проницаемость
пара, большой выбор упаковки, дольше
сохраняется стерильность, дешевый и
простой в использовании метод.
Недостатки:
увлажнение
изделий,
вызывает коррозию металлов.
Паровой метод стерилизации
43. Автоклав стационарный (нового поколения)
44. Воздушный метод Сухой жар —
Воздушный методСухой жар стерилизация осуществляется в специальных
аппаратах — сухо-жаровых шкафахстерилизаторах. Стерилизация в сухожаровом
шкафу происходит при помощи циркуляции
внутри него горячего воздуха.
• Режимы работы автоклава:
180 °C — 60 минут — основной режим.
Стерилизуют все изделия (стекло, металл,
КРОМЕ РЕЗИНОВЫХ).
160 °C — 150 минут — щадящий режим. (стекло,
металл, резиновые изделия, полимерные
изделия — согласно паспорту)
45. Воздушный метод стерилизации
Стерилизующий агент – сухой горячийвоздух (160-200oС).
Упаковки: крафт-пакеты, открытым
способом.

Материалы: металл, стекло, полимер,
резина , латекс.
Достоинства: дешевый, простой метод, не
вызывает коррозии металла, не происходит
увлажнения упаковки и изделий.
Недостатки: ограниченный выбор
упаковки, медленное и неравномерное
прогревание изделий, необходимость
использования более высоких температур,
невозможность использовать материалы из
текстиля.
Воздушный метод стерилизации
46. Воздушный метод
• Примечание:• Стерилизации подвергают сухие изделия;
• Изделия, простерилизованные в крафт- пакетах, упаковке из
бумаги мешочной влагопрочной, хранят 3-е суток, в 2слойной упаковке из бумаги крепированной для медицинских
целей – до 20 суток;
• Изделия, простерилизованные без упаковки, должны быть
использованы непосредственно после стерилизации в течение
рабочей смены (6 часов) в асептических условиях.
• Во время стерилизации воздушным методом металлических
инструментов без упаковки их располагают так, чтобы они не
соприкасались друг с другом.
 Разъёмные изделия
Разъёмные изделиястерилизуют в разобранном виде.
47. Воздушный стерилизатор (сухожаровой шкаф)
48. Гласперленовый метод
• Принцип действия глассперленовогостерилизатора основан на приведении
стерилизуемых хирургических инструментов
в контакт с маленькими стеклянными
сферами, имеющими температуру 250С.
• Стерилизация инструмента производится в
течение очень короткого времени — не более
20 секунд. Благодаря такому короткому
периоду и неразрушающему воздействию
стерилизационных (глассперленовых)
шариков на инструмент, негативное влияние
высокой температуры практически
отсутствует.
Всего за 5 секунд стерилизует: щипцы,
клещи, скальпель-держатели, зонды,
шпатели, долота, зубила, алмазы, файлы,
боры, корневые элеваторы, расширители,
угловые наконечники, иглодержатели,
пинцеты, десневые ножницы и т.д.
49. Инфракрасный метод
Малогабаритныйстерилизатор
предназначен для
стерилизации
стоматологических и
микрохирургических
инструментов из металлов
в условиях госпиталей,
поликлиник, больниц и
других лечебных и
косметологических
учреждений.
Стерилизация
осуществляется
инфракрасным мощным
кратковременным
тепловым воздействием.
50. Камера УФО для хранения стерильных инструментов
51. Химические методы
52. Химическая стерилизация
• При данном методе используются химические веществав газообразном состоянии или стерилизуемые объекты
погружаются в растворы химических веществ.
Стерилизация растворами – вспомогательный
метод, который применяют при невозможности
использовать другие..
Растворы для стерилизации — стерилянты
Для стерилизации в основном используют
Перекись водорода 6%
Режим стерилизации :
Температура 18 °С — экспозиция 360 мин
Температура 50 °С — экспозиция 180 мин
Раствор используется однократно.
53. Химическая стерилизация
Дезоксон-1Режим стерилизации :
Температура 18 °С — экспозиция 45 мин
Сайдекс
Температура 21 °С — экспозиция 240 мин
Виркон 2%
Температура 18 °С — экспозиция 10 мин
54.
 Химическая стерилизация Стерилизация растворами –
Химическая стерилизация Стерилизация растворами –вспомогательный метод, который применяют
при невозможности использовать другие.
Достоинства: доступность, легкость в
исполнении и надежность
Недостатки: изделия стерилизуют без
упаковки, промываются после стерилизации, что
может привести к реконтаминации.
Используется только при децентрализованной
системе.
55. Химическая стерилизация
• Стерилизуемые изделия свободнораскладывают в емкости с растворами. При
большой длине они укладываются по
спирали, каналы и полости заполняются
раствором.
• После окончания стерилизации изделия
трижды дважды погружают на 5 минут в
стерильную воду, каждый раз меняя ее, затем
стерильным корнцангом их переносят в
стерильную емкость (стерилизационная
коробка), выложенную стерильной
простыней. Срок хранения – 3 суток.
56. Химическая стерилизация
При газовой стерилизации используют смесь ОБ(окисьэтилена с бромистым этилом) и его смеси,
формальдегид.

Стерилизуют: Оптика, кардиостимуляторы, изделия из
полимерных материалов, стекла, металлов.
Условия проведения:
Инструментарий упаковывают в два слоя
полиэтиленовой пленкитолщиной 0,06-0,2 мм, бумагу:
упаковочную высокопрочную двухслойную. Срок
сохранения простерилизованных изделий в упаковке из
полиэтиленовой пленки – 5 лет, в пергаменте
57. Химическая стерилизация
Достоинства: В газообразном состоянииэтилен-оксид не вызывает коррозии металлов,
не портит изделий из кожи, шерсти, бумаги,
пластмасс. Он является сильным
бактерицидным, спороцидным и вирулоцидным
средством. Его пары обладают высоким
проникновением. осуществляется при
невысоких температурах (18-80°С) и изделия
стерилизуются в упаковке.
Недостатки: токсичность для персонала и
взрывоопасность при несоблюдении техники
безопасности.
58. Газовая стерилизация
59. Холодный метод стерилизации
Радиационный методСтерилизующим агентом являются ионизирующее
гамма- и бета-излучение.
 Температура объекта при
Температура объекта пристерилизации поднимается незначительно, поэтому
этот способ называют холодной стерилизацией.
Для индивидуальной упаковки помимо бумажных,
используют пакеты из полиэтилена. Стерильность в
такой упаковке сохраняется годами. Срок годности
указывается на упаковке. Этот способ широко
применяется на промышленных предприятиях,
изготавливающих медицинские изделия
одноразового использования (системы для
переливания крови, акушерские комплекты).
60. Холодный метод стерилизации
При плазменном методе стерилизациииспользуют высокочастотную плазму в
отечественных приборах «Пластер», «Ферузо».
Для обработки изделий из термолабильных
материалов (эндоскопы, кардиостимуляторы,
оптические устройства, эндопротезы и т.д.)
используется стерилизатор Стеррад 100-8.
Данный метод применяют для стерилизации
небольших по размерам медицинских изделий
(стоматологические боры, иглы для
иглотерапии и т.
 д.).
д.).61. Низкотемпературный плазменный стерилизатор СТЕРРАД 100NX
Озоновая стерилизация предназначена дляобработки малогабаритных изделий простой
конфигурации из коррозионностойких сталей и
сплавов.
Озон синтезируется из воздуха в газоразрядном
реакторе стерилизатора.
Время стерилизационной выдержки 50 минут,
время дезактивации озона 10 минут.
Озоновый стерилизатор (СО-01-С или СО-5)
относится к низкотемпературным (температура
40°С), используется для стерилизации сухих
скальпелей, пинцетов, зеркал, зондов, шпателей,
боров стоматологических в неупакованном виде,
размещенных в 1 слой в кювете.
63. Стерилизатор озоновый
65. Химическая стерилизация
Выполняется в закрытых емкостях,покрытых неповрежденной эмалью, а
также сделанных из стекла или
пластмассы.
Стерилизуемые объекты погружают в
раствор при температуре 18 ± 2°.
Для стерилизации инструменты полностью
погружают в раскрытом (или разобранном)
виде в один из указанных растворов.

При замачивании в спирте и тройном
растворе инструменты считаются
стерильными через 2-3 часа, в перекиси
водорода — через 6 часов.
66. Газовый метод
• При стерилизации пищевыхпродуктов, лекарственных препаратов
и разного рода приборов, а также в
лабораторной практике оправдало
себя применение окиси этилена,
которая убивает и вегетативные
клетки, и споры, но действует только в
том случае, если подвергаемые
стерилизации материалы содержат
некоторое количество (5-15%) воды.
Окись этилена применяют в виде
газовой смеси (с N2 или С02), в
которой ее доля составляет от 2 до 50%.
• Этиленоксидный метод обеспечивает
самый щадящий температурный
режим стерилизации.
67. Газовый метод стерилизации
Стерилизующий агент –формальдегид или этилен-оксид.
Упаковки: бумага-ламинат,
пергамент, крафт-бумага.
Материалы: полимеры, стекло,
металл.
Достоинства: невысокая
температура, использование любых
материалов.

Недостатки: токсичность для
персонала и взрывоопасность при
несоблюдении техники безопасности,
продолжительный
цикл стерилизации.
Газовый метод стерилизации
68. Холодные методы стерилизации
69. Плазменный метод
позволяет создать биоциднуюсреду на основе водного
раствора пероксида водорода,
а также низкотемпературной
плазмы (ионизированный
газ, образующийся при
низком давлении).
Это самый современный метод
стерилизации, известный на
сегодняшний день. Он
позволяет стерилизовать
любые медицинские изделия,
от полых инструментов до
кабелей, электроприборов,к
которым в ряде случаев
вообще не удается применить
ни один из известных
методов стерилизации.
70. Плазменные стерилизаторы
71. Радиационный метод
Антимикробная обработка может быть осуществлена спомощью ионизирующего излучения (у-лучи),
ультрафиолетовых лучей и ультразвука. Наибольшее
применение в наше время получила стерилизация улучами.
Радиационный метод или лучевую стерилизацию γ-лучами,
применяют в специальных установках при промышленной
стерилизации однократного применения- полимерных
шприцев, систем переливания крови, чашек Петри,
пипеток и др.хрупких и термолабильных изделий.
Используются изотопы Со60 и Cs137. Доза проникающей
радиации должна быть весьма значительной — до 20-25
мкГр, что требует соблюдения особо строгих мер
безопасности. В связи с этим лучевая стерилизация
проводится в специальных помещениях и является
заводским методом стерилизации (непосредственно в
стационарах она не производится).
72. Радиационный метод стерилизации
Радиационный метод необходим для стерилизации изделийиз термолабильных материалов.
Стерилизующий агент – ионизирующие γ и β излучения.
Упаковки: помимо бумажных используют пакеты из
полиэтилена.
Достоинства: надолго сохраняется стерильность в
упаковке.
Недостатки: дороговизна метода.
Радиационный
–
основной
метод
промышленной
стерилизации.
Используется
предприятиями,
выпускающими
стерильные
изделия
однократного
применения.
Радиационный метод стерилизации
73. Радиационный метод
Стерилизация инструментов и прочихматериалов проводится в герметичных
упаковках и при целостности последних
сохраняется до 5 лет. Герметичная упаковка
делает удобными хранение и использование
инструментов (необходимо просто вскрыть
упаковку).
74. Озоновая стерилизация
Предназначена для обработкималогабаритных изделий простой
конфигурации из коррозионностойких
сталей и сплавов
75. Принципы обеспечения стерильности:
• К стерильному предмету прикасайтесь только другимстерильным предметом, чтобы избежать контаминации.
• Держите стерильные предметы всегда на уровне выше пояса.
• Стерильное поле должно всегда быть в пределах видимости.
• Старайтесь не говорить, не кашлять, не чихать и не
наклоняться над стерильной поверхностью, так как
происходящие при этом потоки воздуха содержат
микроорганизмы.
• Пограничную зону вокруг стерильного поля шириной около
2,5 см считают потенциально заражённой.
• Не допускайте промокания салфеток над стерильной
поверхностью, так как любая жидкость проникает сквозь
ткань, а вместе с ней и микроорганизмы.
• Если стерильный предмет коснулся нестерильного, всё
стерильное поле считают загрязнённым и подготавливают
новое стерильное поле.
• Считайте предмет загрязнённым, если вы не уверенны в его
стерильности.
• Индикаторы представляют собой прямоугольную полоску из
инертного бумажного основания с нанесёнными на одной
стороне двумя цветными метками (Рис.1)-индикаторной 4 и
эталоном сравнения 5, и маркировки. Для приклеивания
индикатора необходимо с его обратной стороны под надписью
«Дата» отделить левую часть защитной бумаги 1 (Рис.1) по
линии насечки 2 приклеить левую часть индикатора до линии
перфорации 3 к упаковке. Правая часть индикатора при этом
не приклеивается.
• Для снятия индикатора с упаковки после стерилизации
необходимо, не отделяя защитную бумагу 1, оторвать
индикатор по линии перфорации от приклеенной левой
части. Приклеенная левая часть индикатора со служебными
надписями не удаляется с упаковки и доходит до
потребителя, что позволяет контролировать кратность
использования бумажного упаковочного материала
СПАСИБО ЗА ВНИМАНИЕ!
Методы стерилизации. Физические методы стерилизации
Виды стерилизации | Методы стерилизации | Действующий агент |
Физический | паровой (автоклавирование) | пар под избыточным давлением (120 0 С, давление 1,1 атм) (132 0 С, давление 2,0 атм) |
воздушный | сухой воздух при 180 °С | |
гласперленовый | нагретые стеклянные шарики при 190-240 0 С | |
инфракрасный | инфракрасное излучение при 200±3 0 С | |
ионизирующее излучение 2- 2,5 Мрад | ||
ультразвуковой | механические колебания с частотой от 2х10 4 до 2х10 8 в сек | |
Химический | жидкостной | растворы химических соединений (альдегид-, кислород-, хлорсодержащих) |
окись этилена в смеси с углекислым газом, бромистым метилом и др. | ||
плазменный | пары 20 % пероксида водорода |
Паровой метод стерилизации (автоклавирование)
Впервые стерилизация паром под повышенным давлением в автоклаве осуществлена в 1884 году Л.Л. Гендейрейхом.
При этом способе стерилизации действующим агентом является горячий пар. В автоклаве возможно нагревание воды под повышенным давлением, что приводит к по-вышению точки кипения воды и соответственно пара до 132 0 С (при давлении 2 атм.).
Паровым методом стерилизуют общие хирургические и специальные инструменты, детали приборов и аппаратов из коррозионно-стойких металлов, стекла, шприцы с пометкой 200 0 С, хирургическое белье, перевязочный и шовный материал, изделия из резин (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс.
Режимы стерилизации некоторых медицинских инструментов
Способ стерилизации | Температура, 0 С | Давление, атм. | Время стерилизации, мин | |
Водяным насыщенным паром под избыточным давлением (автоклав) | Изделия из коррозионно-стойких металлов, стекла, изделия из текстильных материалов, резин, лигатурный шовный материал | |||
Изделия из резин, латекса, отдельных видов пластмасс (полиэтилен высокой плотности, ПВХ-пластикаты), лигатурный шовный материал | ||||
Сухим горячим воздухом (суховоздушный стерилизатор) | Изделия из металлов, стекла и резин на основе силиконового каучука |
Материал для стерилизации помещают в специальные биксы Шиммельбуша, пергамент, бумагу мешочную, упаковочную, крепированную, стерилизационные коробки с фильтром.
Одним из основных условий проведения качественной стерилизации является загрузка автоклава в точном соответствии с рекомендациями производителя. Это означает правильное расположение и количество загружаемых предметов. Водяной пар должен свободно циркулировать, а конденсат своевременно выводиться. При загрузке автоклава обращают внимание на то, чтобы тяжелые инструменты располагались на нижних поддонах, а легкие – на верхних.
Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемым изделиям. Не допускается перекрывать продувочные окна и решетки вентиляции. Загрузку и выгрузку изделий проводят при температуре не выше 40-50°С.
Срок хранения простерилизованных изделий: в биксах без фильтра, в двойной мягкой упаковке – 3 суток; в пергаменте, бумаге мешочной непропитанной, мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром – 20 суток.
Воздушный метод стерилизации
При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 160 0 С и 180 0 С; стерилизацию осуществляют в суховоздушных стерилизаторах.
Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из коррозионно-нестойких металлов, шприцы с пометкой 200 0 С, инъекционные иглы, изделия из силиконовой резины.
Перед стерилизацией воздушным методом изделия после предстерилизационной очистки обязательно высушивают в сушильном шкафу при температуре 85 °C до исчезновения видимой влаги.
Качество стерилизации воздушным методом зависит от равномерности распределения горячего воздуха в стерилизационной камере, что достигается правильной загрузкой стерилизатора. Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемому изделию.
Изделия стерилизуют завернутыми в стерилизационные упаковочные материалы. Шприцы стерилизуют в разобранном виде.
Во время стерилизации металлических инструментов без упаковки их располагают так, чтобы они не касались друг друга.
Стерилизация в среде нагретых стеклянных шариков (гласперленовая)
В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные, дрильборы, а также рабочие части гладилок, экскаваторов, зондов и др.). При стерилизации стеклянные шарики нагреваются до температуры 190-240 0 С. Стерилизация проводится в течение 5 — 15 секунд.
Недостатком метода является возможность стерилизации только мелких инструментов. У более крупных инструментов для такой обработки доступна только рабочая часть. А полная их стерилизация даже при увеличении экспозиции не удается. Проблемы возникают и со средствами контроля работы этих стерилизаторов.
Инфракрасная стерилизация
Существуют стерилизаторы, в которых используется метод, основанный на применении кратковременного импульсного инфракрасного излучения, создающего в рабочей камере температуру 200±3 0 С. Время инфракрасной стерилизации инструментария в неупакованном виде составляет от 10 до 25 минут. Недостатками данного метода стерилизации являются отсутствие упаковки инструментов, повреждающее воздействие на полимерные материалы и резину, отсутствие контролирующих индикаторов.
Лучевая стерилизация .
Используют гамма и бета — частицы и относительно тяжелые нейтроны, протоны и т. д. Разница вызываемых ими биологических изменений почти незаметна. Радиоактивное излучение, проходя через среду, вызывает ионизацию последней, в связи с чем его называют ионизирующим излучением. Бактерицидный эффект ионизирующего излучения обусловлен воздействием на метаболические процессы бактериальной клетки. Наибольшее применение получила стерилизация гамма-лучами. Используются изотопы Co 60 и Cs 138 . Доза проникающей радиации значительна и составляет 2-2,5 Мрад. В связи с этим лучевая стерилизация в стационарах не производится и применяется в промышленных условиях.
Метод применяется для стерилизации одноразовых инструментов (шприцы, шовный материал, катетеры, зонды, системы для переливания крови, перчатки и др.). При сохранении целостности упаковки стерильные свойства предметов сохраняются в течение 5 лет.
Ультразвуковая стерилизация
Механические колебания с частотой от 2х10 4 до 2х10 8 колебаний в 1 секунду не воспринимаются ухом человека и называются ультразвуком. Для искусственного получения ультразвука служат специальные приборы. Источником ультразвука являются кристаллы кварца, турмалина, обладающие пьезоэлектрическими свойствами. Пьезоэлектрический эффект обусловлен явлением электрической поляризации кристаллов.
При воздействии на ткани ультразвуковой волны происходит образование микроскопических полостей, которые быстро закрываются под воздействием последующего сжатия. Такое явление называется кавитацией. Ультразвуковая кавитация приводит к образованию свободных радикалов, диссоциации молекул воды на ионы Н + и ОН — , что приводит к нарушению окислительно-восстановительных процессов в микробной клетке.
Ультразвуковые волны используются для стерилизации инструментов, подготовки рук медицинского персонала к операции. Для этого руки (инструменты) погружают в специальную ванну с дезинфицирующим раствором, через который пропускают ультразвуковые волны.
Стерилизация растворами химических средств
Стерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода, 0,9 % раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами.
Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть в тех случаях, когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации.
Для стерилизации растворами химических средств используют такие средства, как первомур, перекись водорода, дезоксон — 1, 4, стераниос 20%, сайдекс, лизоформин-3000, глютарал и др.
При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений).
Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна составлять не менее 20 0 С для альдегидсодержащих средств и не менее 18 0 С – для остальных средств.
Стерилизацию проводят при полном погружении изделий в раствор, свободно их раскладывая. При большой длине изделия его укладывают по спирали. Разъемные изделия стерилизуют в разобранном виде. Каналы и полости заполняют раствором.
После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают в стерильной жидкости, налитой в стерильные емкости, согласно рекомендациям методического документа по применению конкретного средства. При каждом переносе из одной емкости в другую освобождение каналов и полостей и их заполнение свежей жидкостью осуществляют с помощью стерильного шприца, пипетки или иного приспособления.
Промытые стерильные изделия после удаления остатков жидкости из каналов и полостей используют сразу по назначению или помешают (с помощью стерильных пинцетов, корнцангов) на хранение в стерильную стерилизационную коробку, выложенную стерильной простыней, на срок не более 3 суток.
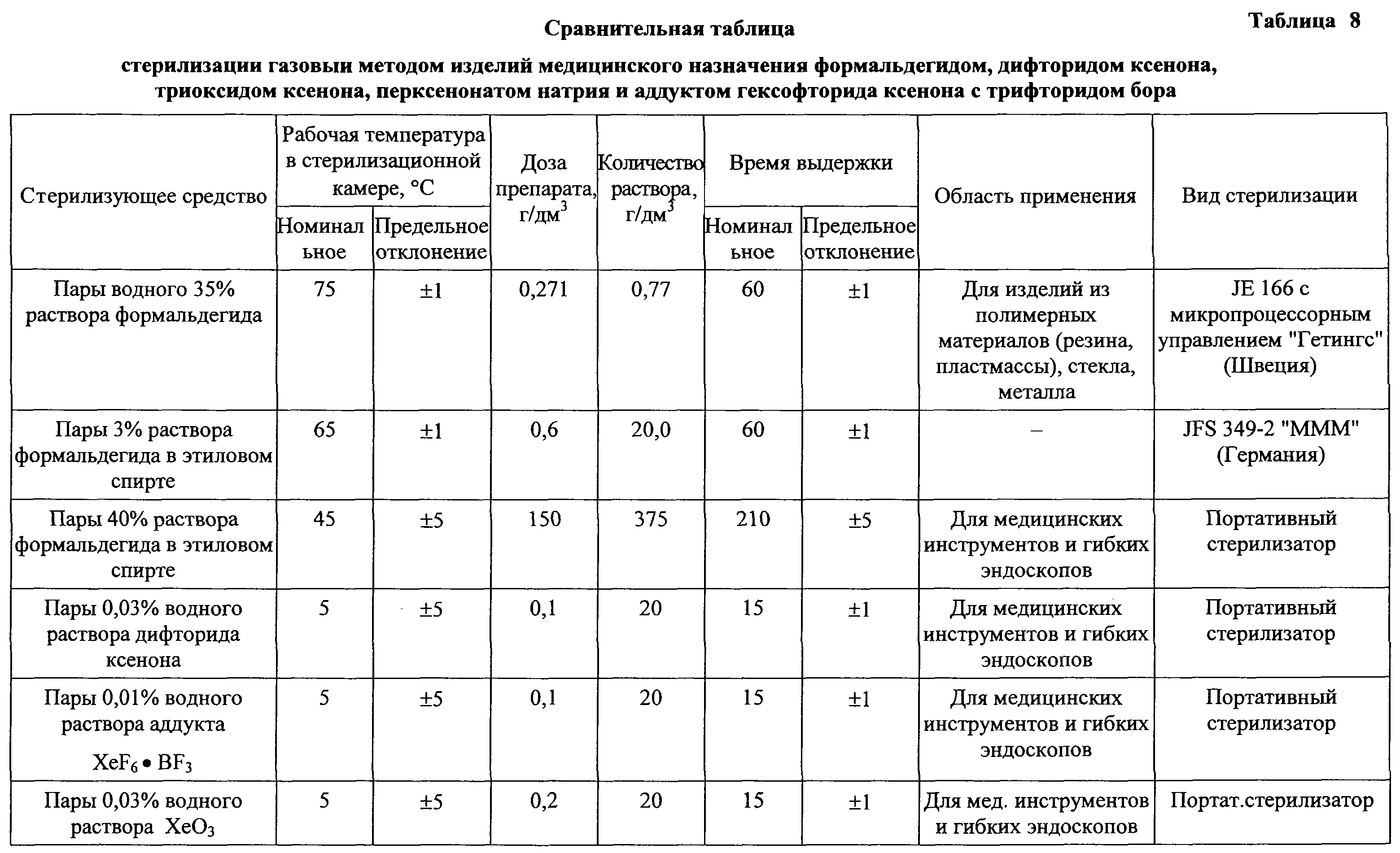
Газовая стерилизация
Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте , а также озон (табл. 4) .
Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 18 0 С), при температуре 35 0 С и 55 0 С, парами раствора формальдегида в этиловом спирте при температуре 80 0 С.
Стерилизация — это процесс уничтожения всех видов микробной флоры, в том числе их споровых форм, и вирусов с помощью физических или химических воздействий. Принято считать медицинское изделие стерильным, если вероятность его бионагрузки равна или менее 10 в степени -6. Стерилизации должны подвергаться медицинские изделия, контактирующие с кровью пациента, контактирующие с раневой поверхностью и соприкасающиеся со слизистой оболочкой и могущие вызвать нарушение ее целостности. Стерилизация -сложный процесс, для успешной реализации которого необходимы следующие требования:
Эффективная очистка;
Соответствующие упаковочные материалы;
Соблюдение правил упаковки медицинских изделий;
Соблюдение правил по загрузке стерилизатора упаковками с медицинскими изделиями;
Адекватное качество и количество стерилизуемого материала; соответствующая работа оборудования;
Соблюдение правил хранения, обращения и транспортировки простерилизованного материала.
Процесс стерилизации медицинских инструментов и изделий от момента окончания операции и до стерильного хранения или следующего применения включает в себя выполнение мероприятий в определенной последовательности. Все этапы должны быть строго соблюдены для обеспечения стерильности и длительного срока жизни инструментов. Схематично это можно представить следующим образом:
Отложить инструменты после использования Дезинфекция -> Механическая очистка инструмента -> Проверить на повреждения -> Промыть инструменты Сушка -> Упаковать в стерилизационную упаковку -> Стерилизация -> Стерильное хранение/применение. При применении стерилизационной упаковки (бумага, фольга или стерилизационные контейнеры) инструменты могут храниться в стерильном виде и позднее использоваться от 24 часов до 6 месяцев.
В лечебно-профилактических учреждениях применяется несколько форм организации стерилизации: децентрализованная, централизованная, осуществляемая в ЦСО, и смешанная. В амбулаторной стоматологической практике чаще применяется децентрализованная стерилизация (особенно в частных клиниках). Централизованная стерилизация характерна для районных стоматологических поликлиник и больших частных клиник. Децентрализованная стерилизация имеет ряд существенных недостатков, влияющих на ее эффективность. Предстерилизационная обработка изделий выполняется чаще всего вручную и при этом качество очистки изделий оказывается низким. Контроль за соблюдением технологии проведения стерилизации, правил упаковки, загрузки изделий в стерилизаторы и за эффективностью работы оборудования в условиях децентрализованной стерилизации затруднен. Все это приводит к снижению качества стерилизации. При применении централизованной формы стерилизации удается достичь более высоких результатов стерилизации за счет совершенствования существующих и внедрению новейших методов стерилизации (механизация мойки инструментов и медицинских изделий, облегчение работы среднего медицинского персонала и др.). В централизованном стерилизационном отделении выделяют: моечную, дезинфекционную, упаковочную и подразделение для стерилизации и раздельного хранения стерильных предметов. Температура воздуха во всех подразделениях должна быть от 18°С до 22°С, относительная влажность — 35-70%, направление потока воздуха — от чистых к относительно загрязненным зонам.
Методы стерилизации
Стерилизация осуществляется физическими методами: паровая, воздушная, гласперленовая (в среде нагретых стеклянных шариков), радиационная, с применением инфракрасного излучения, и химическими методами: растворы химических средств и газы (табл. 3). В последние годы применяется озоновая (стерилизатор С0-01-СПБ) и плазменная стерилизация (установка «Стеррад»), используются установки на основе окиси этилена, паров формальдегида. Выбор метода стерилизации изделий зависит от их устойчивости к методам стерилизационного воздействия.
Преимущества и недостатки различных методов стерилизации представлены в таблице.
Таблица.
Все изделия перед стерилизацией подвергаются предстерилизационной очистке .
При стерилизации физическими методами (паровым, воздушным) изделия, как правило, стерилизуют упакованными в упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению в России. При паровом методе могут применяться стерилизационные коробки без фильтров и с фильтром. При воздушном методе, а также при паровом и газовом методах допускается стерилизация инструментов в неупакованном виде.
Паровой метод стерилизации
Паровым методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла, хирургическое белье, перевязочный и шовный материал, изделия из резины (катетеры, зонды, трубки), из латекса, пластмасс. При паровом методе стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/см2) — 0,21 МПа (2,1 кгс/см2) (1,1-2,0 бар) температурой 110-134°С. Процесс стерилизации происходит в стерилизаторах (автоклавах). Полный цикл составляет от 5 до 180 минут (табл.). Согласно ГОСТ 17726-81, название данного класса устройств: «Стерилизатор паровой». Несмотря на то, что обработка паром достаточно эффективна, она не всегда может обеспечить стерилизацию инструмента. Причина этого состоит в том, что воздушные полости в стерилизуемых объектах могут послужить тепловым изолятором, как например, стоматологические турбинные наконечники. Для решения этой проблемы в автоклавах используется функция создания предварительного вакуума в импульсном режиме. Преимущества метода — короткий цикл, возможность стерилизации нетермостойких изделий, применение различных типов упаковки. Недостатком является высокая стоимость оборудования.
Таблица.
Воздушный метод стерилизации
Стерилизация при воздушном методе осуществляется сухим горячим воздухом температурой 160°, 180° и 200°С (табл.).
Таблица.
Воздушным методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла с пометкой 200°С, изделия из силиконовой резины. Перед стерилизацией воздушным методом изделия подвергаются предстерилизационной очистке и обязательно высушиваются в сушильном шкафу при температуре 85°С до исчезновения видимой влаги. Полный цикл составляет до 150 минут. Преимущество стерилизации горячим воздухом по сравнению с паровым методом состоит в низкой себестоимости оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее 30 мин), опасность повреждения инструментов высокими температурами, невозможность стерилизации тканей и пластмасс, только один контрольный параметр — температура, высокие энергозатраты.
Гласперленовая стерилизация
Гласперленовая стерилизация осуществляется в стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков при рабочей температуре 190-330°С. При стерилизации сухие инструменты помещают в среду раскаленных стеклянных гранул на глубину более 15 мм. Этим методом могут быть простерилизованы только инструменты, размер которых не превышает 52 мм, они должны быть целиком погружены в камеру на 20-180 с в зависимости от размера. После стерилизации изделия используются сразу по назначению. Высокая рабочая температура и невозможность полного погружения инструментов в стерилизующую среду ограничивают возможность стерилизации широкого ассортимента медицинских изделий.
Стерилизация газовым методом
Для газового метода стерилизации применяют смесь окиси этилена и бромистого метила в весовом соотношении 1: 2,5 соответственно (ОБ), окись этилена, пары раствора формальдегида в этиловом спирте, озон. Стерилизацию смесью ОБ и окисью этилена осуществляют при температуре не менее 18°С, 35°С и 55°С, парами раствора формальдегида в этиловом спирте при температуре 80°С. Перед газовой стерилизацией изделия после предстерилизационной очистки подсушивают до исчезновения видимой влаги. Удаление влаги из полостей изделий производят с использованием централизованного вакуума, а при его отсутствии с помощью водоструйного насоса, подсоединенного к водопроводному крану. При стерилизации ОБ и окисью этилена удаляют воздух до давления 0,9 кгс/см2. При использовании портативного аппарата после окончания стерилизации его выдерживают в вытяжном шкафу на протяжении 5 часов.
Озоном, вырабатываемым в озоновом стерилизаторе С0-01 -СПБ, стерилизуют изделия простой конфигурации из коррозионностойких сталей и сплавов, в неупакованном виде при температуре не более 40°С. Цикл стерилизации (выход на режим, стерилизация, дезактивация) составляет 90 минут. После стерилизации инструменты используют по назначению сразу без дополнительного проветривания. Срок сохранения стерильности изделий 6 часов, при соблюдении правил асептики. При упаковке в стерильную двухслойную х/б ткань срок стерильности составляет 3 суток, а при содержании в камере с бактерицидными облучателями — 7 суток.
В России имеет регистрацию единственная установка — стерилизатор газовый компании «Мюнхенер Медицин Механик ГмбХ» с использованием паров формальдегида, рекомендованный для стерилизации проблемной техники.
Инфракрасное воздействие
Новые методы стерилизации нашли свое отражение в стерилизаторе инфракрасной стерилизации, предназначенном для стерилизационной обработки металлических медицинских инструментов в стоматологии, микрохирургии, офтальмологии и других областях медицины.
Высокая эффективность ИК-стерилизующего воздействия обеспечивает полное уничтожение всех исследованных микроорганизмов, в том числе таких как: S. epidermidis, S. aureus, S. sarina flava, Citrobacter diversus, Str. pneumonia, Bacillus cereus.
Быстрый, в течение 30 секунд, выход на режим 200±3°С, короткий цикл стерилизационной обработки — от 1 до 10 минут, в зависимости от выбранного режима, наряду с низкой энергоемкостью, несравнимы по эффективности ни с одним из применяемых до настоящего времени методов стерилизации. Стерилизатор ИК-стерилизации прост в эксплуатации, не требует специально обученных операторов, а сам метод относится к экологически чистым технологиям. В отличие от паровой, воздушной или гласперленовой стерилизации, при ИК-стерилизации отсутствует агрессивное воздействие стерилизующего агента (инфракрасного излучения) на режущий инструмент.
Ионизирующее излучение
Активно действующими агентами являются гамма-лучи. В ЛПУ ионизирующее излучение не используется для дезинфекции. Его используют для стерилизации изделий однократного применения при производстве в заводских условиях.
Данный метод применяют для стерилизации изделий, материалы которых не являются термоустойчивыми, и применение других официально рекомендуемых методов невозможно. Недостатком данного метода является то, что изделия нельзя стерилизовать в упаковке и по окончании стерилизации их необходимо промыть стерильной жидкостью (водой или 0,9% раствором натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению микроорганизмами простерилизованных изделий. Для химических средств применяют стерильные емкости из стекла, термостойких пластмасс, выдерживающих стерилизацию паровым методом, металлов, покрытых эмалью. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна быть не менее 20°С для альдегидсодержащих средств и не менее 18°С для остальных средств (табл.).
Таблица.
Химический метод стерилизации достаточно широко применяется для обработки «проблемной техники», например, для аппаратуры с волоконной оптикой, наркозной аппаратуры, кардиостимуляторов, стоматологического инструментария. Используются такие современные стерилизующие агенты, как глутаровый альдегид, производные ортофталевой и янтарной кислот, кислородосодержащие соединения и производные надуксусной кислоты в режиме экспресс-стерилизации и «Классической стерилизации». Перспективными считаются препараты, полученные на их основе — «Эригид форте», «Лизоформин-3000», «Сайдекс», «НУ Сайдекс», «Сайдекс ОПА», «Гигасепт», «Стераниос», «Секусепт актив», «Секусепт пульвер», «Аниоксид 1000», «Клиндезин форте», «Клиндезин окси», причем подводя экономическое обоснование использования этих препаратов, следует сделать вывод об их неравнозначности, которая определяется сроками использования рабочих растворов (например, из всех препаратов только «Эригид форте» имеет возможность использования рабочего раствора в течение 30 дней для «классической» стерилизации).
Разъемные изделия стерилизуют в разобранном виде. Во избежание нарушения концентрации стерилизационных растворов, погружаемые в них изделия должны быть сухими. Цикл обработки составляет 240-300 минут, что является существенным недостатком метода. Кроме того, недостатком является высокая стоимость дезинфектантов. Преимущество — нет специального оборудования. Промытые стерильные изделия после удаления жидкости из каналов и полостей используют сразу по назначению или после упаковки в двухслойную стерильную х/б бязь, помещают в стерильную коробку, выложенную стерильной простыней, на срок не более 3 суток.
Все работы по стерилизации изделий проводятся в асептических условиях в специальных помещениях, подготавливаемых как операционный блок (квар-цевание, генеральная уборка). Персонал использует стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3 сменах стерильной воды, по 5 минут в каждой.
Контроль эффективности стерилизации
Контроль эффективности стерилизации осуществляется физическими, химическими и бактериологическими методами.
К физическим методам контроля относятся: измерение температуры, давления и времени применения стерилизации.
Для проведения химического контроля на протяжении десятилетий применялись химические вещества, имеющие температуру плавления, близкую к температуре стерилизации. Такими веществами были: бензойная кислота — для паровой стерилизации; сахароза, гидрохинон и некоторые другие -для контроля воздушной стерилизации. Если происходило расплавление и изменение цвета указанных веществ, то результат стерилизации признавался удовлетворительным. Поскольку применение вышеуказанных индикаторов является недостаточно достоверным, в настоящее время внедрены в практику контроля термических методов стерилизации химические индикаторы, цвет которых изменяется под воздействием температуры, адекватной для конкретного режима, для определенного времени, необходимого для реализации данного режима. По изменению окраски индикаторов судят об основных параметрах стерилизации — температуре и продолжительности стерилизации. С 2002 года в России введен в действие ГОСТ РИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования», в котором химические индикаторы распределены на шесть классов:
К 1 классу отнесены индикаторы внешнего и внутреннего процесса, которые размещаются на наружной поверхности упаковки с медицинскими изделиями или внутри наборов инструментов и операционного белья. Изменение цвета индикатора указывает на то, что упаковка подверглась процессу стерилизации.
Ко 2 классу относят индикаторы, которые не контролируют параметры стерилизации, а предназначенные для применения в специальных тестах, например, на основании таких индикаторов оценивают эффективность работы вакуумного насоса и наличие воздуха в камере парового стерилизатора.
К 3 классу относятся индикаторы, при помощи которых определяется один параметр стерилизации, например, минимальная температура. Однако они не дают информации о времени воздействия температуры.
К 4 классу относят многопараметровые индикаторы, изменяющие цвет при воздействии нескольких параметров стерилизации. Примером таких индикаторов являются индикаторы паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест».
К 5 классу относят интегрирующие индикаторы, реагирующие на все критические параметры метода стерилизации.
К 6 классу относят индикаторы-эмуляторы. Индикаторы откалиброваны по параметрам режимов стерилизации, при которых они применяются. Эти индикаторы реагируют на все критические параметры метода стерилизации. Эмулирующие индикаторы являются наиболее современными. Они четко регистрируют качество стерилизации при правильном соотношении всех параметров — температуры, насыщенного пара, времени. При несоблюдении одного из критических параметров индикатр не срабатывает. Среди отечественных термовременных индикаторов используются индикаторы «ИС-120», «ИС-132», «ИС-160», «ИС-180» фирмы «Винар» или индикаторы паровой («ИКПС-120/45», «ИКПС-132/20») и воздушной («ИКПВС-180/60» и «ИКВС-160/150») стерилизации одноразового применения ИКВС фирмы «Медтест».
Основные правила использования индикаторов паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест»
Все операции с индикаторами — выемка, оценка результатов — осуществляются персоналом, проводящим стерилизацию.
Оценку и учет результатов контроля проводят, оценивая изменения цвета начального состояния термоиндикаторной метки каждого индикатора, сравнивая с цветовой меткой Эталона сравнения.
Если цвет конечного состояния термоиндикаторной метки всех индикаторов соответствует цветовой метке Эталона сравнения, это свидетельствует о соблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере.
Допускаются различия в интенсивности глубины окраски термоиндикаторной метки индикаторов, обусловленные неравномерностью допустимых значений температуры в различных зонах стерилизационной камеры. Если термоиндикаторная метка хотя бы одного индикатора полностью или частично сохранила цвет, легко отличимый от цвета эталонного состояния, это свидетельствует о несоблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере.
Индикаторы и Эталоны сравнения должны совпадать по номерам партий. Запрещается оценивать результаты контроля стерилизации, используя индикаторы разных партий.
Оценку соответствия изменения цвета термоиндикаторной метки в сравнении с Эталоном проводят при освещенности не менее 215 лк, что соответствует матовой лампе накаливания 40 Вт, с расстояния не более 25 см. Для проведения бактериологического контроля в настоящее время применяются биотесты, имеющие дозированное количество спор тест-культуры. Существующая методика позволяет оценивать эффективность стерилизации не ранее чем через 48 часов, что не позволяет применять уже простерилизованные изделия до получения результатов бактериологического контроля.
Биологический индикатор представляет собой препарат из патогенных споро-образующих микроорганизмов с известной высокой устойчивостью к данному типу стерилизационного процесса. Задачей биологических индикаторов является подтверждение способности стерилизационного процесса убивать устойчивые микробные споры. Это наиболее критичный и достоверный тест стерилизационного процесса. Применяются биологические индикаторы в качестве контроля загрузки: если результат положительный (микробный рост), то использовать данную загрузку нельзя и необходимо отозвать все предыдущие загрузки до последнего отрицательного результата. Для получения достоверного биологического ответа следует использовать только те биологические индикаторы, которые соответствуют международным стандартам ЕК 866 и ISO 11138/11135. При использовании биологических индикаторов возникают определенные трудности — необходимость наличия микробиологической лаборатории, обученного персонала, продолжительность инкубации многократно превышает длительность стерилизации, необходимость карантина (невозможность использования) простерилизованных изделий до получения результатов. Из-за указанных выше трудностей в применении биологического метода в амбулаторной стоматологической практике обычно используется физический и химический метод контроля эффективности стерилизации.
К физическим методам стерилизации относится воздействие высокой температуры на стерилизуемые объекты (тепловая стерилизация).
А также воздействие ультрафиолетовым, излучением, токами высокой частоты, ультразвуковыми колебаниями, радиоактивным излучением, инфракрасными лучами, и т. д.
В аптечной практике для стерилизации посуды и лекарств пользуются исключительно способами, основанными на воздействии высоких температур. Ультрафиолетовое облучение находит применение главным образом для обеззараживания воздуха аптечных помещений, тары и поступающих в аптеку рецептов.
Использование высокой температуры для стерилизации основано на необратимой коагуляции протоплазмы, пирогенетическом ее разрушении и на повреждении ферментных систем микробной клетки. Температура и длительность нагревания, необходимые для достижения стерильности, могут изменяться в зависимости от вида микрофлоры и других условий.
Большинство патогенных микроорганизмов погибают при температуре около 60°, но их споры выдерживают значительно более высокую температуру. Текучий пар и кипящая вода убивают микроорганизмы значительно быстрее, но многие споры и в этих условиях сохраняются в течение нескольких часов (особенно в вязких средах). Чистый водяной пар действует сильнее, чем в смеси с воздухом.
Пар под давлением (при температуре выше 100°) убивает микроорганизмы быстрее. Сухой горячий воздух убивает бактерии и их споры при более высокой температуре по сравнению с водяным паром. Выбор метода зависит от свойств стерилизуемого объекта. Выбирая метод стерилизации, стремятся к полной ликвидации живой микрофлоры и спор, сохраняя в то же время в неизменности лекарственное вещество.
В практике находят применение следующие физические методы стерилизации.
Прокаливание является одним из наиболее надежных видов стерилизации. Осуществляется в муфельных или тигельных печах нагреванием объекта до 500-800° или же его прокаливанием на голом огне. Применяется для стерилизации платиновых игл для шприцев, фарфоровых фильтров и других фарфоровых предметов. Стальные предметы стерилизовать этим способом не рекомендуется, так как они ржавеют и теряют закалку.
Стерилизация сухим жаром. Стерилизуемый объект нагревают в сушильном шкафу при температуре 180° в течение 20-40 мин или при 200° в течение 10-20 мин. Сухим жаром стерилизуют стеклянную и фарфоровую посуду, жиры, вазелин, глицерин, термоустойчивые порошки (каолин, стрептоцид, тальк, кальция сульфат, цинка окись и др.).
В сушильных шкафах нельзя стерилизовать водные растворы в склянках, так как вода при высоких температурах превращается в пар и склянка может быть разорвана.
Стерилизация влажным жаром. При использовании этого способа стерилизации комбинируются воздействие высокой температуры и влажности. Если сухой жар вызывает главным образом пирогенетическое разрушение микроорганизмов, то влажный жар — коагуляцию белка, требующую участия воды.
На практике стерилизация влажным жаром проводится при температуре 50-150° и осуществляется следующими путями.
Кипячение. Этим способом стерилизуют резиновые предметы, хирургический инструментарий, стеклянную посуду. Применять кипячение для стерилизации инъекционных растворов не рекомендуется, так как по эффективности оно значительно уступает стерилизации паром.
Стерилизация текучим паром. Текучим называется насыщенный водяной пар (без примеси воздуха), имеющий давление 760 мм рт. ст. и температуру 100°. Стерилизацию текучим паром осуществляют в паровом стерилизаторе или автоклаве при 100° в течение 15-60 мин в зависимости от объема раствора. Это один из распространенных методов стерилизации инъекционных растворов в аптеках.
Стерилизация паром под давлением (автоклавирование). Осуществляется в различной конструкции автоклавах. Автоклав представляет собой герметически закрывающийся сосуд, состоящий из толстостенной стерилизационной камеры и кожуха. На автоклаве имеется предохранительный клапан, обеспечивающий выход пара при избыточном давлении, и манометр. При каждом автоклаве должны быть инструкция по его эксплуатации и уходу, а также паспорт котлонадзора.
Стерилизуемый объект помещают внутрь паровой камеры. Водяную камеру подвергают нагреванию. Вначале автоклав нагревают при открытом кране до тех пор, пока пар не пойдет сильной сплошной струей и не вытеснит находящийся в автоклаве воздух, который значительно снижает теплопроводность водяного пара (при содержании в водяном паре 5%- воздуха она уменьшается на 50%).
Во время нагревания автоклава после закрывания крана необходимо следить за давлением, параллельно с возрастанием которого увеличивается температура пара.
Автоклавирование является наиболее надежным способом стерилизации. Обычно стерилизация в автоклаве производится при 119-121° в течение 5-30 мин в зависимости от объема раствора. Этим гарантируется достаточно полная стерилизация независимо от вида микроорганизма. Таким образом, стерилизуют посуду, бумажные и стеклянные фильтры, инструменты, водные растворы устойчивых к воздействию высокой температуры лекарственных веществ, перевязочный материал.
Дробная стерилизация. При дробной стерилизации объект (обычно водный раствор) нагревают текучим паром при 100° в течение 30 мин, затем раствор выдерживают при комнатной температуре в течение 24 ч, после чего снова стерилизуют в тех же условиях (30 мин при 100°). Описанный цикл повторяют 3-5 раз. При первом нагревании погибают вегетативные формы микроорганизмов, при последующих — вновь появившиеся вегетативные формы. Вследствие длительности этот способ в аптеках применяется редко.
Пастеризация — однократное нагревание объекта при температуре 60° в течение 1 ч или при температуре 70-80° в течение 30 мин. Позволяет уничтожить вегетативные формы микробов (кроме термофильных), но не споры.
Тиндализация (дробная пастеризация). При тиндализации объект нагревают при температуре 60-65° по 1 ч ежедневно в течение 5 дней или при 70-80° в течение 3 дней. Это надежный и бережный способ стерилизации термолабильных лекарственных веществ. Однако вследствие длительности он мало пригоден для аптек и в последних почти не используется.
Дезинфекция – это уничтожение в окружающей человека среде вегетативных форм патогенных и условно-патогенных микроорганизмов.
Уничтожить микроорганизмы можно путём воздействия, как физических факторов, так и химических средств, причём в зависимости от продолжительности воздействия (экспозиции) и интенсивности (концентрации) дезинфицирующих средств.
Виды дезинфекции:
1. Профилактическая дезинфекция проводится с целью предупреждения ВБИ.
2. Очаговая дезинфекция проводится в очаге инфекции.
Очаговая дезинфекция делится:
На очаговую текущую дезинфекцию, осуществляемую в очаге инфекции, у постели инфекционного больного, проводится многократно;
Очаговую заключительную дезинфекцию, проводимую однократно но после изоляции, госпитализации в инфекционное отделение, выздоровления или смерти больного с целью полного освобождения инфекционного очага от возбудителей заболевания в первые 6-12 часов. В ЛПУ выполнение дезинфекционных мероприятий возлагается в основном на средний медицинский персонал, который должен руководствоваться инструктивно-методическими документами:
Приказами МЗ РБ в проведении дезинфекционных мероприятий в ЛПУ определённого профиля;
| Этапы контроля | Цель | Используемые методы контроля | Кто проводит |
| Контроль работы оборудования | Оценить качество работы оборудования | Физический | |
| Контро-ль качества стерилизации всей загрузки | Оценить качество стерилизации всего объема стерилизуемых материа-лов, используется тестовая упаковка | Химический, биологический | Персонал, обслуживающий стерилизационное оборудование |
| Контро-ль качества стерилизации и упаковки с материалами | Оценить достижение параметров стерилизации внутри каждой упаковки в момент ее вскрытия непосредственно перед применением | Химический, биологический | Персонал отделений при использовании стерильных материалов |
| Протоколирование полученных результатов | Письмен-но подтвердить качество стерилизационного процесса | Физиче-ский | Вышеуказанные персонала |
тестовая упаковка должна соответствовать стерилизуемым по плотности, размерам и качеству содержимого;
место размещения тестовой упаковки должно быть наиболее трудно доступным для стерилизующих факторов. Принцип размещения тестовой упаковки представлен в табл. 5;
маркировка даты стерилизации проводится перед началом стерилизации;
Оператор составляет протокол проведения стерилизации данной партии материала в специальном журнале учета параметров стерилизации (рис. 3).
Таблица 5
Размещение тестовой упаковки в зависимости от метода стерилизации
Если стерилизатор содержит принтерное устройство, протоколирующее параметры стерилизационного цикла, то полученные диаграммы после окончания каждого цикла вклеиваются в журнал или помещаются в конверт.
По результатам расшифровки индикаторов, размещаемых внутри тестовой упаковки, оператор делает заключение о качестве обработки всей партии стерилизуемых объектов и возможности (невозможности) дальнейшего использования материалов.
Качество обработки каждой конкретной упаковки с. материалами проверяется в отделениях, применяющих стерильные материалы данной партии. Правильность протоколирования результатов контролируется ответственным персоналом (старшая медсестра ЦСО, старшая медсестра отделения).
Упаковка материалов. Применяемые упаковочные материалы для любого метода стерилизации должны обладать следующими характеристиками:
не влиять на качество стерилизуемых объектов;
быть проницаемыми для стерилизующих агентов; обеспечивать герметичность вплоть до вскрытия упаковки;
легко вскрываться без нарушения асептики содержимого.
Упаковочные материалы делятся на две категории: одноразового использования (бумага, бумажно-пластиковые материалы) и многоразового использования (контейнеры).
Используются физические и химические методы стерилизации .
К физическим методам стерилизации относятся стерилизация паром под давлением (автоклавирование), стерилизация горячим воздухом (сухожаровый шкаф) и лучевая стерилизация.
К химическим методам стерилизации относятся газовая стерилизация и стерилизация растворами химических препаратов.
Стерилизацией паром под давлением (автоклавированием) обрабатываются хирургические инструменты, перевязочный материал, операционное белье и одежда, резиновые медицинские
изделия. Все стерилизуется в стерилизационных биксах. При этом боковые отверстия в них открывают перед стерилизацией, а крышку плотно закрывают. Существует .
Для контроля стерильности в бикс кладут 3 запаянных индикатора стерильности или бензойную кислоту с фуксином во флаконе. После загрузки биксов автоклав закрывают герметичной крышкой. Стерилизация паром под давлением — сложная процедура, при которой существует опасность взрыва аппарата. Поэтому в стерилизационной должен работать специально обученный
персонал.
Существует три основных режима стерилизации :
1. При давлении 1 атм., температура 120 °С — 1 час.
2. При давлении 1,5 атм., температура до 127°С — 45 минут.
3. При давлении 2 атм., температура до 134 °С — 30 минут.
По окончании стерилизации биксы некоторое время находятся в горячем автоклаве с приоткрытой дверцей. При извлечении биксов из автоклава боковые отверстия в биксе закрывают
и отмечают дату стерилизации на кусочке клеенки, прикрепленном к биксу. Закрытый бикс без фильтров сохраняет стерильность находящихся в нем предметов в течение 72 часов (3 суток), а бикс с фильтрами — 20 суток. Открытая стерилизационная коробка сохраняет стерильность до 6 часов.
Стерилизация горячим воздухом осуществляется в специальных сухожаровых шкафах. Стерилизуют металлический инструментарий, многоразовые шприцы, стеклянную посуду. Все это укладывают на металлические сетки шкафа. Стерилизация проводится при закрытой дверце шкафа в течение 1 часа при температуре 180 °С. В виде контроля в сухожаровый шкаф на сетку во флаконах кладут сахарозу, тиомочевину или промышленный запаянный индикатор. Сухожаровые шкафы обычно находятся в стерилизационных комнатах отделений.
При лучевой стерилизации антимикробная обработка осуществляется с помощью ионизирующего излучения (у-лучи), ультрафиолетовых лучей и ультразвука. При работе с ионизирующим излучением требуется соблюдение особо строгих мер безопасности. Поэтому лучевая стерилизация является заводским методом стерилизации. Стерильные медицинские материалы, инструменты, перчатки, шприцы и др. выпускаются в герметических упаковках и сохраняются до 5 лет.
Газовая стерилизация осуществляется в специальных герметических камерах. Стерилизация проводится с помощью паров формалина (на дно камеры кладут таблетку формальдегида) или окиси этилена. Такой стерилизации подвергаются оптические части приборов, шовный материал, пластмасса, резиновые предметы. В зависимости от компонентов газовой смеси и температуры в камере стерилизация длится от 6 до 48 часов. Метод может быть использован в больничных условиях.
Стерилизация растворами химических — это холодный способ стерилизации. Стерилизации могут подвергаться резиновые медицинские предметы, эндоскопические части аппаратов, металлические инструменты. Для этого применяются: 6% раствор перекиси водорода, 3 часа при температуре 50 °С и 6 часов при температуре 18-20 °С, 1% раствор дезоксона 45 мин. при температуре 18°С; 8% раствор первомура или 2% раствор хлоргексидина, 5 минут при температуре 20 °С; 70° спирт этиловый. Для стерилизации используется стеклянная, пластмассовая или эмалированная посуда с плотно закрывающейся крышкой. Все растворы используют однократно. После стерилизации все предметы промываются двукратно стерильным изотоническим раствором с помощью стерильного корнцанга и хранятся на стерильном столе. Контроль этого метода — бактериологический.
Стерилизация оксидом этилена для медицинских устройств
Обновление пилотной программы мастер-файлов стерилизации оксидом этилена
20 марта 2020 года, в рамках наших постоянных усилий по ускорению утверждения определенных изменений в процессах и средствах стерилизации оксидом этилена, FDA объявило о своем первом принятии мастер-файла в пилотную программу FDA по стерилизации мастер-файлом оксидом этилена.Узнайте больше о пилотной программе стерилизации мастер-файлов оксидом этилена.
Это принятие происходит в особенно критический момент для FDA, чтобы продолжить нашу важную работу по сокращению нехватки стерилизованных оксидом этилена устройств.
FDA считает, что пилотная программа стерилизации эталонного файла оксидом этилена должна привести к тому, что в стерилизационных помещениях будет использоваться значительно меньшее количество оксида этилена, но при этом обеспечены надежные меры безопасности для пациентов.
FDA продолжит свои усилия по снижению чрезмерной зависимости от оксида этилена при стерилизации медицинских изделий и предоставит обновленную информацию о будущих приемах мастер-файлов.
На этой странице:
Связанные страницы:
Почему оксид этилена используется для стерилизации медицинских изделий?
Медицинские изделия стерилизуют различными способами, включая использование влажного тепла (пар), сухого тепла, излучения, газообразного этиленоксида, испаренного перекиси водорода и других методов стерилизации (например, газообразным диоксидом хлора, испаренной надуксусной кислотой и диоксидом азота. ). Стерилизация оксидом этилена — важный метод стерилизации, который производители широко используют для обеспечения безопасности медицинских устройств.Дополнительные сведения о методах стерилизации см. В разделе «Подача и проверка информации о стерильности в предпродажном уведомлении» (510 (k)) для устройств, помеченных как руководство по стерильности (PDF — 386 КБ).
Для многих медицинских устройств стерилизация оксидом этилена может быть единственным методом, который эффективно стерилизует и не повреждает устройство во время процесса стерилизации. Медицинские устройства, изготовленные из определенных полимеров (пластмассы или смолы), металлов или стекла, или имеющие несколько слоев упаковки или труднодоступные места (например, катетеры), скорее всего, будут стерилизованы оксидом этилена.
Какие устройства стерилизуются оксидом этилена?
Литература показывает, что около пятидесяти процентов 1,2,3 всех стерильных медицинских устройств в США стерилизованы оксидом этилена. Типы устройств, которые стерилизуются оксидом этилена, варьируются от устройств, используемых в общей медицинской практике (например, перевязки ран), до более специализированных устройств, используемых для лечения определенных областей тела (например, стентов).
Как FDA помогает гарантировать безопасность медицинских изделий, стерилизованных оксидом этилена?
Перед тем, как большинство стерильных медицинских изделий появятся на рынке, FDA рассматривает предмаркетные заявки, чтобы определить, есть ли информация о стерильности (например, метод, который производитель выбирает для стерилизации своего изделия, и действия по валидации, используемые для демонстрации того, что изделие может быть эффективно стерилизовано) соответствует международно согласованным добровольным консенсусным стандартам, признанным FDA.Важным элементом нашей нормативно-правовой базы является надежная программа стандартов. FDA поощряет спонсоров медицинских устройств использовать признанные FDA добровольные консенсусные стандарты в своих представлениях, поскольку соответствие соответствующим стандартам упрощает нормативный контроль и способствует повышению качества. Узнайте больше о программе признанных стандартов FDA.
Для стерилизации оксидом этилена два добровольных согласованных стандарта (ANSI AAMI ISO 11135: 2014 и ANSI AAMI ISO 10993-7: 2008 (R) 2012) описывают, как разрабатывать, проверять и контролировать процессы стерилизации оксидом этилена для медицинских устройств, а также приемлемые уровни остаточного этиленоксида и этиленхлоргидрина, оставшегося на устройстве после того, как оно прошло стерилизацию этиленоксидом.Эти стандарты помогают гарантировать, что уровни оксида этилена на медицинских устройствах находятся в безопасных пределах, поскольку длительное и профессиональное воздействие оксида этилена связано с раком. Узнайте больше о рисках, связанных с оксидом этилена, на веб-странице Национального института здравоохранения, посвященной оксиду этилена.
Если производитель медицинского оборудования изменяет метод, процесс или средство, указанные в его первоначальном представлении PMA для стерилизации своих устройств, производитель обычно должен представить приложение PMA, чтобы агентство могло рассмотреть эти изменения и определить, соответствуют ли они также на международном уровне. согласованные добровольные стандарты, признанные FDA.Для производителей, которые являются держателями 510 (k), метод стерилизации, изменения процесса или места могут быть оценены с помощью руководящего документа FDA: «Решение, когда подавать 510 (k) на изменение существующего устройства» для определения того, была ли стерилизация модификации повлекут за собой необходимость повторной подачи.
FDA также проверяет промышленные предприятия, которые стерилизуют медицинские изделия, и предприятия по производству медицинских изделий, чтобы убедиться, что они прошли валидацию процессов стерилизации, соответствующих признанным стандартам FDA.
Государственные департаменты здравоохранения проверяют медицинские учреждения, в которых используется оксид этилена для стерилизации медицинских изделий. Узнайте больше о правилах стерилизации в медицинских учреждениях на веб-странице Центров по контролю и профилактике заболеваний.
Роль EPA в стерилизации оксидом этилена
Агентство по охране окружающей среды США (EPA) проверяет и обеспечивает соблюдение положений Закона о чистом воздухе для стерилизационных помещений, выделяющих оксид этилена, чтобы гарантировать, что они защищают население от значительного риска.Узнайте больше о правилах EPA для оксида этилена на веб-сайте EPA.
Действия FDA по продвижению стерилизации медицинских изделий
FDA активно работает с экспертами по стерилизации, производителями медицинских устройств и другими государственными учреждениями, чтобы продвигать инновационные способы стерилизации медицинских устройств с более низким уровнем используемых в настоящее время агентов и использовать новые агенты или альтернативы, сохраняя при этом безопасность и эффективность устройства.
Заседания Консультативного комитета по практике инфекционного контроля (HICPAC)
В мае и ноябре 2019 года FDA привлекло сообщество по инфекционному контролю на заседании Консультативного комитета по практике инфекционного контроля в здравоохранении (HICPAC), чтобы проинформировать общественность о работе FDA и взаимодействии с промышленностью по методам стерилизации устройств, которые обычно стерилизуются с использованием оксида этилена. .
Инновационные вызовы FDA
15 июля 2019 года FDA объявило о двух государственных инновационных задачах, направленных на поощрение разработки новых методов стерилизации, которые могут включать новые устройства или новые методы, безопасные и эффективные для стерилизации медицинских устройств:
25 ноября 2019 года FDA объявило, что было получено 46 заявок и отобрано 12 участников для испытаний. Подробную информацию о выбранных участниках и дальнейших действиях см. На странице каждой задачи.
Больница общего профиля и приборы для личного пользования Консультативного комитета по медицинскому оборудованию
6-7 ноября 2019 года FDA провело заседание Группы по больницам и устройствам для личного пользования Консультативного комитета по медицинским устройствам, чтобы обсудить, как лучше всего продвигать инновации в стерилизации медицинских устройств. Материалы встречи доступны на странице объявлений о заседании Консультативного комитета.
Одна из рекомендаций совещания консультативного комитета — производителям устройств как можно скорее начать сокращать количество бумаги (например, для этикеток и инструкций по использованию), которые включаются в упаковку стерильного устройства.Медицинское изделие, стерилизованное оксидом этилена, должно быть запечатано в тщательно разработанную газопроницаемую упаковку, которая позволяет проникать газу оксида этилена. Когда стерилизационная загрузка (включающая все материалы, вставленные в камеру стерилизатора с устройством) включает в себя большое количество бумаги с устройством, это препятствует попаданию оксида этилена в устройство и, как правило, означает, что требуется больше оксида этилена. По этой причине FDA поощряет производителей устройств переходить на электронные материалы, если это возможно и безопасно для пользователей устройств.Мы стремимся работать с отраслью, чтобы внести это изменение.
Пилотная программа мастер-файла стерилизации оксидом этилена
25 ноября 2019 года FDA объявило о своей пилотной программе стерилизации мастер-файлов оксидом этилена (EtO Pilot Program). Эта добровольная программа предназначена для того, чтобы позволить компаниям (поставщикам стерилизации), которые стерилизуют одноразовые медицинские устройства с использованием оксида этилена с фиксированной камерой (EtO), предоставить мастер-файл при внесении определенных изменений между участками стерилизации или при внесении определенных изменений в процессы стерилизации, которые используют сокращенные Концентрации EtO.
В рамках этой добровольной программы производители (держатели PMA) устройств класса III, подлежащих предварительному утверждению, которые затронуты такими изменениями, могут ссылаться на мастер-файл, представленный их поставщиком стерилизации, в отчете после утверждения вместо подачи приложения PMA.
Эта пилотная программа направлена на обеспечение доступа пациентов к безопасным медицинским устройствам, одновременно поощряя новые инновационные способы стерилизации медицинских устройств, которые снижают потенциальное воздействие EtO на окружающую среду и здоровье населения.
Пилотная программа EtO Master File началась 25 ноября 2019 года. На сегодняшний день FDA приняло мастер-файлы от участников, перечисленных ниже:
| Компания | Дата приемки |
|---|---|
| Boston Scientific | 18 марта 2020 |
| Becton, Dickinson & Company (BD) | 11 сентября 2020 |
Сообщить об изменениях в месте стерилизации в FDA
Если остановка операций в стерилизационном центре повлияла на вашу продукцию, и вы планируете использовать альтернативную установку для стерилизации своих продуктов:
Сообщить о проблеме или нехватке медицинских товаров
Проблемы с поставками могут привести к нехватке медицинских устройств и могут представлять угрозу для здоровья населения из-за задержки или прекращения оказания неотложной помощи пациентам.FDA уделяет большое внимание устранению проблем с поставками продукции и предотвращению нанесения вреда пациентам из-за нехватки устройств.
Планирование и предотвращение нехватки оборудования — важная обязанность. FDA может помочь предвидеть, предотвратить или уменьшить дефицит в будущем, работая с производителями устройств, которые добровольно предоставляют нам информацию о потенциальных проблемах с поставками продукции. Узнайте больше о том, как сообщить о нехватке медицинских изделий или проблемах с поставками.
Свяжитесь с нами
Чтобы сообщить о нехватке медицинского оборудования или проблемах с поставками, напишите на адрес Deviceshortages @ fda.hhs.gov или по телефону 1-800-638-2041 или 301-796-7100.
1 (31 августа 2017 г.). Сравнение технологий гамма-, электронно-лучевого, рентгеновского и этиленоксида для промышленной стерилизации медицинских устройств и товаров медицинского назначения. Получено 13 марта 2019 г. с сайта http://iiaglobal.com/wp-content/uploads/2018/01/White-Paper-Comparison-Gamma-Eb-Xray-and-EO-for-Sterilisation.pdf
. 2 Бласс, К. (2001). Роль поливинилхлорида в здравоохранении .Шобери, Великобритания: Rapra Technology Limited. Извлечь из оксида https://books.google.com/books?id=vNp3bFNOU_AC&pg=PA47&lpg=PA47&dq=Ethylene стерилизации, медицинские приборы, долю рынка и источник = бл & отс = oQzply-FBQ & сиг = ACfU3U0bKGYVubW_3UEj0Kq7G3CpF6SbuQ & гл = еп & са = Х & вед =
2ahUKEwiKso3BnuzgAhWFk1kKHeiIC8Q4KBDoATAHegQIARAB # v = OnePage & д = Стерилизация оксидом этилена,
медицинских изделий, доля рынка & f = false
3 Нормативный обзор стандарта этиленоксида Управления по охране труда, 29 C.F.R § (2005) 1910.1047 https://www.osha.gov/dea/lookback/ethylene_oxide_lookback.pdf.
% PDF-1.5 % 1 0 объект > эндобдж 2 0 obj > поток 2012-09-27T10: 55: 27 + 02: 002012-09-27T10: 55: 27 + 02: 002012-09-27T10: 55: 27 + 02: 00Приложение Adobe InDesign CS5 (7.0.3) / pdfuuid: 667ab272- Библиотека Adobe PDF 9.9 конечный поток эндобдж 3 0 obj > эндобдж 5 0 obj > / ExtGState> / Font> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Rotate 0 / TrimBox [0.0 0,0 595,276 841,89] / Тип / Страница >> эндобдж 6 0 obj [20 0 R] эндобдж 7 0 объект > поток HWKo # Gu
Когда наиболее целесообразна химическая стерилизация? — CPT Medical
Когда наиболее целесообразна химическая стерилизация?
Во всех лабораториях и больницах стерилизация является обязательной. Это связано с тем, что вирусы, бактерии, грибки и другие возбудители болезней не могут быть полностью уничтожены дезинфекцией.Единственное, что может сделать дезинфекция, — это удалить их так, как мы удаляем грязь и микробы на нашей кухне. Он только удаляет такие агенты, но не убивает и не устраняет их.
Стерилизация — это основной и рекомендуемый метод очистки всего оборудования, инструментов и устройств, которые часто используются, например, хирургических инструментов, щипцов для биопсии и специальных лотков. Эти предметы предрасположены к любому типу заразных заболеваний, которые могут передаваться через эти инструменты и предметы, если их не стерилизовать.
Типы стерилизацииСуществует два типа процессов стерилизации.Это:
- Тепловая стерилизация
- Химическая стерилизация
Тепловая стерилизация — это наиболее рекомендуемый метод стерилизации, который используется уже много десятилетий. Это потому, что болезнетворные микроорганизмы и другие вредные бактерии погибают при определенной температуре тепла. Некоторые небольшие инструменты можно смочить кипятком. Это обеспечит стерилизацию даже самых труднодоступных участков.
В случае более крупных и сложных устройств и оборудования, в которых стерилизация кипящей водой не применяется; используется паровая стерилизация.Стерилизация паром распределяет тепло по всем поверхностям. Этот метод может мгновенно убить и устранить устойчивые бактерии, грибки и патогены. Это также проверенный метод очистки всего больничного и лабораторного оборудования и устройств независимо от размера и формы.
Бывают случаи, когда стерилизация паром неприменима. Некоторые устройства и оборудование уязвимы для влаги и пара. Устройства и оборудование со сложной электронной системой — хороший тому пример. Современная альтернатива их стерилизации — инфракрасная стерилизация.Этот тип тепловой стерилизации мгновенно убивает все болезнетворные агенты.
Химическая стерилизацияВ настоящее время существует множество современных больничных и лабораторных инструментов и инструментов, таких как индивидуальные лотки, которые чувствительны к нагреванию. Это означает, что в них есть некоторые компоненты, которые нельзя подвергать воздействию высоких температур. Эти компоненты — резина, пластик, стекло и другие подобные элементы.
Для их стерилизации без использования тепла рекомендуется химическая стерилизация.Химическая стерилизация — это процесс использования низкотемпературных химикатов для уничтожения, уничтожения и удаления всех микробов, вирусов и бактерий. Это может быть газ или жидкие химикаты.
В химической стерилизации используются следующие элементы и соединения:
- Серебро
- перуксусная кислота
- Перекись водорода
- Фталальдегид
- Глутаральдегид и формальдегид
- Отбеливатель
- Озон
Вышеуказанные химические вещества используются множеством различных способов и процессов.Некоторые из них можно смешивать с другими химическими веществами. Остальные применяются напрямую. Также есть случаи, когда некоторые из них можно использовать вместе с паровой стерилизацией.
Больничные и лабораторные инструменты не нужно нагревать только для их стерилизации. Химическая стерилизация может сделать эту работу без нагревания. Однако не все инструменты и оборудование можно стерилизовать этим методом. Это связано с тем, что есть оборудование или устройства, которые содержат элементы, которые могут бурно реагировать с указанными выше химическими веществами.Перед использованием процесса химической стерилизации с этими типами устройств рекомендуется ознакомиться с инструкциями производителя обоих производителей химикатов и устройств, подлежащих стерилизации.
ЗаключениеХимическая стерилизация в настоящее время становится наиболее рекомендуемым методом стерилизации. Многие больницы и лаборатории начинают сокращать использование одноразовых инструментов. Больницы и лаборатории теперь также используют индивидуальные подносы вместо одноразовых.А есть такие инструменты, которые нельзя нагревать, потому что они могли быть сделаны из пластика или стекла. Здесь уместна химическая стерилизация.
3 Надежные методы медицинской стерилизации
Одним из наиболее важных процессов в критических средах является стерилизация медицинских инструментов и устройств. Безопасность пациентов во многом зависит от эффективности и надежности стерилизационных устройств.Загрязняющие вещества могут стать очень устойчивыми к дезинфекции, что приводит к необходимости применения высокоэффективных методов стерилизации, обеспечивающих стерильность оборудования. Три основных метода медицинской стерилизации связаны с высокими температурами / давлением и химическими процессами.
1. Плазменный газовый стерилизатор
Плазменная стерилизация использует низкотемпературную плазму перекиси водорода внутри камеры для уничтожения всех живых микроорганизмов на медицинском и стоматологическом оборудовании, включая бактерии, споры, вирусы и грибки.Когда в камеру добавляется испаренная перекись водорода, оборудование внутри камеры становится стерильным. После удаления пара из камеры образуется низкотемпературная плазма, обеспечивающая полную стерилизацию всех инструментов. Остатками этого процесса являются вода и кислород, что делает работу безопасной как для медицинского персонала, так и для окружающей среды. Хотя плазменная стерилизация является более дорогим методом, она очень эффективна и идеально подходит для чувствительных к влаге медицинских инструментов.
2. Автоклавы
Автоклав — это большой стальной сосуд или камера, в которых циркулирует пар при высокой температуре и давлении для стерилизации различных предметов или как часть промышленного процесса.Промышленные процессы в автоклаве могут включать вулканизацию резины, обработку композитных деталей и склеивание структурным клеем. Автоклавы — это один из самых экономичных методов стерилизации с коротким циклом.
3. Стерилизаторы с парами перекиси водорода
Подобно плазменной стерилизации, стерилизаторы с испарением перекиси водорода (VHP) также используют пары перекиси водорода, но плазменный газ в процессе не используется. Стерилизаторы VHP удаляют влагу из помещения, и генератор быстро впрыскивает пары перекиси водорода для достижения эффективной концентрации для стерилизации оборудования.Эти пары эффективно удаляют микроорганизмы, которые могут присутствовать, стерилизуя корпус. Затем генератор меняет процесс на обратный, расщепляя пары перекиси водорода на экологически безопасные элементы. Этот метод имеет одно из самых коротких циклов, что позволяет стерилизовать оборудование большими партиями.
Чтобы быть эффективными, все три метода требуют точного контроля давления на каждом этапе процесса стерилизации. Без контроля уровней давления микроорганизмы все еще могут присутствовать в замкнутом пространстве, что приводит к нестерильному оборудованию.Датчики давления обеспечивают точные измерения давления, обеспечивая высокую эффективность всех трех методов. Поскольку для каждого метода используются уникальные процессы стерилизации, при выборе подходящего датчика давления необходимо учитывать множество факторов.
НАЖМИТЕ ЗДЕСЬ, чтобы загрузить нашу техническую документацию по измерению давления в медицинских стерилизаторах.
Холодная химическая стерилизация в медицине — видео и стенограмма урока
Холодная (химическая) стерилизация
Прежде чем я объясню, что такое холодная стерилизация, я хочу кратко остановиться на распространенной альтернативе — автоклаве, который я только что обсуждал.Это устройство, которое использует пар под давлением, как в супер-неудобной паровой сауне для микробов, чтобы убить все живое, находящееся внутри него.
Как вы понимаете, такая неудобная среда может также повредить чувствительные инструменты, расходные материалы и оборудование, которые нельзя помещать в условия высокой температуры или высокого давления. Таким образом, существуют альтернативы стерилизации в автоклаве, а именно газовая стерилизация оксидом этилена, о которой также рассказывается в другом уроке, и холодная химическая стерилизация этого урока.
Холодная (химическая) стерилизация — это использование жидких химических растворов для стерилизации медицинских инструментов. Не все предметы можно стерилизовать с помощью жидких химикатов. Чтобы этот метод был эффективным, его необходимо использовать на относительно гладких, устойчивых к влаге предметах, открытых со всех сторон. Это означает, что предмет, помещаемый внутрь химического стерилизатора, должен иметь такую форму, чтобы жидкий стерилизатор мог контактировать со всеми его поверхностями одновременно. Если в раствор помещается сложный инструмент, его следует полностью открыть или разобрать перед стерилизацией.
Кроме того, предметы, помещенные в холодный стерилизатор, должны быть чистыми и сухими. Это означает, что вся ткань, кровь, гной, слюна и т.п. должны быть физически очищены от предмета перед помещением в раствор. Вся эта кровавая штука — отличный способ изолировать микроорганизмы от стерилизатора. По сути, они похожи на щит вокруг микроорганизмов, потому что химическому стерилизатору трудно проникнуть сквозь них.
Изделие также должно быть сухим, чтобы избыток воды не разбавлял химический раствор и не превращал его в неэффективное химическое стерилизующее средство.Точно так же, как вы не разбавляете моторное масло водой, вы также не хотите разбавлять химический стерилизатор. Ни в том, ни в другом сценарии ничего хорошего не принесет.
Растворы и применение
Растворы, используемые при холодной химической стерилизации, должны быть некоррозионными, чтобы не повредить медицинский инструмент, и их всегда следует смывать с предмета стерильной водой или стерильным физиологическим раствором и сушить стерильным полотенцем перед использованием на нем. пациент! В противном случае химический раствор может серьезно повредить ткани пациента.
Существует множество различных растворов, которые можно использовать для холодной химической стерилизации. Всегда соблюдайте инструкции производителя по использованию, особенно время контакта, необходимое для соответствующей стерилизации.
Самый важный холодный химический стерилизатор, который мы используем, называется глутаровым альдегидом , , и это химическое вещество имеет много разных торговых наименований, например, Cidex. Другие виды растворов, называемые перуксусной кислотой (Spor-Klenz), хлоргексидином (Nolvasan), четвертичным аммонием (Pink Germicide) и 70-процентным изопропиловым спиртом, обычно не используются, поскольку они вызывают коррозию инструментов, или не должны использоваться в качестве исходного химического вещества. стерилизующий раствор, так как они не так эффективны против опасных бактериальных спор.Однако иногда они используются в качестве стерилизатора между хирургическими вмешательствами на некоторых инструментах.
Краткое содержание урока
Стерилизация — это процесс уничтожения всех организмов на неодушевленных предметах, а на некоторых инструментах используется особая форма стерилизации, называемая холодной химической стерилизацией. Холодная (химическая) стерилизация — это использование жидких химических растворов для стерилизации медицинских инструментов.
Для того, чтобы этот метод был эффективным, его необходимо использовать на относительно гладких, устойчивых к влаге предметах, открытых со всех сторон, чистых и сухих.Также помните, что наиболее важным используемым нами холодным химическим стерилизатором является глутаровый альдегид , и это первый предпочтительный холодный химический стерилизатор.
Условия холодной химической стерилизации
| Условия | Определения |
|---|---|
| Стерилизация | Процесс уничтожения всех организмов на неодушевленных предметах |
| Холодная (химическая) стерилизация | Применение жидких химических растворов для стерилизации медицинских инструментов |
| Глутаральдегид | самый важный холодный химический стерилизатор |
Результаты обучения
По мере завершения этого урока учащиеся должны уметь:
- Определить стерилизацию
- Опишите процесс холодной (химической) стерилизации
- Напомним значение вещества, называемого глутаровым альдегидом
Методы обеззараживания для лабораторного использования
Влажное тепло
Влажное тепло — самый надежный метод стерилизации.
Автоклавирование, иногда называемое стерилизацией паром, является наиболее удобным методом быстрого уничтожения всех форм микробной жизни. В автоклавах используется насыщенный пар под давлением примерно 15 фунтов на квадратный дюйм для достижения температуры камеры не менее 250 ° F (121 ° C) в течение заданного времени — обычно 30–60 минут.
Типичные области применения: Автоклавирование — надежный метод стерилизации лабораторного оборудования и обеззараживания биологически опасных отходов.
Ссылки по теме:
Сухой жар
Сухой жар менее эффективен, чем влажный, и требует более длительного времени и / или более высоких температур для достижения стерилизации.Он подходит для уничтожения жизнеспособных организмов на непроницаемых неорганических поверхностях, таких как стекло, но он ненадежен в присутствии мелких слоев органических или неорганических материалов, которые могут действовать как изоляция.
Типичные применения: Стерилизацию стеклянной посуды сухим жаром обычно можно выполнять при 160–170 ° C в течение 2–4 часов.
Меры предосторожности: Регулярно контролируйте стерилизаторы влажного и сухого тепла, используя соответствующие биологические индикаторы [полоски со спорами].
Жидкие дезинфицирующие средства обычно можно разделить на галогены, кислоты, щелочи, соли тяжелых металлов, соединения четвертичного аммония, фенольные соединения, альдегиды, кетоны, спирты и амины.
Эффективность жидкого дезинфицирующего средства зависит от организма, концентрации, времени контакта и других условий использования. Выбирайте только жидкие дезинфицирующие средства, эффективность которых против присутствующих организмов подтверждена.Никакое жидкое дезинфицирующее средство не является одинаково полезным или эффективным при любых условиях и для всех жизнеспособных агентов.
Типичные области применения: Жидкие дезинфицирующие средства используются для дезинфекции поверхностей и, при использовании в достаточной концентрации, в качестве дезинфицирующего средства для жидких отходов перед окончательной утилизацией. Всегда используйте химические дезинфицирующие средства в соответствии с инструкциями на этикетке. Не используйте химические дезинфицирующие средства с истекшим сроком годности.
Меры предосторожности: Чем более химически активным является соединение, тем более вероятно, что оно будет токсичным и коррозионным.
- Рекомендуемые дезинфицирующие средства, их использование и требования см. В «Сводке дезинфицирующих средств » (Excel) (PDF). ПРИМЕЧАНИЕ. В таблице приведены рекомендации по обеззараживанию поверхности.
- Для химической дезинфекции жидких биологически опасных отходов единственным дезинфицирующим средством, одобренным университетом для Калифорнийского университета в Сан-Диего, является отбеливатель ( 1 часть отбеливателя на 9 частей жидких отходов, время контакта 30 минут, затем следует очистка сточных вод ).
- Если ваша лаборатория желает узнать об использовании альтернативных дезинфицирующих средств для инактивации жидких биологически опасных отходов, отправьте электронное письмо со следующей информацией.Вы получите ответ в течение 5 (пяти) рабочих дней относительно утверждения.
- Дезинфицируемый материал
- Используемый химикат
- Концентрация химикатов
- Время контакта
- Способ утилизации (канализация, вывоз опасных отходов)
Ссылки по теме:
Пары и газы при использовании в закрытых системах и в контролируемых условиях температуры и влажности обеспечивают отличную дезинфекцию.К агентам этой категории относятся аэрозольная, паровая или газовая фаза диоксида хлора, глутаральдегида, параформальдегида, этиленоксида, надуксусной кислоты и перекиси водорода.
Типичные применения: Пары и газы в основном используются для дезактивации шкафов биобезопасности, помещений для животных и связанных с ними систем, громоздкого или стационарного оборудования, не подходящего для жидких дезинфицирующих средств, инструментов или оптики, которые могут быть повреждены другими методами дезинфекции, а также комнат, зданий, и сопутствующие системы кондиционирования воздуха.
Осторожно: В связи с их опасным характером, свяжитесь с EH&S Biosafety, (858) 534-5366, чтобы узнать о специальных требованиях по мониторингу, если эти соединения будут использоваться.
Ссылки по теме:
Ионизирующий
Ионизирующее излучение уничтожает микроорганизмы, но не является практическим инструментом для лабораторного использования.
Неионизирующий
Диапазон УФ-С ультрафиолетового (УФ) излучения содержит волны с длиной волны (250–270 нм, оптимальная — 265), которые эффективно уничтожают большинство микроорганизмов в воздухе, воде и на поверхностях.Организмы должны подвергаться прямому воздействию ультрафиолета; грязь, пыль и тени могут защитить от организмов, ограничивая эффективность УФ-лампы.
Типичные области применения: Ультрафиолетовое излучение обычно используется для снижения уровней переносимых по воздуху микроорганизмов и поддержания хорошей гигиены воздуха в воздушных шлюзах, помещениях для содержания животных, вентилируемых шкафах и лабораторных помещениях. УФ также используется в шкафах биологической безопасности (BSC) и в некоторых лабораторных помещениях для уменьшения поверхностного загрязнения.
Меры предосторожности: УФ может вызвать ожоги глаз (фотокератит) и кожи людей, подвергшихся воздействию даже на короткий период времени.
Соблюдайте следующие меры предосторожности:
- Активировать УФ-свет только тогда, когда в помещении никого нет.
- Используйте надлежащую защиту при использовании УФ-ламп.
- Блокирующие УФ-лампы используются для дезактивации пространства с общим освещением комнаты или шкафа, поэтому включение света выключает УФ-излучение.
- Предупредить новый и посещающий персонал об опасном воздействии УФ-излучения и о необходимых мерах предосторожности.
Техническое обслуживание
Поскольку интенсивность УФ-лампы (ее разрушительная сила) со временем снижается, надлежащее техническое обслуживание имеет решающее значение для целей обеззараживания.Выполняйте это регулярное техническое обслуживание:
- Ежемесячно проверяйте эффективность лампы с помощью УФ-метра или контрольной полоски.
- Очищайте УФ-лампы каждые несколько недель, чтобы предотвратить накопление пыли и грязи, что резко снижает эффективность УФ-лампы.
Химические методы контроля
Среди важных критериев выбора антисептика или дезинфицирующего средства — концентрация дезинфицирующего средства, которое будет использоваться, является ли средство бактерицидным или бактериостатическим, природа обрабатываемого материала, будут ли присутствовать органические вещества, температура и pH, при которых будет использоваться химический агент, и доступное время, в течение которого химический агент будет оставаться в контакте с испытуемой поверхностью.
Методы оценки. Для оценки антисептика или дезинфицирующего средства используется тест на фенольный коэффициент . В этом тесте готовятся различные разведения химического агента и тестируются против эквивалентных разведений фенола с такими бактериями, как Staphylococcus aureus и Salmonella typhi . Коэффициент фенола (ПК) больше единицы означает, что химический агент более эффективен, чем фенол, и меньше единицы, что он менее эффективен.
Альтернативным тестом является тест в эксплуатации. Приготавливаются различные разведения химического агента и тестируются на стандартизированном препарате тестовых бактерий на типе материала, который впоследствии будет продезинфицирован при нормальном использовании.
Фенол. Одним из первых химикатов, использованных для дезинфекции, был фенол . Впервые использованный Джозефом Листером в 1860-х годах, он является стандартом для большинства других антисептиков и дезинфицирующих средств. Производные фенола, называемые фенолами , содержат измененные молекулы фенола, полезные в качестве антисептиков и дезинфицирующих средств.Фенольные смолы повреждают клеточные мембраны и инактивируют ферменты микроорганизмов, денатурируя их белки. Они включают крезолов , таких как лизол, а также несколько бисфенолов , таких как гексахлорофен, который особенно эффективен против стафилококков (рис. 1).
Набор химических дезинфицирующих и антисептических средств .
Химический агент, напоминающий фенолы, — это хлоргексидин (Hibiclens), который используется для дезинфекции кожи в качестве альтернативы гексахлорофену.Он сохраняется на коже и эффективен против растущих бактерий, но не спор.
Галогены. Среди галогенных антисептиков и дезинфицирующих средств — хлор и йод. Йод применяется в виде настойки йода, спиртового раствора. Комбинации йода и органических молекул называются йодофорами . Они включают бетадин и изодин, оба из которых содержат поверхностно-активное вещество, называемое повидоном. Йод соединяется с микробными белками и подавляет их функцию.
Хлор также соединяется с микробными белками. Используется как гипохлорит натрия (отбеливатель). В виде гипохлорита кальция хлор используется для дезинфекции оборудования на молочных заводах, скотобойнях и ресторанах. Хлорамины содержат хлор вместе с аммиаком. Они используются для дезинфекции стеклянной посуды и столовых приборов и эффективны в присутствии органических веществ. Хлор также используется в качестве газа для поддержания низкого уровня микробов в питьевой воде.
Спирты.Спирты являются полезными химическими агентами при использовании против бактерий и грибков, но они не действуют на споры бактерий. Наиболее распространенным типом спирта является 70-процентный этиловый спирт (этанол). Изопропиловый спирт (медицинский спирт) также можно использовать в качестве антисептика и дезинфицирующего средства. Поскольку спирты быстро испаряются, они не оставляют следов и полезны для очистки кожи перед инъекциями (рис. 1).
Тяжелые металлы. Ряд из тяжелых металлов обладают антимикробной способностью.Например, серебро используется в качестве нитрата серебра в глазах новорожденных для защиты от заражения Neisseria gonorrheae . Также его применяют для прижигания ран. Медь используется в качестве сульфата меди для замедления роста водорослей в плавательных бассейнах, аквариумах и водоемах. Цинк используется как хлорид цинка в жидкостях для полоскания рта и как оксид цинка в качестве противогрибкового агента в красках. Считается, что тяжелые металлы действуют путем объединения с сульфгидрильными группами клеточных белков.
Мыло и моющие средства. Мыло и моющие средства уменьшают поверхностное натяжение между микроорганизмами и поверхностями и тем самым помогают очистить поверхность. Мыло эмульгирует масляную пленку на поверхности тела, удаляя масла, мусор и микроорганизмы, обезвреживая кожу. Катионные моющие средства представляют собой соединения четвертичного аммония . Они солюбилизируют клеточные мембраны микроорганизмов. Среди популярных соединений — Зефиран (хлорид бензалкония) и Цепакол (хлорид цетилпиридиния) (рис. 1).
Альдегиды. Два альдегида , формальдегид и глутаральдегид, инактивируют микробные белки, сшивая функциональные группы в белках. Формальдегид обычно используется в качестве формалина, 37-процентного раствора газообразного формальдегида. Он широко используется для бальзамирования. Глутаральдегид используется в качестве жидкости для стерилизации больничного оборудования. Однако для уничтожения спор бактерий требуется несколько часов (рис. 1).
Окись этилена. Стерилизация может быть достигнута с помощью химического вещества, известного как оксид этилена (ETO). Это химическое вещество денатурирует белки и уничтожает все микроорганизмы, включая споры бактерий. Он используется при высоких температурах в камере с оксидом этилена. Несколько часов необходимо для воздействия и удаления газа, который может быть токсичным для человека. ETO широко используется для изготовления пластиковых инструментов, таких как чашки Петри, шприцы и искусственные клапаны сердца (рис. 1). Оксид пропилена , подобное соединение, также ценно как стерилизующее средство.
Окислители. Окислители, такие как перекись водорода убивают микроорганизмы, выделяя большое количество кислорода, который способствует изменению микробных ферментов. Перекись водорода полезна для обработки неодушевленных предметов и пищевых продуктов, но на поверхности кожи она быстро расщепляется ферментом каталазой, высвобождая кислород. Этот кислород заставляет рану пузыриться и тем самым удаляет присутствующие микроорганизмы. Однако химическая активность на коже ограничена по сравнению с неодушевленными поверхностями.Контактные линзы можно продезинфицировать перекисью водорода.
Двумя другими окислителями являются пероксид бензоила и озон. Перекись бензоила наносится на кожу для лечения прыщей, вызванных анаэробными бактериями. Кислород, выделяемый соединением, подавляет анаэробный рост. Озон можно использовать для дезинфекции воды, где он окисляет клеточные компоненты заражающих микробов.
Консерванты пищевые. Пищевые продукты можно консервировать, используя органических кислот для поддержания низкой микробной популяции.Сорбиновая кислота используется в ряде кислых продуктов, включая сыр, для предотвращения роста микробов. Бензойная кислота также подавляет рост грибков и используется в кислой пище и безалкогольных напитках. Пропионовая кислота кальция предотвращает рост плесени в хлебе и хлебобулочных изделиях.
.