Этапы предстерилизационной очистки
Дезинфекция медицинских изделий путем погружения в
3% растор хлорамина или 1% раствор гипохлорита кальция на 60 мин, или раствор Пресепта на 90 мин. Перчатки после операции дезинфи-цируются путем погружения их в 3% раствор хлорамина или 6% перекись водорода на 1 час.
Тщательное промывание изделий под проточной водой,
удаляя все загрязнения щетками. Изделия с каналами и полостями промывают с помощью шприцев, резиновых баллонов и пр..
3. Замачивание изделий в разобранном виде с заполнением каналов и полостей в горячем моющем растворе /температура 40% — 50% C/ в течение 15 минут. В процессе обработки температура моющего раствора не поддерживается.
Для замачивания могут использоваться:
0.
 5%
моющий раствор порошка «Билот» /5
г порошка и 995 мл воды температуры 40% —
45% C/;
5%
моющий раствор порошка «Билот» /5
г порошка и 995 мл воды температуры 40% —
45% C/;раствор, содержащий 5 г моющего средства /»Прогресс», «Астра», «Лотос»/ + 20 мл 33% раствора перекиси водорода /пергидроль/ + 975 мл воды температуры 50-55% С;
3% натрий двууглекислый /питьевая сода/;
0,5% перекись водорода с моющими средствами «Лотос», «Лотос-автомат», «Астра», «Айна», «Маричка», «Професс». К этому комплексу добавляется ингибитор коррозии – 0,14% раствор олеата натрия. Моющий комплекс с перекисью водорода можно использовать в течение суток до 6 раз с момента приготовления при условии, что цвет раствора не изменился. Другие моющие растворы используются однократно.
4. Кипячение в течение 15 мин. при полном погружении изделий в один из следующих растворов:
сода питьевая 2%;
моющие средства «Лотос», «Лотос-автомат» 1,5%.

При использовании кипячения предстерилизационная очистка объединяется в один процесс с дезинфекцией.
5. Мойка инструментов в использовавшемся моющем растворе ершами или ватно-марлевыми тампонами в течение 0,5 минуты. Изделия с внутренними каналами промывают с помощью шприцев или баллонов, иглы прочищают мандренами. Механизированная предстерилизационная очистка медицинских изделий с использованием моечных машин и ультразвуковых установок мо-жет производиться только с применением разрешенных для этих целей препаратов в соответствии с инструкцией, прилагаемой к оборудованию.
6. Промывание инструментов под проточной водой для уда-ления остатков моющих средств. При использовании порошка «Биолот» в течение 3 минут, «Прогресс» — 5-6 минут, «Бланизол» — 5 минут, «Астра» и «Лотос» – 10 минут, натрий двууглекистый — 50 минут.
7.
Ополаскивание изделий в дистиллированной
воде в тече-ние 0,5-1 минуты для обессоливания.
Подсушка инструментария — проводится в сухожаровом
шкафу при температуре 80-90 гр.С в течение 15-20 мин. /до полного исчезновения влаги при визуальном контроле/.
2.1.1. Контроль качества предстерилизационной очистки.
Проводится после завершающего этапа предстерилизационной очистки — подсушивания инструментов. Выполняют пробы на наличие остатков крови и моющих средств на инструментах, шприцах, иглах и пр.
Для выявления остатков крови проводят амидопириновую или азопирамовую пробы, а, если это невозможно, — бензидиновую или ортотолидиновую пробы.
Амидопириновая проба.
Смешивают равные количества 0,5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водорода /по 2-3 мл/.
На
нестерильную вату наносят вышеказанный
реактив. Через несколько секунд при
отсутствии цветовой реакции на вате,
этой ватой протирают инструменты или
поршень щприца многоразового использования,
цилиндр с наружной стороны, иглы, канюлю
внутри.
После этого закрепляют на шприце иглу, вновь наливают в цилиндр реактив и пропускают через шприц и иглу /проверяется игла/.
Оценка результатов амидопириновой пробы.
при наличии кровяных загрязнений на вате появляется сине-зеленое окрашивание; окрашивание может быть и при наличии на шприце, а также в игле, лекарственных средств и хлорамина;
при положительных пробах повторный контроль инструмента проводят до получения трехкратного отрицательного результата.
/Из методических рекомендаций по предстерилизационной очистке изделий медицинского назначения N 28 — 6/13 от 08.06.82 г/.
Азопирамовая проба.
Готовят
в аптеке 1% или 1,5% раствор солянокислого
анилина в 95% этиловом спирте. Готовый
раствор может храниться в плотно закрытом
флаконе в темноте /в холодильнике/ 2
месяца, в комнате при температуре + 18-23
гр.С не более одного месяца. Умеренное
пожелтение реактива, наступающее в
процессе хранения, без выпадения осадка
не снижает его рабочих качеств.
Непосредст-венно перед постановкой
пробы готовят рабочий раствор, смешивая
равные по объему количества азопирама
и 3% перекиси водорода. Рабочий раствор
должен быть использован в течение 1-2
часов. При более длительном хранении
может появиться спонтанное розовое
окрашивание реактива. При температуре
+25 гр.С. раствор розовеет быстрее. Поэтому
его наиболее целесообразно использовать
в течение 30-40 минут после приготовления.
Из-за изменения окраски раствора в
условиях высокой температуры нельзя
держать его на ярком свете, вблизи
отопительных приборов, наносить на
горячие инструменты.
Готовый
раствор может храниться в плотно закрытом
флаконе в темноте /в холодильнике/ 2
месяца, в комнате при температуре + 18-23
гр.С не более одного месяца. Умеренное
пожелтение реактива, наступающее в
процессе хранения, без выпадения осадка
не снижает его рабочих качеств.
Непосредст-венно перед постановкой
пробы готовят рабочий раствор, смешивая
равные по объему количества азопирама
и 3% перекиси водорода. Рабочий раствор
должен быть использован в течение 1-2
часов. При более длительном хранении
может появиться спонтанное розовое
окрашивание реактива. При температуре
+25 гр.С. раствор розовеет быстрее. Поэтому
его наиболее целесообразно использовать
в течение 30-40 минут после приготовления.
Из-за изменения окраски раствора в
условиях высокой температуры нельзя
держать его на ярком свете, вблизи
отопительных приборов, наносить на
горячие инструменты.
Пригодность
рабочего раствора азопирама проверяют
при необходимости путем нанесения 2-3
его капель на кровяное пятно.
/Выписка из инструктивно-методических рекомендаций по контролю качества предстерилизационной очистки изделий меди-цинского назначения с помощью реактива азопирам N 28-6/13 от 26.05.86 г./.
Бензидиновая проба.
Не позднее чем за 2 часа до проведения пробы готовят реактив. В мезурку помещают несколько кристаллов бензидина, 2-3 мл 50% уксусной и кислоты столько же 2% раствора перекиси водорода.
Ортолидиновая проба.
Состав реактива: 2-3 мл 50% уксусной кислоты, 0,25 г орто-лидина и 2-3 мл 3% перекиси водорода.
Презентация на тему «Предстерилизационная очистка»
Предстерилизационная очистка Баннова О. В
В
Предстерилизационная очистка является вторым этапом обработки медицинских инструментов, которая проводится после дезинфекции и отмывки изделий от дезинфектанта, с целью окончательного удаления остатков белковых, жировых, механических загрязнений, лекарственных препаратов и т.д.
От полноты и качества проведения предстерилизационной очистки непосредственно зависит эффективность последующей стерилизации, поэтому нормативами в практику введен обязательный контроль качества предстерилизационной очистки, осуществляемый как самим лечебно-профилактическим учреждением, так и специалистами Роспотребнадзора. Это, в частности, пробы, регистрирующие остатки крови на инструментах -азопирамовая и амидопириновая,- а также выявляющие остаточные количества моющих средств: фенолфталеиновая
Этапы предстерилизационной очистки 1 этап: помещение в накопитель
5 слайд Описание слайда:2 этап: помещение в дез. средство и выдержка экспозиции
средство и выдержка экспозиции
3 этап: промывка под проточной водой
7 слайд Описание слайда:4 и 5 этапы: добавление моющего средства и механическая очистка
8 слайд Описание слайда:6 этап: промывка под проточной водой
9 слайд Описание слайда:7 этап: дистиллированная вода
10 слайд Описание слайда:8 этап: сушка
11 слайд Описание слайда:9 этап: проба
12 слайд Описание слайда:10 этап: упаковка
13 слайд Описание слайда:11 этап: стерилизация
14 слайд Описание слайда:Контроль качества ПСО
15 слайд Описание слайда:Азопирановая проба В рамках такого исследования после предстерилизационной очистки можно выявить наличие окислительных компонентов, содержащих хлор. Дополнительно проба показывает гемоглобин, ржавчину, остатки использованных при очистке веществ, в том числе порошков для стирки.
Дополнительно проба показывает гемоглобин, ржавчину, остатки использованных при очистке веществ, в том числе порошков для стирки.
Как это сделано? Азопирам состоит из следующих соединений: солянокислый анилин в количестве одного миллилитра и в сто раз больше амидопирина. Процесс приготовления довольно простой. В сухой емкости смешивают оба вещества, добавляют спирт в концентрации 96%, пока общий объем не достигнет литра. Затем раствор перемешивают специальной палочкой, дожидаясь полного растворения сухих компонентов. Это вещество можно довольно долго хранить, если поместить в надежный стеклянный флакон с плотно закрывающейся крышкой. В холодильнике при температуре не выше четырёх градусов срок годности – 60 дней, в два раза меньше раствор для пробы хранится, если в помещении поддерживается температура 18-20 градусов.
Особенности пробы При хранении состав со временем может приобрети желтоватый оттенок. Если это не сопровождается выпадением осадка, значит, все в норме, рабочие свойства сохранены в полной мере. Перед использованием пробу необходимо подготовить. Для работы требуется трехпроцентный раствор водородной перекиси и приготовленный по описанному выше рецепту препарат. Длительность воздействия на исследуемую поверхность – 60 секунд. При выявлении загрязнения обработанные участки приобретают специфический цвет. Если обнаружены компоненты крови, азопирам трансформируется в синеватый или фиолетовый, ржавчина и хлор провоцируют изменение оттенка на бурый. Моющие компоненты вызывают смену окраски на розовую. Для получения корректного результата необходимо обрабатывать изделия, температура поверхности которых варьируется от 18 до 25 градусов. Подготовленный из водородной перекиси и азопирама раствор пригоден для применения два часа с момента смешивания.
Подготовленный из водородной перекиси и азопирама раствор пригоден для применения два часа с момента смешивания.
Амидопириновая проба Это соединение позволяет проверить наличие на исследуемой поверхности компонентов крови. Для приготовления препарата необходимо иметь в своем распоряжении трехпроцентный раствор перекиси водорода, уксусную кислоту в концентрации 30%, а также пятипроцентный раствор амидопирина на спирте. Ингредиенты смешивают в равном объеме в специальной чистой, сухой емкости.
19 слайд Описание слайда:Применение пробы довольно простое. Смесь перечисленных ингредиентов наносится на те части инструмента, которые соприкасались с поверхностью раны. Обязательно проверяются все подвижные элементы и участки. Если на поверхности обнаружены компоненты крови, индикация либо мгновенная, либо проявляется в ближайшее время – не более 60 секунд с момента контакта. Участок приобретает синеватый, зеленоватый или фиолетовый оттенок. Если обработанная поверхность сменила цвет через две минуты или позднее, такой результат не учитывается как показатель загрязненности – он провоцируется контактом с компонентами окружающей среды. Так как состав довольно нестойкий, эффективным будет применение только подготовленного непосредственно перед применением раствора.
Обязательно проверяются все подвижные элементы и участки. Если на поверхности обнаружены компоненты крови, индикация либо мгновенная, либо проявляется в ближайшее время – не более 60 секунд с момента контакта. Участок приобретает синеватый, зеленоватый или фиолетовый оттенок. Если обработанная поверхность сменила цвет через две минуты или позднее, такой результат не учитывается как показатель загрязненности – он провоцируется контактом с компонентами окружающей среды. Так как состав довольно нестойкий, эффективным будет применение только подготовленного непосредственно перед применением раствора.
На нестерильную вату наносят реактив. Через несколько секунд при отсутствии цветовой реакции на вате, этой ватой протирают инструменты или поршень щприца многоразового использования, цилиндр с наружной стороны, иглы, канюлю внутри.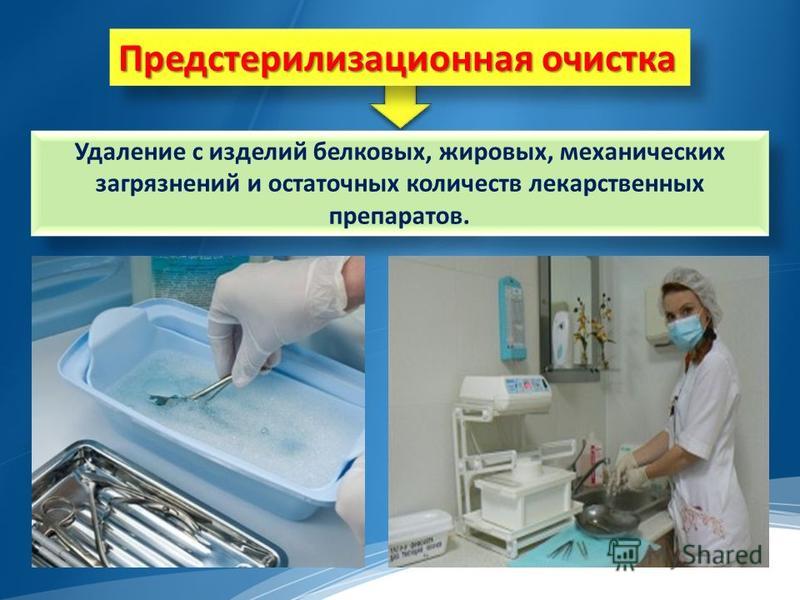 Затем заливают реактив в цилиндр шприца, пропускают его через шприц на другую вату (проверяется цилиндр шприца). После этого закрепляют на шприце иглу, вновь наливают в цилиндр реактив и пропускают через шприц и иглу (проверяется игла)
Затем заливают реактив в цилиндр шприца, пропускают его через шприц на другую вату (проверяется цилиндр шприца). После этого закрепляют на шприце иглу, вновь наливают в цилиндр реактив и пропускают через шприц и иглу (проверяется игла)
Фенолфталеиновая проба Фенолфталеин в виде раствора на спирте используют для выявления следов моющих компонентов. Это соединение позволяет проконтролировать эффективность очистки поверхности медицинского инструментария
22 слайд Описание слайда:В процессе постановки пробы на инструмент наносится пара капель рабочего соединения, причем в первую очередь необходимо проконтролировать качество очистки тех элементов, где инструментарий соприкасается с поверхностью раны, а также участки подвижного соединения. Если проба показывает изменение оттенка рабочего состава на розовый, можно сделать вывод о наличии моющих соединений. Инструментарий, подвергнутый обработке фенолфталеиновой пробой, дополнительно очищают от реактива, замачивают в моющем соединении, снова повторяют все этапы предстерилизационной очистки.
Если проба показывает изменение оттенка рабочего состава на розовый, можно сделать вывод о наличии моющих соединений. Инструментарий, подвергнутый обработке фенолфталеиновой пробой, дополнительно очищают от реактива, замачивают в моющем соединении, снова повторяют все этапы предстерилизационной очистки.
Особенности постановки Фенолфталеиновая проба может использоваться для контроля очистки игл. Для этого необходимо наполнить шприц без коррозийных следов реактивом и пропустить соединение через все иглы, которые нужно проверить, последовательно – их по очереди устанавливают на контрольный шприц. В рамках проверки используется марлевая салфетка, на которую через каждую иглу проводится до четырех капель реактива. Для повышения эффекти
Этапы предстерилизационной очистки. Контроль качества предстерилизационной очистки изделий медицинского назначения :: SYL. ru
ru
Как проводится в лечебном учреждении обработка инструментария с целью предупреждения внутрибольничных заболеваний? Достаточно ли простого ополаскивания под проточной водой? Профессионалы знают точно: сначала необходима предварительная обработка, после которой делают стерилизацию. Лишь корректная, с использованием самых современных методов медицинская предстерилизационная очистка, после которой контролируется качество исполнения работ, может гарантировать, что изделия будут эффективно очищены. А это, в свою очередь, позволяет предупредить эпидемию в стенах лечебного учреждения. Пренебрегать средствами для предстерилизационной очистки категорически недопустимо.
О чем идет речь?
Обработка изделий перед стерилизацией – это такое комплексное мероприятие, в рамках которого удаляются различные загрязнения (препараты, жиры, белки). Корректная дезинфекция изделий медицинского назначения повышает эффективность последующей стерилизации. Одновременно с этим понижается вероятность пирогенных реакций. Ответственность за дезинфекцию изделий медицинского назначения возложена на персонал лечебного учреждения.
Ответственность за дезинфекцию изделий медицинского назначения возложена на персонал лечебного учреждения.
Комплекс мероприятий включает несколько последовательных шагов. В больнице назначают лицо, ответственное за исполнение этих операций, и именно его задачей будет реализовывать все предварительные шаги обработки изделий. Нельзя пренебрегать каким-либо из этапов предстерилизационной очистки, так как от этого зависит не только качество медицинских услуг, но и безопасность персонала и клиентов учреждения.
Основные шаги
В первую очередь предметы, подлежащие обработке, помещают в емкость с концентрированным раствором для дезинфекции. Необходимо помнить, что замачивание изделий в моющем растворе предполагает тщательный контроль за временными промежутками, установленными производителем конкретного состава. Нередко этап делят на два шага: сначала дезинфицируют с учетом экспозиции, после чего еще на четверть часа помещают инструментарий в раствор для очистки.
Следующий шаг обработки – промывка неразъемных, разъемных изделий. Для этого заранее готовят раствор, который используют при помощи тампонов из ваты, марли. Можно применять специальные ёршики для чистки. Поле работы их допускается тщательно промыть и высушить для последующего применения, а вот марля, вата – строго одноразовые. Особенное внимание на этом этапе предстерилизационной очистки уделяют местам соединения, каналам, просветам, замкам.
Для этого заранее готовят раствор, который используют при помощи тампонов из ваты, марли. Можно применять специальные ёршики для чистки. Поле работы их допускается тщательно промыть и высушить для последующего применения, а вот марля, вата – строго одноразовые. Особенное внимание на этом этапе предстерилизационной очистки уделяют местам соединения, каналам, просветам, замкам.
Что дальше?
Следующий шаг – ополаскивание предметов. Для этого необходим мощный водяной поток. Длится этап предстерилизационной очистки до тех пор, пока не удастся качественно удалить все следы дезинфицирующего состава и моющего раствора. Дополнительно контролируют наличие запаха. Мыть инструментарий нужно до полного исчезновения специфических «ароматов». Когда шаг успешно выполнен, предметы полминуты ополаскивают в дистиллированной воде.
Следующий этап предстерилизационной очистки – просушка обработанного инструментария. Есть два широко распространённых варианта: естественная сушка на открытом воздухе и применение специального шкафа, внутри которого воздух прогревается до 85 градусов по шкале Цельсия.
По завершении этого этапа можно приступать к контрольному шагу предстерилизационной очистки изделий медицинского назначения – пробам. Используется несколько методик, позволяющих проверить, насколько эффективно были обработаны предметы. Специалисты обращают внимание: нельзя пренебрегать хотя бы одним из описанных шагов предстерилизационной очистки изделий медицинского назначения. От этого зависит безопасность, эпидемиологическая обстановка, возможность работать и проходить лечение в медицинском учреждении.
Чистый инструмент – залог безопасности
Опыт многочисленных больниц показывает, что халатное отношение к вопросу обработки инструментария очень часто приводит к серьезным последствиям для здоровья людей. Нередко причиной некорректной подготовки изделий является невысокий уровень квалификации работников, на которых возлагается ответственность за этот процесс. Далеко не все в настоящее время знают, что такое ультразвуковая очистка медицинских инструментов, какие еще виды существуют, для какой категории инструментария какую методику лучше применять. К сожалению, не всякий работник осознает, насколько важно корректно и эффективно обрабатывать все используемые в работе изделия.
К сожалению, не всякий работник осознает, насколько важно корректно и эффективно обрабатывать все используемые в работе изделия.
В нашей стране правила очистки предметов, применяемых в медицинских учреждениях, были декларированы специальным нормативным актом, обязательным к соблюдению во всех профильных организациях. Контроль качества предстерилизационной очистки, его важность, меры, для его реализации применяемые, – все это официально установлено в 2003 году требованиями, подписанными главсанврачом государства.
Время от времени в этот документ вносятся поправки, делающие его более современным. Благодаря постоянной корректировке можно не сомневаться, что контроль качества предстерилизационной очистки, выполняемый в соответствии с установленными нормами, даст корректный результат, и внутрибольничная инфекция будет предотвращена.
Особенности очистки медицинского инструментария
Уже в 1994 г. в официальных нормативных актах было постановлено, что в стенах медицинских учреждений необходимо применять специальную аппаратуру для мытья используемых инструментов. Тогда же признали, что ручная очистка применима лишь в том случае, когда объем работ невелик, а сами изделия не слишком сложны по своей конструкции, то есть работа руками может быть эффективной и качественной.
Тогда же признали, что ручная очистка применима лишь в том случае, когда объем работ невелик, а сами изделия не слишком сложны по своей конструкции, то есть работа руками может быть эффективной и качественной.
Наиболее корректный подход к предстерилизационной очистке предполагает создание в рамках медицинского учреждения специального отделения, ответственного именно за эту задачу. Здесь размещают аппаратуру, принимают на работу квалифицированных сотрудников, возлагая на них ответственность за своевременную обработку всего используемого инструментария. Медицинский персонал должен регулярно контролировать пригодность применяемых в работе машин, быть в курсе правил эксплуатации. Важно помнить, что качественные показатели автоматов определяют эффективность очистительных мер. Для контроля эффективности обработки изделия ставится фенолфталеиновая, амидопириновая проба или другая, разрешенная в настоящее время для такой работы.
Проблематика вопроса
В современных условиях в стенах медицинского учреждения довольно сложно действительно эффективно обработать инструментарий перед стерилизацией в силу нескольких причин, характерных для большей части регионов нашей страны. На первое место выходит качество используемой в работе воды. Это не зависит от докторов, хотя в частных клиниках нередко принимают решение об установке дополнительных очистительных сооружений для улучшения качества подаваемой из водопровода жидкости. А вот государственные клиники редко располагают такими возможностями. В то же время признано, что загрязненность, низкое качество трубопроводной системы приводят к тому, что в учреждения, жилые дома поступает не очень чистая вода.
На первое место выходит качество используемой в работе воды. Это не зависит от докторов, хотя в частных клиниках нередко принимают решение об установке дополнительных очистительных сооружений для улучшения качества подаваемой из водопровода жидкости. А вот государственные клиники редко располагают такими возможностями. В то же время признано, что загрязненность, низкое качество трубопроводной системы приводят к тому, что в учреждения, жилые дома поступает не очень чистая вода.
Не менее значимые сложности связаны с тем, что эффективная предстерилизационная очистка и последующая стерилизация требуют времени, и при нерациональном распределении рабочих ресурсов в учреждении может сложиться ситуация нехватки инструментария. Необходимо осознавать, что своевременная, эффективная обработка в соответствии с установленными требованиями, а также последующий контроль с использованием специальных проб (амидопириновая, фенолфталеиновая и другие) – это не просто чиновничья блажь, а залог безопасности персонала и клиентов.
Особенности предстерилизационной очистки
Если необходимо обработать хирургический инструментарий, в том числе применяемый для малоинвазивных операций, а также предметы, используемые в уходе за клиентами, бутылочки для детского питания, контейнеры, необходимо использовать специальные моечные машины. Каждая из категорий требует специфических условий и применяемых составов для очистки. Довольно высокую эффективность показывает термическая обработка, но она применима далеко не всегда. Ее результативность обусловлена долговременным влиянием повышенной температуры. Для усиления эффективности используются щелочные составы, устраняющие любые загрязнения с поверхности приборов (в том числе сложной конструкции). По итогам мероприятия ставится проба (фенолфталеиновая, азопирамовая).
В ряде случаев при повышенной загрязненности предметов рекомендовано дополнительно прибегать к вспомогательному этапу очистки – окислительному, предполагающему использование специфического состава.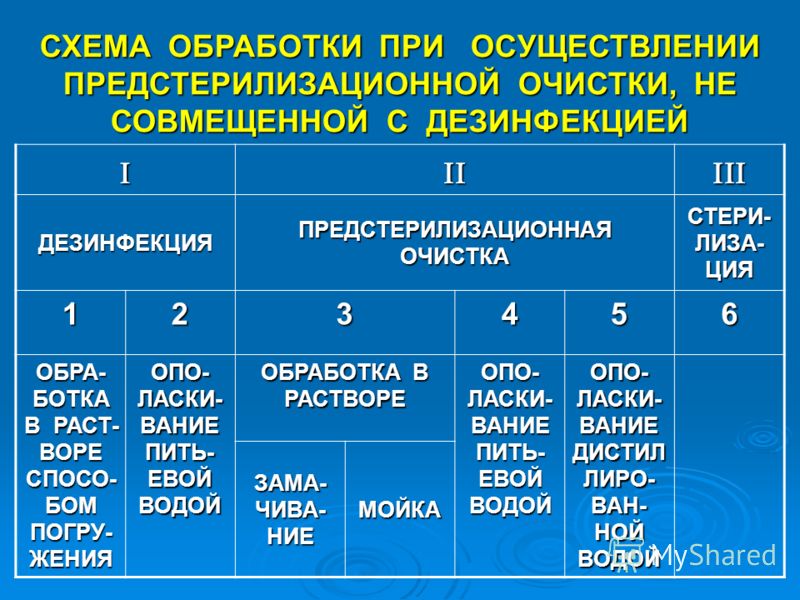 После его применения инструментарий нейтрализуют, дополнительно промывают, уже после этого дезинфицируют в условиях повышенной температуры.
После его применения инструментарий нейтрализуют, дополнительно промывают, уже после этого дезинфицируют в условиях повышенной температуры.
Если обработке необходимо подвергнуть изделие из материала, не обладающего стойкостью к повышенным температурам, нужно использовать специальные машины и компоненты для качественной предстерилизационной очистки. Предметы промывают с применением дезинфицирующих соединений, поддерживая температуру воды на заданном уровне (обычно 60 градусов).
Выбор в пользу конкретного активного компонента для мытья делают, ориентируясь на материал, из которого изготовлен инструментарий, а также на состояние обрабатываемых предметов. Необходимо использовать только растворимые в воде, почти не способные образовывать пену моющие средства, не вредящие во время мойки обрабатываемым изделиям.
Азопирановая проба
В рамках такого исследования после предстерилизационной очистки можно выявить наличие окислительных компонентов, содержащих хлор. Дополнительно проба показывает гемоглобин, ржавчину, остатки использованных при очистке веществ, в том числе порошков для стирки.
Как это сделано?
Азопирам состоит из следующих соединений: солянокислый анилин в количестве одного миллилитра и в сто раз больше амидопирина.
Процесс приготовления довольно простой. В сухой емкости смешивают оба вещества, добавляют спирт в концентрации 96%, пока общий объем не достигнет литра. Затем раствор перемешивают специальной палочкой, дожидаясь полного растворения сухих компонентов. Это вещество можно довольно долго хранить, если поместить в надежный стеклянный флакон с плотно закрывающейся крышкой. В холодильнике при температуре не выше четырёх градусов срок годности – 60 дней, в два раза меньше раствор для пробы хранится, если в помещении поддерживается температура 18-20 градусов.
Особенности пробы
При хранении состав со временем может приобрети желтоватый оттенок. Если это не сопровождается выпадением осадка, значит, все в норме, рабочие свойства сохранены в полной мере.
Перед использованием пробу необходимо подготовить. Для работы требуется трехпроцентный раствор водородной перекиси и приготовленный по описанному выше рецепту препарат. Длительность воздействия на исследуемую поверхность – 60 секунд.
Длительность воздействия на исследуемую поверхность – 60 секунд.
При выявлении загрязнения обработанные участки приобретают специфический цвет. Если обнаружены компоненты крови, азопирам трансформируется в синеватый или фиолетовый, ржавчина и хлор провоцируют изменение оттенка на бурый. Моющие компоненты вызывают смену окраски на розовую. Для получения корректного результата необходимо обрабатывать изделия, температура поверхности которых варьируется от 18 до 25 градусов. Подготовленный из водородной перекиси и азопирама раствор пригоден для применения два часа с момента смешивания.
Амидопириновая проба
Это соединение позволяет проверить наличие на исследуемой поверхности компонентов крови. Для приготовления препарата необходимо иметь в своем распоряжении трехпроцентный раствор перекиси водорода, уксусную кислоту в концентрации 30%, а также пятипроцентный раствор амидопирина на спирте. Ингредиенты смешивают в равном объеме в специальной чистой, сухой емкости.
Применение пробы довольно простое. Смесь перечисленных ингредиентов наносится на те части инструмента, которые соприкасались с поверхностью раны. Обязательно проверяются все подвижные элементы и участки. Если на поверхности обнаружены компоненты крови, индикация либо мгновенная, либо проявляется в ближайшее время – не более 60 секунд с момента контакта.
Смесь перечисленных ингредиентов наносится на те части инструмента, которые соприкасались с поверхностью раны. Обязательно проверяются все подвижные элементы и участки. Если на поверхности обнаружены компоненты крови, индикация либо мгновенная, либо проявляется в ближайшее время – не более 60 секунд с момента контакта.
Участок, обработанный описанным составом, приобретает синеватый, зеленоватый или фиолетовый оттенок. Если обработанная поверхность сменила цвет через две минуты или позднее, такой результат не учитывается как показатель загрязненности – он провоцируется контактом с компонентами окружающей среды. Так как состав довольно нестойкий, эффективным будет применение только подготовленного непосредственно перед применением раствора.
Это важно
Если при применении указанных двух составов одно изделие из партии показало положительный результат, необходимо повторить предстерилизационную обработку этого предмета. Сначала его промывают под проточной водой, после чего помещают в наполненную специальным раствором для промывания емкость.
Следующий шаг – повторная предстерилизационная обработка, по итогам которой еще раз проверяют изделие пробой. Все прошедшие проверку с первого раза инструменты можно направлять в стерилизационную машину для последующей обработки.
Фенолфталеиновая проба
Фенолфталеин в виде раствора на спирте используют для выявления следов моющих компонентов. Это соединение позволяет проконтролировать эффективность очистки поверхности медицинского инструментария. В процессе постановки пробы на инструмент наносится пара капель рабочего соединения, причем в первую очередь необходимо проконтролировать качество очистки тех элементов, где инструментарий соприкасается с поверхностью раны, а также участки подвижного соединения.
Если проба показывает изменение оттенка рабочего состава на розовый, можно сделать вывод о наличии моющих соединений. Всю партию изделий, среди которых хотя бы одно показало положительный результат, отправляют на повторную обработку в моющую машину. Необходимо дополнительно промыть предметы проточной водой, затем обработать дистиллированной. Инструментарий, подвергнутый обработке фенолфталеиновой пробой, дополнительно очищают от реактива, замачивают в моющем соединении, снова повторяют все этапы предстерилизационной очистки.
Особенности постановки
Фенолфталеиновая проба может использоваться для контроля очистки игл. Для этого необходимо наполнить шприц без коррозийных следов реактивом и пропустить соединение через все иглы, которые нужно проверить, последовательно – их по очереди устанавливают на контрольный шприц. В рамках проверки используется марлевая салфетка, на которую через каждую иглу проводится до четырех капель реактива. Для повышения эффективности контрольных мероприятий чистую иглу заворачивают в ватный тампон, предварительно намоченный фенолфталеиновым раствором, после чего протирают всю поверхность.
При проверке катетера и иных полых предметов необходимо наполнить инструментарий составом с фенолфталеином, используя пипетку, шприц, очищенный по установленной методике. Реактив сохраняют внутри изделия не дольше минуты, сливают на салфетку из чистой марли. Каждый день в медицинском учреждении до четырех процентов всех предметов должно контролироваться на предмет качества. Обрабатывать нужно не менее пяти единиц каждой партии. По итогам проверки заполняется специальный журнал.
Тест на тему: ТЕСТОВЫЕ ЗАДАНИЯ «ПРЕДСТЕРИЛИЗАЦИОННАЯ ОЧИСТКА ИМН»
Предстерилизационная очистка – ВАРИАНТ 1
- Целью предстерилизационной очистки медицинского инструментария является:
а) удаление различных загрязнений и остатков лекарственных средств
б) уничтожение только патогенных микробов
в) уничтожение патогенных и условно-патогенных микробов
г) уничтожение всех микробов и их спор
- При проведении предстерилизационной очистки изделий медицинского назначения:
а) удаляют различные загрязнения
б) уничтожают вегетативные формы микроорганизмов
в) уничтожают вегетативные и споровые формы микробов
г) обезвреживают источник инфекции
- Предстерилизационной очистке инструментария предшествует:
а) дезинфекция
б) стерилизация
- Инструменты, поступающие в ЦСО, должны быть:
- продезинфицированными
- вымытыми под проточной водой после их использования
- стерильными
- Детергенты – это:
- дезинфекционные средства
- кожные антисептики
- моющие средства
- Концентрация перекиси водорода в составе моющего раствора (%)
а) 5
6) 3
в) 1
г) 0,5
- Состав 1л моющего раствора с использованием 27,5% пергидроля при предстерилизационной обработке:
а) 33 мл пергидроля + 5 г CMC + до 1 л воды
б) 30 мл пергидроля + 15 г CMC + до 1 л воды
в) 17 мл пергидроля + 5 г CMC + до 1 л воды
г) 14 мл пергидроля + 2,5 г CMC + до 1 л воды
- Для приготовления 1 л моющего раствора при предстерилизационной обработке инструментария необходимо взять 3% раствор перекиси водорода (в мл)
а) 240
б) 160
в) 170
г) 120
- Состав 1л моющего раствора с использованием 3% раствора перекиси водорода при предстерилизационной обработке:
а) 220 мл перекиси водорода + 15 г CMC и до 1 л воды
б) 200 мл перекиси водорода + 20 г CMC и до 1 л воды
в) 160 мл перекиси водорода + 5 г CMC и до 1 л воды
г) 100 мл перекиси водорода + 10 г CMC и до 1 л воды
- Для приготовления 1 л моющего раствора при предстерилизационной обработке инструментария необходимо взять пергидроль 33% раствор (в мл)
а) 33
б) 30
в) 17
г) 14
- Экспозиция замачивания медицинских инструментов в моющем растворе с перекисью водорода при предстерилизационной очистке составляет (мин.)
а) 45
6) 30
в) 15
г) 10
- Приготовление моющего раствора для проведения предстерилизационной очистки:
а) 15 г порошка «Биолот» довести водой до 1 л
б) 10 г порошка «Биолот» довести водой до 1,5 л
в) 5 г порошка «Биолот» довести водой до 1 л
г) 1,5 г порошка «Биолот» довести водой до 1 л
- Срок использования моющего раствора с «Биолотом»:
а) 72 часа
б) 48 часов
в) 24 часа
г) однократно
- Моющий раствор с использованием средства «Биолот» применяют и подогревают:
а) однократно до 50 гр.С
б) однократно до 40-45 гр.С
в) многократно подогревают до 50 гр.С
г) многократно до 45 гр. С
- Моющий раствор с использованием средства «Лотос» применяется:
а) в течение суток до появления фиолетовой окраски, нагревается до 3 раз
б) в течение суток до появления фиолетовой окраски
в) в течение суток до появления розовой окраски, нагревается до 6 раз
г) до появления розовой окраски
- Для предстерилизационной очистки изделий медицинского назначения разрешается использовать:
- 1 % раствор хлорамина
- 2 % раствор питьевой соды
- 5 % раствор поваренной соли
- Моющий раствор, приготовленный с использованием СМС без биодобавок, не изменивший цвета в процессе работы, можно использовать (час):
а) 72
6) 48
в) 24
г) 10
- После проведения предстерилизационной очистки для обессоливания медицинских инструментов используется вода
а) проточная
б) кипяченная
в) дистиллированная
г) дважды дистиллированная
- Медицинские изделия после предстерилизационной очистки разрешено сушить:
а) протиранием ветошью
б) на открытом воздухе
в) сухим горячим воздухом при 85 С
г) в термостате
- После кипячения в растворе двууглекислого натрия с целью предстерилизационной очистки:
а) изделие ополаскивается только дистиллированной водой
б) каждое изделие ополаскивается вначале проточной питьевой водой, затем дистиллированной
Предстерилизационная очистка – ВАРИАНТ 2
- Количество инструментов для контроля качества ПСО:
- 1% от обработанной партии
- 2% от обработанной партии
- 3% от обработанной партии
- Контроль качества проведенной предстерилизационной очистки проводится старшей сестрой:
а) ежедневно
б) не реже раза в неделю
в)2 раза в неделю
г) раз в месяц
- Проба для проверки медицинского инструментария на наличие скрытой крови:
а) бензидиновая
б) фенолфталеиновая
в) азопирамовая
- Азопирам выявляет на исследуемых изделиях наличие:
- крови
- моющих средств
- хлорсодержащих дезинфектантов
- белковых отложений
- ржавчины
- Исходный раствор азопирама можно хранить:
а) только в холодильнике
б) только при комнатной температуре
в) при комнатной температуре и в холодильнике
- В холодильнике раствор азопирама можно хранить:
а)3 месяца
б)2 месяца
в) 1 месяц
г) 2 недели
- При комнатной температуре раствор азопирама хранится:
а) 3 месяца
б) 2 месяца
в) 1 месяц
в) 2 недели
- Соотношение раствора азопирама и 3% перекиси водорода при приготовлении рабочего раствора для проведения пробы:
а)1:1
б)1:2
в)1:3
г)3:1
- Время использования рабочего раствора азопирама (Т не более 25 град) составляет (час.)
а) 2-3
б) 1
в) 1,5-2
- Рабочий раствор (азопирам + 3% перекись водорода) при температуре выше 25°С должен быть использован в течение:
а) 20-30 мин
б) 30-40 мин
в) 40-60 мин
г) 1.5-2 час
- Пригодность рабочего раствора азопирама проверяют нанесением двух-трех капель раствора на:
- стерильный ватный шарик
- кровяное пятно
- моющее средство
- лекарственный препарат
- Результат азопирамовой пробы учитывают в течение:
а) 10 сек
б) 2 мин
в) 1 мин
г) 3 мин
13. Положительная азопирамовая проба на скрытую кровь дает окрашивание:
а) сине-фиолетовое
б) розовое
в) красное
г) фиолетовое, переходящее в сиреневое
14. В случае положительной азопирамовой пробы на скрытую кровь следует повторить обработку инструментов с:
а) замачивания их в моющем растворе
б) мытья под проточной водой
в) кипячения в дистиллированной воде
г) ополаскивания дистиллированной водой
15. На остатки жира проводится проба:
а) амидопириновая
б) судановая
в) фенолфталеиновая
г) азопирамовая
16. Результат судановой пробы читают через:
а) 1 мин
6) 30 сек
в) 10 сек
г) 2 мин
17. Положительная проба на остатки жира имеет цвет:
- сине – фиолетовый
- сиреневый
- розовый
- желтый
18. Фенолфталеиновая проба проводится для определения остатков:
а) масляного раствора
б) крови
в) моющего средства
г) лекарственного средства
19. Для постановки фенолфталеиновой пробы готовят:
а) 1% спиртовый раствор фенолфталеина
б) 5% спиртовый раствор фенолфталеина
в) 5% спиртовый раствор амидопирина
20. Положительная фенолфталеиновая проба дает окрашивание:
а) сине-зеленое
б) фиолетовое
в) розовое
г) коричневое
Эталон ответов ПСО:
1 вариант
- А
- А
- А
- А
- В
- Б
- В
- Б
- В
- Г
- В
- В
- Г
- Б
- В
- Б
- В
- В
- Б,В
- Б
2 вариант
- А
- Б
- В
- А,В,Г,Д
- В
- Б
- В
- А
- В
- Б
- Б
- В
- Г
- А
- Б
- В
- Г
- В
- А
- В
Предстерилизационная очистка
Предстерилизационная очистка — это комплекс мероприятий, направленных на удаление белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов. В настоящее время наиболее перспективными являются группы дезинфектантов, позволяющие совместить дезинфекцию и предстерилизационную очистку.Все новые инструменты, еще не применявшиеся для работы с пациентами, должны пройти предстерилизационную очистку с целью удаления промышленной смазки и механических загрязнений.
Предстерилизационная очистка осуществляется как ручным, так и механизированным способом (с применением моечных машин, установок).
Методика проведения механизированной очистки должна проводиться в соответствии с инструкцией по эксплуатации, прилагаемой к моечному оборудованию. Оба способа требуют применения разрешенных моечных средств, которые должны быть эффективными, нетоксичными, не портить обрабатываемое изделие, обладать высокомоющей и эмульгирующей активностью.
Контроль качества предстерилизационной очистки проводится 1 раз в неделю, контролю подвергается 1% от одновременно обработанных изделий одного наименования (но не менее 3-5 единиц). Качество предстерилизационной обработки инструментов проверяют путем постановки проб (азопирамовой, фенолфталеиновой, амидопириновой). Азопирамовая проба является универсальной.
Азопирамовая проба
Приготовление рабочего раствора:
Сухие компоненты— порошок «А» (большая упаковка) и порошок «СА» (маленькая упаковка) смешивают в сухой посуде.
Смесь заливают 95% этиловым спиртом до объема 100 мл и тщательно размешивают стеклянной палочкой до полного растворения ингредиентов.
Готовый раствор может храниться в плотно закрытом флаконе в темноте при +4°С (в холодильнике) 2 месяца, в темноте при комнатной температуре — не более 1 месяца. Умеренное пожелтение реактива в процессе хранения без выпадения осадка не снижает его рабочих свойств. При наличии стабилизатора раствор хранится в 2 раза дольше нестабилизированного.
Методика постановки пробы. Рабочим раствором протереть различные поверхности инструмента или нанести 2-3 капли азопирама пипеткой. При наличии следов крови немедленно или через 1,5 мин появится фиолетово-синее окрашивание, быстро переходящее в сиренево-пурпурное или буроватое. При наличии ржавчины или кислоты окрашивание буроватое.
Пригодность рабочего раствора азопирама проверяют в случае необходимости так: 2-3 капли наносят на кровяное пятно. Если не позже, чем через минуту появляется фиолетовое окрашивание, переходящее затем в сиреневое, реактив годен к употреблению. Если окрашивание в течение 1 мин не появляется, реактивом пользоваться нельзя.
«Практическое руководство по хирургической стоматологии»
А.В. Вязьмитина
Опубликовал Константин Моканов
контроль качества процедуры стерилизации для изделий медицинского назначения и инструменты для нее
Предстерилизационная обработка является необходимым условием для того, чтобы очистить инструменты и все изделия медицинского назначения от разного рода жировых, белковых, других механических загрязнений и остатков лекарственных средств.
Такую очистку необходимо проводить, так как именно инструменты и материалы представляют собой самый приоритетный фактор при передаче инфекций гемоконтактного характера.
Почему недостаточно только дезинфекции?
Чтобы минимизировать риск заражения, в современной медицинской практике практикуется применение одноразовых расходных материалов и 3-ступенчатая обработка инструментов и изделий многоразового применения (дезинфекция, предстерилизационная очистка, стерилизационные мероприятия).
Этого действительно недостаточно для дальнейшего безопасного применения инструментов и медицинских изделий, уже бывших в употреблении. Во время проведения дезинфекции могут быть допущены ошибки, которые без двух остальных этапов обработки (предстерилизационная очистка, стерилизация) не позволят получить биологически безопасный инструментарий.
Во-первых, для дезинфекции могут быть использованы средства и методики, не разрешенные к применению. Возможно, на вещества отсутствует требуемый разрешительный пакет документов, либо его использование недопустимо в учреждениях лечебно-профилактического профиля, либо оно (средство) вообще фальсифицировано и не может применяться с какой бы то ни было целью.
Во-вторых, могут быть нарушены условия, при которых эти средства для дезинфекции хранились и транспортировались (температурный режим, длительное нахождение в зоне влияния прямого солнечного света, истекший срок годности).
Средство может быть неверно подобрано (не уничтожает возбудителей гепатитов группы В и С, ВИЧ), что делает дальнейшие действия, в частности, такое как предстерилизационная очистка и мероприятия по стерилизации, бесполезными.
Кроме того, неверно выбранный режим дезинфекции не обеспечит уничтожения возбудителей гемоконтактных инфекций. Да и сама дезинфекция может быть проведена некорректно (ошибки при расчете концентрации, не соблюдено время экспозиции, у рабочего раствора истек срок годности).
Факторы риска при очистке
Даже одна (не говоря уже о нескольких) ошибка практически сводит на «нет» эффективность дезинфицирующих мероприятий. В итоге предстерилизационная очистка изделий медицинского назначения может представлять опасность для медперсонала в биологическом плане.
Помимо этого, существует вероятность инфицирования в процессе проведения второго этапа очистки по причине непосредственного контактирования медработника с инструментами и изделиями.
В наибольшей степени это можно отнести к ручному типу обработки (будет описан ниже), однако при механическом человек также соприкасается с инструментарием при перекладывании и сортировке.
Далее важно, чтобы медперсонал во избежание инфицирования не пренебрегал средствами индивидуальной защиты (речь идет о перчатках).
Еще стоит сказать о том, что основная масса современных дезинфицирующих средств предназначена для совмещения таких процессов, как дезинфекция и предстерилизационная очистка.
Однако погружение в такой раствор медицинского изделия отнюдь не означает, что проведены сразу оба эти мероприятия – и дезинфекция, и очистка. После окончания первого этапа должен быть обязательно проведен второй.
Обработка ручным способом
Этапы предстерилизационной очистки ручным способом выглядят следующим образом. После того как все изделия продезинфицированы и тщательно промыты в проточной воде, их в разобранном виде помещают в моющий состав.
Все каналы и полости обрабатываемых изделий должны быть полностью погружены в жидкость и ею заполнены. Продолжительность замачивания зависит от применяемого моющего средства и может составлять от 15 минут до 1 часа.
Затем каждое изделие отдельно моют ершиком или протирают ватно-марлевым тампоном не менее 1 минуты.
Далее изделия и инструменты ополаскиваются в проточной воде. Продолжительность процедуры зависит от применяемого средства. В раковине, которая используется на этом этапе, недопустимо мытье рук медперсонала.
Последний этап при ручной обработке состоит в том, что все изделия и инструменты ополаскиваются в дистиллированной воде и просушиваются в потоке горячих воздушных масс.
Совмещенная обработка
Медицинская предстерилизационная очистка может быть совмещена с мероприятиями по дезинфекции, и проводится она вручную. На начальном этапе все изделия замачивают в специальных моющих средствах, обладающих дезинфицирующими свойствами.
Далее каждая обрабатываемая единица по отдельности моется ершиком или очищается ватно-марлевым тампоном на протяжении 1 минуты.
Здесь важно помнить о поддержании температурного режима, если это оговорено в инструкции по применению моющего состава.
Далее каждая единица инструментария и медизделий ополаскивается в проточной воде на протяжении времени, необходимого для конкретного средства (указано в инструкции). Применение раковины, в которой производится процедура, для других целей недопустимо. На конечном этапе каждая единица ополаскивается дистиллированной водой и сушится под горячим воздухом.
Механический способ очистки изделий
В современных больших лечебных учреждениях чаще всего применяется механическая предстерилизационная очистка изделий. Все инструменты и изделия помещают в специальное оборудование, основные функции которого — проведение мероприятий по дезинфекции и предстерилизационной обработке.
Для такого вида работ могут быть использованы дезинфицирующие вещества, обладающие дополнительно моющим эффектом, или предназначенные отдельно для дезинфицирования и мойки. Если дезинфекция осуществляется термическим способом, то для дальнейшей очистки возможно использование только моющих средств.
Если для конкретного оборудования оговорена какая-то другая технология, значит, мероприятия по очистке проводят в соответствии с инструкцией.
Далее изделия и инструменты ополаскивают в проточной воде. Продолжительность процедуры – согласно инструкции по использованию моющего средства. Этот этап может являться частью функционального цикла задействованного оборудования.
Завершается механическая предстерилизационная очистка ополаскиванием (вода дистиллированная) всех обработанных элементов и сушкой горячими воздушными массами. Этот этап также может являться частью функционального цикла применяемого оборудования.
Преимущества механической обработки
Сегодня наиболее перспективной и предпочтительной считается предстерилизационная очистка медицинских изделий механическим способом. И тому есть несколько причин.
На самом высоком уровне обеспечивается биологическая безопасность медперсонала, так как тактильные контакты людей с медицинскими инструментами и изделиями сведены к минимуму.
Далее, этот способ самый экономически эффективный, так как, во-первых, для обработки большого количества инструментов и медицинских изделий не требуется много времени, а во-вторых, сводится к минимуму возможность повредить дорогостоящий инструментарий (как результат — увеличивается срок его службы).
При таком способе очистки обеспечивается наибольшая биологическая безопасность пациентов: изделия и инструменты самой сложной конфигурации качественно очищаются.
Оборудование и выбор моющих средств
В настоящее время на территории РФ зарегистрированы и разрешены к использованию два вида оборудования для механической обработки, имеющие существенные различия. Принцип работы одного основан на использовании ультразвука.
Предстерилизационная очистка инструментов в другом виде оборудования осуществляется моющими средствами, не содержащими в своем составе дезинфекционных компонентов, так как дезинфекция проводится термическим способом.
Этот вид оборудования в медицинской среде носит название термодезинфектора.
Второй вид оборудования обладает явными преимуществами перед ультразвуковыми аппаратами, т. к. в термодезинфекторе, по сути, осуществляется полный цикл обработки медизделий и инструментария – дезинфекция, очистка, ополаскивание, сушка. На долю человека остается корректно провести загрузку инструментов, а затем правильно их извлечь.
Еще один важный нюанс – это подбор моющих средств. Разрешены для использования два вида: на основе ПАВ (поверхностно-активных веществ) и ферментов. Первые обладают высокими моющими качествами и более востребованы на рынке. Однако у этих средств имеются некоторые недостатки:
- Во-первых, для них характерно высокое пенообразование, а это может стать критичным фактором ввиду несовместимости моющего состава и оборудования при механической очистке.
- Во-вторых, после моющих, произведенных на основе ПАВ, на обработанной поверхности медицинских изделий и инструментов остается пленка, для смывания которой потребуется особенно тщательное ополаскивание.
- В-третьих, чтобы получить самый оптимальный результат, требуется поддерживать определенную температуру, при которой проводится предстерилизационная очистка.
Моющие вещества, изготовленные на основе ферментов, обладают возможностями разрушения не только стенок бактериальных клеток, белковых оболочек вирусов, но и биопленки. Помимо этого, для ферментированных моющих средств характерно низкое пенообразование, и они не теряют активности при комнатных температурах.
Контроль качества: остатки биологических жидкостей
Для определения остатков крови контроль качества предстерилизационной очистки производится с применением нескольких проб: бензидиновой, ортотолидиновой, амидопириновой и азопирамовой.
Бензидиновая проба может осуществляться двумя способами. Водный раствор бензидина хлорида 0,5-1 %-ного (вода — дистиллированная) соединяют с таким же объемом 3 %-ного раствора перекиси водорода. Второй вариант состоит в приготовлении раствора из 5 мл 50 %-ной уксусной кислоты и 0,025 г бензидина сульфата с перекисью водорода (3 %) в объеме 5 мл.
Ортотолидиновая проба может производиться в 3 модификациях. 5-10 мл основного спиртового раствора (ортотолидин — 4 %, спирт этиловый — 96 %) смешивают с такими же объемами дистиллированной воды и уксусной 50-процентной кислоты.
Вторая модификация состоит в смешивании реактива, состоящего из 0,25 г ортотолидина и равных объемов (по 5 мл) 50 %-ной уксусной кислоты и 3 %-ной перекиси водорода.
Третий вариант состоит в соединении равных объемов 1 %-ного водного раствора ортотолидина и 3 %-ной перекиси водорода.
Для того чтобы провести контроль предстерилизационной очистки с помощью амидопириновой пробы, готовят реактив из одинаковых (2-3 мл) объемов 5 %-ного спиртового раствора амидопирина, 30 %-ной уксусной кислоты и 3 %-ной перекиси водорода. 2 капли готового реактива наносят на негорячую поверхность. В случае если проба приобрела сине-фиолетовый оттенок, поверхность очищена недостаточно качественно.
Реактив для проведения азопирамовой пробы изготавливают на основе исходного раствора азопирама. В свою очередь, этот раствор состоит из смешанных вместе 100 г амидопирина и 1 г соляно-кислого анилина, дополненных до 1 л этиловым спиртом (95 %).
Приготовленный таким образом состав можно хранить (тара – закупоренный флакон) без доступа света при комнатной температуре на протяжении 1 месяца, в холодильнике – до 2 месяцев. Когда потребуется проводить пробу, смешивают в равных долях исходный азопирам и 3 %-ную перекись водорода.
Если после нанесения реактива на холодную поверхность проба становится фиолетовой, а затем быстро меняет цвет на розово-сиреневый, значит, на инструментах и изделиях присутствуют остатки крови.
При проведении азопирамовой пробы важно учесть некоторые особенности реакции. Приготовленный для проверки реактив допустимо использовать не позднее чем в течение 1-2 часов.
Хранить его в это время при ярком свете и повышенной температуре недопустимо.
Изменение цвета пробы, наступившее спустя минуту после нанесения, не дает оснований считать, что качество предстерилизационной очистки не соответствует требуемому по инструкции.
В процессе предстерилизационной очистки весьма нежелательно вместо перекиси водорода использовать таблетки гидропирита.
Причина в том, что раствор гидропирита способствует быстрому образованию коррозии, а это приводит к порче инструментов, особенно с режущими плоскостями.
Если ощущается дефицит медицинской перекиси водорода, ее допустимо в процессе обработки заменить технической перекисью марки А и Б.
На контролируемые изделия наносят капли реактивов. При наличии остатков крови состав окрашивается в сине-зеленый цвет.
Контроль качества: остатки моющих средств
Все этапы предстерилизационной очистки при любом способе обработки (ручной, совмещенный, механический) завершаются ополаскиванием медицинских изделий и инструментов.
Качественно ли проведен этот этап, можно определить с помощью фенолфталеиновой пробы. 1-2 капли однопроцентного спиртового раствора фенолфталеина наносят на обработанное (т. е. вымытое) изделие.
Если оно вымыто недостаточно качественно, и на его поверхности присутствуют остатки моющих средств, проба приобр
Инструкции по очистке и стерилизации инструментов
согласно ISO 17664: 2003 и AAMI ST 81: 2004
Устройства:
Электрические и пневматические двигатели и муфты серий 1000 и 2000;
Электродвигатели и муфты серии 5000,
SmartDriver Electric, аккумуляторные и пневматические инструменты и муфты;
Электрические, аккумуляторные и пневматические инструменты и соединители серии 7000,
Электрический и пневматический инструмент для липопластики с усилителем;
Pulse Lavage Instrument,
Hoses, Cables,
Carpal Tunnel Release System (CTRS)
Предупреждения:
- Все время следует соблюдать универсальные меры предосторожности при обращении с загрязненными материалами.
- НЕ смазывайте и не смазывайте наконечники. Смазка может повредить внутренний механизм двигателя. Также примите особые меры предосторожности, чтобы избежать использования чистящих средств, содержащих смазку.
- НЕ погружайте наконечник в какую-либо жидкость.
- НЕ используйте чистящие растворы с низким pH, если они не одобрены для использования с анодированным алюминием и хирургическими инструментами.
- НЕ используйте чистящие средства с хлором или хлоридом, так как активный ингредиент вызывает коррозию нержавеющей стали.
Ограничения на переработку
Повторная обработка в соответствии с приведенными ниже инструкциями оказывает минимальное влияние на многоразовые хирургические инструменты MicroAire. Окончание срока службы обычно определяется износом и повреждением в результате использования.
ИНСТРУКЦИЯ
Место использования:
Удалите излишки биологических жидкостей и тканей одноразовой не проливающейся салфеткой и накройте тканью, смоченной очищенной водой. Жидкости и ткани тела не должны высыхать на инструментах перед очисткой (МАКСИМУМ 30 минут).
Подготовка к дезактивации
- Удалите из наконечника все вставленные хирургические режущие принадлежности (лезвия, боры, рашпили, сверла и т. Д.). Одноразовые хирургические принадлежности следует выбросить после использования, обращаясь с ними так же, как и с любыми загрязненными острыми принадлежностями. Повторное использование хирургических режущих принадлежностей не рекомендуется.
- Разобрать инструменты и принадлежности
- Для автоматической очистки установите крышку шайбы для перечисленных инструментов.
- Разъем для шланга типа MicroAire — CAP-100
- Соединитель для шланга Холла — CAP-200
- Соединитель для шланга 3M Mini — CAP-300
- Соединитель для шланга 3M Maxi Style — CAP-300MAX
- Соединитель шланга типа Stryker — CAP-400
- Соединитель для шланга в стиле Synthes — CAP-600
- PAL-600E — CAP-600E
- Для ручной очистки установите крышку шайбы (как определено выше) или соответствующий пневматический шланг или электрический кабель для инструмента.Если вместо крышки шайбы используется пневматический шланг, перед стерилизацией из шланга необходимо слить все остаточные жидкости. Это можно сделать, удерживая конец шланга за конец, чтобы вся жидкость могла стекать.
Приготовление чистящего средства
Приготовьте фермент с умеренным pH и чистящие средства при разбавлении и температуре, рекомендованных производителем. Выбор чистящих средств определяется местными или национальными правилами.
Очистка: автоматическая
- Загрузите медицинские приборы в стирально-дезинфекторную машину.
a) Избегайте контакта между устройствами (движение во время стирки может привести к повреждению, а действие стирки может быть затруднено). НЕ перегружайте лотки.
b) Расположите медицинские устройства так, чтобы канюли не располагались горизонтально, а отверстия для батареек были направлены вниз (для облегчения дренажа). - Минимальный рекомендуемый цикл мойки / дезинфекции ниже:
# Название Моющее средство Минут Температура 1 Предварительная стирка Ферментативный с умеренным pH * 4 2 Полоскание Нет 1 ** 3 Мойка Мягкий pH 4 > = 60 ° C (140 ° F) 4 Слив в течение 1 минуты минимум 5 Полоскание Нет 2 ** > = 60 ° C (140 ° F) 6 Слив в течение 1 минуты минимум 7 Термическая дезинфекция Нет 10 > = 93 ° C (200 ° F) 8 Слив в течение 1 минуты минимум
* Моющее средство можно не добавлять на этапе предварительной стирки, если оборудование не имеет такой возможности.
** Если не используется моющее средство с мягким pH, увеличьте время полоскания, если это возможно, чтобы уменьшить возможное разложение.
Примечание: стиральные машины / дезинфекторы должны соответствовать требованиям ISO 15883. Они должны быть правильно установлены и регулярно проверяться в соответствии с ISO 15883.
Очистка: Ручная
- Тщательно очистите наконечник и муфты теплой (> 60 ° C / 140 ° F) водой, мягким ферментативным моющим средством с pH и мягкой щеткой. Протрите наконечник щеткой, уделяя особое внимание щелям инструмента.
- При использовании пневматических устройств, пожалуйста, тщательно очистите пневматический воздушный шланг теплой (> 60 ° C / 140 ° F) водой с ферментативным моющим средством с умеренным pH.
- Тщательно промойте наконечники, муфты и пневматические шланги во время работы (
- Тщательно очистите наконечник и муфты теплой (> 60 ° C / 140 ° F) водой, мягким ферментативным моющим средством pH и мягкой щеткой. Протрите наконечник щеткой, уделяя особое внимание щелям инструмента.
- Промойте люмены инструментов и наконечник дрелей и проволочных отверток с помощью Water-Pik или аналогичного устройства.Промывка удаляет кровь, мусор и отложения солевого раствора.
- Тщательно промойте наконечники, муфты и пневматические шланги во время работы (
- После промывки всех пневмошлангов необходимо слить из воздушного шланга все остатки чистящей жидкости. Это можно сделать, удерживая конец шланга за конец, чтобы вся жидкость могла стекать.
Дезинфекция:
Дезинфекция допустима только в качестве дополнения к полной терминальной стерилизации многоразовых хирургических инструментов.См. Раздел стерилизации ниже.
Сушка:
Вытрите воду с наконечника мягким безворсовым полотенцем. Для сушки наконечника также можно использовать воздушный пистолет.
Техническое обслуживание, осмотр и проверка работоспособности:
- Снимите с наконечника крышку шайбы, пневматический шланг или электрический кабель.
- Тщательно осмотрите каждое устройство, чтобы убедиться, что вся видимая кровь и грязь удалены.
- Визуально проверьте на предмет повреждений и / или износа.
- Проверьте действие движущихся частей, чтобы обеспечить плавную работу во всем предполагаемом диапазоне движения.
- Если инструменты являются частью более крупной сборки, проверьте, что устройства собраны с соответствующими компонентами
Примечание. Если замечены проблемы, которые могут нарушить работу устройства, обратитесь к представителю MicroAire.
Упаковка:
- Отдельные инструменты — можно использовать стандартную медицинскую упаковку для стерилизации паром.Убедитесь, что упаковка достаточно велика, чтобы в нее поместился инструмент, не повреждая упаковку. (ANSI / AAMI ST46-1993)
- Наборы инструментов — наборы инструментов могут быть загружены в специальные лотки для инструментов или лотки для стерилизации общего назначения для стерилизации. Если возможно, используйте стандартную медицинскую упаковку для стерилизации паром в соответствии с методом двойной упаковки AAMI (ANSI / AAMI ST46-1993)
Стерилизация:
Стерилизация паром с использованием одного из следующих циклов согласно ISO 17665:
| Цикл стерилизации | Инструмент | Минимальное время и температура | Мин. Время сушки с подогревом |
|---|---|---|---|
| Пар предварительного вакуума | Отдельный инструмент ИЛИ в лотке для стерилизации | Полный цикл, 3 минуты при 134 — 137 ° C (273 — 279 ° F) | 8 минут |
| Полный цикл, 4 минуты при 132 — 135 ° C (270 — 275 ° F) | 8 минут | ||
| Гравитационное смещение | Одиночный инструмент | Полный цикл, 30 минут при 132–135 ° C (270–275 ° F) | 8 минут |
| Лоток для стерилизации | Полный цикл, 45 минут при 132–135 ° C (270–275 ° F) | 8 минут |
Примечание. В тех случаях, когда есть опасения по поводу загрязнения TSE / vCJD, Всемирная организация здравоохранения рекомендует проводить обработку посредством цикла предварительной стерилизации паром в течение 18 минут при 134 ° C (273 ° F).(WHO / CDS / CSR / 2000.3, «Рекомендации ВОЗ по инфекционному контролю для TSE», март 1999 г.).
Хранение:
Стерильные инструменты в упаковке следует хранить в специально отведенном для этого месте с ограниченным доступом, которое хорошо вентилируется и обеспечивает защиту от пыли, влаги, насекомых, паразитов и экстремальных температур / влажности.
Дополнительная информация:
- Стерильные упаковки с инструментами необходимо внимательно осмотреть перед открытием, чтобы убедиться в отсутствии потери целостности упаковки.
- Не используйте инструменты, когда они еще теплые. Им нужно остыть до комнатной температуры
- Не замачивайте инструменты, чтобы охладить их, и не оборачивайте их холодными полотенцами.
IM-CLNSTR Rev G © 2013 MicroAire Surgical Instruments LLC
15. Повторная обработка медицинского оборудования: очистка, дезинфекция и стерилизация
1 15.Повторная обработка медицинского оборудования: чистка, дезинфекция и стерилизация Обычные методы в зонах обработки включают: запрет на прием пищи / питье, хранение продуктов питания, курение, нанесение косметики и обращение с контактными линзами. Запрещается хранение личных вещей, включая продукты питания и напитки. входы в участки обработки. Обучение персонала правилам гигиены рук. Запрещается носить украшения для рук и рук или украшения для ногтей. Должны быть в наличии средства индивидуальной защиты и проводится обучение по выбору и использованию этого оборудования.Гигиена рук, которую необходимо выполнять: Перед началом работы Перед перерывами После завершения работы После посещения туалета, сморкания и других функций организма После снятия перчаток Всякий раз, когда руки загрязнены жидкостями организма. или 15-1
2 Загрязнение рук = используйте воду и мыло. Отсутствие видимых загрязнений рук = мыло и вода или спирт. Дезинфекция рук. Безопасный и здоровый работник в зоне обработки. Все сотрудники, работающие в области обработки, должны быть невосприимчивы к гепатиту B.Во время очистки и обработки медицинского оборудования следует использовать средства индивидуальной защиты из-за риска контакта с кровью и биологическими жидкостями. Если работник подвергся воздействию, то есть повреждению кожи или попаданию брызг на лицо во время обработки медицинского оборудования, немедленно сообщите об этом и получите медицинский осмотр. Для вашей безопасности: ознакомьтесь с рекомендациями производителя по очистке оборудования. Ознакомьтесь с рекомендациями производителя по хранению, разбавлению, использованию и утилизации продуктов. Используйте только дезинфицирующие средства с номером DIN (идентификационный номер лекарственного средства), который указывает на разрешение на использование в Канаде. Таблицы данных (MSDS) доступны для используемых продуктов и знают, где содержится информация на этих листах. Используйте рекомендованные средства индивидуальной защиты. Основные принципы. Процедуры очистки медицинского оборудования должны основываться на инструкциях производителя и должны включать принципы профилактики и контроля инфекций. , Охрана труда и безопасность, биомедицинская инженерия и экологические услуги.Перед дезинфекцией или стерилизацией всегда необходима чистка. Неочищенный предмет нельзя продезинфицировать или стерилизовать. 15-2
3 Грубые загрязнения (например, фекалии, мокрота, кровь) должны быть удалены сразу же в месте использования, перед транспортировкой на участок переработки. После того, как медицинское оборудование поступило в зону обработки, его необходимо отсортировать и пропитать. Требуется специальная зона для обработки. Расположение этой зоны должно способствовать переходу от чистого к стерильному без риска повторного заражения оборудования.Этот односторонний рабочий процесс гарантирует, что работа идет в чистом направлении. Каждый уровень обработки (включая очистку, дезинфекцию и стерилизацию) снижает микробную нагрузку на обрабатываемое медицинское оборудование. Одноразовое оборудование не предназначено для очистки и обработки. Он предназначен только для одноразового использования и последующей утилизации. Факторы, влияющие на процедуру повторной обработки Многие факторы влияют на повторную обработку, особенно когда используется химическая обработка. К этим факторам относятся: Чистота поверхности оборудования: — чем выше биологическая нагрузка, тем сложнее дезинфицировать или стерилизовать оборудование. Характеристики оборудования / устройства: — длинные узкие просветы и каналы трудно чистить — шероховатость или пористые поверхности могут задерживать микроорганизмы. Тип и концентрация продукта: — продукты, используемые для дезинфекции, необходимо смешивать в соответствии с рекомендациями производителя.- просушите оборудование после очистки перед погружением в дезинфицирующее средство, чтобы предотвратить растворение дезинфицирующего раствора. 15-3
4 — проверьте срок годности перед использованием и утилизируйте растворы не позднее срока годности; разбавленные продукты после смешивания нестабильны. — следуйте инструкциям производителя относительно продолжительности использования. — используйте химические тест-полоски для всех жидких дезинфицирующих средств высокого уровня, чтобы оценить их прочность. Во время повторного использования концентрация активных ингредиентов может снизиться по мере разбавления продукта и накопления органических веществ.- используйте соответствующее дезинфицирующее средство для данной задачи. Некоторые микроорганизмы более устойчивы к дезинфекции, чем другие, это необходимо учитывать при выборе продукта и процесса. — если концентрация дезинфицирующего средства слишком низкая, он не сможет достичь требуемого уровня дезинфекции. Продолжительность и температура воздействия продукта: — используйте рекомендации производителя по температуре и времени воздействия, которые необходимы для достижения желаемого уровня дезинфекции / стерилизации.Физические и химические свойства среды переработки: — жесткость воды может повлиять на некоторые дезинфицирующие средства, используйте дистиллированную воду. Если концентрация слишком высока, это увеличивает риск повреждения оборудования и токсического воздействия на техника. Дезинфекция многоразового медицинского оборудования (см. Приложение C) Дезинфекция — это инактивация болезнетворных микроорганизмов. Дезинфекция не уничтожает споры бактерий (например, C. difficile). Дезинфекция медицинского оборудования делится на две основные категории: Дезинфекция низкого уровня Дезинфекция высокого уровня Уровень зависит от назначения и использования оборудования.См. Приложение B по классификации Сполдинга для получения дополнительной информации о категориях. 15-4
5 Дезинфекция низкого уровня (LLD) Дезинфекция низкого уровня уничтожает бактерии, некоторые грибки и вирусы в оболочке. LLD используется для некритического медицинского оборудования и некоторых поверхностей, находящихся в окружающей среде. В категорию некритичного оборудования входит оборудование, которое касается только неповрежденной кожи, но не слизистых оболочек, или не касается непосредственно пациента. Примеры включают комоды, манжеты для измерения артериального давления, столы для осмотра и счетчики.LLD выполняется после тщательной очистки, ополаскивания и сушки оборудования. Некоторые чистящие средства, используемые в медицинских учреждениях, объединяют очистку и дезинфекцию в одном растворе и, таким образом, сводят ее к одноэтапному методу очистки / дезинфекции. Virex 256 — одно из таких чистящих / дезинфицирующих средств. Емкость, используемую для дезинфекции, необходимо мыть, ополаскивать и сушить при смене раствора. Некритическое медицинское оборудование требует дезинфекции с использованием дезинфицирующего средства низкого уровня. 15-5
6 Дезинфекция высокого уровня (HLD) Дезинфекция высокого уровня уничтожает бактерии, вирусы в оболочке и без нее, грибки и микобактерии (например,грамм. туберкулез). HLD используется для полукритического медицинского оборудования. Сюда входит оборудование, которое контактирует с поврежденной кожей или слизистыми оболочками, но не проникает через них. Полукритическое медицинское оборудование требует дезактивации с использованием как минимум дезинфекции высокого уровня. В дезинфицирующих средствах высокого уровня используются продукты, которые включают одно из следующих: 2% глутарового альдегида, 6% перекиси водорода 0,2% перуксусной кислоты 7% ускоренной перекиси водорода 0,55% орто-фталевого альдегида (OPA). ДВУ выполняется после тщательной очистки, ополаскивания и сушки оборудования.Стерилизация — предпочтительный метод обеззараживания оборудования. Некоторое оборудование (например, прицелы) нельзя автоклавировать, поэтому требуется дезинфекция высокого уровня. Жидкая химическая дезинфекция высокого уровня При выборе дезинфицирующего средства для обработки медицинского оборудования в медицинских учреждениях учитывайте следующее: Имеет идентификационный номер лекарственного средства (DIN) от Министерства здравоохранения Канады Достигает желаемой цели Совместимость с оборудованием и поверхностями, подлежащими дезинфекции Совместимость с моющими средствами, чистящие средства и процессы дезинфекции и / или стерилизации Предполагаемое использование оборудования после дезинфекции (см. Критерии Сполдинга, Приложение B) Метод контроля концентрации / разбавления продукта Рекомендации по полосканию для полоскания (например,грамм. качество воды, объем, время) Правильное использование СИЗ. Утилизация, экологическая безопасность и способность к биологическому разложению. 15-6
7 Необходимо соблюдать рекомендации производителя по химическим дезинфицирующим средствам. На продуктах должно быть указано: Время контакта Срок годности Указания по хранению Соответствующее разведение Требуемые СИЗ Процесс дезинфекции высокого уровня требует: Используйте химические тест-полоски, чтобы определить, присутствует ли эффективная концентрация активных ингредиентов, особенно после многократного использования. доливание свежего раствора. Для ручной дезинфекции контейнер, используемый для дезинфекции, необходимо держать закрытым во время использования и мыть, ополаскивать и сушить при смене раствора. Для ополаскивания медицинского оборудования после химической дезинфекции необходимо три отдельных полоскания стерильной водой.Растворы для полоскания необходимо менять после каждого процесса. Области применения — важное медицинское оборудование. Они требуют дезинфекции высокого уровня. Это делается с использованием специального оборудования и процедур. 15-7
8 Стерилизация Стерилизация — это уничтожение всех болезнетворных микроорганизмов, включая бактерии, вирусы, споры и грибки (например, виды Clostridium и Bacillus) и прионы. Стерилизация используется для критически важного медицинского оборудования и, по возможности, для полукритического медицинского оборудования.Для оборудования, которое не выдерживает термической стерилизации, можно использовать химические стерилизаторы. Однако для достижения химической стерилизации концентрация химического вещества и время воздействия должны соответствовать стандартам. Паровая стерилизация (автоклавирование) — предпочтительный метод обеззараживания полукритического медицинского оборудования. 15-8
9 Цикл стерилизации медицинского оборудования: (см. Приложение D) Медицинское оборудование, контактирующее со стерильными тканями или жидкостями организма, считается критически важным оборудованием.Все критическое медицинское оборудование должно быть стерилизовано. Микробное заражение критически важного оборудования может привести к передаче тяжелого заболевания. Важнейшие предметы включают в себя шовные инструменты, оборудование для ухода за ногами, щипцы для биопсии, офтальмологическое оборудование и стоматологическое оборудование. Этапы переработки критически важного медицинского оборудования: Приобретение 1. Покупка 2. Ссуда ОЧИСТКА использование дезинфекции транспорта На всех этапах: Местоположение Помещения Политики / процедуры управления оборудованием проверка складской упаковки транспортная стерилизация утилизация 1.Лом 2. Возврат кредитору 15-9
10 этапов стерилизации: 1. Предварительная очистка Грубые загрязнения (например, фекалии, мокрота и кровь) должны быть немедленно удалены в месте использования. Если очистка не может быть произведена немедленно, медицинское оборудование необходимо погрузить в прохладную воду и моющее средство или ферментный очиститель (например, Empower), чтобы предотвратить высыхание органических веществ. Замачивание в растворе отбеливателя может повредить отделку оборудования. Учтите факторы, влияющие на возможность очистки медицинского оборудования перед очисткой.а) Разборка — если инструменты имеют детали, разборка позволяет чистящему, дезинфицирующему и / или стерилизующему средству контактировать со всеми поверхностями устройства. б) Разделение острых предметов и хрупкого оборудования на сортировку предотвращает травмы персонала и повреждение оборудования. в) Замачивание предотвращает высыхание почвы на оборудовании и облегчает его очистку. (Empower есть на складе, см. Список магазинов в Приложении E). 2. Очистка с помощью скраба щеткой с жесткой щетиной, затем вытрите насухо. В процесс очистки включены следующие процедуры: a) Физическое удаление органических материалов — полностью погрузите предметы, которые будут переносить жидкости во время процесса очистки, чтобы свести к минимуму аэрозолизацию микроорганизмов и помочь в очистка 15-10
11 — Удалите крупную грязь с помощью старых щетинных щеток и безворсовой ткани. b) Ручная очистка — Очистите оборудование с просветами щеткой в соответствии с инструкциями производителя, затем промойте моющим средством раствора (Empower) и промойте водой — Используйте щетку с проволочной щетиной, чтобы вручную очистить поверхности, петли и узкие места c) Уход за чистящими инструментами — Проверяйте щетки и другое чистящее оборудование на предмет повреждений после каждого использования — Очищайте, дезинфицируйте, сушите и храните использованные инструменты для помощи в уборке (например,грамм. щетки, тряпки) г) Ополаскивание — Тщательно промойте все оборудование после очистки водой для удаления остатков — Выполните заключительное ополаскивание оборудования, содержащего просветы, коммерчески подготовленной стерильной водой. Ополаскивание после очистки необходимо, так как остатки моющего средства могут нейтрализовать дезинфицирующее средство. e) Сушка — оборудование можно сушить на воздухе или сушить вручную чистым безворсовым полотенцем. — Осушить оборудование из нержавеющей стали сразу после ополаскивания, чтобы предотвратить образование пятен. Сушка — важный этап, предотвращающий растворение химических дезинфицирующих средств
12 3.Оборудование после очистки, которое проходит дезинфекцию высокого уровня, также должно быть промаркировано, помечено или иметь цветовую маркировку, чтобы указать, что оно было подвергнуто повторной обработке. Стерилизованные паром предметы можно идентифицировать с помощью химических индикаторов (ХИ), таких как автоклавная лента, которая меняет цвет во время стерилизации. Держите очищенное оборудование отдельно от грязного, чтобы избежать повторного загрязнения и смешивания инструментов. Обертывание / упаковка оборудования, которое необходимо стерилизовать, перед стерилизацией необходимо обернуть. — Материалы, используемые для обертывания, должны быть подготовлены таким образом, чтобы обеспечить адекватное удаление воздуха, проникновение пара и эвакуацию на все поверхности.Оберточным материалом должен быть стерильный пакетик или синяя пленка. — Каждая упаковка, подлежащая стерилизации паром, должна включать индикаторную полоску внутри упаковки, закрывать автоклавной лентой (если она синяя) и термосваривать (если она находится в пакете). Обратите внимание на изменение цвета индикатора после автоклавирования на рисунке ниже. До или + После См. CSA Z, Эффективная стерилизация в медицинских учреждениях паровым процессом для получения информации об упаковочных материалах, контейнерах и методах
13 4.Стерилизация Время и настройки автоклавирования должны основываться на технических характеристиках используемого автоклава. Это время и температура должны быть достигнуты для правильной стерилизации оборудования. Стерилизацию паром необходимо проводить дистиллированной водой. Это контролирует накопление минералов в автоклаве, что повлияет на работу и сократит срок службы машины. Правильная подготовка + правильное время + правильная температура = эффективная стерилизация 5. После стерилизации паром и хранения Обработка пакетов после стерилизации включает: — Перед извлечением из автоклава и хранением дайте упаковкам высохнуть, чтобы снаружи не было видно влаги — Проверьте, чтобы убедитесь, что на внутренней индикаторной полосе произошли изменения цвета, а индикатор на внешней стороне упаковки. Стерилизованные упаковки необходимо транспортировать таким образом, чтобы предотвратить загрязнение i.е .: сухие, чистые, без разрывов в упаковке. До После 15-13
14 6. Поддержание стерильности Поддержание стерильности медицинского оборудования до момента его использования является целью стерильного процесса. Это включает в себя: — Медицинское оборудование, приобретенное как стерильное, должно быть использовано до истечения срока годности — Стерильные упаковки, которые теряют свою целостность, должны быть повторно стерилизованы перед использованием (т. Е. Загрязненные, разорванная упаковка или поврежденная пломба) Зоны хранения Зона хранения стерильных оборудование должно быть расположено рядом с зоной обработки стерилизации, желательно в отдельной, замкнутой зоне с ограниченным доступом.Требования к этой области включают: — Контейнеры, используемые для хранения оборудования, должны быть влагостойкими и очищаемыми (т. Е. Нельзя использовать картонные коробки) — Оборудование хранится в чистом, сухом и непыльном помещении — не на уровне пола. и, по крайней мере, на расстоянии одного метра от мусора, стоков и влаги, чтобы предотвратить загрязнение — Оборудование хранится в зоне, где оно не подвергается вмешательству со стороны людей или паразитов — Оборудование обрабатывается и транспортируется таким образом, чтобы избежать загрязнения или повреждения к оборудованию — Расходные материалы и материалы, не используемые для обработки, не должны храниться в стерильных помещениях для обработки
15 Неприемлемые методы дезинфекции / стерилизации Не рекомендуются следующие методы дезинфекции / стерилизации: Кипячение в ультрафиолетовом свете Стерилизация стеклянными шариками Микроволновые печи Chemiclave 7.Использование стерилизованного оборудования В месте использования при вскрытии упаковки и оборудования необходимо проверить: — Отсутствие изменения цвета ленты снаружи упаковки и отсутствие изменения цвета внутренней индикаторной полоски — Изменение цвета или загрязнение. на оборудовании, которое может указывать на ненадлежащую очистку перед стерилизацией — Неисправное оборудование — Влага на упаковке или оборудовании. Если любой из вышеперечисленных пунктов, оборудование необходимо вывести из эксплуатации и обработать или заменить.Обеспечение качества Аудиты практики повторной обработки должны проводиться для обеспечения стерилизации: — Процессы очистки должны проверяться на регулярной основе — Должен существовать процесс повышения качества для устранения любых нарушений и проблем, возникающих в результате аудита
16 Ссылки: Лучшие практики для Очистка, дезинфекция и стерилизация во всех медицинских учреждениях, Провинциальный консультативный комитет по инфекционным заболеваниям (PIDAC), Министерство здравоохранения и долгосрочного ухода, Онтарио, май 2013 г. Стандарты, политика и руководящие принципы общественного здравоохранения Применимые Канадская ассоциация стандартов: CSA Z Эффективная стерилизация в здравоохранении Услуги по уходу с помощью парового процесса CSA Z Обеззараживание медицинских устройств многократного использования 15-16
17 Раздел очистки области: будет добавлено позднее 15-17
18 Приложение A: Микробы в порядке повышения устойчивости к Дезинфекция и стерилизация Споры бактерий (например,g., Clostridium difficile, Bacillus anthracis) Труднее убить микобактерии (например, ТБ) Нелипидные или мелкие вирусы (например, вирус полиомиелита, Коксаки) Грибки (например, Candida, aspergillus) Липидный вирус или вирус среднего размера (например, герпес, ВИЧ, гепатит B / C) Легче уничтожить вегетативные бактерии (например, стафилококки, псевдомонады) 15-18
19 Приложение B: Классификация Сполдинга для медицинского оборудования и требуемый уровень обработки / переработки Система классификации, разработанная Сполдингом, делит медицинское оборудование на три категории в зависимости от о потенциальном риске инфицирования, связанного с его использованием: Классификация Определение Критическое оборудование Оборудование, которое входит в стерильные ткани, включая сосудистую систему Уровень обработки Очистка с последующей стерилизацией Примеры Шовные и хирургические инструменты Инструменты для биопсии Полукритическое оборудование Оборудование, которое поставляется по контракту с не- неповрежденная кожа или слизистые оболочки, но не проникает в них Очистка f следует проводить дезинфекцию высокого уровня (как минимум) Оборудование для ухода за ногами Оборудование для респираторной терапии Оборудование для анестезии Некритическое оборудование Оборудование, которое касается только неповрежденной кожи, а не слизистых оболочек Оборудование, которое не касается напрямую пациента Предпочтительна стерилизация Очистка с последующей дезинфекцией низкого уровня В некоторых случаях ящиков допускается только чистка аппарата ЭКГ Манжеты для измерения кровяного давления Оксиметр Поддоны, писсуары, туалеты 15-19
20 Приложение C Высокий уровень дезинфекции медицинского оборудования ЦЕЛЬ: Обеспечить безопасное оборудование для повторного использования посредством дезинфекции МАТЕРИАЛЫ: Одноразовые перчатки Ферментное моющее средство Empower) Дезинфицирующий раствор (Metricide 28) Полотенца без ворса Ванночки для замачивания При необходимости: — Лицевой щиток — Халат 15-20
21 ЭТАПЫ ОЧИСТКИ 1 Проведите оценку риска Определите риск контакта с микробами и средствами индивидуальной защиты ( СИЗ), необходимые для выполнения задачи. правильные СИЗ для безопасного выполнения работы 2 Замочите сразу после использования: немедленно погрузите в мыльную воду или ферментное моющее средство (Empower) 3 Очистите Очистите все поверхности щеткой со стальной щетиной Используйте ферментное моющее средство Проверьте все стороны на наличие крови 4 Промойте водопроводной водой 5 Высушите 15 -21
22 6 Погрузить в дезинфицирующий раствор высокого уровня (метицид на 20 минут) 7 Высушить безворсовой тканью 8 Маркировать как продезинфицированную и готовую к использованию 9 Хранение Держать в сухом состоянии, очищать от пыли и предотвращать заражение Если возможно, проводится дезинфекция высокого уровня путем стерилизации паром
23 Приложение D Процедура стерилизации ЦЕЛЬ: Обеспечить безопасное оборудование для повторного использования посредством стерилизации МАТЕРИАЛЫ: Одноразовые перчатки Ферментное моющее средство (Empower) Полотенца без ворса Емкости для замачивания При необходимости: — Лицевой щиток — Платье 15 -23
24 ЭТАПЫ ОЧИСТКИ 1 Проведите оценку риска Определите риск воздействие микробов и средства индивидуальной защиты (СИЗ), необходимые для выполнения задачи. Надевайте соответствующие СИЗ для безопасного выполнения работы 2 Замачивание Погрузите в мыльную воду или ферментное моющее средство (Empower) 3 Очистите Очистите все поверхности щеткой со стальной щетиной Используйте ферментное моющее средство 4 Полоскание водой из-под крана 5 Высушите безворсовой тканью или марлей 15-24
25 6 или Упаковка Используйте хирургическую пленку со стерильными индикаторными полосками внутри Закройте автоклавной лентой Упаковка Поместите в отслаиваемый пакет со стерильным индикатором Термосварка или отслаивающая застежка-палочка 7 Готово в автоклав 8 Вставьте упаковку в автоклав для стерилизации 9 Автоклав: установите в соответствии с настройками производителя Просушите в автоклаве перед удалением 15-25
26 10 Хорошо, когда полоска изменит цвет 11 Транспортировка Убедитесь, что упаковка не загрязнена 12 Хранение Хранить в чистом месте.Держите в сухом и защищенном от пыли, чтобы предотвратить загрязнение 15-26
27 Приложение E: Расходные материалы для повторной обработки медицинского оборудования Номер Meditech Название продукта Использование Комментарии Metricide 28 Химический раствор для дезинфекции высокого уровня Тест-полоски Metricide 28 Для тестирования Раствор Metricide Лента для автоклава Закрыть синяя упаковка, полосы меняют цвет, когда автоклав достигает температуры и времени Стерильные индикаторные полоски Помещать в упаковку, меняют цвет, когда внутренняя часть упаковки достигает температуры и времени. Empower Ферментное моющее средство для замачивания инструментов перед чисткой Нитриловые перчатки (маленькие) Нитриловые перчатки (средние) Нитриловые перчатки (большие) Omni wrap 24×24 Для упаковки пакетов для стерилизации паром Omni wrap 30×30 Для упаковки пакетов для стерилизации паром Omni wrap 45×45 Для упаковки пакетов для паровой стерилизации Wrap двойная трубка для очистки прозрачными пластиковыми трубками для паровой стерилизации 3 x Wrap трубка для двойной очистки от прозрачного пластика трубки для стерилизации паром 4 x Wr ap dual peel tube Прозрачные пластиковые трубки для стерилизации паром Кувшин объемом 6 литров Подлежит термосвариванию Подлежит термосвариванию Подлежит термосвариванию Салфетки Tote Одноразовые салфетки без ворса Для сушки и инструментов Проволочная щетка с щетиной Удаление материала с инструментов 15-27
28 Приложение F: Инструкции по очистке домашнего кислородного оборудования Концентратор: Фильтр: Назальная канюля: Протирайте корпус снаружи один раз в неделю влажной тканью.Перед протиранием отключите прибор от сети. Заменяйте фильтр в установке каждые 4 месяца и между клиентами. Ежедневно протирайте кончики канюли мыльной салфеткой и ополаскивайте. Заменяйте каждый месяц или чаще, если есть трещины, поломки или обесцвечивание. Кислородная трубка: каждую неделю протирайте внешнюю часть трубки влажной тканью. Не замачивайте длинную трубку в воде, так как вылить всю воду очень сложно. Меняйте каждые 4 месяца. Баллон увлажнителя: кислородные маски: используйте только в том случае, если врач предписывает больше 4 литров в минуту.Вылейте воду, когда уровень воды достигнет линии наполнения на внешней стороне бутылки. Мойте бутылку раз в неделю, следуя инструкциям по очистке, приведенным в разделе «Кислородные маски». Меняйте бутылку каждый месяц. Умывайтесь раз в неделю в теплой мыльной воде, следуя этим шагам очистки: 1. Разберите маску или бутылку как можно больше. 2. Замочите все детали в теплой мыльной воде. 3. Тщательно промойте проточной водой. 4. Замочите в растворе, состоящем из 1 части белого уксуса и 3 частей воды, на 20 минут, тщательно промойте и дайте высохнуть на воздухе.Храните в пластиковом пакете, когда не используете. Всегда держите под рукой запасную замену. Заменяйте кислородную маску каждый месяц или чаще, если она треснула, сломалась или изменила цвет. Март
Мобильные решения для стерилизации — Мобильная обработка
Живой чат | Подписка по электронной почте Войти / Зарегистрироваться | Моя тележка- Дом
- Товары
- ХИРУРГИЧЕСКОЕ ОБОРУДОВАНИЕ И ОБРАБОТКА
- Хирургические столы
- Принадлежности для хирургических столов
- Хирургические и диагностические системы освещения
- ИЛИ Окружающая среда
- Утилиты и системы видеосвязи
- Шкафы с подогревом AMSCO
- Раковины Скраб
- ИЛИ Системы интеграции
- Хирургические штанги
- Хирургические дисплеи и дисплеи большого формата
- Решения для хранения в операционной
- Пункты документации медсестер
- Гибридное ИЛИ
- Запасные части
- Услуги SecureCare
- Сервисный учебный центр
- СТЕРИЛЬНАЯ ОБРАБОТКА ПРОДУКЦИИ И УСЛУГ
- Паровые стерилизаторы
- Системы мойки и обеззараживания
- Системы низкотемпературной стерилизации V-PRO
- Жидкая химическая стерилизация
- Химия для чистки хирургических инструментов
- Обеспечение и мониторинг стерильности
- Биологические индикаторы
- Химические индикаторы
- Пакеты и лотки для стерилизации
- Мониторинг персонала
- Мобильная стерильная обработка
- Принадлежности для стерильного отделения обработки
- Программное обеспечение для отслеживания хирургических активов SPM
- Программное обеспечение для управления рабочим процессом стерильной обработки CS-iQ
- Технология ConnectAssure
- Запасные части
- Услуги SecureCare
- Сервисный учебный центр
- ПЕРЕРАБОТКА ЭНДОСКОПОВ
- Место использования эндоскопа Предварительная очистка
- Ручная очистка
- ПРОВЕРЬТЕ индикаторы очистки RESI-TEST
- Жидкая химическая стерилизация
- Дезинфекция высокого уровня
- Сушка эндоскопа, хранение и транспортировка
- Технология ConnectAssure
- Запасные части
- Услуги SecureCare
- Сервисный учебный центр
- Хирургические штанги
- Освещение для экзамена HexaLux
- Однокамерные обогревающие шкафы AMSO
- Хирургические дисплеи и дисплеи большого формата
- Запасные части
- Услуги SecureCare
- Сервисный учебный центр
- ЭНДОСКОПИЧЕСКИЕ УСТРОЙСТВА
- Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ)
- Аппараты для эндоскопических ультразвуковых процедур
- Энтероскопия и устройства для доставки капсул
- Устройства для удаления инородных тел
- Управление кровотечением и ирригация GI
- Продукты для процедур GI
- Устройства для полипэктомии и сбора тканей
- Устройства для извлечения сети Roth
- Урологические устройства
- Система криотерапии TruFreeze Spray
- Инсуффляция CO2
- Электрохирургическая установка и оборудование
- Насос для полива торрент
- ХИРУРГИЧЕСКОЕ ОБОРУДОВАНИЕ И ОБРАБОТКА
- Планирование и дизайн
- Запасные части
- обслуживание
-
- Услуги SecureCare
- Сервисный учебный центр
-
Стерилизация — Профилактика инфекций и борьба с ними — Город Торонто
- Любой стерилизуемый предмет необходимо сначала очистить.Ультразвуковой очиститель можно использовать для очистки инструментов перед стерилизацией.
- Все предметы перед стерилизацией должны быть упакованы. Автоклавы
- необходимо контролировать, чтобы убедиться в их правильной работе.
- Требуется три типа мониторинга; биологические, химические и физические.
Необходимо проводить биологический мониторинг (тестирование спор) каждые 2 недели . Вы должны отправить полоски-тесты в лабораторию для тестирования. Пройденный (отрицательный) тест на споры означает, что стерилизатор работает нормально.Неудачный (положительный) тест на споры означает, что стерилизатор не работает должным образом. Храните копии результатов теста на споры на месте в течение года и в файле в течение 5 лет.
** Не используйте стерильные предметы или инструменты до ПОСЛЕ получения положительных (отрицательных) результатов теста на споры **
Необходимо провести три последовательных теста на споры, если:
- Автоклав не прошел тест на споры.
- Используется новый автоклав.
- Автоклав не использовался более 2 недель.
- Автоклав отремонтирован.
- Компания переезжает в новое постоянное место.
Химический мониторинг необходимо выполнять каждый раз при использовании автоклава. Это означает, что все комплекты приборов должны иметь снаружи термочувствительный индикатор. Индикатор изменит цвет, если инструмент прошел цикл в автоклаве. Он не сообщает вам, правильно ли был стерилизован инструмент.
Физический мониторинг означает ведение записей для каждой нагрузки. Вы должны записать дату, время, продолжительность, количество оборудования, температуру, давление и лицо, ответственное за стерилизационную загрузку. Эти записи должны храниться на месте в течение одного года и в течение пяти лет. Дата стерилизации предмета также должна быть указана на упаковке. Перед тем как писать, подождите, пока предмет высохнет, и будьте осторожны, чтобы не порвать упаковку ручкой. Также можно использовать наклейку с датой стерилизации.
Принципы паровой стерилизациии распространенные ошибки с использованием автоклавов
Командная стерилизацияиспользовалась более века для стерилизации предметов, которые могут выдерживать влагу и высокую температуру. Пар — это вода в парообразном состоянии; поэтому он нетоксичен, обычно легко доступен и относительно легко контролируется. Хорошее понимание основных принципов и циклов стерилизации паром необходимо, чтобы избежать ошибок, которые могут привести к нестерильным предметам загрузки, плохой работе оборудования, травмам персонала, снижению производительности, более высоким затратам на эксплуатацию и техническое обслуживание и повреждению предметов загрузки.Паровые стерилизаторы широко используются в фармацевтической и медицинской промышленности. Основное внимание в этой статье уделяется применениям насыщенного пара, таким как стерилизация лабораторных сред, дезактивация и общая стерилизация компонентов. Для окончательной стерилизации парентеральных жидких продуктов или устройств, содержащих жидкости, могут потребоваться процессы с использованием паровоздушных смесей или перегретых водно-воздушных смесей. Эти процессы, а также стерилизация резервуаров, фильтров и т. Д. На месте в данной статье не рассматриваются.
Принципы паровой стерилизации
Шесть факторов особенно важны для обеспечения успешной стерилизации паром:
- Время
- Температура
- Влажность
- Прямой контакт с паром
- Удаление воздуха
- Сушка
1. Время
Время воздействия (стерилизации) является критическим фактором просто потому, что не все организмы погибают одновременно. Для уничтожения всех организмов требуется минимальное время при температуре стерилизации.Споры Geobacillus stearothermophilus (Bst) обычно используются для проверки циклов парового стерилизатора, поскольку они чрезвычайно устойчивы к стерилизации влажным теплом. Они также не являются патогенными и коммерчески легко доступны. Число выживших обычно отображается в логарифмической шкале. Прямолинейная кривая выживаемости, такая как показанная на рисунке 1, является типичной.
D-значение (время для уменьшения микробной популяции на 90%) для Bst должно составлять от 1,5 до 3,0 минут при 121,1 ° C (250 ° F).Для целей данного обсуждения используется значение D121, равное 2,0 минуты, и температура стерилизации 121 ° C (250 ° F). Типичный цикл стерилизации будет включать фазу выдержки продолжительностью не менее 20 минут при 121 ° C (250 ° F) для уровня обеспечения стерильности (SAL) 10-4, при условии, что начальная популяция составляет один миллион (106) организмов. Это означает, что существует один шанс из десяти тысяч (10-4) того, что одна жизнеспособная спора Bst выживет в процессе. Для каждых дополнительных двух минут воздействия при 121 ° C (250 ° F) SAL уменьшается в десять раз.Требуемая лицензия SAL зависит от приложения. Перед разработкой цикла следует позаботиться о том, чтобы правильно выбрать лицензию SAL. Фактическая бионагрузка стерилизуемых продуктов будет уничтожена быстрее, чем Bst. Получающееся в результате «излишнее уничтожение» является приемлемым методом стерилизации предметов длительного пользования, и его следует использовать, когда это возможно.
Услуги по стерилизации | Brooks Life Sciences
В Brooks Life Sciences мы знаем, насколько важно предоставлять лабораторное оборудование в идеальном состоянии и подходящее для ваших исследований.Вот почему мы предлагаем четыре альтернативных метода для продуктов, свободных от загрязнений.
1. Производство стерильно
Профилактика лучше лечения, поэтому мы производим все расходные материалы для хранения проб в условиях чистых помещений класса 8 ISO. Чтобы попасть в эту зону, каждый должен носить халат, перчатки, маску для лица, сетку для волос и галоши. Кроме того, они должны проходить через двойную дверь с «воздушным душем», предназначенным для удаления любых частиц. В чистую комнату не допускаются материалы, которые могут вызвать загрязнение.
Продукты стерильны в момент формования, которое происходит при температурах плавления смолы — обычно от 140 ° C до 150 ° C для сополимера и от 165 ° C до 175 ° C для гомополимера.
Из машины для литья под давлением наши расходные материалы обрабатываются и упаковываются в пакеты в чистой комнате. Только после того, как они покидают чистую комнату, их помещают в транспортный ящик для отправки.
Эффективность этого процесса периодически проверяется, что позволяет нам иметь высокую степень уверенности в том, что наши продукты «производственно стерильны» и соответствуют стандартам, указанным в таблице ниже.
| Загрязнение | Стандарт испытаний |
|---|---|
| Эндотоксин (пироген) | Продукт (продукты) проходят периодические испытания, и обнаружено, что их соответствие ниже допустимого уровня ≤ 0,05 ЕС / мл |
| ДНК / РНК ДНКаза / РНКаза | Продукт (-а) свободен от загрязнений на основании оценки деградации с помощью электрофореза третьей стороной |
| Тяжелые металлы | Ни один из наших продуктов, отвечающих требованиям CONEG 100 частей на миллион / вес, не содержит тяжелых металлов. |
| Ингибиторы ПЦР | Продукт (-а) не содержит ингибиторов ПЦР |
2.Стерилизация гамма-излучением
Обычно лабораторные расходные материалы, требующие стерилизации, обрабатываются для обеспечения «Уровня обеспечения стерильности» (или SAL) 10 -3 или 10 -6 . Облучение не гарантирует, что продукт не содержит других загрязнителей, таких как перечисленные выше, кроме того, что в нем отсутствуют жизнеспособные микроорганизмы. По-прежнему важно подтвердить отсутствие загрязняющих веществ для проверки SAL.
Гамма-облучение не гарантирует уничтожения загрязнения ДНК до такой степени, чтобы оно не усиливалось и не мешало последующему анализу.Обеспечение отсутствия амплифицируемой ДНК зависит от (i) производственной стерильности производства и тестирования, описанных выше, и (ii) выполнения требований для чувствительных применений, таких как стерилизация с использованием этиленоксида (EtO).
Гамма-облучение может отрицательно повлиять на полипропилен, делая его со временем более хрупким и улучшая связывающие характеристики пластика. По этой причине Brooks Life Sciences рекомендует по возможности полагаться на производственную стерильность, чтобы поставлять чистый продукт, необходимый для исследований и длительного хранения.
3. Стерилизация этиленоксидом (EtO)
Стерилизация с использованием EtO так же эффективна, как и гамма-облучение, обеспечивая уровень гарантии стерильности 10 -6 . Кроме того, это гарантирует отсутствие ДНК, которую можно амплифицировать до уровня, при котором существует риск последующего вмешательства. Таким образом, EtO является предпочтительным методом стерилизации в критических областях, таких как судебная экспертиза.
4. Двойная стерилизация этиленоксидом (EtO)
В недавно опубликованном стандарте ISO 18385: 2016 основное внимание уделяется минимизации риска заражения ДНК человека в расходных материалах, используемых при сборе, хранении или анализе биологического материала для целей судебной экспертизы ДНК.Рекомендуется двойная обработка EtO, чтобы еще больше минимизировать присутствие ДНК, амплифицируемой ПЦР.
Обзор
| Производство стерильных | Гамма-облучение | Оксид этилена | Двойной оксид этилена | |
|---|---|---|---|---|
| Общее описание | Продукт произведен в чистом помещении ISO 8 (класс 100K). Продукт — эндотоксин (пироген), ДНК / РНК, тяжелые металлы и продукты животного происхождения. | Гарантирует отсутствие жизнеспособных микроорганизмов, но не может гарантировать заражение уничтоженной ДНК. Влияет на полипропилен, делая его со временем более хрупким и усиливая связывание пластика. | Эффективен для предотвращения амплификации ДНК до уровня, при котором существует риск интерференции. | Рекомендуется для расходных материалов, используемых при сборе, хранении или анализе биологического материала для судебной ДНК. |
| Рекомендуется для стандартного использования | Есть | Нет | Нет | Нет |
| Рекомендуется для критических приложений судебной экспертизы (амплификация ДНК) | Нет | Нет | Есть | Есть |
| Модифицирует полипропилен | Нет | Есть | Нет | Нет |
| Виды продукции | Все | Пробирки с крышкой или без крышки | Только пробирки без крышки, наливные крышки, держатели крышек | Только пробирки без крышки, наливные крышки, держатели крышек |
| Упаковка | Навал на 10 стоек | Гильза из пяти стоек в стандартной комплектации — в индивидуальной упаковке как опция | В индивидуальной упаковке | В индивидуальной упаковке |
| Минимальное количество | Нет | 10 ящиков | 25 ящиков | 25 ящиков |
| Номер детали | НЕТ | -GS | -S | -DS |
| Пример номера детали | 68-0703-02 | 68-0703-02-GS | 68-0703-02-S | 68-0703-02-DS |
 5%
моющий раствор порошка «Билот» /5
г порошка и 995 мл воды температуры 40% —
45% C/;
5%
моющий раствор порошка «Билот» /5
г порошка и 995 мл воды температуры 40% —
45% C/;
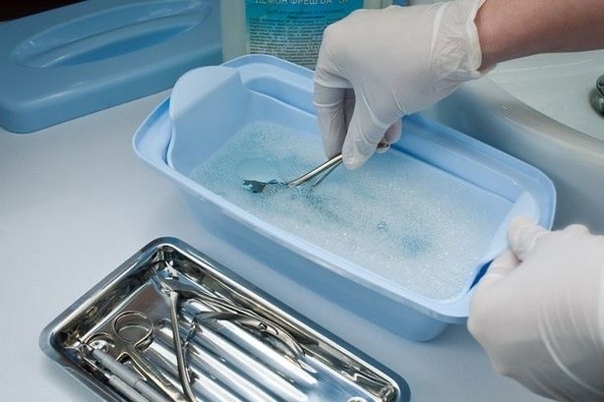 ru
ru