Средства дезинфекции. Современные средства и методы дезинфекции
На сегодняшний день вопросы дезинфекции и стерилизации затрагивают очень многие сферы деятельности – от промышленной до ведения домашнего хозяйства. Зловредные микроорганизмы наносят непоправимый урон как животным и растениям, так и самому человеку, вызывая широкий спектр различных заболеваний. Поэтому своевременное проведение комплекса необходимых мер по их уничтожению является крайне важным.
Под дезинфекцией понимается совокупность мероприятий, которые направлены на уничтожение вредоносных и болезнетворных бактерий в окружающей человека среде. При этом речь идет только о патогенных формах микроорганизмов. Для проведения этой процедуры обычно используются такие средства дезинфекции как гипохлорид и формальдегид натрия и различные дезинфицирующие растворы органических веществ (надуксусная кислота, хлоргексидин).
Различают 3 вида дезинфекции: профилактическую, текущую и заключительную. Профилактическая дезинфекция проводится на постоянной основе с определенной периодичностью и не зависит от эпидемической обстановки, она носит предотвращающий характер, текущая – с целью предотвращения дальнейшего распространения уже возникшего заражения, заключительная – после устранения очага инфекции для удаления всех возможных ее следов.
Современные методы и средства дезинфекции
Методы и средства дезинфекции от «Совдез» можно подразделить на три основные группы:
1. Механические методы дезинфекции. К ним относится уборка помещений, в том числе влажная, их покраска и побелка;
2. Физические, такие как использование ультрафиолетового излучения, прокаливание, проглаживание и обжиг, пастеризация и кипячение, паровое воздействие;
3. Химические. Проводятся с помощью специализированных дезинфицирующих средств путем орошения, распыления, протирания, погружения в раствор со средством.
Этапы дезинфекции, как правило, включают в себя выявление очага распространения микроорганизмов и размеров зараженной площади, выбор наиболее подходящего способа дезинфекции и необходимых для этого препаратов и приспособлений, проведение процедуры дезинфекции самостоятельно или с помощью специальных служб.
Стерилизация как современное средство дезинфекции
Стерилизация – это обработка предметов и объектов, при которой достигается полное уничтожение всех микроорганизмов и их спор, и именно в этом ее отличие от дезинфекции, при которой происходит гибель только патогенных форм микробов и болезнетворных бактерий. Стерилизация может быть физической и химической. Под физической стерилизацией понимается кипячение, воздействие пара и жара, прокаливание предметов в огне, кипячение. Химическую стерилизация обычно проводят при помощи окиси этилена, которая имеет крайне губительное влияние как на сами бактерии, так и на их споры, что позволяет не только устранить существующий очаг заражения, но и исключить возможность его повторного возникновения. Химические средства, которыми проводится стерилизация, также отличаются токсичностью и требуют крайней осторожности при использовании.
Химическую стерилизация обычно проводят при помощи окиси этилена, которая имеет крайне губительное влияние как на сами бактерии, так и на их споры, что позволяет не только устранить существующий очаг заражения, но и исключить возможность его повторного возникновения. Химические средства, которыми проводится стерилизация, также отличаются токсичностью и требуют крайней осторожности при использовании.
Таким образом, современные средства дезинфекции и стерилизации имеют высокую эффективность в борьбе с болезнетворными микроорганизмами, но в силу своей специфики и токсичности должны использоваться только в рамках деятельности специализированных организаций, таких как наша дезинфекционная служба «Совдез» поможет вам провести качественную дезинфекцию и стерилизацию по разумной цене.
Методы и средства дезинфекции и стерилизации инструментов в косметологии
Красивый бизнес — это не только общение с клиентами и выполнение процедур. Закулисная сторона деятельности салона красоты подразумевает ведение отчетности, закуп и учет средств, препаратов и расходных материалов, а также постоянную обработку инструментов, оборудования и помещения. Неважно, идет речь о лицензированной клинике, оказывающей косметологические медицинские услуги, или о небольшом салоне-парикмахерской с кабинетом маникюра, дезинфекция и стерилизация — важная часть ежедневной работы.
Неважно, идет речь о лицензированной клинике, оказывающей косметологические медицинские услуги, или о небольшом салоне-парикмахерской с кабинетом маникюра, дезинфекция и стерилизация — важная часть ежедневной работы.
Дезинфекция и стерилизация в косметологии
Соблюдение норм дезинфекции и стерилизации — основной козырь успешного бизнеса. Чистоплотность и забота о здоровье клиентов выгодно выделит мастера или косметолога из числа конкурентов. Жесткое соблюдение правил санитарной безопасности обезопасит салон от возможных судебных разбирательств, его не застанет врасплох внезапная проверка из СЭС.
Существует целый перечень законодательно закрепленных нормативов и требований к чистоте и стерильности инструментария и помещений. Косметологу, парикмахеру и мастеру маникюра необходимо знать следующий необходимый минимум.
- Основные правила санитарной обработки инструмента и помещений медицинских учреждений отражены в отраслевом стандарте ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения.
 Методы, средства и режимы» Он утвержден приказом Министерства здравоохранения СССР № 770 и действует до сих пор.
Методы, средства и режимы» Он утвержден приказом Министерства здравоохранения СССР № 770 и действует до сих пор. - СанПиН 2.1.2 1199-03 «Парикмахерские. Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию» регулирует работу небольших салонов красоты, специализирующиеся на услугах по уходу за волосами.
- СП 1.1.1058-01 «Организация и проведение производственного контроля за соблюдением санитарных правил и выполнением санитарно-противоэпидемических (профилактических) мероприятий» предписывают .
Предприятия, позиционирующие себя как клиники эстетической медицины, должны относиться к санитарно-эпидемиологическим требований более строго. Их работа координируется расширенным перечнем документов, в том числе:
- СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность»
- СанПиН 2.1.3. 1375-03 «Гигиенические требования к размещению, устройству, оборудованию и эксплуатации больниц, родильных домов и других лечебных стационаров» (при оказании косметологических услуг)
- СанПиН 2.
 2.1/2.1.1.1278-03 «Гигиенические требования к естественному, искусственному и совмещенному освещению жилых и общественных зданий»
2.1/2.1.1.1278-03 «Гигиенические требования к естественному, искусственному и совмещенному освещению жилых и общественных зданий» - СанПиН 2.2.4.548-96 «Гигиенические требования к микроклимату производственных помещений»
Согласно документации, обработка инструмента многоразового использования состоит из трех этапов:
- Дезинфекция;
- Предстерилизационная обработка — ПСО;
- Стерилизация.
Методы дезинфекции
Дезинфекций принято называть мероприятия, направленные на уничтожение микробов, бактерий, грибков и других вредных микроорганизмов во внешней среде: на коже клиента, руках косметолога, поверхностях инструмента, мебели, оборудования и т.п. Ее цель — прервать возможную передачу инфекции.
Методы дезинфекции:
- Механический — уборка и вынос мусора, стирка полотенец и спецодежды, фильтрация воздуха и воды и т.п.
- Физический:
- воздействие высокими температурами:
• кипячение в течение 30 минут или 15 минут в 2%-ном растворе соды;
• глажка утюгом;
• прокаливание инструмента;
• сжигание мусора.
- облучение ультрафиолетом с помощью бактерицидных ламп.
- Химический — применение различных химических дезсредств.
Дезинфицировать инструмент и рабочие поверхности необходимо после каждого клиента. Существенно сэкономить время помогают одноразовые расходные материалы: простыни, перчатки, деревянные шпатели и т.п.
Дезинфекция многоразового инструмента и емкостей в условиях косметологического кабинета выполняется ручным способом. В конце дня все использованные предметы погружаются в дезраствор, покрывающий их на толщину не менее 1 см. Жидкость должна заполнять все внутренние пустоты, а инструменты с замковыми соединениями погружаются раскрытыми. После окончания срока экспозиции, указанного на этикетке каждого средства, инструменты вынимают и 30 секунд тщательно промывают проточной водой.
Второй этап обработки — предстерилизационная очистка — предполагает механическое (ручное) удаление остатков дезсредств и препаратов, биологических жидкостей, кусочков кожи, волос, ногтей клиентов. Сегодня существует целый ряд средств, совмещающих этапы дезинфекции и ПСО, они намного удобнее для небольшого салона.
Сегодня существует целый ряд средств, совмещающих этапы дезинфекции и ПСО, они намного удобнее для небольшого салона.
Методы стерилизации
Непосредственно стерилизация обеспечивает гибель всех возможных форм существования микроорганизмов. Стерилизовать необходимо все предметы, которые соприкасались с инъекционными препаратами, кровью или слизистыми клиента.
Методы стерилизации в салоне:
- Термический:
• в сухожаровом шкафу;
• в глассперленовом стерилизаторе. - Химический — специальными средствами, перекисью водорода или спиртом.
Стерилизованные таким методом предметы ополаскивают на два раза дистиллированной водой, используют сразу или хранят в стерильных запечатанных крафт-пакетах до 3-х дней.
Контроль за химической стерилизаций выполняет руководитель салона или сотрудник санитарно-эпидемиологической службы применением катализаторов-проб:
- азопирамовая — выявляет остатки крови на инструменте;
- фенолфталеиновая — остатки моющих средств.

Контролировать качество стерилизации можно специальными индикаторами-полосками, меняющими окраску при определенной температуре. Они закладываются среди партии инструментов в сухожаровой шкаф. Появление эталонного цвета полоски означает, что инструмент стерилен.
Средства дезинфекции и стерилизации
Существует очень много средств для дезинфекции, перечислить их полностью невозможно. Они выпускаются в готовом виде, в форме таблеток и жидких концентратов. Выбирая удобные для использования в салоне красоты или косметическом кабинете средства, стоит руководствоваться некоторыми советами.
Они должны:
- быть удобными с применении. Их приготовление не должно занимать много времени, а сами они должны совмещать этапы стерилизации и ПСО. К таким средствам относятся Виркон, Пироксимед, Лизоформин и др.;
- хорошо растворяться в воде;
- действовать быстро, по возможности в малых концентрациях;
- обладать низкой токсичностью;
- быть стойкими при долгом хранении.

Для дезинфекции металлических изделий нельзя применять хлорсодержащие растворы — они вызывают коррозию. Такие предметы обрабатывают полным погружением в 70% спирт на полчаса. Сложные инструменты типа машинки для стрижки волос, разбираются на части.
Незаменимы для салона дезинфектанты-аэрозоли на спирту. Они помогают обработать после каждого клиента кушетку и стул мастера, лампу-луму, аппараты, инструментальный столик. Средства в аэрозольных баллончиках не нужно разводить, ими можно обрабатывать пластмассовые, пластиковые, стеклянные, керамические и другие поверхности, устойчивые к спиртовым растворам. После высыхания средства мебель и оборудование считаются продезинфицированными.
Стерилизацию инструмента, помимо специальных средств, проводят 6%-ный раствором перекиси водорода. Обрабатываемые предметы должны находиться в нем не менее 6 часов при комнатной температуре. Режим обработки при 50 градусах — 3 часа.
Дезинфекция рук
Мытье рук на глазах у клиента — обязательное условие для косметолога, парикмахера или мастера маникюра.
Помимо этого:
- кожа рук должна быть здоровой, без признаков дерматита, экземы и язв;
- лучше использовать жидкое средство или мыло, которое хорошо пенится;
- полотенце должно быть чистым и индивидуальным.
Пилинги, дермабразию, маникюр, другие процедуры с возможным повреждением кожи делают в стерильных перчатках. Перед этим руки тщательно моют, заходя на область предплечья, и обрабатывают антисептиком в такой последовательности:
- ладонь к ладони;
- ладонью одной руки по тылу другой;
- между пальцами;
- большие пальцы;
- вращательное трение ладони одной руки пальцами другой.
Дезинфекция предметов обстановки
Правила дезинфекции подразумевают ежедневную уборку помещения каждого кабинета салона или клиники, где идет прием клиентов. Обработку внешней обстановки проводят в начале и конце рабочего дня в такой последовательности:
- шарфы и емкости со стерильным материалом;
- шкафы с препаратами и косметическими средствами;
- столик или подставка для инструментов;
- оборудование;
- стул и кушетка для клиентов;
- стул косметолога или мастера;
- подоконник и стены на вытянутую руку;
- пол.

В конце уборки помещение кварцуют: утром — полчаса, вечером — час.
Обработку кушетки, стула клиента и наконечников оборудования нужно проводить после каждого клиента. Здесь на помощь приходят одноразовые простыни и дезинфектанты-спреи, о которых говорилось выше. По правилам, два раза в день нужно выбирать время для текущей уборки, включающей мытье полов и кварцевание кабинета на 15-20 минут.
Генеральную уборку проводят раз в неделю. Мебель отодвигают от стен и с помощью распылители обрабатывают стены, пол, потолок и все предметы, находящиеся в кабинете 6-%-ной перекисью водорода, добавленной в моющий раствор. Смывают горячей водой через час, включают кварц на 2 часа, затем комнату тщательно проветривают. Учет проведения генеральных уборок и стерилизации инструментария ведется в специальных журналах по особой форме.
Оборудование для стерилизации инструментов
Помимо прямой задачи уничтожения инфекции, стерилизация инструмента работает на репутацию и прибыль предприятия красивого бизнеса.
Решение о покупке оборудования для стерилизации инструмента должно приниматься, исходя из:
- масштаба салона;
- ежедневного количества загрязняемого инструмента;
- характера оказываемых услуг.
Так, компактный глассперленовый стерилизатор обрабатывает большое количество мелких металлических предметов за 20-30 секунд, поэтому удобен для мастера маникюра, пирсинга, татуажа. Вопреки расхожему мнению, использовать для полной обработки ультрафиолетовый аппарат в кабинете ногтевого сервиса нельзя: он уничтожает микроорганизмы, но не стерилизует инструмент. УФО-стерилизатор подойдет для этапа дезинфекции и обработки парикмахерских ножниц, расчесок, металлических шпателей, кисточек и прочих предметов, которые не соприкасаются с кровью клиента.
Оборудование | Принцип действия | Особенности |
Ультрафиолетовый стерилизатор | Ликвидация микроорганизмов с поверхности инструмента УФО-излучением | 1. Предназначен для дезинфекции. |
Глассперленовый стерилизатор | Полное уничтожение микроорганизмов множеством мелких стеклянных шариков, нагретых до температуры 250-300 градусов | 1. |
Сухожаровый шкаф | Стерилизация сухим горячим воздухом | 1. Экологически чистый метод |
Паровой стерилизатор (автоклав) | Стерилизация горячим паром | 1. Обычно применяется в больницах и крупных клиниках для стерилизации большого количества инструмента и габаритных предметов. |
Безукоснительное соблюдение правил дезинфекции и стерилизации застрахует салон красоты от возможных неприятностях при проверках и сформирует в глазах клиентов образ заведения высокого уровня.
Актуальные вопросы дезинфекции и стерилизации
Главная \ Актуальные вопросы дезинфекции и стерилизации
АННОТАЦИЯ
Дополнительная профессиональная программа повышения квалификации «Актуальные вопросы дезинфекции и стерилизации» (далее – Программа) представляет собой форму обучения, при которой Слушатель осваивает образовательную программу под руководством преподавателя Института, при этом для самоподготовки имеет возможность использовать дистанционную платформу на сайте http://dist.profnauka.ru и включающей в себя: учебно-методическую документацию, определяющую требования к содержанию и уровню подготовки Слушателя, виды учебных занятий по реализации учебного процесса, руководство самостоятельной работой слушателей и формы контроля по данному курсу.
Программа предназначена для подготовки специалистов со средним медицинским образованием. Программа призвана дать слушателям умение самостоятельно выполнять все работы, предусмотренные требованиями законов и подзаконных актов, в соответствии с техническими требованиями и нормами, установленными в отношении порядка оказания медицинской помощи.
Группы комплектуются из числа медицинских работников, имеющих среднее медицинское образование.
Планируемые результаты обучения:
В результате освоения дополнительной профессиональной программы, обучающиеся должны знать:
принципы организации дезинфекционно-стерилизационного режима медицинской организации
современную инструктивно-методическую литературу (СанПины и иные документы), регламентирующую организацию и проведение
дезинфекционных и стерилизационных мероприятий в медицинских организациях
свойства и назначение средств для дезинфекции
классы опасности дезинфицирующих средств
виды и методы дезинфекции
современные направления проведения стерилизационных мероприятий
виды стерилизации
правила ведения медицинской документации
меры безопасности при проведении мероприятий по дезинфекции и стерилизации
В результате освоения дополнительной профессиональной программы, обучающиеся должны уметь:
организовывать и проводить дезинфекционные и стерилизационные мероприятия в медицинских организациях
соблюдать правила использования дезинфицирующих средств, дезинфекционного и стерилизационного оборудования
проводить контроль дезинфекции, предстерилизационной очистки и стерилизации
вести утвержденную медицинскую документацию
В результате освоения дополнительной профессиональной программы обучающиеся должны владеть навыками (получить практический опыт):
организации и проведения дезинфекционных и стерилизационных мероприятий в медицинских организациях
проведения контроля качества дезинфекции, предстерилизационной очистки и стерилизации
ведения медицинской документации
Особенности электронного обучения: занятия проводятся в формате электронного обучения (онлайн-курс) на базе Образовательного портала http://dist. profnauka.ru.
profnauka.ru.
Вход и идентификация обучающихся осуществляется по индивидуальному логину и паролю в личном кабинете.
В процессе обучения слушатели изучают лекционный материал в текстовом формате, промежуточная аттестация проводится в форме онлайн-тестирования. Результаты обучения отображаются в личном кабинете. Для освоения учебного материала в формате онлайн-курса слушателям необходимо иметь компьютер (планшет) с выходом в информационно-телекоммуникационную сеть «Интернет».
Итоговая аттестация: проводится в форме онлайн-тестирования. В результате успешного освоения дополнительной профессиональной программы повышения квалификации выдается документ установленного образца — Удостоверение о повышении квалификации.
УЧЕБНЫЙ ПЛАН
программы повышения квалификации
Цель обучения: качественное совершенствование компетенций, необходимых для организации и проведения дезинфекционных и стерилизационных мероприятий в медицинской организации. Совершенствуемые компетенции: способность и готовность к организации и проведению дезинфекционных и стерилизационных мероприятий в медицинской организации
Совершенствуемые компетенции: способность и готовность к организации и проведению дезинфекционных и стерилизационных мероприятий в медицинской организации
Программа повышения квалификации для среднего медицинского персонала по следующим специальностям:
- Основная:
Сестринское дело
- Дополнительные:
Медицинский массаж
Лабораторная диагностика
Лечебное дело
Общая практика
Операционное дело
Реабилитационное сестринское дело
Сестринское дело
Сестринское дело в косметологии
Сестринское дело в педиатрии
Стоматология
Стоматология профилактическая
Стоматология ортопедическая
Скорая и неотложная помощь
Физиотерапия
Функциональная диагностика
Форма обучения: заочное обучение с элементами электронного обучения на основе дистанционных образовательных технологий.
Срок обучения: 18 академических часов (3 дня)
Режим занятий: в соответствии с утвержденным графиком.
№п/п | Наименование тем | Количество часов | |||
всего | Лекции | Практики | Форма контроля | ||
Основная нормативно-правовая документация, регламентирующая способы, режимы и средства для дезинфекции, предстерилизационной очистки и стерилизации | 4 |
| 4 | тест | |
Основные виды современных дезинфицирующих средств, применяемых в здравоохранении в настоящее время. | 2 | 2 | 0 |
| |
Классы опасности дезинфицирующих средств | 2 | 2 | 0 |
| |
Понятие, виды и методы современной дезинфекции. | 2 | 2 | 0 |
| |
Понятие, виды, методы стерилизации, организация работы по современной стерилизации. | 2 | 2 | 0 |
| |
Основные меры безопасности при проведении дезинфекции, предстерилизационной очистки и стерилизации. | 2 | 2 | 0 |
| |
| ИТОГОВЫЙ ТЕСТ | 4 |
| 4 | тест |
| итого | 18 | 10 | 8 |
|
Современные технологии для улучшения очистки и дезинфекции поверхностей окружающей среды в больницах | Устойчивость к противомикробным препаратам и инфекционный контроль
Rutala WA, Weber DJ. Дезинфицирующие средства, используемые для дезинфекции окружающей среды и новые технологии дезактивации помещений. Am J Infect Control. 2013; 41: S36–41.
PubMed Статья Google ученый
Донски CJ. Уменьшает ли улучшение очистки и дезинфекции поверхностей число инфекций, связанных с оказанием медицинской помощи? Am J Infect Control.2013; 41: S12–9.
PubMed Статья Google ученый
Танцовщица SJ. Борьба с внутрибольничной инфекцией: особое внимание уделяется роли окружающей среды и новым технологиям обеззараживания. Clin Microbiol Rev.2014; 27: 665–90.
CAS PubMed PubMed Central Статья Google ученый
Хан Дж. Х., Салливан Н., Лис Б. Ф., Пегес Д. А., Качмарек Дж. Л., Умшайд, Калифорния.Очистка поверхностей в больничных палатах для предотвращения инфекций, связанных с оказанием медицинской помощи. технический бриф. Ann Intern Med. 2015; 163: 598-607.
Carling PC, Bartley JM. Оценка гигиенической чистки в медицинских учреждениях: то, чего вы не знаете, может навредить вашим пациентам. Am J Infect Control. 2010; 38: S41–50.
PubMed Статья Google ученый
Бойс Дж. М., Хэвилл Н. Л., Липка А., Хэвилл Х., Ризвани Р. Различия в практике ежедневной уборки в больницах.Инфекционный контроль Hosp Epidemiol. 2010. 31: 99–101.
PubMed Статья Google ученый
Сицлар Б., Дешпанде А., Фертелли Д., Кундрапу С., Сетхи А.К., Донски С.Дж. Одиссея дезинфекции окружающей среды: оценка последовательных вмешательств для улучшения дезинфекции изоляторов Clostridium difficile. Инфекционный контроль Hosp Epidemiol. 2013; 34: 459–65.
PubMed Статья Google ученый
Аппельбаум Э., Берг П., Фрост А., Пройс Г., Аппельбаум Э. Влияние реструктуризации работы на низкооплачиваемых и низкоквалифицированных рабочих в больницах США. В: Bernhadt A, Murnane R, редакторы. Америка с низкой заработной платой: как работодатели меняют возможности на рабочем месте. Нью-Йорк: Фонд Рассела Сейджа; 2003. с. 77–117.
Google ученый
Зубери Д.М., Пташник М.Б. Пагубные последствия приватизации и аутсорсинга для вспомогательной работы больниц: опыт нанятых по контракту уборщиков больниц и диетических средств в Ванкувере, Канада.Soc Sci Med. 2011; 72: 907–11.
PubMed Статья Google ученый
Зоутман Д.Е., Форд Б.Д., Софа К. Ресурсы и мероприятия по очистке окружающей среды в канадских больницах неотложной помощи. Am J Infect Control. 2014; 42: 490–4.
PubMed Статья Google ученый
Думиган Д.Г., Бойс Дж.М., Хэвилл Н.Л., Голебевски М., Балогун О., Ризвани Р. Кто действительно заботится о вашем окружении ухода? Разработка стандартизированных процедур очистки и эффективных методов мониторинга.Am J Infect Control. 2010; 38: 387–92.
PubMed Статья Google ученый
Андерсон Р. Э., Янг В., Стюарт М., Робертсон К., Танцовщица С. Дж. Аудит чистоты клинических поверхностей и оборудования: кто что чистит? J Hosp Infect. 2011; 78: 178–81.
CAS PubMed Статья Google ученый
Али С., Мур Дж., Уилсон А.П. Влияние покрытия и отделки поверхности на очищаемость перил кровати и распространение Staphylococcus aureus.J Hosp Infect. 2012; 80: 192–8.
CAS PubMed Статья Google ученый
Каднум Дж. Л., Херлесс К. Н., Кундрапу С., Донски С.Дж. Перенос спор Clostridium difficile неспорицидными салфетками и неправильно использованными салфетками из гипохлорита: практика + продукт = совершенство. Инфекционный контроль Hosp Epidemiol. 2013; 34: 441–2.
PubMed Статья Google ученый
Сиани Х, Купер С, Майярд Дж. Эффективность «спорицидных» салфеток против Clostridium difficile. Am J Infect Control. 2011; 39: 212–8.
CAS PubMed Статья Google ученый
Engelbrecht K, Ambrose D, Sifuentes L, Gerba C, Weart I, Koenig D. Снижение активности имеющихся в продаже дезинфицирующих средств, содержащих соединения четвертичного аммония, при воздействии на хлопковые полотенца. Am J Infect Control. 2013; 41: 908–11.
CAS PubMed Статья Google ученый
Бойс Дж. М., Салливан Л., Букер А., Бейкер Дж. Проблемы с дезинфицирующим средством на основе четвертичного аммония, возникшие в отделе экологических услуг. Инфекционный контроль Hosp Epidemiol. 2016; 37: 340–2.
PubMed Статья Google ученый
Ramm L, Siani H, Wesgate R, Maillard JY. Перенос патогенов и высокая вариабельность удаления патогенов с помощью салфеток с моющими средствами.Am J Infect Control. 2015; 43: 724–8.
CAS PubMed Статья Google ученый
Вебер Д. Д., Рутала В. А., Сикберт-Беннет Э. Вспышки, связанные с зараженными антисептическими и дезинфицирующими средствами. Антимикробные агенты Chemother. 2007; 51: 4217–24.
CAS PubMed PubMed Central Статья Google ученый
Бойс Дж. М., Хэвилл Н.Л., Тетро Дж., Саттар С.А.Рост бактерий в используемом дезинфицирующем средстве на основе четвертичного аммония для больниц. Представлено на 21-м ежегодном научном собрании Общества эпидемиологии здравоохранения Америки, 2 апреля 2011 г., Даллас, Техас, abstr 113, 2011 г.
Kampf G, Degenhardt S, Lackner S, Jesse K, von Baum H, Ostermeyer C. Плохо обработанные многоразовые диспенсеры для дезинфекции поверхностей могут быть источником инфекции. BMC Infect Dis. 2014; 14: 37.
PubMed PubMed Central Статья Google ученый
Экштейн BC, Адамс Д.А., Экштейн Е.К., Рао А., Сетхи А.К., Ядавалли Г.К. и др. Снижение загрязнения поверхностей окружающей среды Clostridium difficile и ванкомицином Enterococcus после вмешательства по улучшению методов очистки. BMC Infect Dis. 2007; 7: 61.
PubMed PubMed Central Статья Google ученый
French GL, Otter JA, Shannon KP, Adams NMT, Watling D, Parks MJ.Борьба с загрязнением окружающей среды больницы метициллин-устойчивым стафилококком Staphylococcus (MRSA): сравнение традиционной конечной очистки и обеззараживания паров перекиси водорода. J Hosp Infect. 2004; 57: 31–7.
CAS PubMed Статья Google ученый
Сиглер В., Хенсли С. Устойчивость смешанных скоплений стафилококков после дезинфекции поверхностей больничных палат. J Hosp Infect.2013; 83: 253–6.
CAS PubMed Статья Google ученый
Митчелл Б.Г., Дигни В., Медальон П., Танцовщица С.Дж. Борьба с метициллин-устойчивым золотистым стафилококком (MRSA) в больнице и роль дезактивации перекисью водорода: анализ прерванных временных рядов. BMJ Open. 2014; 4: e004522.
PubMed PubMed Central Статья Google ученый
Hayden MK, Bonten MJ, Blom DW, Lyle EA, van de Vijver DA, Weinstein RA. Снижение приобретения устойчивых к ванкомицину Enterococcus после выполнения обычных мер по очистке окружающей среды. Clin Infect Dis. 2006; 42: 1552–60.
PubMed Статья Google ученый
Маниан Ф.А., Гриснауэр С., Сенкель Д. Влияние окончательной очистки и дезинфекции на изоляцию комплекса Acinetobacter baumannii с неодушевленных поверхностей больничных палат количественными и качественными методами.Am J Infect Control. 2013; 41: 384–5.
PubMed Статья Google ученый
Strassle P, Thom KA, Johnson JK, Leekha S, Lissauer M, Zhu J, et al. Влияние окончательной очистки на уровень загрязнения окружающей среды Acinetobacter baumannii с множественной лекарственной устойчивостью. Am J Infect Control. 2012; 40: 1005–7.
PubMed Статья Google ученый
Гудман Э.Р., Платт Р., Басс Р., Ондердон А.Б., Йокое Д.С., Хуанг СС.Влияние мероприятий по очистке окружающей среды на наличие метициллин-резистентных Staphylococcus и ванкомицин-резистентных энтерококков на поверхностях в палатах интенсивной терапии. Инфекционный контроль Hosp Epidemiol. 2008; 29: 593–9.
PubMed PubMed Central Статья Google ученый
Пассаретти К.Л., Оттер Дж. А., Райх Н. Г., Майерс Дж., Шепард Дж., Росс Т. и др. Оценка дезактивации окружающей среды парами перекиси водорода для снижения риска заражения пациента микроорганизмами с множественной лекарственной устойчивостью.Clin Infect Dis. 2013; 56: 27–35.
CAS PubMed Статья Google ученый
Митчелл Б.Г., Танцовщица С.Дж., Андерсон М., Ден Э. Риск заражения организма от предыдущих обитателей комнаты: систематический обзор и метаанализ. J Hosp Infect. 2015; 91: 211–7.
CAS PubMed Статья Google ученый
Carling PC, Briggs JL, Perkins J, Highlander D.Улучшенная уборка комнат пациентов с помощью нового метода наведения. Clin Infect Dis. 2006; 42: 385–8.
PubMed Статья Google ученый
Бойс Дж. М., Хэвилл Н. Л., Думиган Д. Г., Голебевски М., Балогун О., Ризвани Р. Мониторинг эффективности методов очистки больниц с использованием анализа биолюминесценции АТФ. Инфекционный контроль Hosp Epidemiol. 2009. 30: 678–84.
PubMed Статья Google ученый
Рупп М.Э., Фитцджеральд Т., Шольц Л., Лайден Э., Карлинг П. Сохранение выгоды: программа по устойчивому повышению эффективности очистки окружающей среды. Инфекционный контроль Hosp Epidemiol. 2014; 35: 866–8.
PubMed Статья Google ученый
Альфа М.Дж., Ло Э, Уолд А., Дьюк С., Дегань П., Хардинг Г.К. Улучшенное уничтожение спор Clostridium difficile из туалетов госпитализированных пациентов с использованием ускоренной перекиси водорода в качестве чистящего средства.BMC Infect Dis. 2010; 10: 268.
PubMed PubMed Central Статья Google ученый
Rutala WA, Gergen MF, Weber DJ. Эффективность улучшенной перекиси водорода против важных патогенов, связанных со здоровьем. Инфекционный контроль Hosp Epidemiol. 2012; 33: 1159–61.
PubMed Статья Google ученый
Boyce JM, Havill NL. Оценка нового дезинфицирующего средства для салфеток с перекисью водорода.Инфекционный контроль Hosp Epidemiol. 2013; 34: 521–3.
PubMed Статья Google ученый
Alfa MJ, Lo E, Olson N, MacRae M., Buelow-Smith L. Использование ежедневного дезинфицирующего очистителя вместо ежедневного очистителя снизило уровень внутрибольничных инфекций. Am J Infect Control. 2015; 43: 141–6.
CAS PubMed Статья Google ученый
Рутала В.А., Герген М.Ф., Сикберт-Беннетт Е.Е., Уильямс Д.А., Вебер Д.Эффективность улучшенной перекиси водорода в обеззараживании штор, зараженных патогенами с множественной лекарственной устойчивостью. Am J Infect Control. 2014; 42: 426–8.
CAS PubMed Статья Google ученый
Чиу С., Скура Б., Петрик М., Макинтайр Л., Гэмидж Б., Исаак-Рентон Дж. Эффективность обычных дезинфицирующих / чистящих средств в инактивации норовируса мыши и калицивируса кошек в качестве суррогатных вирусов для норовируса человека.Am J Infect Control. 2015; 43: 1208–12.
CAS PubMed Статья Google ученый
Карлинг П.С., Перкинс Дж., Фергюсон Дж., Томассер А. Оценка новой парадигмы для сравнения дезинфекции поверхностей в клинической практике. Инфекционный контроль Hosp Epidemiol. 2014; 35: 1349–55.
PubMed Статья Google ученый
Deshpande A, Mana TS, Cadnum JL, Jencson AC, Sitzlar B, Fertelli D, et al.Оценка ежедневного дезинфицирующего средства на основе перуксусной кислоты / перекиси водорода со спороцидным действием. Инфекционный контроль Hosp Epidemiol. 2014; 35: 1414–6.
PubMed Статья Google ученый
Микин Н.С., Боуман С., Льюис М.Р., Танцовщица С.Дж. Сравнение эффективности очистки используемого дезинфицирующего средства и электролизованной воды в английском доме престарелых. J Hosp Infect. 2012; 80: 122–7.
CAS PubMed Статья Google ученый
Fertelli D, Cadnum JL, Nerandzic MM, Sitzlar B, Kundrapu S, Donskey CJ. Эффективность электрохимически активированного физиологического раствора для дезинфекции больничного оборудования. Инфекционный контроль Hosp Epidemiol. 2013; 34: 543–4.
PubMed Статья Google ученый
Стюарт М., Богуш А., Хантер Дж., Деванни И., Ип Б., Рид Д. и др. Оценка использования нейтральной электролизованной воды для очистки поверхностей, находящихся рядом с пациентом. Инфекционный контроль Hosp Epidemiol.2014; 35: 1505–10.
CAS PubMed Статья Google ученый
Кэхилл О.Дж., Кларо Т., О’Коннор Н., Кафолла А.А., Стивенс Н.Т., Дэниэлс С. и др. Плазма холодного воздуха для обеззараживания неодушевленных поверхностей в больнице. Appl Environ Microbiol. 2014; 80: 2004–10.
PubMed PubMed Central Статья CAS Google ученый
О’Коннор Н., Кэхилл О., Дэниэлс С., Гэлвин С., Хамфрис Х.Холодная плазма атмосферного давления и дезактивация. Может ли это способствовать профилактике внутрибольничных инфекций? J Hosp Infect. 2014; 88: 59–65.
PubMed Статья Google ученый
Кларо Т., Кэхилл О.Дж., О’Коннор Н., Дэниэлс С., Хамфрис Х. Плазма атмосферного давления холодного воздуха против спор Clostridium difficile: потенциальная альтернатива обеззараживанию неодушевленных поверхностей в больницах. Инфекционный контроль Hosp Epidemiol.2015; 36: 742–4.
PubMed Статья Google ученый
Унал Н., Яник К., Карадаг А., Одабаси Х., Эсен С., Гунайдин М. Оценка эффективности тумана акацида плюс (R) в искоренении возбудителей внутрибольничных инфекций. Int J Clin Exp Med. 2014; 7: 5867–71.
PubMed PubMed Central Google ученый
Мур Г., Гриффит С. Лабораторная оценка обеззараживающих свойств салфеток из микроволокна.J Hosp Infect. 2006. 64: 379–85.
CAS PubMed Статья Google ученый
Rutala WA, Gergen MF, Weber DJ. Микробиологическая оценка швабр из микрофибры для дезинфекции поверхностей. Am J Infect Control. 2007; 35: 569–73.
PubMed Статья Google ученый
Мур Г., Холл Т.Дж., Уилсон А.П., Гант В.А. Эффективность неорганического биоцида на основе меди CuWB50 снижается из-за жесткой воды.Lett Appl Microbiol. 2008; 46: 655–60.
CAS PubMed Статья Google ученый
Али С., Мур Дж., Уилсон А.П. Распространение и устойчивость спор Clostridium difficile во время и после очистки спорицидными дезинфицирующими средствами. J Hosp Infect. 2011; 79: 97–8.
CAS PubMed Статья Google ученый
Берген Л.К., Мейер М., Хог М., Рубенхаген Б., Андерсен Л.П.Распространение бактерий на поверхности при очистке салфетками из микрофибры. J Hosp Infect. 2009. 71: 132–7.
CAS PubMed Статья Google ученый
Трайтман А.Н., Маникам К., Альфа МДж. Салфетки из микрофибры уменьшают перенос спор Clostridium difficile на поверхности окружающей среды по сравнению с хлопчатобумажными тканями. Am J Infect Control. 2015; 43: 686–9.
PubMed Статья Google ученый
Вебер DJ, Рутала, Вашингтон. Самостоятельная дезинфекция поверхностей: обзор текущих методологий и перспективы на будущее. Am J Infect Control. 2013; 41: S31–5.
PubMed Статья Google ученый
Хамфрис Х. Самостоятельная дезинфекция и пропитка микробиоцидом поверхностей и тканей: каков потенциал в предотвращении распространения инфекций, связанных с оказанием медицинской помощи? Clin Infect Dis. 2014; 58: 848–53.
PubMed Статья CAS Google ученый
Schmidt MG, Attaway HH, Sharpe PA, John Jr J, Sepkowitz KA, Morgan A, et al. Устойчивое снижение микробной нагрузки на обычные больничные поверхности за счет введения меди. J Clin Microbiol. 2012; 50: 2217–23.
PubMed PubMed Central Статья Google ученый
Шмидт М.Г., Аттауэй III, Х.Х., Фейри С.Е., Стид Л.Л., Мичелс Х.Т., Сальгадо К.Д. Медь постоянно ограничивает концентрацию бактерий, обитающих на поручнях кровати в отделении интенсивной терапии.Инфекционный контроль Hosp Epidemiol. 2013; 34: 530–3.
PubMed Статья Google ученый
Салгадо С.Д., Сепковиц К.А., Джон Дж. Ф., Кэнти Дж. Р., Аттавей Х. Х., Фриман К. Д. и др. Медные поверхности снижают количество инфекций, приобретенных в отделении интенсивной терапии. Инфекционный контроль Hosp Epidemiol. 2013; 34: 479–86.
PubMed Статья Google ученый
Schweizer M, Graham M, Ohl M, Heilmann K, Boyken L, Diekema D. Новые больничные занавески с антимикробными свойствами: рандомизированное контролируемое исследование. Инфекционный контроль Hosp Epidemiol. 2012; 33: 1081–5.
PubMed Статья Google ученый
Коцанас Д., Вийесория В. Р., Слоан Т., Стюарт Р. Л., Гиллеспи Э. Серебряная подкладка одноразовых занавесок для уединения спорицидного действия в отделении интенсивной терапии. Am J Infect Control. 2014; 42: 366–70.
PubMed Статья Google ученый
Бакса Д., Шетрон-Рама Л., Голембиески М., Голембиески М., Джайн С., Гордон М. и др. Оценка in vitro нового процесса снижения бактериального загрязнения поверхностей окружающей среды. Am J Infect Control. 2011; 39: 483–7.
CAS PubMed Статья Google ученый
Boyce JM, Havill NL, Guercia KA, Schweon SJ, Moore BA.Оценка двух органосилановых продуктов на предмет устойчивой антимикробной активности на чувствительных поверхностях в палатах пациентов. Am J Infect Control. 2014; 42: 326–8.
CAS PubMed Статья Google ученый
Tamimi AH, Carlino S, Gerba CP. Длительная эффективность самодезинфицирующего покрытия в отделении интенсивной терапии. Am J Infect Control. 2014; 42: 1178–81.
CAS PubMed Статья Google ученый
Hedin G, Rynback J, Lore B. Снижение бактериального загрязнения поверхности в больнице за счет применения нового продукта со стойким эффектом. J Hosp Infect. 2010; 75: 112–5.
CAS PubMed Статья Google ученый
Пейдж К., Уилсон М., Паркин И.П. Антимикробные поверхности и их потенциал в снижении роли неодушевленной среды в возникновении внутрибольничных инфекций. J Mater Chem.2009; 19: 3819–31.
CAS Статья Google ученый
Park GW, Cho M, Cates EL, Lee D, Oh BT, Vinje J, et al. Фторированный TiO (2) в качестве вирулицидного поверхностного покрытия, активируемого окружающим светом, для борьбы с норовирусом человека. Журнал J Photochem Photobiol B. 2014; 140: 315–20.
CAS PubMed Статья Google ученый
Bogdan J, Zarzynska J, Plawinska-Czarnak J.Сравнение чувствительности инфекционных агентов к фотокаталитическому воздействию наноразмерных оксидов титана и цинка: практический подход. Nanoscale Res Lett. 2015; 10: 1023.
PubMed Google ученый
de Jong B, van Zanten ARH. Влияние MVX (диоксида титана) на микробную колонизацию поверхностей в отделении интенсивной терапии. Идентификатор Clinical Trials.gov: NCT02348346, 2015.
Otter JA, Yezli S, Perl TM, Barbut F, French GL.Роль автоматических систем дезинфекции помещений в профилактике инфекций и борьбе с ними. J Hosp Infect. 2013; 83: 1–13.
CAS PubMed Статья Google ученый
Оттава (ON): Канадское агентство по лекарствам и технологиям в области здравоохранения. Не ручные методы дезинфекции помещений в медицинских учреждениях: обзор клинической эффективности и руководящие принципы. 2014.
Андерсен Б.М., Раш М., Хохлин К., Йенсен Ф. Х., Висмар П., Фредриксен Дж. Э.Обеззараживание помещений, медицинского оборудования и машин скорой помощи аэрозолем дезинфицирующего средства перекиси водорода. J Hosp Infect. 2006; 62: 149–55.
CAS PubMed Статья Google ученый
Shapey S, Machin K, Levi K, Boswell TC. Активность системы сухого тумана с перекисью водорода в отношении загрязнения окружающей среды Clostridium difficile в палатах ухода за престарелыми. J Hosp Infect. 2008; 70: 136–41.
CAS PubMed Статья Google ученый
Bartels MD, Kristoffersen K, Slotsbjerg T., Rohde SM, Lundgren B., Westh H. Экологическая дезинфекция Staphylococcus aureus (MRSA), устойчивого к метициллину, с использованием перекиси водорода, образующейся в сухом тумане. J Hosp Infect. 2008; 70: 35–41.
CAS PubMed Статья Google ученый
Барбут Ф., Менуэт Д., Верахтен М., Жиру Э. Сравнение эффективности системы дезинфекции сухим туманом перекисью водорода и раствора гипохлорита натрия для уничтожения спор Clostridium difficile .Инфекционный контроль Hosp Epidemiol. 2009. 30: 507–14.
CAS PubMed Статья Google ученый
Пискин Н., Селеби Дж., Кулах С., Менгелоглу З., Юмусак М. Активность системы обеззараживания перекисью водорода с помощью сухого тумана против метициллин-устойчивых Staphylococcus aureus и Acinetobacter baumannii. Am J Infect Control. 2011; 39: 757–62.
PubMed Статья Google ученый
Landelle C, Legrand P, Lesprit P, Cizeau F, Ducellier D, Gouot C и др. Затяжная вспышка Acinetobacter baumannii с множественной лекарственной устойчивостью после межконтинентального переноса колонизированных пациентов. Инфекционный контроль Hosp Epidemiol. 2013; 34: 119–24.
PubMed Статья Google ученый
Бест Е.Л., Парнелл П., Тиркелл Г., Верити П., Копленд М., Эльсе П. и др. Эффективность глубокой очистки с последующей дезактивацией перекисью водорода при высокой заболеваемости инфекцией Clostridium difficile.J Hosp Infect. 2014; 87: 25–33.
CAS PubMed Статья Google ученый
Фиче Г., Антиога К., Комой Е., Деслис Дж. П., Макдоннелл Г. Инактивация прионов с использованием нового процесса стерилизации газообразным перекисью водорода. J Hosp Infect. 2007. 67: 278–86.
CAS PubMed Статья Google ученый
Heckert RA, Best M, Jordan LT, Dulac GC, Eddington DL, Sterritt WG.Эффективность испаренной перекиси водорода против экзотических вирусов животных. Appl Environ Microbiol. 1997; 63: 3916–8.
CAS PubMed PubMed Central Google ученый
Rogers JV, Sabourin CL, Choi YW, Richter WR, Rudnicki DC, Riggs KB, et al. Оценка дезактивации спор Bacillus anthracis, Bacillus subtilis и Geobacillus stearothermophilus на внутренних поверхностях с использованием газогенератора перекиси водорода. J Appl Microbiol.2005; 99: 739–48.
CAS PubMed Статья Google ученый
Pottage T, Richardson C, Parks S, Walker JT, Bennett AM. Оценка систем газовой дезинфекции перекисью водорода для обеззараживания вирусов. J Hosp Infect. 2010. 74: 55–61.
CAS PubMed Статья Google ученый
Ray A, Perez F, Beltramini AM, Jakubowycz M, Dimick P, Jacobs MR, et al.Использование обеззараживания испаренной перекисью водорода во время вспышки инфекции Acinetobacter baumannii с множественной лекарственной устойчивостью в больнице для долгосрочной неотложной помощи. Инфекционный контроль Hosp Epidemiol. 2010; 31: 1236–41.
PubMed PubMed Central Статья Google ученый
Гэлвин С., Бойл М., Рассел Р.Дж., Коулман Д.К., Кример Э., О’Гара Дж. П. и др. Оценка испарения перекиси водорода, Citrox и pH-нейтрального Ecasol для дезактивации закрытых помещений: пилотное исследование.J Hosp Infect. 2012; 80: 67–70.
CAS PubMed Статья Google ученый
Chmielarczyk A, Higgins PG, Wojkowska-Mach J, Synowiec E, Zander E, Romaniszyn D, et al. Контроль вспышки инфекции Acinetobacter baumannii с помощью испаренной перекиси водорода. J Hosp Infect. 2012; 81: 239–45.
CAS PubMed Статья Google ученый
Бейтс К.Дж., Пирс Р. Использование паров перекиси водорода для контроля окружающей среды во время вспышки болезни Serratia в отделении интенсивной терапии новорожденных. J Hosp Infect. 2005. 61: 364–6.
CAS PubMed Статья Google ученый
Hall L, Otter JA, Chewins J, Wengenack NL. Использование паров перекиси водорода для дезактивации Mycobacterium tuberculosis в шкафу биологической безопасности и комнате. J Clin Microbiol.2007; 45: 810–5.
CAS PubMed PubMed Central Статья Google ученый
Hall L, Otter JA, Chewins J, Wengenack NL. Деактивация диморфных грибов Histoplasma capsulatum, Blastomyces dermatitidis и Coccidioides immitis с использованием паров перекиси водорода. Med Mycol. 2008. 46: 189–91.
CAS PubMed Статья Google ученый
Boyce JM, Havill NL, Otter JA, McDonald LC, Adams NMT, Cooper T и др. Влияние дезактивации паровой комнаты перекиси водорода на загрязнение окружающей среды и передачу Clostridium difficile в медицинских учреждениях. Инфекционный контроль Hosp Epidemiol. 2008; 29: 723–9.
PubMed Статья Google ученый
Otter JA, French GL. Выживание внутрибольничных бактерий и спор на поверхностях и инактивация парами перекиси водорода.J Clin Microbiol. 2009. 47: 205–7.
CAS PubMed PubMed Central Статья Google ученый
Manian FA, Griesenauer S, Senkel D, Setzer JM, Doll SA, Perry AM, et al. Изоляция комплекса Acinetobacter baumannii и метициллин-устойчивого золотистого стафилококка из больничных помещений после окончательной очистки и дезинфекции: можем ли мы сделать лучше? Инфекционный контроль Hosp Epidemiol. 2011; 32: 667–72.
PubMed Статья Google ученый
Барбут Ф, Йезли С., Мимун М., Фам Дж., Чауат М., Оттер Дж. А. Снижение распространения Acinetobacter baumannii и метициллин-резистентного золотистого стафилококка на ожоговом отделении за счет вмешательства группы инфекционного контроля. Бернс. 2013; 39: 395–403.
PubMed Статья Google ученый
Джинс А., Рао Г., Осман М., Меррик П. Искоренение стойких экологических MRSA. J Hosp Infect. 2005. 61: 85–6.
CAS PubMed Статья Google ученый
Драйден М., Парнаби Р., Дайли С., Льюис Т., Дэвис-Блюз К., Оттер Дж. А. и др. Обеззараживание паров перекиси водорода в борьбе со вспышкой поликлонального метициллин-устойчивого Staphylococcus aureus в хирургическом отделении. J Hosp Infect. 2008; 68: 190–2.
CAS PubMed Статья Google ученый
Оттер Дж. А., Йезли С., Схоутен М. А., ван Зантен А. Р., Хумес-Зильман Г., Нольманс-Паульссен М.К. Обеззараживание паров перекиси водорода отделения интенсивной терапии для удаления из окружающей среды резервуаров грамотрицательных стержней с множественной лекарственной устойчивостью во время вспышки.Am J Infect Control. 2010. 38: 754–6.
PubMed Статья Google ученый
Купер Т., О’Лири М., Йезли С., Оттер Дж. Влияние дезактивации окружающей среды с использованием паров перекиси водорода на частоту инфицирования Clostridium difficile в одном больничном фонде. J Hosp Infect. 2011; 78: 238–40.
CAS PubMed Статья Google ученый
Сниткин Е.С., Желязны А.М., Томас П.Дж., Сток Ф., Хендерсон Д.К., Палмор Т.Н. и др.Отслеживание больничной вспышки устойчивой к карбапенемам Klebsiella pneumoniae с помощью полногеномного секвенирования. Sci Transl Med. 2012; 4: 148ra116.
PubMed PubMed Central Статья Google ученый
Гопинатх Р., Савард П., Кэрролл К.С., Уилсон Л.Э., Ландрам Б.М., Perl TM. Соображения по профилактике инфекций, связанные с металло-бета-лактамазой Enterobacteriaceae Нью-Дели: отчет о болезни. Инфекционный контроль Hosp Epidemiol. 2013; 34: 99–100.
PubMed Статья Google ученый
Оттер Дж. А., Новаковски Э., Салкельд Дж. А., Дюкло М., Пассаретти К. Л., Йезли С. и др. Экономия средств за счет обеззараживания упаковки неиспользованных медицинских принадлежностей с использованием паров перекиси водорода. Инфекционный контроль Hosp Epidemiol. 2013; 34: 472–8.
PubMed Статья Google ученый
Otter JA, Barnicoat M, Down J, Smyth D, Yezli S, Jeanes A.Обеззараживание паров перекиси водорода помещения отделения интенсивной терапии, где лечили пациента с лихорадкой Ласса. J Hosp Infect. 2010; 75: 335–7.
CAS PubMed Статья Google ученый
Оттер Дж. А., Мефам С., Атан Б., Мак Д., Смит Р., Джейкобс М. и др. Окончательная дезактивация изолятора высокого уровня Royal Free London после случая заболевания вирусом Эбола с использованием паров перекиси водорода. Am J Infect Control.2016; 44: 233–5.
PubMed Статья Google ученый
Оттер Дж. А., Пухович М., Райан Д., Салкельд Дж. Э., Купер Т. А., Хэвилл Н. Л. и др. Оценка возможности рутинного использования паров перекиси водорода (ВПЧ) для дезинфекции помещений в загруженной больнице США. Инфекционный контроль Hosp Epidemiol. 2009. 30: 574–7.
PubMed Статья Google ученый
Berrington AW, Pedler SJ.Исследование газообразного озона для дезактивации MRSA боковых комнат больницы. J Hosp Infect. 1998. 40: 61–5.
CAS PubMed Статья Google ученый
de Boer HEL, van Elzelingen-Dekker CM, van Rheenen-Verberg CMF, Spanjaard L. Использование газообразного озона для уничтожения метициллин-устойчивого Staphylococcus aureus из домашней среды колонизированного сотрудника больницы. Инфекционный контроль Hosp Epidemiol.2006; 27: 1120–2.
PubMed Статья Google ученый
Sharma M, Hudson JB. Озон — эффективное и практичное антибактериальное средство. Am J Infect Control. 2008; 36: 559–63.
PubMed Статья Google ученый
Дэвис А., Поттедж Т., Беннетт А., Уокер Дж. Технологии очистки воздуха и газов от Clostridium difficile в сфере здравоохранения.J Hosp Infect. 2011; 77: 199–203.
CAS PubMed Статья Google ученый
Гиббс С.Г., Лоу Дж. Дж., Смит П. У., Хьюлетт А.Л. Газообразный диоксид хлора как альтернатива борьбе с клопами. Инфекционный контроль Hosp Epidemiol. 2012; 33: 495–9.
PubMed Статья Google ученый
Секстон Дж. Д., Таннер Б. Д., Максвелл С. Л., Герба С. П.. Снижение микробной нагрузки на чувствительные к контакту поверхности в больничных палатах за счет обработки с помощью портативной системы дезинфекции насыщенным паром.Am J Infect Control. 2011; 39: 655–62.
PubMed Статья Google ученый
Nernandzic MM, Cadnum JL, Pultz MJ, Donskey CJ. Оценка автоматизированного устройства ультрафиолетового излучения для обеззараживания Clostridium difficile и других патогенов, связанных со здоровьем, в больничных палатах. BMC Infect Dis. 2010; 10: 197.
Артикул Google ученый
Rutala WA, Gergen MF, Weber DJ. Обеззараживание помещений УФ-излучением. Инфекционный контроль Hosp Epidemiol. 2010; 31: 1025–9.
PubMed Статья Google ученый
Boyce JM, Havill NL, Moore BA. Окончательная дезактивация палат с использованием автоматизированной мобильной УФ-установки. Инфекционный контроль Hosp Epidemiol. 2011; 32: 737–42.
PubMed Статья Google ученый
Rutala WA, Gergen MF, Tande BM, Weber DJ. Быстрая дезактивация больничной палаты с использованием ультрафиолетового (УФ) света с наноструктурированным покрытием стен, отражающим УФ-лучи. Инфекционный контроль Hosp Epidemiol. 2013; 34: 527–9.
PubMed Статья Google ученый
Андерсон Д. Д., Герген М. Ф., Сматерс Э., Секстон Д. Д., Чен Л. Ф., Вебер Д. Д. и др. Обеззараживание целевых патогенных микроорганизмов в палатах пациентов с помощью автоматизированного устройства, излучающего ультрафиолетовое излучение.Инфекционный контроль Hosp Epidemiol. 2013; 34: 466–71.
PubMed PubMed Central Статья Google ученый
Махида Н., Воан Н., Босвелл Т. Первая оценка в Великобритании автоматизированного устройства для дезактивации помещений ультрафиолетом-С (Tru-D). J Hosp Infect. 2013; 84: 332–5.
CAS PubMed Статья Google ученый
Nerandzic MM, Fisher CW, Donskey CJ.Сортировка множества вариантов: сравнительная оценка двух систем ультрафиолетовой дезинфекции. PLoS One. 2014; 9: e107444.
PubMed PubMed Central Статья CAS Google ученый
Рутала В.А., Герген М.Ф., Танде Б.М., Вебер Диджей. Обеззараживание помещений аппаратом ультрафиолетового излучения C с коротким временем воздействия ультрафиолета. Инфекционный контроль Hosp Epidemiol. 2014; 35: 1070–2.
PubMed Статья Google ученый
Rutala WA, Weber DJ, Gergen MF, Tande BM, Sickbert-Bennett EE. Улучшает ли покрытие всех поверхностей комнаты ультрафиолетовое светоотражающее покрытие C по сравнению с покрытием только стен? Инфекционный контроль Hosp Epidemiol. 2014; 35: 323–5.
PubMed Статья Google ученый
Havill NL, Moore BA, Boyce JM. Сравнение микробиологической эффективности процессов паров перекиси водорода и ультрафиолетового света для дезактивации помещений.Инфекционный контроль Hosp Epidemiol. 2012; 33: 507–12.
PubMed Статья Google ученый
Андерсон Диджей, Секстон Диджей. Эффективность усиленной дезинфекции терминального зала для предотвращения инфекций, связанных со здоровьем (HAI). Идентификатор Clinical Trials.gov: NCT01579370, 2015.
Stibich M, Stachowiak J, Tanner B, Berkheiser M, Moore L, Raad I, et al. Оценка воздействия импульсного ксенонового ультрафиолетового дезинфекционного устройства для помещений с точки зрения воздействия на больничные операции и снижение микробного загрязнения.Инфекционный контроль Hosp Epidemiol. 2011; 32: 286–8.
PubMed Статья Google ученый
Левин Дж., Райли Л.С., Пэрриш С., Инглиш Д., Ан С. Влияние портативного импульсного ксенонового ультрафиолетового света после окончательной очистки на больничную инфекцию Clostridium difficile в общественной больнице. Am J Infect Control. 2013; 41: 746–8.
PubMed Статья Google ученый
Jinadatha C, Quezada R, Huber TW, Williams JB, Zeber JE, Copeland LA. Оценка воздействия импульсного ксенонового ультрафиолетового устройства для дезинфекции помещений на уровень загрязнения метициллин-устойчивым золотистым стафилококком. BMC Infect Dis. 2014; 14: 187.
PubMed PubMed Central Статья CAS Google ученый
Ghantoji SS, Stibich M, Stachowiak J, Cantu S, Adachi JA, Raad II, et al. Не уступает импульсному ксеноновому ультрафиолетовому излучению по сравнению с отбеливателем для снижения загрязнения окружающей среды Clostridium difficile на высокочувствительных поверхностях в изоляторах инфекций Clostridium difficile.J Med Microbiol. 2015; 64: 191–4.
CAS PubMed Статья Google ученый
Сандер Дж., Ладенштейн М. Надежность дозаторов дезинфицирующих средств в больницах (пер. Автора). Dtsch Med Wochenschr. 1974; 99: 1560–4.
CAS PubMed Статья Google ученый
Нагараджа А., Визинтайнер П., Хаас Дж. П., Менз Дж., Вормсер Г. П., Монтекальво Массачусетс. Инфекции Clostridium difficile до и во время использования ультрафиолетовой дезинфекции.Am J Infect Control. 2015; 43: 940–5.
Артикул Google ученый
Миллер Р., Симмонс С., Дейл С., Стибич М., Стаховяк Дж. Использование и воздействие импульсной ксеноновой ультрафиолетовой дезинфекционной системы комнаты и многопрофильной бригады по уходу на Clostridium difficile в учреждении долгосрочной неотложной помощи . Am J Infect Control. 2015; 43: 1350–3.
PubMed Статья Google ученый
МакМаллен К., Вуд Х, Буол В., Джонсон Д., Брэдли А., Вельтье К. и др. Воздействие системы дезинфекции помещения импульсным ксеноновым ультрафиолетовым светом (PX-UV) на нормы Clostridium difficile . Представлено на IDWeek 2015, аннотация 1714, 10 октября 2015 г., Сан-Диего, Калифорния. 2015.
Nerandzic MM, Thota P, Sankar CT, Jencson A, Cadnum JL, Ray AJ, et al. Оценка системы импульсной ксеноновой ультрафиолетовой дезинфекции для снижения количества патогенов, связанных со здоровьем, в больничных палатах.Инфекционный контроль Hosp Epidemiol. 2015; 36: 192–7.
PubMed Статья Google ученый
Maclean M, MacGregor SJ, Anderson JG, Woolsey GA, Coia JE, Hamilton K, et al. Обеззараживание окружающей среды изолятора больницы с использованием узкоспектрального света высокой интенсивности. J Hosp Infect. 2010; 76: 247–51.
CAS PubMed Статья Google ученый
Bache SE, Maclean M, MacGregor SJ, Anderson JG, Gettinby G, Coia JE и др. Клинические исследования системы обеззараживания окружающей среды высокоинтенсивным узким спектром света (HINS-light EDS) для непрерывной дезинфекции ожогового отделения в стационарных и амбулаторных условиях. Бернс. 2012; 38: 69–76.
PubMed Статья Google ученый
Маклин М., Маккензи К., Андерсон Дж. Г., Геттинби Дж., МакГрегор С. Дж.. Световая технология 405 нм для инактивации патогенов и ее потенциальная роль для дезинфекции окружающей среды и борьбы с инфекциями.J Hosp Infect. 2014; 88: 1–11.
CAS PubMed Статья Google ученый
Cram N, Shipman N, Quarles JM. Уменьшение количества переносимых по воздуху микробов в хирургической операционной и других клинических условиях: исследование с использованием системы AiroCide. J Clin Engineering. 2004: 79–88.
Предотвращение распространения инфекции в больницах
Haga click aquí para leer este texto en español
И пациенты, и персонал больницы должны уничтожать микробы, чтобы предотвратить распространение инфекций.Важным примером этого является борьба с инфекциями, связанными с оказанием медицинской помощи, (HAI), инфекциями, которые переносятся больными пациентами в результате их пребывания в больнице. Это может быть связано с загрязнением оборудования, хирургических инструментов или неправильной гигиеной персонала.
У каждой больницы должен быть план битвы, чтобы предотвратить распространение HAI. Стратегия борьбы с микробами в больнице состоит из трех процессов, выполняемых в следующем порядке: очистка, дезинфекция и, наконец, стерилизация.Давайте рассмотрим их по порядку, начиная от самой слабой формы уничтожения микробов (очистка) до самой серьезной (стерилизация).
Первый удар: Уборка
Когда мы используем термин «очистка», мы подразумеваем удаление всей видимой грязи, пыли и других посторонних материалов. Это означает, что оборудование, очищенное вручную с использованием мыла / моющего средства и воды, не содержит всех физических и химических остатков и большинства микроорганизмов.
Цель очистки — уменьшить бионагрузку.Бионагрузка (или начальное загрязнение ) относится к популяции жизнеспособных организмов на материале, инструменте, продукте или упаковке. В зависимости от того, где и как объект будет использоваться, очистки может быть достаточно для уменьшения бионагрузки, но для большинства других типов медицинского оборудования очистка является только первым шагом, за которым следует либо только дезинфекция, либо дезинфекция, а затем стерилизация. Другими словами, чистка всегда является первым шагом в последующей дезинфекции и стерилизации оборудования.
Чистка всего медицинского оборудования так важна по пяти основным причинам:
- Он удаляет всю оставшуюся кровь, гной, грязь или инородные частицы, которые могут вызвать опасные осложнения для следующего человека, которому предстоит операция с использованием этого инструмента.
- Снижает бионагрузку.
- Он забирает питательную среду для выживших микробов.
- Предотвращает коррозию высокоточных и дорогих инструментов с тонкими шарнирами и шарнирами.
- Обеспечивает безопасную транспортировку оборудования для сборки и упаковки для дезинфекции или стерилизации.
4 Методы стерилизации и очистки | Предотвращение прямого заражения Европы
4 Методы стерилизации и очисткиПроцедуры, используемые для обеспечения чистоты космического корабля и, в конечном итоге, для достижения желаемых стандартов стерилизации, начинаются во время проектирования и производства компонентов космического корабля.После этого, когда компоненты собираются, выполняются дальнейшие протоколы очистки и стерилизации. К сожалению, в настоящее время нецелесообразно стерилизовать весь космический корабль за один раз после сборки, одновременно защищая все его различные компоненты и датчики от повреждений или отказов. Различная чувствительность внутренних компонентов к процедурам стерилизации требует, чтобы многие части стерилизовались индивидуально, используя процедуру, совместимую с их функцией.Следовательно, для сложных научных миссий стерилизация всего космического корабля не является вариантом — единичная процедура стерилизации будет ограничена наиболее чувствительным компонентом космического корабля. В результате этого ограничения многие компоненты космического корабля стерилизуются индивидуально, а затем собираются в чистых помещениях с использованием строгих процедур, сводящих к минимуму повторное загрязнение.
СТАНДАРТЫ ОЧИСТКИ И СТЕРИЛИЗАЦИИТекущие требования NASA к защите планет для миссий на Марс основаны на процедурах, применяемых к посадочным модулям Viking.Миссии, в которых не проводятся эксперименты по обнаружению жизни, должны быть очищены, чтобы общая биологическая нагрузка космического корабля не превышала 300 000 спор, а плотность спор на поверхности космического корабля не превышала 300 м -2. Миссии с экспериментами по обнаружению жизни должны пройти дополнительные процедуры, чтобы гарантировать, что общая биозагрузка не превышает 30 спор. Эффективность различных процедур, используемых в настоящее время НАСА и его подрядчиками для соответствия этим стандартам биологической нагрузки, определяется использованием эталонных организмов, включая Bacillus subtilis (var. niger ), Bacillus pumilis, и Bacillus stearothermophilus. Bacillus spp. (эндоспорообразователи) были первоначально выбраны в качестве микробиологического индикатора успеха стерилизации на основании их повышенной устойчивости к нагреванию, высыханию и радиации.
ДОСТИЖЕНИЕ СТАНДАРТОВДвойной подход к контролю над прямым загрязнением, используемый миссией «Викинг» — тщательная очистка космического корабля с последующим активным снижением биологической нагрузки за счет тепловой стерилизации (см. Вставку 1.1 в главе 1) — формирует основу для используемых в настоящее время процедур. Все миссии тщательно очищаются, а затем те, в которых проводятся эксперименты по обнаружению жизни, проходят стерилизацию.
Посадочные аппараты Viking были собраны в чистых помещениях (см. Вставку 4.1 для описания текущих процедур в чистых помещениях). Во время сборки были проведены микробиологические анализы (см. Главу 5), чтобы установить, что среднее и общее количество спор на доступных поверхностях посадочного модуля составляло 300 м -2 и 300 000, соответственно. 1 Текущая практика требует, чтобы те части космического корабля, которые не соответствуют необходимым стандартам биологической нагрузки, были промыты изопропиловым спиртом и / или спорицидом (этанол, 65 процентов, изопропанол, 30 процентов и формальдегид, 5 процентов), чтобы уменьшить их бионагрузку. Затем очищенные поверхности повторно тестируются на предмет их микробиологической нагрузки.
После того, как посадочные аппараты были собраны и запечатаны внутри своих биощитов, биозагрузка была дополнительно уменьшена за счет сухого нагрева всего космического корабля как минимум до 111.7 ° C в течение примерно 30 часов. Эта процедура позволила снизить бионагрузку спускаемого аппарата в 10 4 раз. Космические аппараты будущего могут быть спроектированы таким образом, чтобы обеспечить максимальную доступность их компонентов для уменьшения биологической нагрузки до и после сборки. Однако некоторые компоненты герметично закрываются перед сборкой, поэтому перед герметизацией необходимо провести процедуры очистки / стерилизации, чтобы предотвратить повторное загрязнение. Процедуры стерилизации, обычно применяемые в различных сферах применения для герметичных и открытых компонентов, перечислены в таблице 4.1. Стоит отметить, что многие из этих процедур могут отрицательно сказаться на характеристиках космического аппарата и могут увеличить стоимость полета.
Физические методы очистки и дезинфекции поверхностей
Ассадиан О., Крамер А. (2008) Desinfektion unbelebter Materialien. В: Kramer A, Assadian O (eds) Wallhäußers Praxis der Sterilization, Desinfektion, Antiseptik und Konservierung. Георг Тиме, Штутгарт, стр. 161–184
Google ученый
Eigener U (2008) Grundlagen der Konservierung. В: Kramer A, Assadian O (eds) Wallhäußers Praxis der Sterilization, Desinfektion, Antiseptik und Konservierung. Георг Тиме, Штутгарт, стр. 255–259
Google ученый
Lopez-Malo A, Palou E (2005) Ультрафиолетовое излучение и консервирование продуктов питания. В: Барбоса-Кановас Г.В., Тапиа М.С., Пилар Кано М. (ред.) Новые технологии пищевой промышленности. CRC Press, Boca Raton, pp 405–422
Google ученый
Rotter ML (2008) Desinfektion der Hände. В: Kramer A, Assadian O (eds) Wallhäußers Praxis der Sterilization, Desinfektion, Antiseptik und Konservierung. Георг Тиме, Штутгарт, стр. 146–160
Google ученый
Watkinson WJ (2008) Химия моющих и дезинфицирующих средств. In: Tamime AE (ed) Очистка на месте: производство молочных продуктов, продуктов питания и напитков. Блэквелл, Оксфорд, стр. 56–80
Google ученый
Блок СС (2001) Определение терминов. В: Block SS (ed) Дезинфекция, стерилизация и консервация. Липпинкотт, Уильямс и Уилкинс, Филадельфия, стр. 19–30
Google ученый
Джей Х.М., Лесснер М.Дж., Голден Д.А. (2005) Современная пищевая микробиология. Спрингер, Нью-Йорк
Google ученый
Шерман Р. (2007) Очистка снега с помощью двуокиси углерода. Part Sci Technol 25: 37–57
CAS Google ученый
Hills MM (1995) Очистка струей двуокиси углерода от молекулярных загрязнений. J Vac Sci Technol A 13: 30–34
CAS Google ученый
Ян С.К., Хуанг К.С., Лин Ю.К. (2007) Оптимизация импульсной снежной струи двуокиси углерода для очистки КМОП-датчиков изображения с помощью метода Тагучи. Sens Actuat A 139: 265–271
Google ученый
Эльбинг Ф., Анагре Н., Дорн Л., Ульманн Э. (2003) Струйная очистка сухим льдом как предварительная обработка алюминиевых поверхностей для улучшения адгезионной прочности алюминиевых клеевых соединений.Int J Adhes Adhes 23: 69–79
CAS Google ученый
Ульманн Э., Аксманн Б., Эльбинг Ф. (1998) Strahlstoßkraftmessung beim Strahlen mit CO 2 -Пеллеты. ZWF Z Wirtschaft Fabrikbetrieb 93: 240–243
CAS Google ученый
Uhlmann E, Axmann B, Elbing F (1998) Trockeneisstrahlen — neue Erkenntnisse durch Hochgeschwindigkeits-Videographie.JOT J Oberflächentechnik 38 (7): 46–51
CAS Google ученый
Toscano C, Ahmadi G (2003) Механизмы удаления частиц при криогенной очистке поверхности. J Adhes 79: 175–201
CAS Google ученый
Брандт В.В. (2001) Очистка подложек фотошаблонов с использованием снега с CO2. В: Дао Г., Гренон Б.Дж. (ред.) 21-й ежегодный симпозиум BACUS по технологии фотошаблонов. Proc SPIE 4562, pp 600–608
Шерман Р., Хирт Т., Вэйн Р. (1994) Очистка поверхностей с помощью снеговой струи из углекислого газа. J Vac Sci Technol A 12: 1876–1881
CAS Google ученый
Uhlmann E, Axmann B, Elbing F (1998) Reinigen mit Trockeneisstrahlen in der Austauschmotorenfertigung. VDI-Z Integrierte Produktion 140: 70–72
CAS Google ученый
Шерман Р., Уитлок В. (1990) Удаление пятен от углеводородов и силиконовой смазки с кремнеземных пластин.J Vac Sci Technol B 8: 560–567
Google ученый
Spur G, Uhlmann E, Elbing F (1999) Струйная очистка сухим льдом для очистки: процесс, оптимизация и применение. Одежда 233–235: 402–411
Google ученый
Доннелли Т. (1991) Струйная очистка сухим льдом: новая технология очистки стержневых ящиков. Мод Cast 81: 30–31
CAS Google ученый
Hills MM (1995) Механизм зарядки поверхности при очистке струей CO 2 . J Vac Sci Technol A 13: 412–420
CAS Google ученый
Бернольд Л. Е., Ли Т. С., Ку Дж. К., Мун Д. С. (2010) Автоматизированная экологически чистая система удаления дорожных полос. Настройка автомата 19: 694–701
Google ученый
Schuh A, Uter W, Holzwarth U, Kachler W, Goske J, Raab B, Mayerhofer T (2005) Поверхности, свободные от остаточных частиц после дробеструйной обработки при модульной артропластике тазобедренного сустава, возможны.Zbl Chirurg 130: 576–579
CAS Google ученый
Abbott KE (1996) Сухая струйная очистка для удаления лакокрасочных покрытий с поверхностей аэрокосмической отрасли. Отделка с удовлетворением требований 94: 33–35
CAS Google ученый
Аноним (2006) Trockeneisreinigung von Abluftkanälen. Getränke-Industrie 60 (6): 44–46
Google ученый
Dangwal A, Muller G, Reschke D, Floettmann K, Singer X (2007) Эффективное удаление участков, излучающих поле, с металлических поверхностей с помощью очистки сухим льдом. J Appl Phys 102: 044903
Google ученый
Kosic T, Palser JL (1998) Двуокись углерода решает задачи точной очистки. Solid State Technol 41 (5): 23–25
Google ученый
Кимура В.Д., Ким Г.Х., Балик Б. (1995) Сравнение лазера и CO. 2 снег для очистки больших астрономических зеркал.Publ Astron Soc Pac 107: 888–895
Google ученый
Zito RR (2000) CO 2 очистка оптики от снега: решение проблемы загрязнения. В: Philip T, Chen O, Uy OM (eds) Загрязнение и деградация оптических систем II: эффекты, измерения и контроль. Proc SPIE 4096, pp 82–100
Кларк Дж., Вигдор М., Мирик Э. (2002) CO 2 струйная очистка оптических систем распылением. В: Philip T, Chen O, Uy OM (eds) Загрязнение оптических систем: эффекты, измерения и контроль VII.Proc SPIE 4774, стр. 29–44
Quarini J, Shire S (2007) Обзор гидравлических трубопроводных скребков и их применения. Proc IMechE Часть E J Proc Mech Eng 221: 1–10
Google ученый
Quarini J (2002) Ледяной скребок для уменьшения и удаления обрастания и очистки на месте. Appl Therm Eng 22: 747–753
Google ученый
Бристольский университет (2001) Очистка и разделение в трубопроводах потока жидкости.Патент Великобритании WO0151224
Davies DW (2005) Шламовый лед в качестве теплоносителя с большим количеством областей применения. Int J Refrig 28: 108–114
CAS Google ученый
Bellas J, Chaer I., Tassou SA (2002) Теплопередача и падение давления ледяной суспензии в пластинчатых теплообменниках. Appl Therm Eng 22: 721–732
CAS Google ученый
Shire S, Quarini J, Ayala RS (2005) Экспериментальное исследование поведения перемешивания перекачиваемых ледяных пульп и ледяных скребков в потоках труб. Proc IMechE Часть E J Proc Mech Eng 219: 301–309
Google ученый
Quarini GL, Evans TS, Shire GSF (2007) Экологически безопасный метод очистки оборудования для производства пищевых продуктов сложной формы и воздуховодов с максимальным извлечением продукта с использованием перекачиваемой ледяной суспензии. Food Manuf Eff 1 (2): 15–27
Google ученый
Кварини Дж., Эйнсли Э., Герберт М., Динс Т., Эш Д., Рис Д., Хаскинс Б., Нортон Дж., Эндрюс С., Смит М. (2010) Исследование и разработка инновационной технологии очистки скребками для отрасли водоснабжения. Proc IMechE Часть E J Proc Mech Eng 224: 79–89
Google ученый
Shire GSF, Quarini GL, Evans TS (2009) Падение давления текучей суспензии льда в промышленных теплообменниках. Appl Therm Eng 29: 1500–1506
CAS Google ученый
Ainslie EA, Quarini GL, Ash DG, Deans TJ, Herbert M, Rhys TDL (2009) Очистка теплообменников с использованием ледяной скребков. В: Müller-Steinhagen H, Malayeri MR, Watkinson AP (eds) Загрязнение и очистка теплообменника VIII. Proc Int Conf очистка загрязнений теплообменников, Шладминг, Австрия, стр 433–438
Кнорр Д., Зенкер М., Хайнц В., Ли Д.Ю. (2004) Применение и потенциал ультразвука в пищевой промышленности. Trends Food Sci Technol 15: 261–266
CAS Google ученый
Mason TJ, Paniwnyk L, Lorimer JP (1996) Использование ультразвука в пищевой технологии. Ультразвуковой Sonochem 3: S253 – S260
CAS Google ученый
Schneider Y, Zahn S, Hofmann J, Wecks M, Rohm H (2007) Акустическая кавитация, вызванная ультразвуковыми режущими устройствами: предварительное исследование. Ultrason Sonochem 13: 117–120
Google ученый
Arnold G, Leiteritz L, Zahn S, Rohm H (2009) Ультразвуковая резка сыра: состав влияет на сокращение работы резки и потребление энергии.Int Dairy J 19: 314–320
CAS Google ученый
Зан С., Шнайдер Й, Ром Х (2006) Ультразвуковая резка пищевых продуктов: влияние величины возбуждения и скорости резания на сокращение работы резания. Innov Food Sci Emerg Technol 7: 288–293
Google ученый
Mason TJ, Rierea E, Vercet A, Lopez-Buesa P (2005) Применение ультразвука. В: Sun DW (ред.) Новые технологии для пищевой промышленности.Academic Press, New York, pp 321–351
Google ученый
Maisonhaute E, Prado C, White PC, Compton RG (2002) Поверхностная акустическая кавитация, понимаемая с помощью наносекундной электрохимии. Часть III: напряжение сдвига при ультразвуковой очистке. Ultrason Sonochem 9: 297–303
CAS Google ученый
Krefting D, Mettin R, Lauterborn W (2004) Высокоскоростное наблюдение акустической кавитационной эрозии в многопузырьковых системах.Ultrason Sonochem 11: 119–123
CAS Google ученый
Tanimura Y, Yoshida K, Watanabe Y (2010) Исследование очищающей способности колеблющихся пузырьков под действием низкочастотного ультразвука. Jap J Appl Phys 49: 07HE20
Google ученый
Holzfuss J, Rüggeberg M, Billo A (1998) Ударно-волновое излучение сонолюминесцентного пузыря. Phys Rev Lett 81: 5434–5437
CAS Google ученый
Laborde JL, Bouyer C, Caltagirone JP, Gérard A (1998) Акустическая пузырьковая кавитация на низких частотах. Ультрасон 36: 589–594
Google ученый
Ламминен М.О., Уокер Х.В., Уиверс Л.К. (2004) Механизмы и факторы, влияющие на ультразвуковую очистку керамических мембран, загрязненных частицами. J Membr Sci 237: 213–223
CAS Google ученый
Патил М.Н., Пандит А.Б. (2007) Кавитация — новый метод создания стабильных наносуспензий.Ultrason Sonochem 14: 519–530
CAS Google ученый
Niemczewski B (2007) Наблюдения за интенсивностью кавитации воды в практических условиях ультразвуковой очистки. Ultrason Sonochem 14: 13–18
CAS Google ученый
Фармер А.Д., Коллингс А.Ф., Джеймсон Г.Дж. (2000) Влияние ультразвука на очистку поверхности от частиц кремнезема. Int J Min Proc 60: 101–113
CAS Google ученый
Piyasena P, Mohareb E, McKellar RC (2003) Инактивация микробов с помощью ультразвука: обзор. Int J Food Microbiol 87: 207–216
CAS Google ученый
Sponer J (1991) Теоретическая оценка порога кавитации для очень коротких импульсов ультразвука. Ультрасон 29: 376–380
Google ученый
Flint EB, Suslick KS (1991) Температура кавитации.Наука 253: 1397–1398
CAS Google ученый
Suslick KS, Didenko Y, Fang MM, Hyeon T, Kolbeck KJ, McNamara WB III, Mdledeni MM, Wong M (1999) Акустическая кавитация и ее химические последствия. Фил Транс Рой Soc A 357: 335–353
CAS Google ученый
Крам Л.А. (1994) Сонолюминесценция, сонохимия и сонофизика. J Acoust Soc Am 95: 559–562
Google ученый
Pagan R, Manas P, Raso J, Condon S (1999) Устойчивость бактерий к ультразвуковым волнам под давлением при несмертельных (манозоникация) и летальных (манотермозоникация) температурах. Appl Env Microbiol 65: 297–300
CAS Google ученый
Манас П., Паган Р., Расо Дж., Сала Ф. Дж., Кондон С. (2000). Инактивация Salmonella enteritidis , Salmonella typhimurium и Salmonella Senftenberg ультразвуковыми волнами под давлением.J Food Prot 63: 451–456
CAS Google ученый
Джейкобс С.Е., Торнли М.Дж. (1954) Смертельное действие ультразвуковых волн на бактерии, взвешенные в молоке и других жидкостях. J Appl Bacteriol 17: 38–55
Google ученый
Дэвис Р. (1959) Наблюдения за использованием ультразвуковых волн для разрушения микроорганизмов. Biochim Biophys Acta 33: 491–493
Google ученый
Ахмед ФИК, Рассел C (1975) Синергизм между ультразвуковыми волнами и перекисью водорода в уничтожении микроорганизмов. J Appl Microbiol 39: 31–40
CAS Google ученый
Condon S, Raso J, Pafan E (2005) Микробная инактивация ультразвуком. В: Барбоса-Кановас Г.В., Тапиа М.С., Пилар Кано М. (ред.) Новые технологии пищевой промышленности. CRC Press, Boca Raton, pp 423–442
Google ученый
Мейсон Т.Дж., Петерс Д. (2002) Практическая сонохимия, использование и приложения мощного ультразвука. Эллис Хорвуд, Чичестер
Google ученый
Гарсия М.Л., Бургос Дж., Санс Б., Ордоньес Дж. А. (1989) Влияние тепла и ультразвуковых волн на выживаемость двух штаммов Bacillus subtilis . J Appl Bacteriol 67: 619–628
CAS Google ученый
Герреро С., Лопес-Мало А., Альзамора С.М. (2001) Влияние ультразвука на выживаемость Saccharomyces cerevisiae : влияние температуры, pH и амплитуды.Innov Food Sci Emerg Technol 2: 31–39
Google ученый
Burgos J (1999) Manothermosonication. В: Робинсон Р.К., Батт С.А., Патель П.Д. (ред.) Энциклопедия пищевой микробиологии. Academic Press, New York, pp 1462–1469
Google ученый
Мейсон Т.Дж. (2000) Крупномасштабная сонохимическая обработка: стремление и актуальность. Ultrason Sonochem 7: 145–149
CAS Google ученый
Kyllonen HM, Pirkonen P, Nyström M (2005) Мембранная фильтрация, усиленная ультразвуком: обзор. Десалин 181: 319–335
CAS Google ученый
Spettmann D, Eppmann S, Flemming HC, Wingender J (2008) Визуализация очистки мембраны с помощью конфокальной лазерной сканирующей микроскопии. Десалин 224: 195–200
CAS Google ученый
Фенг Д., Ван Девентер Дж. С. Дж., Олдрич С. (2006) Ультразвуковая очистка мембран обратного осмоса, используемых для очистки сточных вод.Сен Purif Technol 50: 318–323
CAS Google ученый
Ли Дж., Сандерсон Р.Д., Якобс Е.П. (2002) Ультразвуковая очистка нейлоновых мембран микрофильтрации, загрязненных стоками с фабрики крафт-бумаги. J Membr Sci 205: 247–257
CAS Google ученый
Boley A, Narasimhan K, Kieninger M, Müller WR (2010) Керамическая мембранная ультрафильтрация естественной поверхностной воды с усиленной ультразвуком обратной промывкой.Water Sci Technol 61: 1121–1128
CAS Google ученый
Jin W, Guo W, Lü X, Han P, Wang Y (2008) Влияние ультразвука, генерируемого очисткой плоского преобразователя на загрязненную поливинилиденфторидную половолоконную ультрафильтрационную мембрану. Chin J Chem Eng 16: 801–804
CAS Google ученый
Киллонен Х., Пирконен П., Нистрем М., Нуортила-Йокинен Дж., Гронроос А. (2006) Экспериментальные аспекты поперечной мембранной фильтрации промышленных сточных вод с усилением ультразвуком.Ultrason Sonochem 13: 295–302
Google ученый
Lamminen MO, Walker HW, Weavers LK (2006) Очистка загрязненных частицами мембран во время фильтрации с поперечным потоком с использованием встроенной системы ультразвукового преобразователя. J Membrane Sci 283: 225–232
CAS Google ученый
Muthukumaran S, Yang K, Seuren A, Kentish S, Ashokkumar M, Stevens GW, Grieser F (2004) Использование ультразвуковой очистки для ультрафильтрационных мембран в молочной промышленности.Sep Purific Techol 39: 99–107
CAS Google ученый
Сеймур И.Дж., Барфут Д., Смит Р.Л., Кокс Л.А., Локвуд А. (2002) Ультразвуковая дезактивация минимально обработанных фруктов и овощей. Int J Food Sci Technol 37: 547–557
CAS Google ученый
Лиллард Х.С. (1994) Обеззараживание кожи птицы обработкой ультразвуком. Food Technol 44: 73–74
Google ученый
Oulahal-Lagsir N, Martial-Gros A, Boistier E, Blum LJ, Bonneau M (2000) Разработка ультразвукового аппарата для неинвазивного и повторяемого удаления загрязнений в пищевом оборудовании. Lett Appl Microbiol 30: 47–52
CAS Google ученый
Oulahal-Lagsir N, Martial-Gros A, Bonneau M, Blum LJ (2000) Ультразвуковой метод в сочетании с биолюминесценцией АТФ для неинвазивного обнаружения загрязнения в оборудовании для пищевой промышленности — проверка и применение на молочной фабрике .J Appl Microbiol 89: 433–441
CAS Google ученый
Assere A, Oulahal N, Carpentier B (2008) Сравнительная оценка методов подсчета выживших клеток биопленки, приставших к поверхности поливинилхлорида, подвергшейся воздействию хлора или высыханию. J Appl Microbiol 104: 1692–1702
CAS Google ученый
Tolvanen R, Lunden J, Horman A, Korkeala H (2009) Опытное оборудование для непрерывной ультразвуковой очистки снижает уровни Listeria monocytogenes на конвейерных лентах.J Food Prot 72: 408–411
Google ученый
Chiu KY, Cheng FT, Man HC (2005) Эволюция шероховатости поверхности некоторых металлических материалов при кавитационной эрозии. Ультразвуковой 43: 713–716
CAS Google ученый
Карими А., Авеллан Ф. (1986) Сравнение механизмов эрозии при различных типах кавитации. Износ 113: 305–322
CAS Google ученый
Нагараджан Р., Диван М., Авасти П., Шукла А., Шарма П., Гудсон М., Авад С. (2006) Оптимизация ультразвуковой очистки для чувствительных к эрозии микроэлектронных компонентов. В: Proc IEEE / SEMI Adv Semicond Manuf Conference, стр. 233–237
Арванитояннис И.С., Церкезоу П. (2010) Законодательство об облучении пищевых продуктов. В кн .: Арванитояннис И.С. (ред.) Облучение пищевых продуктов. Эльзевир, Амстердам, стр. 3–20
Google ученый
Бегум М., Хокинг А.Д., Ди Мискелли А. (2009) Инактивация грибков, вызывающих порчу пищевых продуктов, ультрафиолетовым (УФС) излучением. Int J Food Microbiol 129: 74–77
CAS Google ученый
Genuis SJ (2008) Реализация актуальной идеи: изучение воздействия электромагнитного излучения на здоровье населения. Общественное здравоохранение 122: 113–124
Google ученый
Хаджи-Саид М., Сампа MHO, Chmielewski AG (2007) Радиационная обработка для стерилизации упаковочных материалов.Radiat Phys Chem 76: 1535–1541
CAS Google ученый
Бакнум MJ, Castro EA (2007) Некоторые комментарии к гипотезе световой волны материи. J Math Chem 42: 367–372
CAS Google ученый
Миллер РБ (2003) Облучение пищевых продуктов с использованием тормозного рентгеновского излучения. Radiat Phys Chem 68: 963–974
CAS Google ученый
Бинцис Т., Литопулу-Цанетаки Э., Робинсон Р.К. (2000) Существующие и потенциальные применения ультрафиолетового света в пищевой промышленности — критический обзор. J Sci Food Agric 80: 637–645
CAS Google ученый
Sommer R, Haider T, Cabaj A, Probil W, Lhotsky M (1998) Взаимодействие доз во времени при УФ-дезинфекции воды. Wat Sci Technol 38: 145–150
CAS Google ученый
McDonald KF, Curry RD, Clevenger TE, Brazos B, Unklesbay K, Eisenstark A, Baker S, Golden J, Morgan R (2000) Сравнение импульсных и непрерывных источников ультрафиолетового света для очистки поверхностей. IEEE Trans Plasma Sci 28: 1581–1587
CAS Google ученый
Омс-Олю Дж., Мартин-Беллосо О., Солива-Фортуни Р. (2010) Обработка импульсным светом для консервирования пищевых продуктов. Обзор. Food Bioproc Technol 3: 13–23
Google ученый
Гомес-Лопес В.М., Девлигере Ф., Бондюэль В., Дебевере Дж. (2005) Обеззараживание минимально обработанных овощей интенсивными световыми импульсами и срок их хранения. Int J Food Microbiol 103: 79–89
Google ученый
Гомес-Лопес В.М., Девлигере Ф., Бондюэль В., Дебевере Дж. (2005) Факторы, влияющие на инактивацию микроорганизмов интенсивными световыми импульсами. J Appl Microbiol 99: 460–470
Google ученый
Озер Н.П., Демирчи А. (2006) Инактивация Escherichia coli O157: H7 и Listeria monocytogenes , инокулированных на сырое филе лосося путем обработки импульсным УФ-светом. Int J Food Sci Technol 41: 354–360
CAS Google ученый
Snowball MR, Hornsey IS (1988) Очистка источников воды с использованием ультрафиолетового света. В: Робинсон Р.К. (ред.) Развитие пищевой микробиологии — 3. Elsevier, London, стр. 171–192
Google ученый
Гомес-Лопес В.М., Рагерта П., Дебевереа Дж., Девлиегер Ф. (2007) Импульсный свет для обеззараживания пищевых продуктов: обзор. Trends Food Sci Technol 18: 464–473
Google ученый
Ван Т., МакГрегор С.Дж., Андерсон Дж. Г., Вулси Г.А. (2005) Спектр импульсной ультрафиолетовой инактивации Escherichia coli . Water Res 39: 2921–2925
CAS Google ученый
Rowan NJ, MacGregor SJ, Anderson JG, Fouracre RA, McIlvaney L, Farish O (1999) Инактивация связанных с пищевыми продуктами микроорганизмов импульсным светом. Appl Env Microbiol 65: 1312–1315
CAS Google ученый
Такешита К., Сибато Дж., Самешима Т., Фукунага С., Исобе С., Арихара К., Ито М. (2003) Повреждение дрожжевых клеток, вызванное импульсным световым излучением. Int J Food Microbiol 85: 151–158
Google ученый
Андерсон Дж. Г., Роуэн Н. Дж., МакГрегор С. Дж., Фуракре Р. А., Фариш О. (2000) Инактивация пищевых энтеропатогенных бактерий и грибков, вызывающих порчу, с помощью импульсного света. IEEE Trans Plasma Sci 28: 83–88
Google ученый
Turtoi M, Nicolau A (2007) Обработка интенсивным световым импульсом как альтернативный метод уничтожения спор плесени на бумажно-полиэтиленовых упаковочных материалах. J Food Eng 83: 47–53
CAS Google ученый
Sommer R, Pribil W, Appelt S, Gehringer P, Eschweiler H, Leth H, Cabaj A, Haider T (2001) Инактивация бактериофагов в воде с помощью неионизирующего (УФ-253,7 нм) и ионизирующего (гамма) излучения : сравнительный подход. Wat Res 35: 3109–3116
CAS Google ученый
Cleaver JE (2003) Фотореактивация. Ремонт ДНК 2: 629–638
CAS Google ученый
Kao YT, Saxena C, Wang L, Sancar A, Zhong D (2005) Прямое наблюдение за репарацией димера тимина в ДНК-фотолиазе. PNAS 102: 16128–16132
CAS Google ученый
Setlow B (1992) Я выживу: защита и восстановление ДНК спор. J Bacteriol 175: 2737–2741
Google ученый
Manzocco L, Da Pieve S, Maifreni M (2011) Влияние УФ-света на безопасность и качество свежесрезанной дыни.Innov Food Sci Emerg Technol 12: 13–17
CAS Google ученый
Yaun BR, Sumner SS, Eifert JD, Marcy JE (2004) Ингибирование патогенов в свежих продуктах с помощью ультрафиолетовой энергии. Int J Food Microbiol 90: 1–8
Google ученый
Yaun BR, Sumner SS, Eifert JD, Marcy JE (2003) Ответ Salmonella и Escherichia coli O157: H7 на УФ-энергию.J Food Prot 66: 1071–1073
Google ученый
Fine F, Gervais P (2004) Эффективность импульсного УФ-света для микробной дезинфекции пищевых порошков. J Food Prot 67: 787–792
CAS Google ученый
Woodling SE, Moraru CI (2005) Влияние топографии поверхности на эффективность обработки импульсным светом для инактивации Listeria innocua на поверхностях из нержавеющей стали.J Food Microbiol Saf 70: 345–351
Google ученый
Тамиме А.Ю., Робинсон Р.К. (1999) Йогурт — наука и технологии. Вудхед, Кембридж
Google ученый
Riley DJ, Bavastrello V, Covani U, Barone A, Nicolini C (2005) Исследование in vitro стерилизации титановых зубных имплантатов с использованием низкоинтенсивного УФ-излучения. Стоматологический мат 21: 756–760
CAS Google ученый
Marquis RE, Baldeck JD (2007) Спорицидные взаимодействия ультрафиолетового излучения и перекиси водорода, связанные с асептическими технологиями. Chem Eng Proc 46: 547–553
CAS Google ученый
Lacroix M (2005) Облучение пищевых продуктов. В: Sun DW (ред.) Новые технологии для пищевой промышленности. Academic Press, Нью-Йорк, стр. 353–386
Google ученый
Kilcast D (1995) Облучение пищевых продуктов: текущие проблемы и будущий потенциал.Int Biodeterior Biodegrad 36: 279–296
Google ученый
Мой Дж. Х. (2005) Облучение пищевых продуктов — новая технология. В: Барбоса-Кановас Г.В., Тапиа М.С., Пилар Кано М. (ред.) Новые технологии пищевой промышленности. CRC Press, Boca Raton, pp 375–404
Google ученый
Лакруа М., Маркотт М., Рамасвами Х. (2002) Облучение в сочетании с другими процессами консервирования фруктов, овощей, орехов и специй.В: Чакраверти А., Муджумдар А.С., Рагхаван GSV, Рамасвани Х.С. (ред.) Справочник по послеуборочной технологии. Марсель Деккер, Нью-Йорк, стр. 623–652
Google ученый
Farkas J (2006) Облучение для улучшения пищевых продуктов. Trends Food Sci Technol 17: 148–152
CAS Google ученый
Аноним (2009) Отчет Комиссии по облучению пищевых продуктов за 2007 год.Off J Europ Union C 242/2, Брюссель
Kume Z, Furuta M, Todoriki S, Uenoyama N, Kobayashi Y (2009) Состояние облучения пищевых продуктов в мире. Radiat Phys Chem 78: 222–226
CAS Google ученый
Диксон Дж. С. (2001) Радиационная инактивация микроорганизмов. В: Molins R (ed) Облучение пищевых продуктов, принципы и применения. Wiley, New York, pp. 23–35
. Google ученый
Farkas J (1998) Облучение как метод обеззараживания пищевых продуктов — обзор. Int J Food Microbiol 44: 189–204
CAS Google ученый
Ouattara B, Giroux M, Smoragiewicz W, Saucier L, Lacroix M (2002) Комбинированное влияние гамма-излучения, аскорбиновой кислоты и съедобного покрытия на улучшение микробных и биохимических характеристик говяжьего фарша. J Food Prot 65: 981–987
CAS Google ученый
Monk JD, Beuchat LR, Doyle MP (1995) Облучение инактивации пищевых микроорганизмов. J Food Prot 58: 197–208
Google ученый
Farkas J (1990) Сочетание облучения с мягким лечением. Обзор. Food Control 1: 223–229
Google ученый
Котов Ю.А., Соковнин С.Ю., Балезин М.Е. (2003) Обзор возможных применений наносекундных электронных пучков для стерилизации в промышленном птицеводстве.Trends Food Sci Technol 14: 4–8
CAS Google ученый
Ahn HJ, Kim JH, Kim JK, Kim DH, Yook HS, Byun MW (2005) Комбинированное воздействие облучения и упаковки в модифицированной атмосфере на минимально обработанную китайскую капусту ( Brassica rapa L.). Food Chem 89: 589–597
CAS Google ученый
Мой Дж. Х., Вонг Л. (2002) Эффективность и прогресс в использовании радиации в качестве карантинной обработки пищевых продуктов — тематическое исследование на Гавайях.Radiat Phys Chem 63: 397–401
CAS Google ученый
Vachon D, D’Aprano G, Letende M, Lacroix M (2002) Влияние процесса съедобного покрытия и обработки клубники облучением Fragaria spp. по сохранности хранения. J Food Sci 68: 608–612
Google ученый
Mahrouz M, Lacroix M, D’Aprano G, Oufedjikh H, Boubekri C (2004) Срок годности и оценка качества клементина после комбинированной обработки с гамма-облучением.Radiat Phys Chem 71: 141–143
Google ученый
Gölge E, Ova G (2008) Влияние облучения пищевых продуктов на качество ядер кедровых орехов. Radiat Phys Chem 77: 365–369
Google ученый
Sommers CH, Fan X, Niemira BA, Sokorai K (2003) Радиационная (гамма) устойчивость и рост после облучения Listeria monoctytogenes , взвешенного в говяжьей болонке, которая содержала диацетат натрия и лактат калия.J Food Prot 66: 2051–2056
CAS Google ученый
Sommers C, Fan X, Niemira B, Rajkowski K (2004) Облучение готовых к употреблению продуктов питания в Восточном региональном исследовательском центре Министерства сельского хозяйства США, обновленная информация за 2003 год. Radiat Phys Chem 71: 509–512
Google ученый
Sommers CH, Thayer DW (2000) Выживаемость инокулированных на поверхности Listeria monocytogenes коммерчески доступных сосисок после гамма-облучения.J Food Saf 20: 127–137
Google ученый
Молинс Р.А. (2001) Облучение мяса и птицы. В: Molins R (ed) Облучение пищевых продуктов, принципы и применения. Wiley, New York, pp 3–31
Google ученый
Аль-Масри М.Р., Аль-Башир М. (2007) Микробная нагрузка, кислотность, окисление липидов и летучий основной азот облученной рыбы и мясо-костной муки. Biores Technol 98: 1163–1166
CAS Google ученый
Lacroix M, Jobin M, Hamel S, Stahl V, Gagnon M, Couvercelle C (1991) Влияние доз гамма-излучения 3 и 7 кГр на запах и вкус свежей куриной грудки. Микробиол Алим Нутр 9: 375–379
Google ученый
Ehioba RM, Kraft AA, Molins RA, Walker HW, Olson DG, Subbaraman G, Skowronski RP (1987) Влияние низких доз (100 крад) гамма-излучения на микрофлору свиного фарша в вакуумной упаковке с и без добавления фосфатов натрия.J Food Sci 52: 1477–1480
Google ученый
Уаттара Б., Сабато С.Ф., Лакруа М. (2001) Комбинированный эффект антимикробного покрытия и гамма-облучения на продление срока хранения предварительно приготовленных креветок ( Penaeus spp.). Int J Food Microbiol 68: 1–9
CAS Google ученый
Fan X (2005) Антиоксидантная способность свежесрезанных овощей, подвергшихся воздействию ионизирующего излучения.J Sci Food Agric 85: 995–1000
CAS Google ученый
Ferreira LFS, Del Mastro NL (1998) Реологические изменения в облученных куриных яйцах. Radiat Phys Chem 52: 59–62
CAS Google ученый
Nam KC, Ahn DU (2002) Окись углерода-гемовый пигмент отвечает за розовый цвет облученного сырого мяса грудки индейки. Meat Sci 60: 25–33
CAS Google ученый
Han J, Gomes-Feitosa CL, Castell-Perez E, Moreira RG, Silva PF (2004) Качество упакованных сердец салата ромэн, подвергнутых облучению низкими дозами электронного луча. Lebensm Wiss Technol 37: 705–715
CAS Google ученый
Mittendorfer J, Bierbaumer HP, Gratzl F, Kellauer E (2002) Обеззараживание упаковки пищевых продуктов с помощью электронного луча — состояние и перспективы. Radiat Phys Chem 63: 833–836
CAS Google ученый
Neijssen P (1994) Гамма-стерилизация упаковки. Scand Dairy Inf 8: 40–42
Google ученый
Helfinstine SL, Vargas-Aburto C, Uribe RM, Woolverton CJ (2005) Инактивация эндоспор Bacillus в оболочках облучением электронным пучком. Appl Env Microbiol 71: 7029–7032
CAS Google ученый
Нибур С., Диксон Дж. (2003) Уничтожение спор штамма Bacillus anthracis 34F2 в почтовых конвертах путем облучения электронным пучком.Lett Appl Microbiol 37: 17–20
CAS Google ученый
Клегхорн Д.А., Данн Дж., Набло С.В. (2002) Стерилизация пластиковых контейнеров с использованием облучения электронным пучком, направляемого через отверстие. J Appl Microbiol 93: 937–943
CAS Google ученый
Джордж Дж., Кумар Р., Садживкумар В.А., Сабапати С.Н., Вайджапуркар С.Г., Кумар Д., Кчавахха А., Бава А.С. (2007) Влияние гамма-излучения на коммерческие моно- и многослойные ретортируемые упаковочные материалы для пищевых продуктов на основе полипропилена .Radiat Phys Chem 76: 1205–1212
CAS Google ученый
Pentimalli M, Capitani D, Ferrando A, Ferri D, Ragni P, Segre AL (2000) Гамма-облучение пищевых упаковочных материалов: исследование ЯМР. Полимер 41: 2871–2881
CAS Google ученый
Beneitez P, Correcher V, Millan A, Calderon T (1994) Термолюминесцентный анализ для тестирования облучения специй.J Radioanal Nucl Chem 185: 401–410
CAS Google ученый
Силлано О., Роман А., Деза А., Рубио Т., Эспиноза Дж. (1994) Применение измерений термолюминесценции для обнаружения столового винограда, облученного низкими дозами гамма-излучения. Radiat Phys Chem 43: 585–588
Google ученый
Кальдерон Т., Ренделл Х.М., Бенейтес П., Таунсенд П.Д., Миллан А., Вуд Р. (1994) Спектры термолюминесценции неорганической пыли от облученных трав и специй.J Food Sci 59: 1070–1071
CAS Google ученый
Sommers C, Fan XT (2003) Гамма-облучение тонкоэмульсионных колбас, содержащих диацетат натрия. J Food Prot 66: 819–824
CAS Google ученый
Gould GW, Jones MV (1989) Комбинированные методы лечения и синергетические эффекты. В: Gould HW (ed) Механизмы действия процедур консервирования пищевых продуктов.Elsevier, London, стр. 401–421
Google ученый
Хагенмайер Р.Д., Бейкер Р.А. (1998) Микробная популяция измельченной моркови в упаковке с модифицированной атмосферой в связи с обработкой облучением. J Food Sci 63: 162–164
CAS Google ученый
Богертс А., Нейтс Э., Гиджбельс Р., ван дер Маллен Дж. (2002) Плазма газового разряда и их применение. Spectrochim Acta B 57: 609–658
Google ученый
Montie TC, Kelly-Wintenberg K, Roth JR (2000) Обзор исследований с использованием однородной плазмы тлеющего разряда с одной атмосферой (OAUGDP) для стерилизации поверхностей и материалов. IEEE Trans Plasma Sci 28: 41–50
Google ученый
Бирмингем Дж. Г., Хаммерстром Д. Д. (2000) Бактериальная дезактивация с использованием нетепловых разрядов при атмосферном давлении. IEEE Trans Plasma Sci 28: 51–55
Google ученый
Канадзава С., Когома М., Окадзаки С., Мориваки Т. (1989) Обработка тлеющей плазмой при атмосферном давлении для модификации поверхности и осаждения пленки. Nucl Instrum методы Phys Res B37–38: 842–845
Google ученый
Йокояма Т., Когома М., Окадзаки С., Мориваки Т. (1990) Механизм стабилизации тлеющей плазмы при атмосферном давлении. J Phys D Appl Phys 23: 1125–1128
CAS Google ученый
Roth JR, Rahel J, Dai X, Sherman DM (2005) Физика и феноменология реакторов с однородной плазмой тлеющего разряда с одной атмосферой (OAUGDP ™) для обработки поверхностей. J Phys D Appl Phys 38: 555–567
CAS Google ученый
Herrmann HW, Henins I, Park J, Selwyn GS (1999) Обеззараживание боевых химических и биологических агентов (CBW) с использованием плазменной струи атмосферного давления. Phys Plasmas 6: 2284–2289
CAS Google ученый
Moreau S, Moisan M, Tabrizian M, Barbeau J, Pelletier J, Ricard A, Yahia LH (2000) Использование протекающего послесвечения плазмы для инактивации спор Bacillus subtilis : влияние рабочих условий. J Appl Phys 88: 1166–1174
CAS Google ученый
Kelly-Wintenberg K, Montie TC, Brickman C, Roth JR, Carr AK, Sorge K, Wadsworth LC, Tsai PPY (1998) Стерилизация поверхностей и тканей при комнатной температуре с помощью плазмы тлеющего разряда с однородной атмосферой.J Ind Microbiol Biotechnol 20: 69–74
CAS Google ученый
Wrobel AM, Lamontagne B, Wertheimer MR (1988) Микроволновое и радиочастотное плазменное травление полимеров большой площади. Plasma Chem Plasma Proc 8: 315–329
CAS Google ученый
Ральченко В.Г., Смолин А.А., Конов Б.И., Сергечев К.Ф., Сычов И.А., Власов И.И., Мигулин В.В., Воронин С.В., Хомич А.Б. (1997) Осаждение алмаза большой площади с помощью микроволновой плазмы.Diam Relat Mater 6: 417–421
CAS Google ученый
Сурешкумар С., Неоги С. (2009) Характеристики инактивации бактерий в емкостной плазме аргона. IEEE Trans Plasma Sci 37: 2347–2352
CAS Google ученый
Gaunt LF, Beggs CB, Georghiou GE (2006) Бактерицидное действие реактивных частиц, образующихся газоразрядной нетепловой плазмой при атмосферном давлении: обзор.IEEE Trans Plasma Sci 34: 1257–1269
CAS Google ученый
Laroussi M, Sayler GS, Glascock BB, McCurdy B., Pearce ME, Bright NG, Malott CM (1999) Изображения биологических образцов, подвергающихся стерилизации тлеющим разрядом при атмосферном давлении. IEEE Trans Plasma Sci 27: 34–35
Google ученый
Ларуси М. (2002) Нетепловая дезактивация биологических сред плазмой атмосферного давления: обзор, анализ и перспективы.IEEE Trans Plasma Sci 30: 1409–1415
CAS Google ученый
Ван Дж., Ковентри Дж., Свиергон П., Сангуансри П., Верстег С. (2009) Достижения в инновационных технологиях обработки для инактивации микробов и повышения безопасности пищевых продуктов — импульсное электрическое поле и низкотемпературная плазма. Trends Food Sci Technol 20: 414–424
CAS Google ученый
Ларусси М., Ричардсон Дж. П., Доббс Ф. К. (2002) Влияние неравновесной плазмы атмосферного давления на гетеротрофные пути бактерий и на морфологию их клеток.Appl Phys Lett 81: 772–774
CAS Google ученый
Deng S, Ruan R, Mok CK, Huang G, Lin X, Chen P (2007) Инактивация Escherichia coli на миндале с использованием нетепловой плазмы. J Food Sci 72: M62 – M66
CAS Google ученый
Rowan NJ, Espie S, Harrower J, Farrell H, Marsili L, Anderson JG, MacGregor SJ (2008) Доказательства летальных и сублетальных повреждений бактериальных патогенов пищевого происхождения, подвергшихся воздействию высокоинтенсивного импульсного газа плазмы разряды.Lett Appl Microbiol 46: 80–86
CAS Google ученый
Ekem N, Akan T, Akgun Y, Kiremitci A (2006) Стерилизация Staphylococcus aureus импульсной плазмой атмосферного давления. Surf Coat Technol 201: 993–997
CAS Google ученый
Uhm HS, Lim JP, Li SZ (2007) Стерилизация бактериальных эндоспор струей аргоновой плазмы атмосферного давления.Appl Phys Lett 90: 261501
Google ученый
Li SZ, Lim JP, Kang JG, Uhm GS (2006) Сравнение плазмы гелия и аргона атмосферного давления, генерируемой емкостным радиочастотным разрядом. Физ Плазма 13: 093503
Google ученый
Kelly-Wintenberg K, Hodge A, Montie TC, Deleanu L, Sherman D, Roth JR, Tsai P, Wadsworth L (1999) Использование плазмы тлеющего разряда с однородной атмосферой для уничтожения широкого спектра микроорганизмов .J Vac Sci Technol A 17: 1539–1544
CAS Google ученый
Roth JR, Sherman DM, Gadri RB, Karakaya F, Chen Z, Montie TC, Kelly-Wintenberg K, Tsai PPY (2000) Реактор дистанционного воздействия (RER) для плазменной обработки и стерилизации плазменными активными частицами в одной атмосфере. IEEE Trans Plasma Sci 28: 56–64
Google ученый
Iseki S, Ohta T, Aomatsu A, Ito M, Kano H, Higashijima Y, Hori M (2010) Быстрая инактивация спор Penicillium digitatum с использованием неравновесной плазмы при атмосферном давлении высокой плотности.Appl Phys Lett 96: 153704
Google ученый
Yun H, Kim B, Jung S, Kruk ZA, Kim DB, Choe W, Jo C (2010) Инактивация Listeria monocytogenes , привитых на одноразовый пластиковый лоток, алюминиевую фольгу и бумажный стаканчик при атмосферном давлении плазма. Food Control 21: 1182–1186
CAS Google ученый
Vleugels M, Shama G, Deng XT, Greenacre E, Brocklehurst T, Kong MG (2005) Атмосферная плазменная инактивация биопленкообразующих бактерий для контроля безопасности пищевых продуктов.IEEE Trans Plasma Sci 33: 824–828
CAS Google ученый
Critzer VJ, Kelly-Winterberg K, South SL, Golden DA (2007) Атмосферная плазменная инактивация патогенов пищевого происхождения на поверхности свежих продуктов. J Food Prot 70: 2290–2296
Google ученый
Schwabedissen A, Lacinski P, Chen X, Engemann J (2007) PlasmaLabel — новый метод дезинфекции товаров внутри закрытой упаковки с использованием диэлектрических барьерных разрядов.Contrib Plasma Phys 47: 551–558
CAS Google ученый
Kim B, Yun H, Jung S, Jung Y, Jung H, Choe W, Jo C (2011) Влияние плазмы атмосферного давления на инактивацию патогенов, инокулированных в бекон, с использованием двух различных газовых композиций. Пищевой микробиол 28: 9–13
CAS Google ученый
Song HP, Kim B, Choe JH, Jung S, Moon SY, Choe W, Jo C (2009) Оценка плазмы атмосферного давления для повышения безопасности нарезанного сыра и ветчины, инокулированных коктейлем из 3 штаммов Listeria monocytogenes .Food Microbiol 26: 432–436
CAS Google ученый
Whittaker AG, Graham EM, Baxter RL, Jones AC, Richardson PR, Meek G, Campbell GA, Aitken A, Baxter HC (2004) Плазменная очистка стоматологических инструментов. J Hosp Inf 56: 37–41
CAS Google ученый
Wei QF, Wang XQ, Mather RR, Fotheringham AF (2003) Исследование ESEM удаления размера керамических волокон с помощью плазменной обработки.Appl Surf Sci 220: 217–223
CAS Google ученый
Морент Р., Де Гейтер Н., Вершурен Дж, Де Клерк К., Кикенс П., Лейс С. (2008) Нетепловая плазменная обработка текстильных материалов. Surf Coat Technol 202: 3427–3449
CAS Google ученый
Белин Р.Е. (1976) Влияние обработки коронным разрядом на когезию между волокнами и на их смачиваемость. J Text Inst 67: 249–252
Google ученый
Sun D, Stylios GK (2006) Свойства поверхности ткани, подверженные воздействию низкотемпературной плазменной обработки. J Mat Proc Technol 173: 172–177
CAS Google ученый
Раковски В. (1997) Плазменная обработка шерсти сегодня. 1. Свойства волокна, прядение и защита от усадки. J Soc Dyers Color 113: 250–255
CAS Google ученый
Deilmann M, Halfmann H, Bibinov N, Wzbderlich J, Awakowicz P (2008) Плазменная стерилизация бутылок из полиэтилентерефталата с помощью микроволн с низким давлением.J Food Prot 71: 2119–2123
CAS Google ученый
Ren Y, Xu S, Long J, Rutkevych P, Cheng Q, Huang S, Ostrikov K (2008) Углеводородная плазма для обработки биоразлагаемых пищевых контейнеров. IEEE Trans Plasma Sci 36: 1306–1307
CAS Google ученый
Предварительный просмотр теста | Стерилизация и дезинфекция предметов ухода за пациентами в стоматологических учреждениях | Курс непрерывного образования
- Все следующие утверждения верны в отношении стерилизации и уровней дезинфекции, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. Стерилизация — это проверенный процесс, который уничтожает все формы микробной жизни. Б. Дезинфекция высокого уровня уничтожает все патогены, но не все споры бактерий. C. Дезинфекция промежуточного уровня убивает микобактерии, все нелипидные или мелкие вирусы (например,g., полиомиелит), все грибы, все вегетативные бактерии и все липидные или средние вирусы (например, HBV, ВИЧ), но не бактериальные споры. D. Низкоуровневая дезинфекция убивает липидные или средние вирусы (например, HBV, ВИЧ), некоторые грибки и вегетативные бактерии.
- Все следующие утверждения относятся к подходу Сполдинга к стерилизации и дезинфекции, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. В процессе использования по назначению важные предметы проникают в мягкие и твердые стерильные ткани или в сосудистую систему. Б. В процессе использования по назначению полукритические предметы контактируют, но не проникают через неповрежденную кожу или слизистые оболочки. С.В процессе использования по назначению некритичные предметы контактируют с неповрежденной кожей, но не со слизистыми оболочками. D. Во время оказания помощи наиболее важным фактором, определяющим риск заражения от зараженных инструментов, является продолжительность воздействия.
- Все следующие утверждения, относящиеся к критическим, полукритическим или некритическим вопросам ухода за пациентами, верны, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. Термостойкие предметы первой необходимости для ухода за пациентами представляют собой высокую степень риска заражения, если они заражены патогенами, и их необходимо стерилизовать в тепловом стерилизаторе, одобренном Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Б. Термостойкие предметы для ухода за пациентами в полукритическом состоянии, включая все стоматологические наконечники, должны подвергаться тепловой стерилизации.C. Чувствительные к нагреву критически важные предметы должны подвергаться минимальной дезинфекции промежуточного уровня с использованием химического стерилизатора, зарегистрированного FDA. D. При отсутствии видимых загрязнений для некритичных предметов предпочтительным методом инфекционного контроля во время их использования является одноразовая барьерная защита.
- Все следующие утверждения, относящиеся к критическим, полукритическим или некритическим вопросам ухода за пациентами, верны, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. Термостойкие полукритические предметы, такие как наконечники, должны минимально подвергаться высокоуровневой дезинфекции с использованием зарегистрированного FDA химического стерилизатора, используемого в качестве дезинфицирующего средства высокого уровня. B. Жаростойкие критические и полукритические предметы необходимо стерилизовать паром, ненасыщенным химическим паром или сухим жаром.C. Чувствительные к нагреву критически важные предметы можно стерилизовать оксидом этилена или погружая их в жидкие химические бактерицидные средства, зарегистрированные FDA как химические стерилизаторы. D. Некритические предметы, если они явно загрязнены, должны быть продезинфицированы зарегистрированным EPA дезинфицирующим средством среднего уровня для больниц.
- Все следующие утверждения относительно паровых стерилизаторов верны, ЗА ИСКЛЮЧЕНИЕМ какого?
А.Стерилизация паром (автоклавирование) — это наиболее широко используемый метод для упакованных и неупакованных важных и полукритических предметов, которые не чувствительны к теплу и влаге. Б. Для уничтожения микроорганизмов стерилизация паром требует, чтобы каждый предмет подвергался прямому контакту с паром при определенной температуре и давлении в течение определенного периода времени. С.Паровые стерилизаторы с гравитационным вытеснением следует проверять ежедневно на предмет адекватного удаления воздуха. D. Большинство настольных стерилизаторов, используемых в учреждениях по уходу за полостью рта, представляют собой стерилизаторы с гравитационным вытеснением.
- Все нижеследующие утверждения относительно стерилизаторов паром ненасыщенных химикатов верны, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. Ненасыщенная химическая паровая стерилизация включает нагревание химического раствора, в первую очередь спирта с 0,23% формальдегида, в закрытой камере под давлением. Б. Преимущество использования стерилизации химическим паром ненасыщенным способом заключается в том, что инструменты не нужно сушить перед стерилизацией.C. При использовании стерилизатора паров ненасыщенных химикатов необходимо проконсультироваться с федеральными, государственными и местными властями относительно требований по утилизации опасных отходов. D. Ненасыщенная химическая паровая стерилизация вызывает меньшую коррозию инструментов из углеродистой стали, чем паровая стерилизация, поскольку во время цикла присутствует меньше воды.
- Какие из следующих утверждений верны в отношении стерилизации сухим жаром, ИСКЛЮЧАЯ одного. Какой из них является исключением?
A. Сухое тепло можно использовать для стерилизации предметов ухода за пациентом, которые могут быть повреждены влажным теплом (например, боров и некоторых ортодонтических инструментов).Б. Сухое тепло имеет преимущества низкой стоимости эксплуатации и отсутствия коррозии. C. Сухой жар — длительный процесс, и требуемые высокие температуры не подходят для стерилизации многих инструментов и устройств. Д.Преимущество статической воздушной стерилизации — более короткое время цикла стерилизации по сравнению с принудительной воздушной стерилизацией.
- Все следующие утверждения верны в отношении использования химических стерилизующих и дезинфицирующих средств, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
A. Чувствительные к теплу критически важные предметы необходимо очистить и стерилизовать, погрузив их на 3–12 часов в жидкие бактерицидные средства, зарегистрированные FDA как химические стерилизаторы.Б. Термочувствительные полукритические предметы должны как минимум подвергаться высокоуровневой дезинфекции, то есть они должны быть погружены в химический стерилизатор, зарегистрированный FDA, но для более короткого времени контакта (≤12 мин.). C. Некритические предметы ухода за пациентами, если они явно загрязнены, должны быть очищены и продезинфицированы (время контакта 10 минут для большинства продуктов) с использованием зарегистрированного EPA дезинфицирующего средства промежуточного уровня с туберкулоцидным действием.D. Все вышесказанное верно.
- Все следующие утверждения верны в отношении обработки загрязненных предметов ухода за пациентами многоразового использования, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
А.Должна быть центральная зона обработки (ЦПЗ) подходящего размера с четырьмя последовательными станциями для (1) приема и очистки; (2) подготовка и упаковка; (3) стерилизация или дезинфекция; и (4) хранение стерилизованных единиц. B. Внутри CPA каждая станция должна быть физически отделена, чтобы контролировать транспортный поток и удерживать загрязняющие вещества во время процесса. С.Если физическое разделение станций нецелесообразно, необходимо установить барьеры для изоляции станций. D. Загрязненные предметы ухода за пациентами многократного использования должны транспортироваться от места использования до CPA в герметичных герметичных контейнерах с символом биологической опасности.
- Все следующие утверждения верны в отношении очистки многоразовых инструментов и других устройств, за исключением одного.Какой из них является исключением?
A. Если не удалить видимый мусор (как органические, так и неорганические загрязнители), это помешает инактивации микробов и нарушит процессы стерилизации и дезинфекции. B. Факторы, которые следует учитывать при выборе метода очистки, включают (1) эффективность используемого метода, процесса и оборудования; (2) совместимость с предметами, подлежащими очистке; и (3) профессиональные риски для здоровья и воздействия.C. Использование автоматизированного оборудования (например, ультразвукового очистителя или моечной / дезинфекционной машины) не рекомендуется, поскольку ручная очистка инструментов более эффективна. D. Если используется ручной метод, инструменты должны быть помещены в герметичный, устойчивый к проколам контейнер и пропитаны моющим средством, дезинфицирующим средством / моющим средством или ферментным очистителем для предотвращения высыхания загрязнений.
- Все следующие утверждения верны в отношении моющих и ферментных чистящих средств, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
A. Моющие средства с кислым pH обычно обеспечивают наилучший профиль совместимости материалов и хорошее удаление загрязнений. Б.Ферменты, обычно протеазы, иногда добавляют для нейтрализации растворов pH, чтобы помочь удалить органический материал. C. Некоторые чистящие растворы также содержат липазы (ферменты, инактивирующие жир) и амилазы (ферменты, инактивирующие крахмалы). D. После очистки инструменты необходимо вымыть, чтобы удалить остатки моющих средств и ферментов.
- Все следующие утверждения верны в отношении подготовки и упаковки инструментов, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
A. Отдельные инструменты должны быть помещены в индивидуальные самозаклеивающиеся или термосвариваемые пластиковые и бумажные пакеты или размещены в жестких или перфорированных лотках / кассетах и завернуты.B. Навесные инструменты, помещенные в различные упаковки, должны находиться в закрытом, заблокированном положении. C. Каждый приборный блок должен иметь внутренний индикатор, расположенный внутри, и, если внутренний индикатор не виден, внешний индикатор должен быть нанесен снаружи. Д.Упаковочный материал, например, бумажные или пластиковые пакеты, нетканые и тканые обертки, должен обеспечивать стерильность инструментов во время транспортировки и хранения.
- Все следующие утверждения верны в отношении стерилизации упакованных инструментов, загружающих инструменты, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
А.Перфорированные лотки / кассеты следует размещать параллельно полке. Б. Неперфорированные емкости следует ставить на край. C. Пакеты с кожурой следует класть на края, а мелкие предметы следует свободно класть в проволочные корзины. Д.По завершении цикла стерилизации снимите пакеты, чтобы они остыли и просохли за пределами камеры.
- Все следующие утверждения верны в отношении стерилизации неупакованных инструментов и их использования, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
A. Неупакованные инструменты необходимо тщательно очистить и высушить перед стерилизацией.B. При стерилизации неупакованных инструментов необходимо проверять механические индикаторы, но нет необходимости размещать химический индикатор вместе с предметами. C. Важнейшие предметы, стерилизованные без упаковки, должны быть перенесены из стерилизатора в место использования асептическим методом для немедленного использования. Д.Неупакованные стерильные инструменты могут быть загрязнены пылью, переносимыми по воздуху организмами и другими загрязнителями, поэтому их нельзя хранить.
- Все следующие утверждения верны в отношении стерилизации и дезинфекции высокого уровня бактерицидами, ЗА ИСКЛЮЧЕНИЕМ одного. Какой из них является исключением?
А.Предметы ухода за пациентом после погружения необходимо промыть стерильной водой, чтобы удалить токсичные или раздражающие остатки. Б. При обращении с предметами ухода за пациентом необходимо использовать стерильные перчатки, высушить стерильными полотенцами и доставить к месту использования в асептических условиях для немедленного использования. C. Эффективность процесса стерилизации или дезинфекции высокого уровня с использованием бактерицидов легко проверить.D. Федеральный закон требует, чтобы инструкции на этикетках для продуктов, зарегистрированных FDA и EPA, соблюдались (например, использование-разбавление, срок годности, хранение, совместимость материалов, безопасное использование и утилизация).
- Все следующие утверждения верны в отношении хранения стерилизованных предметов, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. После завершения цикла стерилизации и того, что приборные блоки высохнут и остынут, проверьте все упаковки на предмет надлежащего изменения цвета по видимым химическим индикаторам. Б. Приборы следует хранить в чистом, сухом, закрытом шкафу. С.Практика хранения упакованных стерилизованных инструментов зависит от времени, т. Е. Следует учитывать, что упакованные инструменты сохраняют свою стерильность в течение определенного времени. D. Если упаковка повреждена (т. Е. Разорвана, намокла или открыта), инструменты следует повторно очистить, повторно упаковать в новую упаковку и повторно стерилизовать.
- Все следующие утверждения верны в отношении различных показателей обеспечения качества процесса стерилизации, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. Мониторинг физических показателей включает наблюдение за датчиками или дисплеями стерилизатора и запись времени, температуры и давления, связанных с каждым циклом стерилизации для каждой загрузки. B. В химических индикаторах используются чувствительные химические вещества для оценки критических переменных (например, времени, температуры, насыщенности пара) во время цикла стерилизации и подтверждения того, что стерилизация была достигнута.C. Биологические индикаторы (БИ) или тесты спор непосредственно оценивают уничтожение известных высокорезистентных, непатогенных бактериальных спор. D. Результаты физического, химического и биологического мониторинга должны быть задокументированы в протоколе мониторинга стерилизации.
- Все следующие утверждения верны в отношении биологического мониторинга процесса стерилизации, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. В учреждениях по уходу за полостью рта БИ следует обрабатывать с загрузкой во всех стерилизаторах не реже одного раза в неделю. B. BI должен обрабатываться при каждой загрузке, содержащей имплант, и имплантат должен быть помещен в карантин до тех пор, пока не станет известен результат теста на споры. С.Когда биологическое тестирование проводится в офисе, тест BI необходимо инкубировать (вместе с положительным контролем из той же партии, но не обработанным в стерилизаторе) в течение двух часов (или в холодильнике). D. Споры Bacillus atrophaeus используются для паровых стерилизаторов.
- Все следующие утверждения относительно записи мониторинга стерилизации (SMR) верны, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. Документация в виде журнала является абсолютным требованием обеспечения качества. B. Отчеты о биологическом мониторинге, отправляемые по почте, ведутся испытательным агентством, и отдельного ведения записей в стоматологическом кабинете не требуется. С.SMR обеспечивает механизм для определения того, указан ли отзыв, и, в сочетании с датой и номером стерилизатора на каждой упаковке, степень отзыва. D. Запись о мониторинге стерилизации и запись о техническом обслуживании стерилизатора должны храниться в течение определенного периода времени (требования государственной стоматологической комиссии могут отличаться).
- Все следующие утверждения верны в отношении процедур, которым необходимо следовать в случае положительного результата теста на споры, ЗА ИСКЛЮЧЕНИЕМ одного.Какой из них является исключением?
A. В случае положительного результата теста на споры стерилизатор следует вывести из эксплуатации и просмотреть все записи физического и химического мониторинга с момента последнего отрицательного теста BI. B. Если физические и химические индикаторы показывают, что стерилизатор работает правильно, рассмотрите возможность ошибки оператора, используя тот же цикл, который привел к отказу, повторите тест на споры сразу после правильной загрузки стерилизатора.C. Если упаковка, загрузка и рабочие процедуры были подтверждены как выполненные правильно и повторный тест BI дал отрицательный результат, стерилизатор должен оставаться в нерабочем состоянии до тех пор, пока он не будет проверен, отремонтирован и повторно проверен с помощью подтверждающего теста BI. D. Все предметы, стерилизованные от подозрительных партий, относящихся к последнему отрицательному тесту BI, должны быть повторно очищены, обернуты и повторно стерилизованы.
Руководство по очистке и стерилизации интраокулярных хирургических инструментов — 2018
Настоящее руководство предназначено для оказания помощи центрам амбулаторной хирургии (ASC) в их усилиях по внедрению соответствующих методов очистки и стерилизации интраокулярных хирургических инструментов. Они предназначены только для научных, образовательных и информационных целей.Они не предназначены для установления единственно приемлемых или подходящих стандартов, методов или практик для очистки и стерилизации таких инструментов. Соблюдение этих рекомендаций не гарантирует соблюдение каких-либо правовых или нормативных стандартов, включая, помимо прочего, критерии лицензирования или сертификации ASC, возмещения расходов по программе Medicare или другим сторонним плательщикам. Кроме того, любые обсуждения или рекомендации в этом руководстве относительно использования лекарств или устройств, которые отличаются от U.S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) — использование такого продукта (т. Е. «Не по прямому назначению») разрешено только в научных и образовательных целях и должно подпадать под исключение FDA для «медицинской практики» для случаев, когда это запрещено. этикетка использует. Отдельные врачи должны выносить независимые суждения о том, уместно ли использование определенного лекарства или устройства не по назначению и отвечает ли интересам пациента, исходя из фактов и обстоятельств конкретного случая.
Введение
Послеоперационный инфекционный эндофтальмит и синдром токсического переднего сегмента (ТАСС) являются редкими, но потенциально опасными для зрения осложнениями катаракты и других внутриглазных операций.Небольшой объем глаза и его чувствительность к незначительным количествам химических или микробных загрязнителей означает, что неправильная очистка или стерилизация инструментов могут представлять значительный риск для пациентов. Целевая группа по очистке и стерилизации офтальмологических инструментов (OICS) состоит из представителей Американского общества катарактальной и рефракционной хирургии (ASCRS), Американской академии офтальмологии (AAO) и Общества амбулаторной офтальмохирургии (OOSS). Эти профессиональные сообщества представляют офтальмологов и клинический персонал офтальмологических центров амбулаторной хирургии, включая хирургов, медсестер и техников.В состав рабочей группы OICS входят эксперты по ТАСС и эндофтальмиту, и этот документ был написан с целью предоставить специализированные, основанные на фактических данных рекомендации по очистке и стерилизации интраокулярных хирургических инструментов. Этот документ представляет собой обновленную версию оригинальных рекомендованных практик очистки и стерилизации интраокулярных хирургических инструментов, опубликованных в 2007 году. 1
Большинство рекомендуемых практик основано на существующих основанных на фактических данных рекомендациях по очистке и стерилизации всех хирургических инструментов в целом, 2–4 из опубликованных анализов вспышек заболеваний TASS, 5–12 и инструкций производителей по применению (IFU) для хирургические инструменты и оборудование.Кроме того, члены целевой группы сотрудничали в проведении нового исследования, которое поддерживает определенные рекомендации, упомянутые в этом документе.
Этот специализированный документ направлен на определение минимальных стандартов очистки и стерилизации интраокулярных инструментов на основе консенсуса экспертов, представляющих 3 спонсирующих общества. Хотя рекомендации в этом документе разработаны специально для хирургии катаракты, они также актуальны для инструментов, используемых в других внутриглазных хирургических процедурах.Он не является исчерпывающим списком всех требований к стерилизации и обеспечению качества процесса стерилизации. Отдельные центры могут принять решение о включении дополнительных мер помимо того, что описано в этом документе.
Следует также принять во внимание рекомендации других соответствующих организаций. 2–4,13 Однако многие рекомендации из этих опубликованных руководств сделаны в отношении всех хирургических процедур и не относятся к офтальмологическим инструментам и хирургии.Поэтому в этих рекомендациях часто не учитываются уникальные условия внутриглазной хирургии и особые требования к чистке и стерилизации офтальмологических инструментов. В результате всеобъемлющие и широкие руководящие принципы, пытающиеся охватить операцию с головы до ног, иногда могут включать несоответствующие или даже рискованные методы лечения офтальмологических случаев. Например, операции по удалению катаракты короче, чем многие общие хирургические процедуры, и часто выполняются с большим ежедневным объемом. Внутриглазные хирургические инструменты являются одними из самых маленьких по размеру и, как правило, не сильно загрязняются тканями или бактериями.С другой стороны, незначительные количества детергента или химических загрязнителей, которые хорошо переносятся в других полостях тела, могут вызвать серьезное внутриглазное воспаление (TASS) при попадании в глаз. 14,15 Эти характеристики могут отличать оптимальные процедуры очистки и стерилизации при хирургии катаракты от процедур, необходимых для многих других типов хирургии.
Синдром токсического переднего сегмента (ТАСС)
Синдром токсического переднего сегмента — это острая тяжелая воспалительная реакция на токсический контаминант, попавший в переднюю камеру глаза во время внутриглазной хирургии.Помимо тяжелых клеток передней камеры и обострения, это может быть связано с фибрином, гипопионом, диффузным отеком роговицы от лимба к лимбу, атоническим зрачком, вторичной глаукомой и в некоторых случаях с клетками стекловидного тела. 16 Из-за этих признаков ТАСС может быть неправильно диагностирован и неправильно обработан как инфекционный эндофтальмит. Даже если ТАСС разрешится лечением и без постоянных последствий, пациент часто страдает эмоциональной травмой, полагая, что он или она может иметь потенциально ослепляющую инфекцию.
Крупная вспышка ТАСС в 2006 г. привела к формированию Целевой группы ASCRS ТАСС, опросы и посещения которой неизменно показывают, что неправильная очистка и стерилизация инструментов является наиболее часто определяемой причиной ТАСС. 17,18 Целевая группа ТАСС отдельно проанализировала и сравнила причины появления ТАСС за 2 периода: 2007–2009 и 2009–2012 гг. 17,18 Данные 130 анкет и 71 посещения пораженных центров амбулаторной хирургии (ASC) были включены в окончательный анализ 1454 случаев TASS в результате примерно 69 000 сопутствующих операций по удалению катаракты.Наиболее частыми факторами риска ТАСС являются неправильная промывка и ополаскивание наконечников, использование ферментных моющих средств и использование ультразвуковых ванн. 18
Офтальмологический обзор практики стерилизации, 2014 г., ASC
В 2014 г. в ASC-члены OOSS было разослано исследование, разработанное Целевой группой OICS, касающееся очистки и стерилизации внутриглазных инструментов. Опрос был проведен 232 центрами-респондентами, представляющими различные амбулаторные хирургические учреждения, включая специализированные офтальмологические центры и многопрофильные центры.Модели собственности включали 100% принадлежность врачей, аффилированные с корпорациями, филиалы больниц и амбулаторные отделения больниц (HOPD). В целях анализа практики очистки и стерилизации, в частности, для офтальмологической хирургии, были исключены мультиспециализированные ASC, связанные с больницей ASC и HOPD. Всего было проанализировано 182 полных ответа на этот руководящий документ OICS. В течение предшествующих 12 месяцев респонденты-респонденты из одной специальности сообщили, что провели в общей сложности 608 117 глазных хирургических вмешательств.Общий уровень инфицирования составил 0,02%: в 116 учреждениях не было зарегистрировано ни одного случая заболевания, а в 66 учреждениях — 104 случая эндофтальмита. Общий показатель ТАСС составил 0,01%, при этом 161 учреждение сообщило о нулевых случаях и 21 учреждение сообщило в общей сложности о 50 случаях. Большинство объектов (97,3%) были проинспектированы регулирующим органом в течение предыдущего трехлетнего периода. В результате проверки 16,9% предприятий сообщили, что им было предложено изменить протоколы очистки или стерилизации.
Общие административные принципы
Все помещения должны иметь письменные протоколы очистки и стерилизации инструментов.Эти «политики и процедуры» должны быть основаны на отраслевых стандартах и рекомендациях с участием медперсонала и медицинского персонала. Они должны быть одобрены руководящим органом учреждения и быть доступными для операционной и персонала, занимающегося обработкой инструментов. Кроме того, эти политики и процедуры следует пересматривать ежегодно и при приобретении нового инструментария или стерилизационного оборудования. 2,3 Мы признаем большое разнообразие офтальмологических хирургических учреждений, а также используемых хирургических продуктов и инструментов.Врачам и руководителям медперсонала должна быть предоставлена некоторая свобода действий при разработке и пересмотре письменных политик и процедур их учреждения по очистке и стерилизации инструментов на основе наилучших имеющихся клинических данных. Затем они должны быть одобрены руководящим органом предприятия.
Привлекаемый персонал должен быть надлежащим образом обучен обращению, чистке и стерилизации внутриглазных хирургических инструментов и подлежит периодическому контролю. 2,3,13 Помимо общих принципов асептики, это обучение должно также включать очистку, осмотр, подготовку, упаковку, стерилизацию, хранение и распространение интраокулярных хирургических инструментов.Соответствующий персонал также должен быть обучен смежным задачам, таким как эксплуатация оборудования и профилактическое обслуживание. Они должны пройти проверку компетентности путем непосредственного наблюдения за работой. 2,3 Обучение, подготовка и подтверждение компетентности персонала должны обновляться и документироваться не реже одного раза в год и одновременно с внедрением нового хирургического оборудования, медицинских устройств или систем упаковки. 2,3
И инфекционный эндофтальмит, и ТАСС являются редкими событиями, и их частота должна контролироваться как средство подтверждения безопасности и эффективности письменных протоколов учреждения.Персонал операционной должен быть осведомлен о причинах как эндофтальмита, так и ТАСС. Следует внедрить систему эпиднадзора для отчетности и документирования инфекционного эндофтальмита и ТАСС. Любое увеличение частоты инфекционного эндофтальмита или ТАСС должно побуждать к тщательному анализу и документированному анализу процедур и протоколов учреждения по очистке и стерилизации инструментов. 17 Записи об использовании инструментов, использования лекарств и процедур стерилизации должны вестись в соответствии с политикой учреждения. 2–4,16 Такие записи могут помочь в расследовании любых вспышек ТАСС или инфекционного эндофтальмита. 2–4,16
Очистка интраокулярных хирургических инструментов
Очистка и дезинфекция, включая тщательное ополаскивание и промывку, должны предшествовать дезинфекции или стерилизации. Рекомендуется чистить офтальмологические инструменты отдельно от неофтальмологических хирургических инструментов. Загрязненные инструменты также следует очищать в зоне, отдельной от места упаковки и стерилизации.
Во время обеззараживания и очистки весь мусор, включая офтальмологическое вискохирургическое устройство (OVD), следует удалить с инструментов. 7,16,19 Может быть полезно держать инструменты влажными до начала процесса очистки, чтобы избежать высыхания мусора и OVD. 2,3,16,20 Смоченную ткань без ворса или мягкую щетку следует использовать для очистки инструментов в соответствии с инструкциями производителя. 3,4 Для каждого инструмента могут потребоваться дополнительные или повторяющиеся шаги очистки и промывки, чтобы обеспечить удаление всего мусора и OVD. 21
Объем и тип воды для очистки и ополаскивания инструментов должны соответствовать инструкциям производителя. и для окончательного ополаскивания. 16,23 Промывку инструментов с просветом следует начинать в операционной и завершать в зоне дезактивации. 3,4 Когда стерильные водяные бани используются для очистки или замачивания загрязненных инструментов в операционной, их следует отделить от стерильного поля и инструментов, которые все еще используются.Когда промывка используется как часть метода очистки, сточные воды следует сбрасывать в раковину или отдельный бассейн, сводя к минимуму разбрызгивание и аэрозолизацию, чтобы загрязненная жидкость не распространялась.
Производственные предприятия могут отказаться от чистящих шприцев или щеток после каждого использования. Если щетки используются повторно, их следует очищать, дезинфицировать или стерилизовать не реже одного раза в день. 4,24 Инструменты должны быть визуально проверены на предмет мусора и повреждений после очистки и перед упаковкой для стерилизации, чтобы гарантировать удаление мусора. 4,13,16,25
Сразу после использования насадки для факоэмульсификации и ирригации / аспирации (I / A) можно поместить в стерильную водяную баню, отделенную от активного операционного поля, чтобы избежать высыхания OVD до очистки. 2,3 Инструменты с просветом, такие как наконечники фако или I / A, следует очищать и промывать в соответствии с инструкциями производителя. Весь мусор, включая OVD, следует удалять как можно скорее. 2,3
Многие инструкции по применению требуют тщательной промывки критической водой.Промывка должна обеспечивать поток воды через инструменты и над ними, а сточные воды сбрасывать, чтобы для последующего ополаскивания использовалась только вода, свободная от мусора.
Ферментное моющее средство
Одной из спорных практик является использование ферментных детергентов для обеззараживания интраокулярных хирургических инструментов. Инструкции производителя, которые прилагаются к офтальмологическим инструментам и ваннам для ультразвуковой очистки, часто требуют использования ферментных очистителей, пропуск которых, следовательно, будет считаться не по назначению.Однако необходимость ферментных детергентов для очистки загрязненных внутриглазных инструментов не установлена. В отличие от IFU некоторых производителей для внутриглазных инструментов, наша позиция состоит в том, что ферментные детергенты не должны регулярно требоваться для внутриглазных инструментов по нескольким причинам. Эти детергенты обычно содержат экзотоксины субтилизина или альфа-амилазы, ни один из которых не денатурируется при стерилизации в автоклаве. Эндотелиальная токсичность ферментных детергентов была подтверждена в исследованиях как на животных, так и на людях. 15,26,27 Неправильное использование или неполное полоскание ферментных детергентов было связано со вспышками ТАСС. 17,18
Ферментное моющее средство предназначено для удаления большого количества биоматериала с хирургических инструментов. Однако внутриглазные инструменты приобретают минимальную бионагрузку во время операции на глазах, а собираемый ими материал обычно полностью удаляется с помощью немедленной ручной промывки и очистки. Исследования показали, что при соблюдении инструкций производителя даже незначительный остаток фермента, оставшийся на внутриглазных инструментах, может вызвать ТАСС. 14 Небольшие просветы и хрупкость внутриглазных инструментов часто затрудняют полное удаление всех следов ферментного детергента. Недавнее исследование глазного центра Морана показало, что остатки моющего средства можно обнаружить с помощью сканирующей электронной микроскопии (SEM) и энергодисперсионной рентгеновской спектроскопии (EDS) на поверхности фако-наконечников даже после тщательного ополаскивания стерильной водой перед стерилизацией после стерилизации. Инструкцию производителя инструмента. 28 Обнаруживаются гораздо более крупные остатки фермента, если не проводить тщательную промывку. 28
В исследованиях на кроликах, проведенных в глазном центре Морана, было проанализировано, могут ли ферментные моющие средства, используемые для очистки офтальмологических инструментов, вызывать реакцию, подобную TASS. 14 Различные разведения ферментного детергента вводили в передние камеры глаз кроликов, и животных после операции обследовали на наличие признаков воспаления переднего сегмента. Тяжелое воспаление переднего сегмента, включая образование фибрина, развилось в течение 72 часов после инъекции.Существовала дозозависимая корреляция между концентрацией фермента и тяжестью воспалительной реакции. Посмертное витальное окрашивание показало дозозависимую токсичность ферментного детергента для эндотелия роговицы.
Многие ASC специально избегают использования ферментных детергентов для интраокулярных инструментов, что, в зависимости от инструмента, может быть не по назначению. В исследовании, проведенном в 2014 г. среди ASC-членов OOSS, большинство учреждений (55,5%) не использовали ферментные очистители для дезактивации внутриглазных инструментов по сравнению с 44.5% кто сделал. Средняя частота эндофтальмита, о которой сообщают сами пациенты, составляла 0,021% для учреждений, не использующих ферменты, по сравнению с 0,027% для учреждений, использующих ферменты. Нам неизвестно ни одного исследования, показывающего, что ферментное моющее средство для внутриглазных инструментов снижает частоту эндофтальмита. Не обладая доказанной эффективностью для профилактики эндофтальмита, ферментные детергенты могут излишне повышать риск ТАСС, не принося значительной пользы пациенту. Наша позиция заключается в том, что если внутриглазные хирургические инструменты тщательно промываются критической водой сразу после каждого использования, рутинное использование ферментных детергентов не требуется и не должно требоваться для рутинной дезактивации внутриглазных офтальмологических инструментов.
Некоторые инструменты IFU, однако, указывают на использование ферментных детергентов, и это привело к тому, что хирургические центры, которые не используют ферментные детергенты, были упомянуты инспекторами Центров Medicare и Medicaid Services (CMS) или других регулирующих органов. После встречи с представителями CMS, Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Ассоциации по развитию медицинского оборудования (AAMI) по поводу потенциального риска для TASS, связанного с этой практикой, наша целевая группа OICS в 2016 году обратилась к производителям интраокулярных хирургических инструментов. для проверки альтернативных методов очистки и обеззараживания, которые не требуют регулярного использования ферментных моющих средств.
Очистка ферментным моющим средством может потребоваться в определенных ситуациях. Если по какой-либо причине используются ферментные моющие средства, необходимо соблюдать инструкции по правильному разбавлению и утилизации чистящих растворов. Чистящий раствор следует смешивать с отмеренными количествами воды и моющего средства (т. Е. Не смешивать с расчетными объемами) в соответствии с инструкциями по применению моющего средства. 3,4,22 Инструменты следует тщательно промыть, чтобы обеспечить удаление всех чистящих средств, а также всего мусора, удаленного во время процесса очистки. 15,16,20 Использование водопроводной воды для полоскания и удаления моющего средства следует использовать только в соответствии с инструкциями производителя для моющего средства и оборудования. Поскольку водопроводная вода может содержать термостойкий эндотоксин грамотрицательных бактерий, обнаруженных в городском водопроводе, для окончательной промывки инструмента рекомендуется использовать критически важную воду. 16,23
Ультразвуковая очистка
Ультразвуковая очистка представляет собой еще один фактор риска для ТАСС, согласно исследованиям оперативной группы ТАСС.Если используется ультразвуковой очиститель, технический специалист должен удалить все видимые загрязнения перед помещением инструментов в ультразвуковой очиститель. Ультразвуковая установка должна быть предназначена для очистки медицинских инструментов и предпочтительно должна использоваться только для офтальмологических инструментов. Если устройство используется для других типов хирургических инструментов, его следует опорожнить, очистить и промыть перед использованием с офтальмологическими инструментами, чтобы избежать перекрестного загрязнения. 4
Ультразвуковые аппараты следует опорожнять, очищать, дезинфицировать, ополаскивать и сушить не реже одного раза в день. 9,10,29 Если иное не указано производителем, очистка должна выполняться с использованием дезинфицирующего средства, зарегистрированного Агентством по охране окружающей среды и одобренного для предприятия, с последующей критической промывкой водой, достаточной для полного удаления чистящего средства. Если IFU ультразвукового очистителя не противопоказан, следует рассмотреть возможность заключительного ополаскивания 70-90% этиловым или изопропиловым спиртом для отделения ультразвуковой очистки. Машину следует полностью высушить безворсовой тканью, а затем очистить в соответствии с инструкциями производителя перед следующим использованием. 24,30
Повторное использование наконечников Phaco
Если это возможно и безопасно, повторное использование некоторых хирургических инструментов может повысить рентабельность операции по удалению катаракты. В дополнение к надлежащей очистке и стерилизации для предотвращения микробного заражения, надлежащее повторное использование требует сохранения структурной целостности инструмента, чтобы он сохранял свою хирургическую функцию. Во многих странах фако наконечники обычно используются повторно, чтобы сократить отходы и снизить стоимость замены.По усмотрению хирурга, использованный наконечник можно выбросить, если будет замечено какое-либо снижение эффективности резки. У нас нет убедительных доказательств того, что эта потенциально не рекомендованная к применению практика опасна или менее эффективна, чем использование нового фако-наконечника в каждом случае. Хотя большинство наконечников фако-наконечников изготовлены из сопоставимого титанового сплава, 31 , между производителями существуют большие различия в маркировке для повторного использования. Один производитель (Alcon, Форт-Уэрт, Техас) указывает только одноразовое использование всех своих фако-наконечников.Другой производитель (MicroSurgical Technology, Редмонд, Вашингтон) разрешает 50 повторных использований своих фако-насадок. Третий производитель (Abbott Medical Optics / Johnson & Johnson Vision, Санта-Ана, Калифорния) допускает 20 повторных использований 1 наконечника, но только один раз для другой модели наконечника фако-наконечника.
В одном исследовании, проведенном в глазном центре Морана, оценивалось 8 фако-наконечников (как одноразовых, так и многоразовых) после 10 циклов стерилизации в автоклаве. 28 Ни один из протестированных наконечников не показал каких-либо значительных морфологических изменений при анализе SEM или EDS.Во втором исследовании Moran Eye Center совместно с лабораторией Nanofab в Юте было протестировано 8 моделей фако-наконечников от 3 производителей с использованием хорошо описанной модели катаракты свиньи ex vivo. Тестирование каждого наконечника с помощью SEM и интерферометрии в белом свете (WLI) проводилось после 5 имитированных повторных применений, включающих длительные непрерывные ультразвуковые циклы в ядрах различной плотности. 32 Независимо от того, были ли они помечены для одноразового или многократного использования, повторно используемые наконечники факоиндикатора в этой экспериментальной модели не показали значительных ультраструктурных повреждений или износа, таких как микротрещины, деформации, трещины или поломки.Эта модель была очень надежной и использовала максимальную настройку 100% непрерывной продольной фако-мощности, которая была бы эквивалентна 10-минутному непрерывному факоэмульсификации при 20% -ной мощности. Неудивительно, что некоторые поверхностные изменения на поверхности использованных насадок были обнаружены на SEM в этом исследовании и во втором исследовании, оценивающем клинически используемые насадки. 33 Теоретическая значимость или актуальность этих микроскопических изменений поверхности спорна, но они не должны представлять угрозу безопасности. Результаты этих исследований показывают, что маркировка некоторых титановых фако-наконечников для одноразового использования может быть произвольной, в частности, когда фактически идентичные титановые наконечники маркируются для 20 или 50 применений разными производителями.В отсутствие клинических доказательств обратного мы предлагаем производителям провести валидационные исследования для многоразовых фако-наконечников. Что касается насадок, протестированных в этом исследовании, мы согласны с предположением исследователей о том, что хирургам по лечению катаракты разрешается по своему усмотрению использовать факонасадки не по назначению на основании их клинических наблюдений и суждений. 32,34
Стерилизация интраокулярных хирургических инструментов
Контроль и управление процессом стерилизации имеют решающее значение для программы инфекционного контроля ASC.Следует установить достаточное время для выполнения рекомендованных процедур очистки и стерилизации инструментов. 13,35 Метод стерилизации инструментов должен основываться на рекомендациях производителя медицинского устройства, системы упаковки и стерилизатора. Регулярный мониторинг и проверка работы стерилизатора с помощью биологических индикаторов должны выполняться не реже одного раза в неделю, а предпочтительно ежедневно, в соответствии с инструкциями производителя стерилизатора и фиксироваться в журнале. 2–4 Необходимо принять меры для обеспечения того, чтобы профилактическое обслуживание, очистка и осмотр стерилизаторов выполнялись и документировались на плановой основе в соответствии с инструкциями производителя стерилизатора. 2–4
Строгое соблюдение всех инструкций по применению не всегда возможно. Могут быть расхождения между отдельными IFU для стерилизатора, упаковочной системы и / или медицинского устройства. Многие хирургические лотки содержат инструменты более чем одного производителя, у которых могут быть противоречивые IFU.Разделение инструментов по производителям и выполнение различных процедур стерилизации для каждой группы инструментов нецелесообразно. В таких ситуациях врачам и медсестрам целесообразно руководствоваться своим клиническим мнением при разработке политик очистки и стерилизации инструментов, обеспечивающих безопасность при разрешении противоречивых IFU.
Для стерилизации офтальмологических хирургических инструментов следует использовать полные терминальные циклы стерилизации в упаковке, которые будут храниться на ночь для будущего использования.Короткий цикл стерилизации паром обычно используется для так называемых последовательных офтальмологических процедур в тот же день; то есть последующие последовательные операции, проводимые в тот же день, когда инструменты стерилизованы. 36 Однако терминология, используемая агентствами, лицензирующими и регулирующими ASC для описания и различения коротких циклов стерилизации паром, вызвала некоторую путаницу в офтальмологической индустрии ASC.
CMS Survey and Certification S&C: 14-44-Hospital / CAH / ASC «Изменение терминологии и обновление меморандума об обследовании и сертификации (S&C) 09-55 относительно немедленного использования паровой стерилизации (IUSS) в хирургических учреждениях» было выпущено в августе. 2014 г. 37 В нем IUSS определено как терминология, заменяющая устаревший термин «мгновенная стерилизация», и указано, что IUSS неприемлем в качестве стандартного метода стерилизации. IUSS может использоваться в экстренных случаях для предоставления инструментов операционной для хирургического случая, который уже ведется. После встреч и обсуждений с Целевой группой OICS, CMS впоследствии разъяснила в 2015 году, что «IUSS — это не то же самое, что стерилизация« коротким циклом », которая является формой терминальной стерилизации, приемлемой для рутинного использования для упакованных / содержащихся загрузок. где предварительная очистка инструментов выполняется в соответствии с инструкциями производителя, и загрузка соответствует инструкциям производителя устройства по применению (IFU), включает использование времени полного высыхания и упакована в обертку или жесткий стерилизационный контейнер, утвержденный для последующего использования .Использование короткоцикловой стерилизации особенно распространено в учреждениях, где проводятся операции на глазах, и допустимо, когда соблюдаются все IFU (т.е. стерилизатор, устройство и производитель контейнеров). Однако, похоже, в этой области существует путаница в отношении различий между IUSS и короткоцикловой стерилизацией, а также неправильное использование термина IUSS для обозначения того, что на самом деле является короткоцикловой стерилизацией. Учреждения, выполняющие операции, должны понимать различия между IUSS и короткоцикловой стерилизацией, чтобы обеспечить соответствие требованиям Medicare по профилактике и контролю инфекций ». 38
Короткий цикл, последовательное использование в тот же день
Важность полной сушки офтальмологических хирургических инструментов после стерилизации паром зависит от того, как обрабатываются и хранятся загрузки после завершения цикла стерилизации. Влага, присутствующая после стерилизации, может стать вектором для микроорганизмов из окружающей среды или нестерильных рук, чтобы проникнуть в закрытую упаковочную систему и загрязнить содержимое загрузки. Поэтому, если иное не указано в инструкциях по упаковке упаковочной системы, упакованные инструменты, окончательно стерилизованные перед хранением в течение ночи, всегда должны быть полностью сухими.Это также необходимо для обеспечения целостности микробного барьера любой системы упаковки или упаковки инструментов, с которыми будут работать нестерильные руки.
Короткий цикл стерилизации упакованной или неупакованной загрузки подходит для последовательного повторного использования инструментов в тот же день. Неупакованные стерильные инструменты должны быть защищены от микробного заражения во время переноса из точки стерилизации в точку использования. Это может быть выполнено с помощью одобренного закрытого защитного устройства.Некоторые IFU стерилизатора допускают прерывание фазы сушки при определенных обстоятельствах. 39 Риск заражения из-за стерильной влаги в контейнере или на инструментах, когда невысушенные (влажные) и неупакованные инструменты стерилизуются для последовательного использования в тот же день и доставляются из стерилизатора непосредственно в операционную в закрытом контейнере. устройство не установлено.
В опросе ASC, входящих в OOSS в 2014 г., короткие циклы стерилизации обычно использовались между последовательными случаями в один день (52.3% респондентов). Наиболее часто используемыми стерилизаторами для последовательных случаев в один день были AMSCO (STERIS, Mentor, OH) (42,1%) и STATIM (SciCan, Canonsburg, PA) (28,4%). В целом, 49,7% ответивших предприятий имели стерилизатор марки STERIS AMSCO, а 44,3% — стерилизатор марки SciCan STATIM. Для стерилизации инструментов между последовательными случаями в один день обычно использовались следующие методы обработки: кассета STATIM (28,2%), закрытые стерилизационные контейнеры (26,0%) и упаковка (18,2%).
Исследование, инициированное Целевой группой OICS, финансируемое OOSS, ASCRS и AAO, оценивало текущие методы стерилизации офтальмологических инструментов с использованием коротких циклов двух паровых стерилизаторов, одобренных FDA, которые широко используются согласно обзору OOSS ASC. 36 Первым был стерилизатор STATIM 2000 (SciCan) с использованием металлической кассеты, поставляемой с STATIM, а вторым был стерилизатор предварительного вакуумирования AMSCO Century V116 (STERIS) с жестким контейнером Case Medical SteriTite (Case Medical, South Hackensack, Нью-Джерси).Оценки были выполнены независимой лабораторией для валидации медицинских устройств (Highpower Validation Testing and Lab Services, Рочестер, штат Нью-Йорк) и сравнивали упакованные, содержащиеся и неупакованные инструменты с прерыванием фазы сушки и без нее. Отдельные исследования были выполнены для проверки эффективности стерилизации 2 стерилизаторов с короткими циклами, а также стерильности любой влаги, присутствующей в 2 устройствах для удержания инструментов. Для оценки были выбраны наконечники и насадки Phaco, поскольку они представляют собой наиболее сложные для очистки и стерилизации предметы на лотке для катаракты.Были протестированы наконечники Phaco от каждого из трех основных производителей факоаппаратов в США — Infiniti (Alcon), Signature (Abbott Medical Optics / Johnson & Johnson Vision) и Stellaris (Bausch & Lomb).
Терминальная стерилизация была выполнена на каждой модели наконечника фако для хранения в течение ночи, а эффективность стерилизации была успешно подтверждена для стерилизаторов STATIM и AMSCO. Они были завернуты (STATIM) или содержали (AMSCO) загрузки, которые были полностью высушены и хранились в течение 7 дней перед тестированием на стерильность.Короткий цикл стерилизации каждой модели наконечника с использованием неупакованных (STATIM) или содержащихся (AMSCO) загрузок также был подтвержден, когда фаза сушки была прервана через 1 минуту. Это имитировало быстрое использование стерилизованных инструментов, которые все еще были влажными, для последовательного случая в тот же день. Наконец, в отдельной серии исследований проверяли насадки и контейнеры фако на стерильность влагой после 3-минутного периода хранения / транспортировки после короткого цикла стерилизации без упаковки или стерилизации с прерыванием фазы сушки через 1 минуту.Время хранения / транспортировки, равное 3 минутам, было использовано для приближения верхнего предела времени, необходимого для переноса удерживающего устройства в несмежную операционную. Стерильность была проверена для каждой модели наконечника и защитного устройства.
Основываясь на результатах этих исследований и данных самих производителей стерилизаторов, мы считаем, что развернутые настройки и короткоцикловая стерилизация, используемые в соответствии с инструкциями по применению стерилизаторов, одобренных FDA, подходят для рутинного использования между последовательными офтальмологическими случаями в один и тот же день. . 36 Влажные или неупакованные инструменты, стерилизованные для последовательного использования в тот же день, следует незамедлительно транспортировать из стерилизатора в операционную в закрытом защитном устройстве для предотвращения повторного заражения микробами. Закрытое устройство для удержания инструментов следует открывать только в операционной. С влажными стерильными упакованными или неупакованными инструментами должны работать только стерильные сотрудники в перчатках и халатах в стерильном помещении. Наконечники Phaco сразу же заполняются сбалансированным солевым раствором и остаются влажными, пока находятся на стерильном столе для инструментов.Следовательно, теоретический риск от остаточной влаги будет в первую очередь связан с повторным заражением стерильной загрузки, которая обрабатывалась, хранилась или транспортировалась за пределами операционной. Хотя близость стерилизатора к операционной является предпочтительной для стерилизации без упаковки, исследование рабочей группы OICS показало, что влага в закрытом защитном устройстве не приводила к повторному заражению в течение как минимум 3 минут. Наша позиция заключается в том, что полная сушка не является необходимой для поддержания стерильности завернутых или неупакованных офтальмологических инструментов, которые хранятся в закрытом защитном устройстве до тех пор, пока стерильный персонал в перчатках и халатах не извлечет их из операционной для последующего случая после некоторой короткой задержки.
Низкотемпературные методы стерилизации не должны использоваться, если производитель офтальмологического инструмента и производитель стерилизатора не утвердили метод для конкретных инструментов в отношении эффективности стерилизации, потенциальной токсичности для глаз (например, из-за окисления металлов) и функциональности инструмента. .11 Глутаральдегид не рекомендуется для стерилизации лазерных контактных линз или интраокулярных инструментов из-за токсичности остатков глутарового альдегида, возникающих в результате неадекватной промывки или загрязнения во время пост-стерилизационного обращения.
Углеродный след хирургии катаракты
Изменение климата или глобальное потепление — серьезная проблема для общественного здравоохранения, а промышленность здравоохранения является основным источником выбросов, на которые приходится 10% общего углеродного следа в Соединенных Штатах. 34,40-44 Факоэмульсификация в Соединенном Королевстве выделяет около 180 кг эквивалента углекислого газа (CO2-e) за операцию, что аналогично выбросам от вождения среднего автомобиля в США на расстояние примерно 430 миль. Более половины этого углеродного следа связано с закупкой в основном одноразовых принадлежностей.Выбросы от факоэмульсификации на крупномасштабном предприятии в Индии составляют менее 1/10 от выбросов в Великобритании с сопоставимыми показателями безопасности. Во многом это связано с частым повторным использованием хирургических материалов и инструментов, а также строгими хирургическими процедурами и процедурами стерилизации. 43,44
Большинство центров офтальмологической хирургии могут снизить выбросы в окружающую среду за счет минимизации использования материалов, повторного использования или переработки хирургических материалов, когда это применимо, вовлечения своей цепочки поставок в экологически предпочтительные закупки, сотрудничества с руководством оборудования для снижения энергопотребления, безопасного повышения эффективности оборота операционных и оптимизации хирургические и центральные стерильные процессы.Карточки предпочтений врача в отношении хирургических подносов и одноразовых индивидуальных упаковок следует регулярно пересматривать. Для многоразовых инструментов воздействие на окружающую среду может быть уменьшено путем удаления повторяющихся или ненужных шагов в процессе очистки и стерилизации, приобретения энергоэффективных приборов, надлежащей очистки и обслуживания машин и удаления ненужных инструментов из хирургических подносов. Следует рассмотреть возможность использования жестких стерилизационных контейнеров или работы с утилизацией отходов, чтобы найти вариант переработки для упаковки синей упаковки с инструментами.Для получения дополнительной информации о сокращении выбросов в окружающую среду посетите веб-сайты Practice GreenHealth A или Healthcare Without Harm. Б
Экономическая эффективность хирургии катаракты
Хирургия катаракты — самая распространенная хирургическая процедура в современной медицине. По прогнозам, в ближайшие 20 лет объем и потребность в хирургии катаракты значительно возрастут. Мы цитируем и соглашаемся с этим кратким изложением катаракты в предпочтительной методике лечения глаз взрослых, опубликованной в 2016 году AAO: 45
«Учитывая прогнозируемый значительный рост численности пожилого населения во всем мире, значительное бремя затрат на операцию по удалению катаракты будет продолжать расти для каждой глобальной системы здравоохранения.В связи с общественным императивом того, чтобы операция по удалению катаракты была безопасной и рентабельной, важно оценивать бездоказательные и потенциально ненужные методы лечения на основе тщательно контролируемых исследований результатов хирургического вмешательства.
Во многих странах протоколы стерилизации и асептики для офтальмологической хирургии были произвольно определены национальными регулирующими органами. Многие из этих мер были разработаны на основе исследований в неофтальмологических специальностях и могут не быть специально утверждены для офтальмологической хирургии, где источником большинства инфекций являются собственное веко пациента и внешняя глазная флора.Например, используя протоколы инфекционного контроля, основанные на постоянном мониторинге данных о результатах, одна офтальмологическая больница в Индии сообщила о частоте эндофтальмита только 0,09% (0,02% случаев факоэпидоза) в более чем 42000 последовательных операциях по удалению катаракты с использованием короткоцикловой стерилизации паром и непрерывной стерилизации. повторное использование халатов, перчаток, хирургических трубок и ирригационных растворов. 46 Новые более дорогостоящие новые меры инфекционного контроля в офтальмологической хирургии не должны произвольно вводиться регулирующими органами без доказательной поддержки.(III, хорошее качество, сильная рекомендация) »
Более поздние исследования, проведенные в 10 региональных офтальмологических больницах, входящих в систему Aravind Eye Care System (AECS) в Тамил Наду, Индия, документально подтверждают, что уровень эндофтальмита составил 0,02% в 555 550 последовательных операциях по удалению катаракты, при которых все глаза также получали местную и внутрикамерную антибиотикопрофилактику. 47-49 В рамках AECS многие одноразовые расходные материалы, такие как хирургические перчатки, халаты, трубки I / A, ирригационные бутыли, лезвия и канюли, обычно повторно используются для снижения затрат и сокращения отходов.Несколько пациентов одновременно проходят операцию по удалению катаракты в одной операционной, в которой есть несколько хирургических столов и бригад. Оперирующие хирурги и медсестры не занимаются чисткой, восстановлением и уходом за больными между последовательными случаями. Несмотря на эти многочисленные методы, которые были бы запрещены в любом лицензированном хирургическом учреждении в Северной Америке, показатели эндофтальмита AECS выдающиеся и статистически идентичны объединенному уровню самооценки всех офтальмологических ASC в США, ответивших на опрос OOSS 2014 года. 47 Очевидно существует вероятность того, что многие методы, санкционированные регулирующими и лицензирующими органами, могут не иметь доказанных преимуществ для глазной хирургии и, следовательно, могут не оправдать значительно более высокие затраты и углеродный след, которые они влекут за собой. Дальнейшие исследования могут быть проведены для оценки некоторых практик, таких как повторное использование одноразовых инструментов. Кроме того, учитывая текущую и исторически низкую частоту посткатарактального эндофтальмита, не следует вводить дорогостоящие новые правила без доказательств их пользы. 45
Список литературы
1. Американское общество катарактальной и рефракционной хирургии и Американское общество дипломированных офтальмологических медсестер. Рекомендуемые методы очистки и стерилизации интраокулярных хирургических инструментов. J Cataract Refract Surg 2007; 33: 1095–1100. Доступно по адресу: http://www.ascrs.org/sites/default/files/resources/TASS_guidelines-CBC.pdf. По состоянию на 17 марта 2018 г.
2. AORN. Рекомендуемые методы очистки и ухода за хирургическими инструментами и электрооборудованием.В кн .: Ассоциация медсестер операционной. Стандарты, рекомендуемая практика и руководящие принципы. Денвер, Колорадо, АОРН, 2006; 555–563
3. Комитет по рекомендуемой практике АОРН. Рекомендуемые методы стерилизации в периоперационном периоде. AORN J 2006; 83: 700–722. Доступно по адресу: http://www.ajicjournal.org/article/S0001-2092(06)60198-1/pdf. По состоянию на 17 марта 2018 г..
4. Association for the Advancement of Medical Instrumentation. Всеобъемлющее руководство по стерилизации паром и обеспечению стерильности в медицинских учреждениях (ANSI / AAMI ST79: 2006).Арлингтон, Вирджиния, Ассоциация развития медицинского оборудования, 2006: 42-114
5. Кокс М.Дж., Вудс Дж. А., Ньюман С., Эдлич Р.Ф. Токсическое действие порошков хирургических перчаток на глаза. J Long Term Eff Med Implants 1996; 6: 219–226
6. Bene C, Kranias G. Возможное загрязнение интраокулярной линзы порошком хирургической перчатки. Офтальмологическая хирургия 1986; 17: 290–291
7. Ким Дж. Х. Внутриглазное воспаление денатурированной вязкоупругой субстанции при удалении катаракты и имплантации хрусталика. J Cataract Refract Surg 1987; 13: 537–542
8.Breebaart AC, Nuyts RMMA, Pels E, Edelhauser HF, Verbraak FD. Токсическое разрушение эндотелиальных клеток роговицы после рутинной операции по экстракапсулярной катаракте. Arch Ophthalmol 1990; 108: 1121–1125
9. Ричбург Ф.А., Рейди Дж. Дж., Apple DJ, Олсон Р. Дж.. Стерильный гипопион, вторичный по отношению к ультразвуковому чистящему раствору. J Cataract Refract Surg 1986; 12: 248–251
10. Крейслер К. Р., Мартин С. С., Янг К. В., Андерсон К. В., Мамалис Н. Послеоперационное воспаление после экстракции катаракты, вызванное бактериальным загрязнением моющего средства для чистящей ванны.J Cataract Refract Surg 1992; 18: 106–110
11. Даффи Р. Э., Браун С. Е., Колдуэлл К. Л., Любневски А., Андерсон Н., Эдельхаузер Н., Холли Г., Тесс А., Диван Н., Хелми М., Ардуино М., Джарвис В. Р.. Эпидемия разрушения роговицы, вызванная стерилизацией плазменным газом; группа исследователей синдрома разрушения токсических эндотелиальных клеток. Arch Ophthalmol 2000; 118: 1167–1176. Доступно по адресу: http://archopht.ama-assn.org/cgi/reprint/118/9/1167?ck=nck. По состоянию на 17 марта 2018 г.
12. Hellinger WC, Hasan SA, Bacalis LP, Thornblom DM, Beckmann SC, Blackmore C, Forster TS, Tirey JF, Ross MJ, Nilson CD, Mamalis N, Crook JE, Bendel RE, Shetty R, Стюарт М.В., Боллинг Дж. П., Эдельхаузер Х. Ф.Вспышка токсического синдрома переднего сегмента после операции по удалению катаракты, связанная с примесями во влаге пара автоклава. Инфекционный контроль Hosp Epidemiol 2006; 27: 294–298
13. Берлев Дж. Уход и обращение с офтальмологическими микрохирургическими инструментами, 2-е изд. Сан-Франциско, Калифорния, Американское общество офтальмологических дипломированных медсестер, 2006: 1-60
14. Mamalis N. Синдром токсичного переднего сегмента: роль ферментных детергентов, используемых при очистке внутриглазных хирургических инструментов [редакционная статья]. J Cataract Refract Surg 2016; 42: 1249–1250.Доступно по адресу: http://www.jcrsjournal.org/article/S0886-3350(16)30328-5/pdf. По состоянию на 17 марта 2018 г..
. 15. Парих С., Сиппи Б.Д., Мартин Д.Ф., Эдельхаузер Х.Ф. Действие детергентов ферментативной стерилизации на эндотелий роговицы. Arch Ophthalmol 2002; 120: 165–172. Доступно по адресу: http://archopht.jamanetwork.com/article.aspx?articleid=269553. По состоянию на 17 марта 2018 г..
. 16. Мамалис Н., Эдельхаузер Х.Ф., Доусон Д.Г., Чу Дж., Лебойер Р.М., Вернер Л. Синдром токсического переднего сегмента. J Cataract Refract Surg 2006; 32: 324–333
17.Катлер Пек С.М., Брубакер Дж., Клоузер С., Дэнфорд С., Эдельхаузер Х.Э., Мамалис Н. Синдром токсического переднего сегмента: частые причины. J Cataract Refract Surg 2010; 36: 1073–1080
18. Боднар З., Клоузер С., Мамалис Н. Синдром токсического переднего сегмента: обновленная информация о наиболее распространенных причинах. J Cataract Refract Surg 2012; 38: 1902–1910
19. Rutala WA. Дезинфекция и стерилизация времени ухода за пациентами. Инфекционный контроль Hosp Epidemiol 1996; 17: 377–384
20. Парих CH, Edelhauser HF. Глазная хирургическая фармакология: эндотелиальная безопасность и токсичность роговицы.Curr Opin Ophthalmol 2003; 14: 178–185
21. Беран РФ. Чистка офтальмологических алмазных скальпелей. J Refract Corneal Surg 1994; 10: 582–586
22. AORN. Рекомендуемые практики для оценки и выбора продуктов и медицинских устройств, используемых в периоперационной практике. AORN J 1998; 67: 270–272
23. Ассоциация по развитию медицинского оборудования. Вода для обработки медицинских устройств (AAMI TIR34: 2014 / (R) 2017). Арлингтон, штат Вирджиния, Ассоциация развития медицинского оборудования, 2017; 18
24.Рекомендации различных сообществ по переработке гибких эндоскопов желудочно-кишечного тракта: обновление 2016 г., Подготовлено: Целевой группой по разработке рекомендаций по повторной обработке, Бретом Т. Петерсеном Б.Т., Коэном Дж., Хамбриком Р.Д. III, Буттаром Н., Гринвальдом Д.А., Бускаглией Дж. М., Коллинзом Дж., Эйзеном Г. Gastrointesti Endosc 2017. ; 85: 282–294. Доступно по адресу: http://www.giejournal.org/article/S0016-5107(16)30647-2/pdf. По состоянию на 17 марта 2018 г.
25. Dinakaran S, Kayarkar VV. Мусор на обработанных офтальмологических инструментах: повод для беспокойства. Eye 2002; 16: 281−284. Доступно по адресу: http: // www.nature.com/eye/journal/v16/n3/pdf/6700132a.pdf. По состоянию на 17 марта 2018 г..
26. MacRae SM, Brown B, Edelhauser HF. Роговичная токсичность дооперационных кожных антисептиков. Am J Ophthalmol 1984; 97: 221–232,
27. Финни Р. Б., Мондино Б. Дж., Хофбауэр Д. Д., Мейслер Д. М., Лэнгстон Р. С., Форстот С. Л., Бенес СК. Отек роговицы, связанный со случайным воздействием Hibiclens. Am J Ophthalmol 1988; 106: 210–215
28. Tsaousis KT, Werner L, Reiter N, Perez JP, Li HJ, Guan JJ, Mamalis N. Сравнение различных типов насадок для факоэмульсификации.II. Морфологические изменения, вызванные многократными циклами стерилизации паром с использованием ферментных моющих средств и без них. J Cataract Refract Surg 2016; 42: 1353–1360
29. Миллер С.Х., Ригген С.Д., Шелдрейк Массачусетс, Ниб Дж. М.. Наличие микроорганизмов в использованных растворах для ультразвуковой очистки. Am J Dent 1993; 6: 27–31
30. Центры по контролю и профилактике заболеваний. Руководство по контролю за инфекциями окружающей среды в медицинских учреждениях; Рекомендации CDC и Консультативного комитета по практике инфекционного контроля (HICPAC), 2003 г.Доступно по адресу: https://www.cdc.gov/infectioncontrol/pdf/guidelines/environmental-guidelines.pdf. По состоянию на 17 марта 2018 г..
31. Tsaousis KT, Werner L, Paulo-Perez J, Li HE, Reiter N, Guan JJ, Mamalis N. Сравнение различных типов наконечников для факоэмульсификации. I. Количественный анализ элементного состава и микрошероховатости поверхности иглы. J Cataract Refract Surg 2016; 42: 1345–1352
32. Tsaousis KT, Chang DF, Werner L, Perez JP, Guan JJ, Reiter N, Li HJ, Mamalis N. Сравнение различных типов советов по факоэмульсификации: III.Морфологические изменения, вызванные после многократного использования на модели ex vivo. J Cataract Refract Surg 2018; 44: 91–97
33. Чеккини П., Д’Алоизио Р., Антонуччио М., Турко Дж., Бондино Ф., Маньяно Э., Ди Никола М., Тоннетто Д. Химический и физический анализ поверхности факонакопителей до и после операции по удалению катаракты. J Cataract Refract Surg 2017; 43: 1107–1114
34. Мамалис Н. Снижение воздействия хирургии катаракты на окружающую среду. Экологичность против безопасности: компромисс? [от редакции] J Cataract Refract Surg 2018; 44: 1-2.Доступно по адресу: http://www.jcrsjournal.org/article/S0886-3350(18)30021-X/pdf. По состоянию на 17 марта 2018 г.
35. AORN. Экспликации для периоперационного ухода. В кн .: Ассоциация медсестер операционной. Стандарты, рекомендуемая практика и руководящие принципы. Денвер, Колорадо, АОРН, 2006; 167–197
36. Чанг Д.Ф., Херли Н., Мамалис Н., Уитман Дж. Оценка стерильности офтальмологических хирургических инструментов с использованием короткоцикловой стерилизации для последовательного использования в тот же день. Офтальмология 2018; 125: в печати. Доступно по адресу: http: // www.aaojournal.org/article/S0161-6420(18)30341-5/pdf По состоянию на 28 марта 2018 г.
37. Центры услуг Medicare и Medicaid. Изменение терминологии и обновление меморандума об освидетельствовании и сертификации (S&C) 09-55 в отношении немедленной стерилизации паром (IUSS) в хирургических учреждениях. Центр клинических стандартов и качества / Группа исследований и сертификации; 2014. Доступно по адресу: http://www.cms.gov/Medicare/Provider-Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-44.pdf. По состоянию на 17 марта 2018 г..
38. Учебная сеть Medicare. MLN подключается. Провайдер eNews, 26 февраля 2015 г., https://www.cms.gov/Outreach-and-Education/Outreach/FFSProvPartProg/Downloads/2015-02-26-eNews-.pdf. По состоянию на 17 марта 2018 г..
39. Association for the Advancement of Medical Instrumentation. Немедленная стерилизация паром. Доступно по адресу: https://www.aami.org/publications/standards/ST79_Immediate_Use_Statement.pdf. По состоянию на 17 марта 2018 г..
40. Ван Х., Хортон Р. Решение проблемы изменения климата: величайшая возможность для глобального здравоохранения [комментарий].Ланцет 2015; 386: 1798–1799. Доступно по адресу: https://climatehealthcommission.files.wordpress.com/2015/04/commentary-richard-horton-and-helena-wang.pdf. По состоянию на 17 марта 2018 г..
41. Eckelman MJ, Sherman J. Влияние системы здравоохранения США на окружающую среду и влияние на общественное здоровье. PLoS One 2016; 11 (6): e0157014. Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4
. 42. Моррис Д.С., Райт Т., Сомнер JEA, Коннор А. Углеродный след хирургии катаракты.Глаз 2013; 27: 495–501. Доступно по адресу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3626018/pdf/eye20139a.pdf. По состоянию на 17 марта 2018 г..
43. Venkatesh R, van Landingham SW, Khodifad AM, Haripriya A, Thiel CL, Ramulu P, Robin AL. Углеродный след и экономическая эффективность хирургии катаракты. Curr Opin Ophthalmol 2016; 27: 82–88
44. Тиль С.Л., Шехлейн Э., Равилла Т., Равиндран Р.Д., Робин А.Л., Саеди О.Дж., Шуман Дж.С., Венкатеш Р. Хирургия катаракты в экологической устойчивости: отходы и оценка жизненного цикла факоэмульсификации в частном медицинском учреждении.J Cataract Refract Surg 2017; 43: 1391–1398
45. Американская академия офтальмологии. Катаракта глаза взрослого; Preferred Practice Pattern®. Сан-Франциско, Калифорния, Американская академия офтальмологии, 2016 г. Доступно по адресу: http://www.aaojournal.org/article/S0161-6420(16)31418-X/pdf. По состоянию на 17 марта 2018 г..
46. Равиндран Р.Д., Венкатеш Р., Чанг Д.Ф., Сенгупта С., Гьятшо Дж., Талвар Б. Заболеваемость посткатарактным эндофтальмитом в глазной больнице Аравинд; результаты более чем 42 000 последовательных случаев с использованием стандартизированных протоколов стерилизации и профилактики.J Cataract Refract Surg 2009; 35: 629–636
47. Хариприя А., Чанг Д. Ф., Равиндран Р. Д.. Снижение эндофтальмита с помощью внутрикамерной профилактики моксифлоксацином; анализ 600 000 операций. Офтальмология 2017; 124: 768–775
48. Чанг Д.Ф., Хариприя А., Равиндран Р.Д. Ответ на письмо RE: Снижение эндофтальмита с помощью внутрикамерной профилактики моксифлоксацином: анализ 600 000 операций. Офтальмология 2017; 124: e78 – e79. Доступно по адресу: http://www.aaojournal.org/article/S0161-6420(17)30748-0/pdf. По состоянию на 17 марта 2018 г.
49.Харипирья А, Чанг Д.Ф. Внутрикамерные антибиотики во время операции по удалению катаракты: доказательства и препятствия. Curr Opin Ophthalmol 2018; 29: 33–39
Прочие цитируемые материалы
A. Практика Greenhealth. Путь к устойчивому здравоохранению через практику Greenhealth, более здоровые больницы. Доступно по адресу: https://practicegreenhealth.org/tools-resources/healthier-hospitals. По состоянию на 18 марта 2018 г..
B. Здравоохранение без вреда. Доступно на: https://noharm.org/. Доступ 18 марта 2018 г.
Одобрения
Целевая группа по очистке и стерилизации офтальмологических инструментов (OICS)
Сопредседатели: Дэвид Ф.Чанг, доктор медицины, Ник Мамалис, доктор медицины
Члены рабочей группы OICS:
Американское общество катарактальной и рефракционной хирургии (ASCRS): Роберт Дж. Чионни, доктор медицины, Ричард С. Хоффман, доктор медицины, Фрэнсис С. Ма, доктор медицины, Нил Х. Шорштейн, доктор медицины, Нэнси К. Макканн, Директор по связям с правительством, Джойс Дж. Д’Андреа, COMT, директор Allied Health Education
Американская академия офтальмологии (AAO): Майкл X. Репка, доктор медицины, магистр делового администрирования, Флора Лам, доктор медицины, вице-президент, Отдел качества и науки
Общество амбулаторной офтальмохирургии (OOSS): Джеффри Уитман, доктор медицины, Майкл А.Романски, JD, Вашингтонский советник, Никки Херли, RN, MBA, COE
© 2018 Американская академия офтальмологии ®
P.O. Box 7424 / San Francisco, CA 94120 / 415.561.8500
A Пошаговое руководство по стерилизации инструментов — Инфекционный контроль
включает «_nav_tab.php». Существует три метода стерилизации: стерилизация паром (также известная как «автоклавирование» или «влажное тепло под давлением»), стерилизация сухим жаром (электрическая печь) и химическая («холодная») стерилизация.Обратите внимание, что если в вашем учреждении выполняются какие-либо процедуры, связанные с контактом с кровотоком или тканями под кожей, у вас должно быть более одного метода стерилизации, который можно использовать в качестве резервного, если ваше оборудование выходит из строя, расходуются расходные материалы или отсутствует электричество.
Вот обзор ключевых последовательностей событий, необходимых для выполнения различных типов стерилизации, а также дезинфекции высокого уровня. Советы адаптированы из всеобъемлющего бесплатного курса повышения квалификации, разработанного EngenderHealth (writeOutLink («www.engenderhealth.org/ip/instrum/in11.html»,1)). эхо «
»; echo «». strtoupper («Предстерилизационная упаковка.»). «
«;
Обертывание предметов перед стерилизацией паром и сухим жаром помогает снизить вероятность их загрязнения перед использованием. Чтобы обернуть инструменты и другие предметы для стерилизации паром, используйте два слоя бумаги, газетной бумаги, муслина или хлопчатобумажной ткани. Не используйте холст для стерилизации паром, так как пар не может проникнуть в этот материал. При упаковке предметов для стерилизации сухим жаром используйте фольгу, двухслойную хлопчатобумажную ткань или муслиновую ткань.
- Шаг 1
Поместите инструмент или другой предмет в центр верхней обертки. Обертку следует расположить так, чтобы точки, а не плоские края, находились сверху, снизу и по бокам. - Шаг 2
Сложите нижнюю часть верхней обертки к центру и загните кончик. - Шаг 3
Сложите левую часть к центру и загните острие. - Step 4
Согните правую часть к центру и загните острие. - Шаг 5
Сложите верхнюю часть к центру и загните острие. Шаг 6
Сложите нижнюю часть нижней обертки к центру и загните кончик. - Шаг 7
Сложите левую часть к центру и загните острие. - Шаг 8
Сложите правую часть к центру и загните острие. - Шаг 9
Сложите верхнюю часть к центру и загните острие. - Шаг 10
Подоткните острие под правую и левую секции. Шаг 11
Надежно закрепите складки с помощью автоклавной ленты, если таковая имеется.
» .strtoupper («Автоклавирование»). «
»;
- Шаг 1
Обеззараживайте, очищайте и сушите все инструменты и другие предметы, подлежащие стерилизации. - Step 2
Откройте или разблокируйте все сочлененные инструменты и другие предметы, такие как кровоостанавливающие зажимы и ножницы, и разберите те, у которых есть скользящие или состоящие из нескольких частей.Это позволяет пару достигать всех поверхностей изделия. Избегайте плотного расположения инструментов и других предметов, так как это предотвратит попадание пара на все поверхности. - Шаг 3
Оберните инструменты. - Step 4
Расположите все упаковки, барабаны или развернутые предметы в камере автоклава так, чтобы пар мог свободно циркулировать. - Step 5
Примечание. Единицы измерения давления, указанные на манометре автоклава, могут отличаться от одного автоклава к другому.Следующие значения давления (которые приблизительно эквивалентны) являются желаемым давлением для автоклавирования:- 15 фунтов / дюйм2 (15 фунтов на квадратный дюйм)
- 106 кПа (106 килопаскалей)
- 1 атм (1 атмосфера)
- 1 кгс / см2 (1 килограмм силы на квадратный сантиметр)
- 776 торр
- 776 мм рт. Ст. (776 миллиметров ртутного столба)
- Шаг 6
Если автоклав автоматический, нагрев отключится, и давление начнет падать после завершения цикла стерилизации.Если автоклав не автоматический, выключите нагрев или снимите автоклав с источника тепла через 30 минут, если предметы обернуты, и через 20 минут, если предметы неупакованы. Подождите, пока манометр не покажет «ноль», чтобы открыть автоклав. Откройте крышку или дверцу, чтобы выпустить оставшийся пар. Оставьте пакеты с инструментами или предметы в автоклаве до полного высыхания, что может занять до 30 минут. Примечание: предметы необходимо снимать насухо. После извлечения из автоклава влажные пакеты втягивают микроорганизмы из окружающей среды и должны считаться загрязненными. - Шаг 7
Удалите упаковки, барабаны или развернутые предметы из автоклава, используя стерильные съемники.Чтобы предотвратить образование конденсата после извлечения пакетов или бочек из автоклава, поместите их на поверхность, покрытую стерильной бумагой или тканью, пока они не остынут. Перед хранением подождите, пока пачки, бочки или предметы не достигнут комнатной температуры (это может занять до нескольких часов). - Шаг 8
Храните предметы правильно.
» .strtoupper («Стерилизация сухим жаром»). «
«;
- Шаг 1
Шаг 2
Либо 1) оберните инструменты и другие предметы фольгой, двухслойной хлопчатобумажной тканью или муслиновой тканью; 2) кладите неупакованные инструменты и другие предметы на поднос или полку; или 3) поместите инструменты и другие предметы в металлический контейнер с крышкой. - Шаг 3
Поместите инструменты и другие предметы в духовку и нагрейте до заданной температуры. В духовке должен быть термометр или датчик температуры, чтобы гарантировать достижение заданной температуры.Используйте приведенный здесь список, чтобы определить подходящее время стерилизации для инструментов. Время отражает продолжительность стерилизации инструмента при соответствующей температуре.
- 170 ‘C (340’ F) — 1 час
- 160 ‘C (320’ F) — 2 часа
- 150 ° C (300 ° F) — 2.5 часов
- 140 ° C (285 ° F) — 3 часа
Примечание: поскольку сухой жар может затупить острые инструменты и иглы, эти предметы не следует стерилизовать при температуре выше 160 ° C.
- Шаг 4
Дайте предметам остыть в духовке, прежде чем вынимать их. Когда они остынут, извлеките предметы стерильными пикапами и немедленно используйте или храните. - Шаг 5
Храните предметы правильно.
» .strtoupper («Химическая (« холодная ») стерилизация»).«
»; Химическая стерилизация используется для инструментов и других предметов, которые чувствительны к нагреванию или когда методы, требующие тепла, недоступны. Предметы стерилизуются путем замачивания их в определенном химическом растворе (например, содержащем глутаровый альдегид) с последующим ополаскиванием в стерильной воде.
|
- Шаг 1
Обеззараживайте, очистите и тщательно высушите все инструменты и другие предметы, подлежащие стерилизации. Вода из влажных вещей разбавит химический раствор, тем самым снизив его эффективность. - Step 2
Приготовьте глутаральдегид (или другой химический раствор), следуя инструкциям производителя — или используйте раствор, который был приготовлен ранее, если он прозрачный (не мутный) и не просрочен.После приготовления раствора переложите его в чистую емкость с крышкой. Всегда отмечайте контейнер с датой приготовления раствора и датой истечения срока его годности.Примечание. Большинство имеющихся в продаже растворов глутаральдегида можно использовать в течение как минимум двух недель после приготовления. Следуйте инструкциям производителя. В идеале следует использовать индикаторную полоску каждый раз, когда нужно использовать раствор, чтобы определить, действительно ли раствор по-прежнему эффективен.
- Шаг 3
Откройте все навесные инструменты и другие предметы и разберите те, которые имеют выдвижные или составные части.Для обеспечения стерилизации раствор должен контактировать со всеми поверхностями. Полностью погрузите в раствор все инструменты и другие предметы. Все части предметов должны находиться под поверхностью раствора. Поставьте все миски и емкости вертикально, а не вверх дном, и залейте раствором. - Step 4
Следуйте инструкциям производителя относительно времени, необходимого для стерилизации. Как правило, если раствор содержит глутаральдегид, накройте контейнер и дайте инструментам и другим предметам впитаться не менее 10 часов.Не добавляйте и не удаляйте какие-либо элементы в раствор после того, как начался отсчет времени. - Шаг 5
Извлеките предметы из раствора, используя большие стерильные пипетки. - Step 6
Тщательно промойте стерильной водой, чтобы удалить остатки химических стерилизаторов на предметах. Этот остаток токсичен для кожи и тканей.Примечание: кипяченая вода не стерильна; кипячение не гарантирует уничтожения бактериальных эндоспор.
- Шаг 7
Храните предметы правильно.
» .strtoupper («Дезинфекция высокого уровня (ДВУ)»). «
»; Когда стерилизация недоступна или неосуществима, дезинфекция высокого уровня (HLD) становится третьим шагом в обработке инструментов. ДВУ — это не то же самое, что стерилизация. HLD уничтожает бактерии, вирусы, грибки и паразитов, но не убивает все бактериальные эндоспоры, вызывающие такие заболевания, как столбняк и газовая гангрена. HLD подходит для предметов, которые будут контактировать с поврежденной кожей или неповрежденными слизистыми оболочками.
Многие учреждения используют метод HLD в качестве резервной копии основного метода стерилизации. Существует три метода ДВУ: кипячение, химическое ДВУ и пропаривание.
- Кипячение. Кипячение — это простой метод ДВУ, который может выполняться в любом месте, где есть доступ к чистой воде и источнику тепла. Используя этот метод, инструменты и другие предметы помещают в кастрюлю или бойлер, а воду нагревают до кипения в течение 20 минут.
- Химическая ДВУ. Химическая ДВУ, как и химическая стерилизация, используется для термочувствительных предметов, таких как лапароскопы, или когда источник тепла недоступен.Химический ДВУ отличается, потому что: —Для ДВУ можно использовать глутаральдегид или хлор. (Хлор нельзя использовать для стерилизации или для HLD лапароскопов или других эндоскопов.) —Время замачивания короче для HLD —Предметы ДВУ можно ополаскивать кипяченой водой. (Стерилизованные предметы необходимо ополаскивать стерильной водой.) —В большинстве случаев единственными химическими веществами, подходящими для ДВУ, являются хлор и глутаральдегид. Никогда не используйте спирт, карболовую кислоту (например, лизол, фенол), глюконат хлоргексидина с цетримидом (например, савлон), глюконат хлоргексидина (например, гибитан, гибискраб), хлороксиленол (например, деттол), перекись водорода или йодофоры (например, бетадин). .
- Варка на пару. Предметы готовятся в пароварке, состоящей из одного-трех ярусов. Обработка паром — лучший метод HLD для перчаток и полезный метод HLD для канюль, используемых во время ручной вакуумной аспирации (MVA). Хотя канюли MVA можно обрабатывать другими методами, ДВУ перчаток другими методами менее целесообразно, поскольку: —Перчатки могут подвергнуться ДВУ при кипячении, но это не рекомендуется, поскольку трудно высушить перчатки должным образом, не загрязнив их. При необходимости HLD перчатки путем кипячения перчатки можно носить мокрыми. — Использование химикатов для перчаток HLD непрактично, так как их сложно смыть должным образом с остатков химикатов.
» .strtoupper («Обычные дезинфицирующие средства высокого уровня»). «
«; Двумя химическими веществами, наиболее доступными в большинстве стран с ограниченными ресурсами, которые подходят для HLD инструментов и других предметов, являются хлор и глутаральдегид.
- Хлор. Эффективен против широкого спектра микроорганизмов, включая туберкулезные микроорганизмы.
 Методы, средства и режимы» Он утвержден приказом Министерства здравоохранения СССР № 770 и действует до сих пор.
Методы, средства и режимы» Он утвержден приказом Министерства здравоохранения СССР № 770 и действует до сих пор. 2.1/2.1.1.1278-03 «Гигиенические требования к естественному, искусственному и совмещенному освещению жилых и общественных зданий»
2.1/2.1.1.1278-03 «Гигиенические требования к естественному, искусственному и совмещенному освещению жилых и общественных зданий»
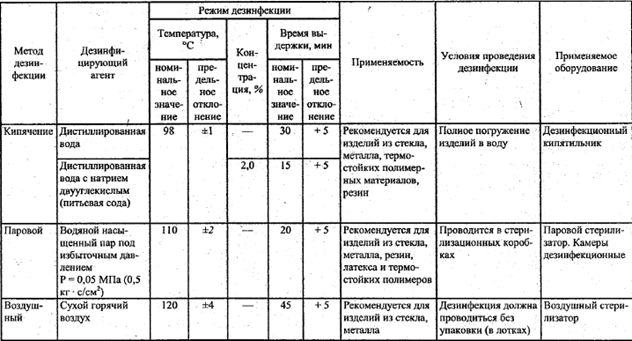

 Для бережной стерилизации большого количества мелкого инструмента.
Для бережной стерилизации большого количества мелкого инструмента.