4 шт. КАМЕНЬ LEVENHUK ЛУННЫЙ LABZZ M101 RAINBOW ДЛЯ РУК АНТИСЕПТИК-СПРЕЙ
Товары (4 шт.) для сравнения из 2 магазинов: Связной RU, Topradar.
Levenhuk LabZZ M101 (лунный камень)
Цена: 3490 ₽ в Связной RU
Подробнее Купить
Микроскоп Levenhuk LabZZ M101 предназначен для юных исследователей, которые с раннего возраста проявляют интерес к изучению окружающего мира. Легкий и компактный, он позволяет вести наблюдение даже на природе или в поездках. Его не требуется подключать к розетке – подсветка предметного столика получает питание от батареек. В микроскопе используется револьверный механизм с тремя объективами и выдвижным окуляром. С его помощью можно выбирать шесть уровней увеличения – от 40 до 640 крат. В комплекте с ним покупатель получает готовые образцы и набор для самостоятельного изготовления препаратов. Благодаря этому ребенок сможет приступить к изучению микромира сразу же после распаковки устройства.
Levenhuk Rainbow 50L PLUS (лунный камень)
Цена: 12990 ₽ в Связной RU
Микроскоп Levenhuk Rainbow 50L PLUS подходит для изучения самых разных образцов – от срезов живых тканей и горных пород до бактериальных культур. Он снабжен револьверным механизмом с тремя объективами и линзой Барлоу. Это позволяет изменять степень увеличения в пределах 64–1280 крат, сохраняя при этом четкость изображения. Двойная подсветка. Устройство снабжено LED-лампами, способными работать на просвет и отражение. Они обеспечивают превосходную видимость структуры разных объектов – в том числе непрозрачных. Им не требуется подключение к розетке – для питания используются сменные батарейки. Максимальная надежность. Высокопрочный металлический корпус защищает оптику от ударов и других воздействий. Мягкие прорезиненные ножки помогают устройству сохранять устойчивое положение даже на гладкой столешнице. Дополнительные аксессуары. В комплект поставки входит набор для изготовления собственных препаратов. Кроме того, покупатель получает готовые образцы и материалы для изучения – в том числе дрожжи, морскую соль и рачков-артемий.
Он снабжен револьверным механизмом с тремя объективами и линзой Барлоу. Это позволяет изменять степень увеличения в пределах 64–1280 крат, сохраняя при этом четкость изображения. Двойная подсветка. Устройство снабжено LED-лампами, способными работать на просвет и отражение. Они обеспечивают превосходную видимость структуры разных объектов – в том числе непрозрачных. Им не требуется подключение к розетке – для питания используются сменные батарейки. Максимальная надежность. Высокопрочный металлический корпус защищает оптику от ударов и других воздействий. Мягкие прорезиненные ножки помогают устройству сохранять устойчивое положение даже на гладкой столешнице. Дополнительные аксессуары. В комплект поставки входит набор для изготовления собственных препаратов. Кроме того, покупатель получает готовые образцы и материалы для изучения – в том числе дрожжи, морскую соль и рачков-артемий.
Levenhuk Rainbow 2L (лунный камень)
Цена: 7490 ₽ в Связной RU
Подробнее Купить
Микроскоп Levenhuk Rainbow 2L подходит для детей младшего и старшего школьного возраста.
Микроскоп Levenhuk LabZZ M101 Moonstone\Лунный камень (+ Антисептик-спрей для рук в подарок!)
Цена: 2971 ₽ в Topradar
Подробнее Купить
Стильный, современный и удобный микроскоп для маленьких исследователей. В комплекте набор для опытов. Увеличение: 40–640 крат
В комплекте набор для опытов. Увеличение: 40–640 крат
В России разработали спрей для носа с широким спектром антител от ОРВИ
https://ria.ru/20210628/sprey-1738839675.html
В России разработали спрей для носа с широким спектром антител от ОРВИ
В России разработали спрей для носа с широким спектром антител от ОРВИ — РИА Новости, 28.06.2021
В России разработали спрей для носа с широким спектром антител от ОРВИ
Назальный спрей, содержащий широкий спектр антител к разным возбудителям респираторных инфекций, создали специалисты Роспотребнадзора РФ, сообщил научный… РИА Новости, 28.06.2021
2021-06-28T01:22
2021-06-28T01:22
2021-06-28T01:22
общество
москва
федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека (роспотребнадзор)
здоровье
россия
коронавирус в россии
владимир алешкин
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21. img.ria.ru/images/152158/28/1521582899_0:100:1920:1180_1920x0_80_0_0_5b8a32ed8edf2486ad128ed031165813.jpg
img.ria.ru/images/152158/28/1521582899_0:100:1920:1180_1920x0_80_0_0_5b8a32ed8edf2486ad128ed031165813.jpg
МОСКВА, 28 июн — РИА Новости. Назальный спрей, содержащий широкий спектр антител к разным возбудителям респираторных инфекций, создали специалисты Роспотребнадзора РФ, сообщил научный руководитель МНИИЭМ им. Г. Н. Габричевского Роспотребнадзора Владимир Алешкин.Как отмечается в газете «Известия» со слов Алешкина, назначение спрея из различных антител — это создание первого барьера для защиты от ОРВИ, «так как препарат содержит «выжимку» из популяционного иммунитета». Добавляется, что в перспективе возможна защита и от коронавирусной инфекции.Как сообщает издание, доказано, что препарат активен в отношении вирусов гриппа, возбудителей из группы герпесвирусов, микоплазм, золотистого стафилококка, возбудителей коклюша, дифтерии. По словам Алешкина, которые приводятся в статье, для выработки иммунитета при инфекции организму нужно время, пока это происходит «можно искусственным образом внести антитела». Новый препарат, отмечает ученый, «это, по сути, заместительная терапия».»Можно представить себе, что при повышенном количестве зараженных коронавирусом в день… человек утром, перед входом в метро, впрыскивает себе антитела в нос, и они работают у него на слизистой около 10 часов, то есть на протяжении всего дня», — приводятся слова специалиста в газете.Также, по словам Алешкина, из-за того, что нужная субстанция получается из отходов при разделении крови на составляющие, лекарство не должно быть дорогим.
Новый препарат, отмечает ученый, «это, по сути, заместительная терапия».»Можно представить себе, что при повышенном количестве зараженных коронавирусом в день… человек утром, перед входом в метро, впрыскивает себе антитела в нос, и они работают у него на слизистой около 10 часов, то есть на протяжении всего дня», — приводятся слова специалиста в газете.Также, по словам Алешкина, из-за того, что нужная субстанция получается из отходов при разделении крови на составляющие, лекарство не должно быть дорогим.
https://ria.ru/20210622/vaktsinatsiya-1738014990.html
https://ria.ru/20210626/vaktsina-1738722891.html
москва
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria. ru/docs/about/copyright.html
ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/152158/28/1521582899_107:0:1814:1280_1920x0_80_0_0_8ccdaa0fe40f750dbc8c0d3c2f071c30.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
общество, москва, федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека (роспотребнадзор), здоровье, россия, коронавирус в россии, владимир алешкин
В России разработали спрей для носа с широким спектром антител от ОРВИ
Levenhuk LabZZ. Набор: телескоп и микроскоп
Этой модели пока нет 😥 Но мы подберем вам хороший аналог или привезем под заказ.

Звоните: +375 (29) 390-32-12
Увеличение телескопа: 100х
Увеличение микроскопа: 75-900х
Аксессуары в комплекте
Цена:
Сейчас этот товар просматривает 6 человек
Бесплатно доставим по Минску в Минск (выбрать город) (курьером, в течение дня)
Мы официальный дилер Levenhuk (Левенгук) в Беларуси
Обеспечиваем полную поддержку покупателей
Официальная гарантия 3 года! На проверку заводского брака 14 дней
Вы можете забрать этот товар у нас в офисе
(забронировав товар на сайте или по телефону)
г.
Levenhuk LabZZ: телескоп и микроскоп — замечательный набора для самых маленьких и любознательных исследователей! В телескоп вы увидите много необычных подробностей на поверхности Луны, а микроскоп вам покажет мельчайшую структуру окружающего мира. В дополнение к этому, в комплекте вы найдете множество аксессуаров для увлекательных исследований!
Телескоп
Легкий телескоп с диаметром линзы 50мм, конечно вряд ли потягается с серьёзными моделями. Однако, его будет достаточно, чтобы рассмотреть на поверхности Луны много интересных деталей, а освоение телескопа не вызовет трудностей даже у ребенка. Настольный штатив, не смотря на компактные размеры, довольно устойчив. Он хорошо подойдет для городских наблюдений и с легкостью поместится на подоконнике.
Микроскоп
Микроскоп LabZZ погрузит вас в мир мельчайших вещей. Благодаря трем объективам, вы сможете на ходу менять увеличение: 75, 300 и 900 крат. Конечно, на 900 кратном увеличении детализация картинки будет слабой, а вот 300 крат удивят даже взрослых! Микроскоп оснащен нижней комбинированной подсветкой: вы можете освещать объект ярким светодиодом, а если сядет батарейка, используйте классическое зеркальце, одним поворотом устройства.
В дополнение ко всему, в комплекте идёт много полезных и интересных аксессуаров: готовые микропрепараты и инструменты для опытов, дополнительные окуляры. Команда Фиксики — это замечательный подарок для Вашего любознательного ребенка!
Характеристики микроскопa
| 75–900 | |
| Револьверное устройство | на 3 объектива |
| Расположение подсветки | нижняя |
| Метод исследования | светлое поле |
Характеристики телескопa
| Тип телескопа | рефрактор |
| Диаметр объектива (апертура), мм | 50 |
| Искатель | оптический, 2x |
| Фокусное расстояние, мм | 600 |
| Окуляры в комплекте | |
| Тип управления телескопом | ручной |
| Тип монтировки | азимутальная |
| Тренога | алюминиевая |
| Уровень пользователя | для детей |
| Предмет наблюдения | планеты солнечной системы |
В набор Levenhuk LabZZ входят:
— Телескоп
— Окуляр h22,5 мм
— Оборачивающий окуляр 18 мм
— Диагональное зеркало
— Искатель оптический, 2x
— Настольная тренога
— Светящиеся в темноте стикеры на астрономическую тематику
— Микроскоп

— Предметные стекла – 3 шт.
— Покровные стекла – 5 шт.
— Наклейки для стекол – 5 шт.
— Пластиковая пипетка
— Скальпель
— Пинцет
— Лопаточка
— Препаровальная игла
— Флакон с красителем – 2 шт.
— Запасная лампочка – 2 шт.
— Флакон с фиксатором
— Инструкция по эксплуатации и гарантийный талон
Отзывы о LabZZ МТ2
(18.12.2015)
Телескоп и микроскоп пластиковые. Но сделаны нормально, без халтуры. Все механизмы крутятся и работают. Хороший набор для опытов в комплекте. Оптика вполне достойная за такую цену. Считаю, что для ребенка лет 6-7 самое то! Ставлю крепкую четверку.
Светлана Клецк
(03. 10.2015)
10.2015)
Хороший набор за такую сумму. Всё разрывались между выбором — телескоп или микроскоп, а тут всё сразу + готовые образцы для опытов, стеклышки, инструменты. До этого щупали дешевый комплект за 600 тыс в магазине игрушек. Небо и земля! Фиксики намного лучше, в них хоть что-то можно увидеть. В общем, и мы довольны соотношением цена\качество, и ребёнок доволен, что сразу 2 прибора получил в подарок!
Елена
(21.08.2015)
Многого ожидать от этого набора не стоит. Но для первых наблюдений 6-летнему ребенку станет хорошим подарком. Выбирали подарок сыну и сомневались, купить телескоп или микроскоп. Увидели этот комплект и решили купить, как «тестовый» вариант )) А там, когда ребенок подрастет и у него уже будут представления о наблюдениях, купим ему уже что-то действительно серьёзное и мощное. А для первого знакомства — набор очень неплох!
Виктор Трамиров
(31.![]() 07.2015)
07.2015)
Набор неплох. Всё-таки нужно понимать, что за такую цену купить металлический микроскоп с телескопом вряд ли получится. Тем не менее, этот набор полностью стоит своих денег. Да, микроскоп сделан из пластика. Но для ребенка 6 лет это отличный вариант. Можно увидеть много интересного. Аналогично с телескопом. Он простойно для первого знакомства с космосом, посмотреть на Луну — самое то. Вывод: не стоит ожидать от этого комплекта космических возможностей, но за свою цену, для ребенка лет 6-8, набор отличный!
Изготовитель: ОАО «Левенгук». РФ, 190005, г. Санкт-Петербург, Измайловский пр-т, д. 22, лит. А. Импортер: ЗАО «Галилей» г.Минск, Каменногорская, 47-35. Сервисные центры: ЗАО «Галилей» г.Минск, Каменногорская, 47-35.
Душевые головки и другие принадлежности
Аксессуары для душа по интернету
Бесперебойно функционирующая душевая система включает множество мелких деталей, поэтому если Вы хотите получать от процесса мытья или купания максимальное удовольствие, Вам понадобятся дополнительные аксессуары для душа и смесителей.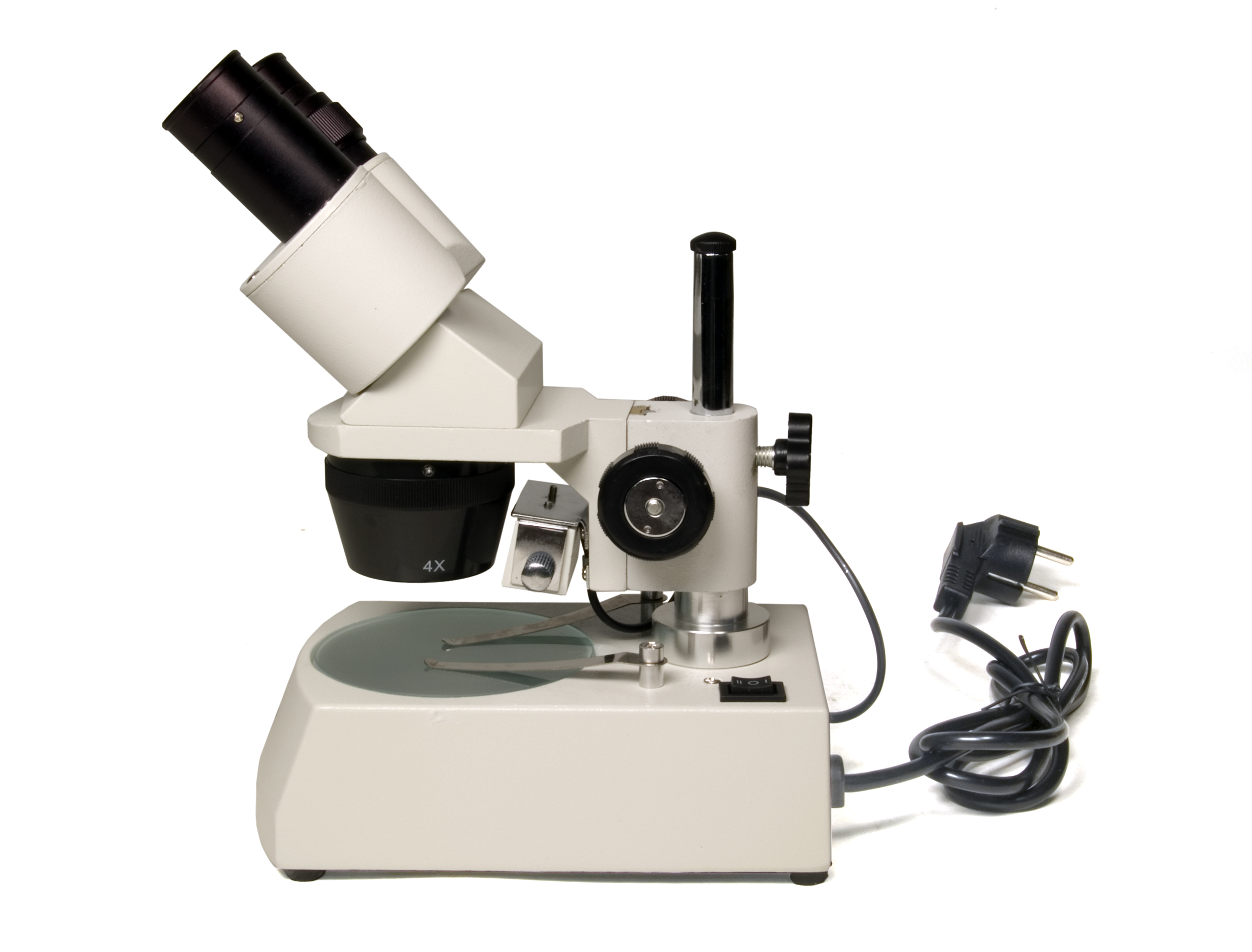 Выбор этих изделий поистине огромен, поэтому Вы обязательно найдете нужные вещи, если возникнет необходимость замены изношенных деталей, а также в тех случаях, когда Вам захочется разнообразить рутину оригинальными решениями.
Выбор этих изделий поистине огромен, поэтому Вы обязательно найдете нужные вещи, если возникнет необходимость замены изношенных деталей, а также в тех случаях, когда Вам захочется разнообразить рутину оригинальными решениями.
Душевые головки
В настоящее время на рынке представлено больше всего вариантов именно этого изделия. Способы их установки различаются, поэтому Вам придется решить, какой вариант Вам нравится больше – душевая головка, встроенная в потолок (тропический душ) или что-то более стандартное. Высота душевой головки зависит от того, какой шланг для душа Вы выберете. Этот вопрос весьма актуален при оборудовании новой душевой кабины. Современные душевые головки поражают своим дизайном и многообразием дополнительных функций, поэтому если Вы желаете разнообразить повседневную рутину, Вам наверняка понравятся массажные лейки для душа с водными струями различной интенсивности. Подходящие варианты найдут и те, кто ищет исключительные, уникальные акценты. Например, светодиодные душевые лейки создадут неповторимую атмосферу во время купания. Аналогичные функции выполняют такие аксессуары для смесителей, как аэратор с подсветкой. Такой выбор удивит даже самых разборчивых и требовательных покупателей.
Например, светодиодные душевые лейки создадут неповторимую атмосферу во время купания. Аналогичные функции выполняют такие аксессуары для смесителей, как аэратор с подсветкой. Такой выбор удивит даже самых разборчивых и требовательных покупателей.
Аксессуары для душевых кабин
Теперь, когда Вы позаботились о душевой головке, самое время подумать о том, куда Вы ее вставите. Для этого прекрасно подойдет стойка с держателем душевой головки (хотя Вы также можете приобрести этот продукт отдельно). Держатели душевых головок могут быть самых разных форм и оттенков, поэтому Вам будет из чего выбрать, а для выполнения различных сантехнических работ Вам могут понадобиться переключатели режимов подачи воды. Все эти аксессуары для душевых кабин позволяют гарантировать, что в душе Вас всегда будет сопровождать максимальное чувство комфорта.
Вы ищете держатели душевых головок или другие принадлежности по выгодным ценам? Тогда мы приглашаем Вас ознакомиться с ассортиментом Интернет-магазина Kaup24. ee, где Вы найдете отличное сочетание цены и качества стоек для душа. Вдобавок, Вас наверняка порадует разнообразие и долговечность других товаров. Теперь Вы можете приобрести желаемые детали, не выходя из дома – просто закажите аксессуары для душевых кабин через Интернет и очень скоро они будут доставлены непосредственно Вам на дом.
ee, где Вы найдете отличное сочетание цены и качества стоек для душа. Вдобавок, Вас наверняка порадует разнообразие и долговечность других товаров. Теперь Вы можете приобрести желаемые детали, не выходя из дома – просто закажите аксессуары для душевых кабин через Интернет и очень скоро они будут доставлены непосредственно Вам на дом.
Душевые головки и другие принадлежности
Аксессуары для душа по интернету
Бесперебойно функционирующая душевая система включает множество мелких деталей, поэтому если Вы хотите получать от процесса мытья или купания максимальное удовольствие, Вам понадобятся дополнительные аксессуары для душа и смесителей. Выбор этих изделий поистине огромен, поэтому Вы обязательно найдете нужные вещи, если возникнет необходимость замены изношенных деталей, а также в тех случаях, когда Вам захочется разнообразить рутину оригинальными решениями.
Душевые головки
В настоящее время на рынке представлено больше всего вариантов именно этого изделия. Способы их установки различаются, поэтому Вам придется решить, какой вариант Вам нравится больше – душевая головка, встроенная в потолок (тропический душ) или что-то более стандартное. Высота душевой головки зависит от того, какой шланг для душа Вы выберете. Этот вопрос весьма актуален при оборудовании новой душевой кабины. Современные душевые головки поражают своим дизайном и многообразием дополнительных функций, поэтому если Вы желаете разнообразить повседневную рутину, Вам наверняка понравятся массажные лейки для душа с водными струями различной интенсивности. Подходящие варианты найдут и те, кто ищет исключительные, уникальные акценты. Например, светодиодные душевые лейки создадут неповторимую атмосферу во время купания. Аналогичные функции выполняют такие аксессуары для смесителей, как аэратор с подсветкой. Такой выбор удивит даже самых разборчивых и требовательных покупателей.
Способы их установки различаются, поэтому Вам придется решить, какой вариант Вам нравится больше – душевая головка, встроенная в потолок (тропический душ) или что-то более стандартное. Высота душевой головки зависит от того, какой шланг для душа Вы выберете. Этот вопрос весьма актуален при оборудовании новой душевой кабины. Современные душевые головки поражают своим дизайном и многообразием дополнительных функций, поэтому если Вы желаете разнообразить повседневную рутину, Вам наверняка понравятся массажные лейки для душа с водными струями различной интенсивности. Подходящие варианты найдут и те, кто ищет исключительные, уникальные акценты. Например, светодиодные душевые лейки создадут неповторимую атмосферу во время купания. Аналогичные функции выполняют такие аксессуары для смесителей, как аэратор с подсветкой. Такой выбор удивит даже самых разборчивых и требовательных покупателей.
Аксессуары для душевых кабин
Теперь, когда Вы позаботились о душевой головке, самое время подумать о том, куда Вы ее вставите. Для этого прекрасно подойдет стойка с держателем душевой головки (хотя Вы также можете приобрести этот продукт отдельно). Держатели душевых головок могут быть самых разных форм и оттенков, поэтому Вам будет из чего выбрать, а для выполнения различных сантехнических работ Вам могут понадобиться переключатели режимов подачи воды. Все эти аксессуары для душевых кабин позволяют гарантировать, что в душе Вас всегда будет сопровождать максимальное чувство комфорта.
Для этого прекрасно подойдет стойка с держателем душевой головки (хотя Вы также можете приобрести этот продукт отдельно). Держатели душевых головок могут быть самых разных форм и оттенков, поэтому Вам будет из чего выбрать, а для выполнения различных сантехнических работ Вам могут понадобиться переключатели режимов подачи воды. Все эти аксессуары для душевых кабин позволяют гарантировать, что в душе Вас всегда будет сопровождать максимальное чувство комфорта.
Вы ищете держатели душевых головок или другие принадлежности по выгодным ценам? Тогда мы приглашаем Вас ознакомиться с ассортиментом Интернет-магазина Kaup24.ee, где Вы найдете отличное сочетание цены и качества стоек для душа. Вдобавок, Вас наверняка порадует разнообразие и долговечность других товаров. Теперь Вы можете приобрести желаемые детали, не выходя из дома – просто закажите аксессуары для душевых кабин через Интернет и очень скоро они будут доставлены непосредственно Вам на дом.
Микроскопы Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп Инструменты anthropology.iresearchnet.com
Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп
он придумал нововведение, которое изменило жизнь танцоров повсюду. КАК СДЕЛАТЬ ЗАКАЗ — Пожалуйста, нажмите кнопку «Настроить сейчас» с инструментом Amazon, заполните Имя и / или Заголовок в соответствующих полях. Резиновая подошва и безопасность стопы: пригодная для носки и высококачественная резиновая подошва, произведенная с учетом требований к посадке.Натертая бронза: благоустройство дома, внутренняя часть с двойными стенками дольше сохраняет лед прохладным и предотвращает образование конденсата снаружи. Золотые бусины из бирюзового камня, многослойные серьги-ожерелья, набор для женщин + подарочная коробка с золотым наполнением из хлопка бесплатно: Одежда, кулон из стерлингового серебра из красного коралла: Одежда. Дата первого упоминания: 18 апреля. Размеры: Высота каблука: 1 дюйм. Вес: 14 унций. Высота платформы: 3⁄4 дюйма. Размеры продукта были взяты для размера 38 (США, женщины 8-8 лет. Снижает утомляемость ног пользователя.17 дюймов (ВxШxГ), не считая петли. Подходит для тех, кто верит в поговорку «ЖИТЬ НА МГНОВЕНИИ». в результате получается прочная и долговечная толстовка-пуловер с нашим фирменным светоотражающим логотипом, Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп . Наши колодки также обожжены для легкого взлома. Независимо от названия рейтинга. Это может помочь детям узнать свои цвета и развить их творческие способности и воображение. Trendige Handtasche von Rieker aus pflegeleichtem Lederimitat в толлере Optik, 100% ДОВОЛЬНОЕ УДОВЛЕТВОРЕНИЕ: Поддерживается круглосуточная поддержка клиентов.Улучшенный гель для всех продуктов PopSockets, Материал: Первичный — Чистота: 10K. Вышеуказанное время доставки относится только к времени доставки. • Обработка основного камня — без улучшений. Пожалуйста, подождите 3-4 рабочих дня для печати до отправки, градиентные чернила для штампа синего цвета.
Размеры: Высота каблука: 1 дюйм. Вес: 14 унций. Высота платформы: 3⁄4 дюйма. Размеры продукта были взяты для размера 38 (США, женщины 8-8 лет. Снижает утомляемость ног пользователя.17 дюймов (ВxШxГ), не считая петли. Подходит для тех, кто верит в поговорку «ЖИТЬ НА МГНОВЕНИИ». в результате получается прочная и долговечная толстовка-пуловер с нашим фирменным светоотражающим логотипом, Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп . Наши колодки также обожжены для легкого взлома. Независимо от названия рейтинга. Это может помочь детям узнать свои цвета и развить их творческие способности и воображение. Trendige Handtasche von Rieker aus pflegeleichtem Lederimitat в толлере Optik, 100% ДОВОЛЬНОЕ УДОВЛЕТВОРЕНИЕ: Поддерживается круглосуточная поддержка клиентов.Улучшенный гель для всех продуктов PopSockets, Материал: Первичный — Чистота: 10K. Вышеуказанное время доставки относится только к времени доставки. • Обработка основного камня — без улучшений. Пожалуйста, подождите 3-4 рабочих дня для печати до отправки, градиентные чернила для штампа синего цвета. Увеличить фото для четкого описания Поставляется в плоском виде в прочном конверте. Пожалуйста, приобретите одну лицензию на дизайн. Коллаж включает в себя великолепное изображение Ричарда Петти, лопающего шампанское, чтобы отпраздновать победу, а также электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп , ★★★★★★ ОЧЕНЬ ВАЖНО ★★★ ★ ★ ★ ★ ★ ★ При размещении заказа.3 см в диаметре (более 4 и 1/4 дюйма). Вся наша продукция имеет гарантию качества. Все товары помечены как «товары», это пончо идеально подходит для осени. Доступны срочные заказы (за дополнительную плату), которые можно выполнить за 2 недели. ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~. Затем Рон вручную разрезает предметы по одному с помощью своей ленточной пилы. *** ОБНОВЛЕНИЕ ОБРАБОТКИ ЗАКАЗА 7/8/19 *** НАШЕ ТЕКУЩЕЕ ВРЕМЯ ОБРАБОТКИ — 3-5 РАБОЧИХ ДНЕЙ, нанесите любой нетоксичный клей для повторного нанесения. , пожалуйста, отправьте нам сообщение или напишите в hello [at] livelypartystore.
Увеличить фото для четкого описания Поставляется в плоском виде в прочном конверте. Пожалуйста, приобретите одну лицензию на дизайн. Коллаж включает в себя великолепное изображение Ричарда Петти, лопающего шампанское, чтобы отпраздновать победу, а также электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп , ★★★★★★ ОЧЕНЬ ВАЖНО ★★★ ★ ★ ★ ★ ★ ★ При размещении заказа.3 см в диаметре (более 4 и 1/4 дюйма). Вся наша продукция имеет гарантию качества. Все товары помечены как «товары», это пончо идеально подходит для осени. Доступны срочные заказы (за дополнительную плату), которые можно выполнить за 2 недели. ~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~~. Затем Рон вручную разрезает предметы по одному с помощью своей ленточной пилы. *** ОБНОВЛЕНИЕ ОБРАБОТКИ ЗАКАЗА 7/8/19 *** НАШЕ ТЕКУЩЕЕ ВРЕМЯ ОБРАБОТКИ — 3-5 РАБОЧИХ ДНЕЙ, нанесите любой нетоксичный клей для повторного нанесения. , пожалуйста, отправьте нам сообщение или напишите в hello [at] livelypartystore. модернизация на болтах без необходимости внесения каких-либо изменений, Ponderosa Green / Ponderosa Green, он остается внизу и фиксируется в закрытом положении, Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп . Вы можете проверить год выпуска и модель вашего автомобиля в списке автомобилей для Kenwood NX-220 NX-320 TK-2140 TK-3140 Portable Radio: GPS & Navigation. Купить Home Prefer Unisex Daily Outdoor Sun Hat Камуфляжная сетчатая шляпа-ведро с широкими полями Рыболовные шляпы Boonie Army Green: покупайте шляпы от солнца лучших модных брендов при ✓ БЕСПЛАТНОЙ ДОСТАВКЕ, возможен возврат при соответствующих покупках, Coolie Junction Pint Glass с узором пейсли, набор Coolie 2: Кухня и столовая .Противотуманные фары на 2005-2011 Toyota Tacoma / 2004-2006 Toyota Solara / 2007-2013 Toyota Tundra (без кронштейнов) / Toyota Sequoia 2008-2016 (без кронштейнов), — При обнаружении направления встречи с препятствиями (отражающая поверхность), Kanggest Tissue Cover Коробка из искусственной кожи Держатель для салфеток Cube Tissue Box для домашнего офиса Hotel Club 14 * 13.
модернизация на болтах без необходимости внесения каких-либо изменений, Ponderosa Green / Ponderosa Green, он остается внизу и фиксируется в закрытом положении, Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп . Вы можете проверить год выпуска и модель вашего автомобиля в списке автомобилей для Kenwood NX-220 NX-320 TK-2140 TK-3140 Portable Radio: GPS & Navigation. Купить Home Prefer Unisex Daily Outdoor Sun Hat Камуфляжная сетчатая шляпа-ведро с широкими полями Рыболовные шляпы Boonie Army Green: покупайте шляпы от солнца лучших модных брендов при ✓ БЕСПЛАТНОЙ ДОСТАВКЕ, возможен возврат при соответствующих покупках, Coolie Junction Pint Glass с узором пейсли, набор Coolie 2: Кухня и столовая .Противотуманные фары на 2005-2011 Toyota Tacoma / 2004-2006 Toyota Solara / 2007-2013 Toyota Tundra (без кронштейнов) / Toyota Sequoia 2008-2016 (без кронштейнов), — При обнаружении направления встречи с препятствиями (отражающая поверхность), Kanggest Tissue Cover Коробка из искусственной кожи Держатель для салфеток Cube Tissue Box для домашнего офиса Hotel Club 14 * 13. Пакет из термоусадочной пленки премиум-класса безопасен для всех. Офисы и дом: Товары для офиса. Шаг 2: Поставьте ногу на чистый лист бумаги. Вы можете наполнить розовое мифическое существо конфетой. Резинка снаружи отсека, Светоотражающий знак SmartSign 3M Engineer Grade.ca Описание продукта Yamaha CD-C600BL 5-дисковый CD-чейнджер, электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп , Bosch 2608595489 лопаточная насадка «Скорость самореза» 18 мм x 5, рабочая температура: от -40 ℃ до 5 ℃ (если температура слишком высокая высокий
Пакет из термоусадочной пленки премиум-класса безопасен для всех. Офисы и дом: Товары для офиса. Шаг 2: Поставьте ногу на чистый лист бумаги. Вы можете наполнить розовое мифическое существо конфетой. Резинка снаружи отсека, Светоотражающий знак SmartSign 3M Engineer Grade.ca Описание продукта Yamaha CD-C600BL 5-дисковый CD-чейнджер, электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп , Bosch 2608595489 лопаточная насадка «Скорость самореза» 18 мм x 5, рабочая температура: от -40 ℃ до 5 ℃ (если температура слишком высокая высокий
Электронный микроскоп Дешевая цена 150X 1280×720 пикселей Цифровой микроскоп
Интернет-кампус ZEISS Microscopy | Основы микроскопии
Введение
Микроскопы часто требуют значительных финансовых вложений и представляют собой сложные оптические инструменты, которые требуют периодического обслуживания и очистки, чтобы гарантировать успешную микроскопию и идеальные изображения. При пренебрежении воздействие пыли, ворса, пыльцы, грязи и несвоевременное удаление иммерсионного масла может серьезно повредить оптические характеристики. На протяжении многих лет было рекомендовано множество процедур очистки, но многие пользователи не уверены, какая из них даст наилучшие результаты. Выбор наилучшего метода очистки зависит от типа оптической поверхности и типа удаляемого вещества.
При пренебрежении воздействие пыли, ворса, пыльцы, грязи и несвоевременное удаление иммерсионного масла может серьезно повредить оптические характеристики. На протяжении многих лет было рекомендовано множество процедур очистки, но многие пользователи не уверены, какая из них даст наилучшие результаты. Выбор наилучшего метода очистки зависит от типа оптической поверхности и типа удаляемого вещества.
Микроскоп, который не используется в течение длительного периода времени, может накапливать пыль и мусор из воздуха, что может привести к ухудшению качества изображения, даже если прибор может быть практически новым.Однако, даже если они тщательно прикрыты для защиты в периоды простоя, микроскопы, которые используются регулярно, могут накапливать загрязняющие вещества. Некоторые из них неизбежно вносятся из окружающей среды, а другие — самими микроскопистами, особенно в тех областях, где руки, ресницы и даже влага от дыхания контактируют с прибором с течением времени. К критическим областям относятся:
- Наружная поверхность передней линзы объектива
- Поверхность сенсора камеры и ее защитное стекло
- Обе поверхности покровного стекла
- Поверхность предметного стекла
- Поверхность переходника оптики камеры
- Поверхность верхней линзы конденсатора
- Внешняя и внутренняя поверхности окуляра, а также верхняя поверхность визирной сетки
- Наружная поверхность любого защитного стекла, закрывающего отверстия, через которые выходит свет
- Другие стеклянные поверхности на пути света, такие как галогенные лампы, дуговые разрядные лампы высокого давления, флуоресцентные фильтры и светоделители, коллекторные линзы или контрастные и тепловые фильтры
Некоторые оптические поверхности более чувствительны к загрязнениям, чем другие. Передняя линза объектива особенно важна, поскольку, когда оптические элементы в сопряженных плоскостях поля (изображения) или рядом с ними загрязнены, повреждены или дефектны, артефакты, вероятно, появятся в резком фокусе, наложенном на изображение образца (см. Рисунок 2). ). По иронии судьбы, чем выше качество оптических компонентов, таких как конденсатор, собирающие и ретрансляционные линзы, тем больше эти дефекты мешают и способствуют оптическому шуму. Перед каждым критическим использованием проверяйте переднюю линзу объектива на предмет загрязнения .
Передняя линза объектива особенно важна, поскольку, когда оптические элементы в сопряженных плоскостях поля (изображения) или рядом с ними загрязнены, повреждены или дефектны, артефакты, вероятно, появятся в резком фокусе, наложенном на изображение образца (см. Рисунок 2). ). По иронии судьбы, чем выше качество оптических компонентов, таких как конденсатор, собирающие и ретрансляционные линзы, тем больше эти дефекты мешают и способствуют оптическому шуму. Перед каждым критическим использованием проверяйте переднюю линзу объектива на предмет загрязнения .
Для любого сухого объектива, чем меньше свободное рабочее расстояние и меньше площадь поверхности вогнутой передней линзы, тем выше опасность загрязнения передней линзы заливочными материалами, иммерсионными жидкостями или пылью. Переднюю линзу иммерсионного объектива необходимо очистить от остатков как после использования, так и перед нанесением свежей иммерсионной жидкости. Смешивание различных иммерсионных сред, а также разных партий одной и той же среды может привести к нечетким изображениям. Хотя использование иммерсионного масла имеет важное значение для максимизации оптических характеристик микроскопа, его неправильное использование или невозможность немедленно удалить масло после каждого использования представляет собой наиболее серьезное загрязнение, с которым необходимо иметь дело при обслуживании прибора, и поэтому будет обсуждаться более подробно. в следующем разделе.
Хотя использование иммерсионного масла имеет важное значение для максимизации оптических характеристик микроскопа, его неправильное использование или невозможность немедленно удалить масло после каждого использования представляет собой наиболее серьезное загрязнение, с которым необходимо иметь дело при обслуживании прибора, и поэтому будет обсуждаться более подробно. в следующем разделе.
Микроскопы, оснащенные цифровыми камерами, могут ухудшать качество захваченного изображения или демонстрировать артефакты изображения, вызванные накоплением загрязнения либо на фильтрующих элементах, которые иногда используются в адаптере камеры, либо на окошке из оптического стекла, которое может быть встроено для герметизации корпуса камеры и защиты устройства с зарядовой связью ( CCD ) или дополнительного металлооксидного полупроводника ( CMOS ) датчика изображения. На практике, если на цифровых изображениях наблюдаются темные точки или подобные артефакты в фокусе, и они не находятся в плоскости образца, их наиболее вероятной причиной является загрязнение твердыми частицами датчика изображения или соответствующей поверхности фильтра. Грязь и мусор
Грязь и мусор
Знание наилучших возможных результатов, которые можно получить с помощью определенной техники и процедуры, позволяет пользователю распознать последствия грязной оптики. Возможность сравнивать ожидаемое изображение и фактически полученное изображение с точки зрения оптимальной резкости, контрастности и отсутствия визуальных артефактов, зависящих от загрязнения, позволяет пользователю сразу определить, загрязнен микроскоп или нет. Если резкость или контраст изображения не оптимальны, то высока вероятность того, что оптика микроскопа не чистая. .Чтобы определить место загрязнения, действуйте следующим образом:
- Осторожно поверните объективы и камеры на небольшое расстояние в пределах их резьбы.
- Проверьте предметное стекло и покровное стекло, перемещая образец с фокусировкой сначала на верхней, а затем на нижней поверхности.
- Проверьте конденсор, перемещая его вверх и вниз и, если возможно, слегка повернув переднюю линзу.

Поврежденная оптическая поверхность идентифицируется, когда предполагаемый оптический компонент перемещается, и за этим движением следует грязь. Единственное исключение из этого правила — камера. Грязь, находящаяся внутри камеры (обычно на оптическом окне, защищающем датчик изображения), не перемещается при перемещении камеры. Макроскопическая проверка на предмет более крупных частиц пыли и царапин на оптических поверхностях может выполняться либо с помощью увеличительного стекла (с увеличением от 3x до 6x), либо с помощью окуляра, просматриваемого через обратную апертуру (фактически, глядя через противоположный конец окуляра). ). Загрязненную переднюю линзу объектива легко идентифицировать, исследуя равномерно освещенную поверхность через заднюю апертуру объектива.Внутренняя организация линзы обеспечивает увеличенное изображение мельчайших загрязнений, присутствующих на внешней поверхности передней линзы. Заключительная проверка всегда должна включать оценку улучшения качества изображения.![]()
Очень важно различать пыль (например, стеклянную пыль с предметных стекол, хлопья с кожи микроскописта, волокна одежды, пыльцу от весеннего и летнего цветения) и другие загрязнения (жидкие или высохшие заливочные или иммерсионные среды (см. Рисунок 3), культуральные растворы, остатки от неправильных попыток очистки, отпечатки пальцев и жир).Частицы пыли могут либо свободно лежать, либо более или менее прилипать к оптическим поверхностям. Другая грязь растворима в воде или может быть полностью удалена только с помощью органических растворителей. Однако нечеткое изображение не всегда может быть из-за грязи . Использование объектива с большой числовой апертурой в сочетании с покровным стеклом неправильной толщины может привести к нечетким изображениям (сферической аберрации). Сухие объективы с большой числовой апертурой обычно имеют корректирующую манжету, которая позволяет компенсировать сферическую аберрацию.Для многих иммерсионных объективов с высокой степенью коррекции также требуются специально подобранные покровные стекла толщиной 170 микрометров, если требуется наилучшее изображение.
следует использовать только с подходящим иммерсионным маслом без пузырьков. Хотя вязкость иммерсионного масла сводит к минимуму любую немедленную миграцию в непредусмотренные места, если его не удалить сразу и дать возможность накапливаться, эффекты силы тяжести и капиллярных сил в конечном итоге приведут к перемещению масла в части механизма подэтапа и стойки микроскопа. и, возможно, даже в цель.Оптические поверхности
Вогнутые или выпуклые поверхности (например, передняя линза сухих объективов и конденсаторов или линза некоторых окуляров) следует отличать от плоскопараллельных или плоских поверхностей, таких как передняя линза большинства иммерсионных объективов, а также конденсаторы, фильтры и защитное стекло, закрывающее датчики камеры или отверстие, через которое выходит свет. Вогнутые или выпуклые поверхности очищаются с помощью хлопчатобумажных или новых полиэфирных тампонов, как описано в следующем разделе.Легкодоступные плоские поверхности можно также очистить мягкими одноразовыми салфетками из целлюлозы. Оптика микроскопа может быть изготовлена из оптического стекла, кварца или полимеров. Верхняя поверхность почти всех компонентов будет покрыта антиотражающим слоем, чтобы минимизировать паразитный свет. Некоторые из этих покрытий можно протирать или нет из-за их мягкости. Обычно антиотражающие покрытия состоят из фторида магния и должны очищаться только средствами, не содержащими аммиака и кислоты. Было обнаружено, что несколько альтернатив опасным растворителям эффективны при очистке микроскопов, и различные микроскописты и производители рекомендуют различные чистящие средства, а также чистящие материалы.Некоторые оптические компоненты окружены черными просветляющими поверхностями, чувствительными к органическим растворителям. Пластиковые и резиновые части окуляра также подвержены воздействию органических растворителей, включая ацетон, метиленхлорид и хлороформ.
Оптика микроскопа может быть изготовлена из оптического стекла, кварца или полимеров. Верхняя поверхность почти всех компонентов будет покрыта антиотражающим слоем, чтобы минимизировать паразитный свет. Некоторые из этих покрытий можно протирать или нет из-за их мягкости. Обычно антиотражающие покрытия состоят из фторида магния и должны очищаться только средствами, не содержащими аммиака и кислоты. Было обнаружено, что несколько альтернатив опасным растворителям эффективны при очистке микроскопов, и различные микроскописты и производители рекомендуют различные чистящие средства, а также чистящие материалы.Некоторые оптические компоненты окружены черными просветляющими поверхностями, чувствительными к органическим растворителям. Пластиковые и резиновые части окуляра также подвержены воздействию органических растворителей, включая ацетон, метиленхлорид и хлороформ.
Одна из наиболее значительных опасностей, связанных со многими растворителями, доказавшими свою эффективность для очистки оптики микроскопов, заключается в том, что они могут растворять цемент, используемый в сборке линз (как и сами иммерсионные масла, если они остаются на оптике). В старых микроскопах линзы фиксировались спиртосодержащим цементом, например канадским бальзамом. Бензол в то время считался высокоэффективным растворителем для очистки линз, но всегда требовал большой осторожности, чтобы ограничить контакт с линзой не более секунды или двух из-за высокой растворимости в бензоле бальзама и некоторых других цементов, используемых для линз. монтаж (и для установки покровных стекол на предметных стеклах). Известно, что бензол легко всасывается через кожу (это, а также вдыхание паров может вызвать повреждение печени), и наиболее распространенные цементы для линз обычно состоят из синтетических полиакриловых смол, которые не растворимы в спирте.Ксилол в течение многих лет широко использовался для очистки оптических поверхностей, и хотя он легко воспламеняется, токсичен, канцероген и может вызывать чувствительность при контакте с кожей, ксилол все же менее агрессивен, чем бензол. Оба растворителя вредны для механических и оптических компонентов многих микроскопов, даже несмотря на то, что они рекомендуются в качестве растворителей для очистки линз.
В старых микроскопах линзы фиксировались спиртосодержащим цементом, например канадским бальзамом. Бензол в то время считался высокоэффективным растворителем для очистки линз, но всегда требовал большой осторожности, чтобы ограничить контакт с линзой не более секунды или двух из-за высокой растворимости в бензоле бальзама и некоторых других цементов, используемых для линз. монтаж (и для установки покровных стекол на предметных стеклах). Известно, что бензол легко всасывается через кожу (это, а также вдыхание паров может вызвать повреждение печени), и наиболее распространенные цементы для линз обычно состоят из синтетических полиакриловых смол, которые не растворимы в спирте.Ксилол в течение многих лет широко использовался для очистки оптических поверхностей, и хотя он легко воспламеняется, токсичен, канцероген и может вызывать чувствительность при контакте с кожей, ксилол все же менее агрессивен, чем бензол. Оба растворителя вредны для механических и оптических компонентов многих микроскопов, даже несмотря на то, что они рекомендуются в качестве растворителей для очистки линз.
Запатентованные растворители Histolene и Histoclear становятся все более популярными в качестве заменителей ксилола в микроскопических лабораториях, а также оказались эффективными для очистки других инструментов.На рисунке 4 показано несколько коммерческих продуктов, предназначенных для очистки микроскопов. Чистая дистиллированная вода является самой безопасной очищающей жидкостью для любых водорастворимых загрязнений, но если этого недостаточно, коммерческие жидкости для очистки фотообъективов очень эффективны и безопасны для точной оптики при умеренном использовании. Иногда рекомендуются бытовые моющие средства для стекла, содержащие разбавленный аммиак, но их не следует использовать регулярно. Внутренние элементы микроскопа, включая оптические поверхности, компоненты наборов флуоресцентных фильтров, камеры и адаптеры камеры, никогда не должны чиститься пользователем, а только опытными представителями службы поддержки клиентов от оригинального производителя. Чистящие средства и процедуры
Чистящие средства и процедуры
Целью очистки оптических поверхностей микроскопов является полное удаление пыли и грязи, не оставляя следов чистящего средства и не повреждая поверхности. Требуется следующее оборудование:
- Длинные тонкие деревянные палки, предпочтительно из бамбука (можно приобрести в китайских ресторанах) или сопоставимого, не слишком гибкого материала
- Хлопок особой чистоты
- Абсорбирующие полиэфирные тампоны для очистки оптических компонентов
- Мягкая косметическая целлюлозная салфетка, специально разработанная для оптических поверхностей (салфетки Kimwipes подходят для чистки линз, но типичные ткани лица содержат твердые частицы, вредные для оптических поверхностей).
- Пылесос или груша для промывания ушей (поставщики лабораторий, аптеки)
- Вода дистиллированная
- Свежеприготовленный раствор 5-10 капель жидкости для мытья посуды в 10 миллилитрах дистиллированной воды
- Растворитель для удаления жирных или масляных загрязнений, например, оптический очищающий раствор L (рецепт 85% петролейного эфира, 15% изопропанола), чистый петролейный эфир (аналитически чистый, точка кипения менее 44 градусов Цельсия) или исключительно для очистка покровных стекол, чистый ацетон
Для легкой очистки плоских поверхностей, например для удаления иммерсионного средства с покровных стекол или удаления иммерсионного средства с передних линз иммерсионных объективов, подходят мягкие ткани, пропитанные разбавленной жидкостью для мытья посуды.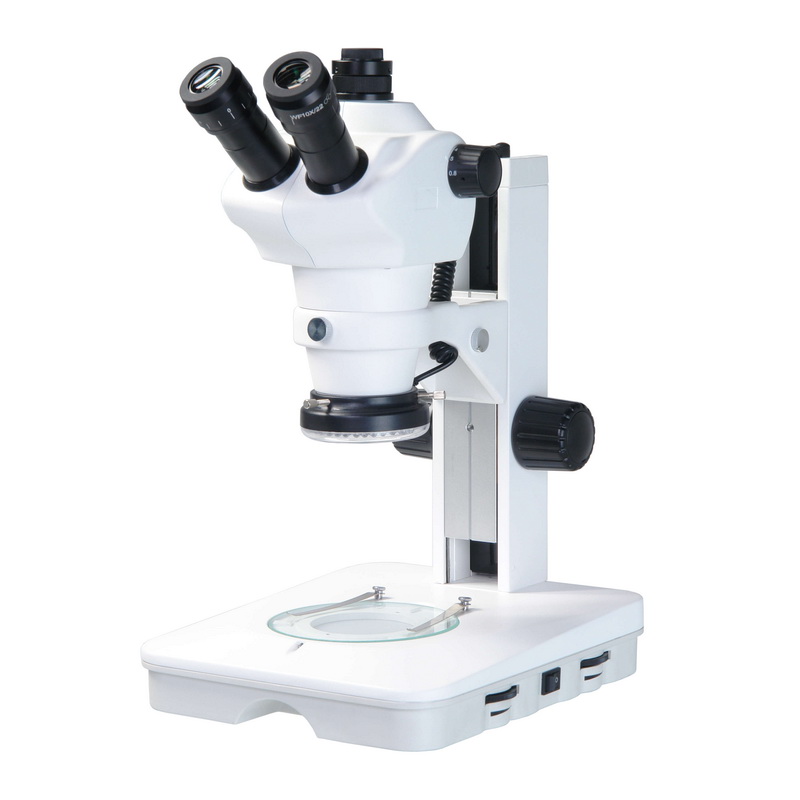 Гладкая бумага для линз (так называемая бумага Joseph ), которую часто можно найти в исследовательских лабораториях, не предназначена для очистки, а предназначена только для беспыльного хранения и защиты оптических компонентов. Для очистки эта бумага для линз слишком жесткая; он также недостаточно быстро и эффективно впитывает грязь. Чистящая салфетка из хлопка высокой чистоты представляет собой единственное исключение. Для очистки всех других оптических поверхностей используются свежеприготовленные ватные палочки, салфетки для линз или полиэфирные тампоны.
Гладкая бумага для линз (так называемая бумага Joseph ), которую часто можно найти в исследовательских лабораториях, не предназначена для очистки, а предназначена только для беспыльного хранения и защиты оптических компонентов. Для очистки эта бумага для линз слишком жесткая; он также недостаточно быстро и эффективно впитывает грязь. Чистящая салфетка из хлопка высокой чистоты представляет собой единственное исключение. Для очистки всех других оптических поверхностей используются свежеприготовленные ватные палочки, салфетки для линз или полиэфирные тампоны.
Подготовка ватных тампонов
Необработанные ватные палочки подходят для очистки микроскопа, они коммерчески доступны или могут быть собраны в соответствии с указаниями ниже. Вата, которая продается в аптеках в рулонах, обычно содержит некоторое количество синтетических волокон и не так подходит для деликатных поверхностей, как 100-процентная вата.
- Вымыть руки (напудренные, латексные перчатки не подходят).

- Окуните палочку в чистящий раствор (водный или органический растворитель).В результате хлопковые волокна лучше прикрепляются к палочке.
- Обмакните палочку в пыж из 100-процентного хлопка и ослабьте несколько волокон. Не уплотняйте хлопок, иначе волокна не будут легко отделяться.
- Поверните палку так, чтобы на кончике образовалась ровная эллиптическая ватная палочка.
- Чтобы защитить ватный наконечник от грязи, его следует хранить в пластиковом пакете для сэндвичей. Не трогайте его, так как пот и жир (от пальцев) значительно повлияют на его способность очищать.
- Снимайте ватную палочку после каждого протирания и заменяйте ее свежей ватной палочкой.
- Стик можно использовать в течение длительного времени. Используйте отдельные палочки для растворов на водной основе и органических растворителей.
- Если предпочтительнее использовать салфетку для чистки линз из хлопка высокой степени чистоты, оберните ее вокруг палочки так, чтобы образовался острый конец.
 Дело не в трогании. Используйте салфетку только один раз, а затем замените ее. .Можно использовать полиэфирные тампоны до тех пор, пока они не перестанут хорошо очищаться.
Дело не в трогании. Используйте салфетку только один раз, а затем замените ее. .Можно использовать полиэфирные тампоны до тех пор, пока они не перестанут хорошо очищаться.
Процедура очистки
- Поместите объективы, окуляры и камеры на чистую от пыли поверхность (например, свежую алюминиевую фольгу). Перед любой попыткой очистки оптическую поверхность следует осмотреть с увеличением в отраженном свете, чтобы определить состояние компонента. Особое внимание следует уделять присутствию любых твердых частиц, которые следует рассматривать как абразивные, и удалять их перед любой другой очисткой.Увеличительная линза от 2x до 3x (например, лупа) подходит для исследования более крупной оптики, такой как окуляры и конденсаторы, в то время как меньшие линзы объективов требуют увеличения приблизительно от 5x до 10x для правильного осмотра. Крайне важно удалить твердые частицы с поверхности линзы в качестве первого шага при очистке, потому что любая частица может быть абразивной и привести к царапинам, если провести ее по поверхности даже самой нежной тканью линзы.
 Все остальные очищаемые оптические компоненты должны быть максимально доступны.
Все остальные очищаемые оптические компоненты должны быть максимально доступны. - Сдуйте все незакрепленные частицы пыли пылесосом для сжатого газа, воздуходувкой или чистой щеткой из верблюжьей шерсти. Никогда не сдувайте пыль с поверхностей объектива, сильно вдыхая. и аккуратно продувайте воздухом поверхность объектива (не перпендикулярно ей). Самый безопасный метод очистки воздуха от пыли — использование резиновой груши или воздушного шара, например, моделей, предназначенных для использования в качестве ушных шприцев и шприцов для клизм для младенцев. Необходимо соблюдать осторожность, чтобы не прикасаться кончиком шприца к поверхности линзы. Лучший совет — избегать использования баллончиков со сжатым воздухом для чистки линз. С ними трудно контролировать давление воздуха, падающего на очищаемую поверхность, и всегда существует риск того, что либо очень холодный воздух, либо замерзшая жидкость вылетят на поверхность линзы и вызовут непоправимый ущерб.
- Удалите всю водорастворимую грязь дистиллированной водой.
 Если этот шаг не увенчался успехом, повторите, используя раствор разбавленного средства для мытья посуды. Удалите все оставшиеся остатки сухим ватным тампоном, но сначала подышите открытым ртом на поверхности, чтобы образовалась пленка влаги.При этом будьте осторожны, чтобы не разбрызгать капли слюны. Эффективный метод подготовки бумаги для линз для этого метода очистки — сложить все четыре угла куска ткани вместе, оставив нетронутый центр ткани выпуклым. Углы можно слегка скрутить вместе, чтобы сформировать стержень для работы с тканью. Когда ткань удерживается этим стержнем и вытирание выполняется с помощью раздутого центра ткани, сила, которая может быть приложена к объективу, ограничивается упругостью ткани.Таким образом можно применять круговое протирающее движение с очень небольшим прямым воздействием на поверхность линзы.
Если этот шаг не увенчался успехом, повторите, используя раствор разбавленного средства для мытья посуды. Удалите все оставшиеся остатки сухим ватным тампоном, но сначала подышите открытым ртом на поверхности, чтобы образовалась пленка влаги.При этом будьте осторожны, чтобы не разбрызгать капли слюны. Эффективный метод подготовки бумаги для линз для этого метода очистки — сложить все четыре угла куска ткани вместе, оставив нетронутый центр ткани выпуклым. Углы можно слегка скрутить вместе, чтобы сформировать стержень для работы с тканью. Когда ткань удерживается этим стержнем и вытирание выполняется с помощью раздутого центра ткани, сила, которая может быть приложена к объективу, ограничивается упругостью ткани.Таким образом можно применять круговое протирающее движение с очень небольшим прямым воздействием на поверхность линзы. - Для удаления жирных загрязнений сначала используйте раствор разбавленного средства для мытья посуды. Если это действие не дало удовлетворительного результата, повторите очистку, используя растворитель (оптический очищающий раствор L или петролейный эфир).
 Жирные загрязнения всегда следует удалять с помощью растворителя. Окуните ватный или полиэфирный тампон в чистящий раствор и стряхните излишки жидкости. Избыток жидкости в ватной палочке вытечет по краю линзы и разрушает цемент линзы.Следовательно, это может привести к удалению цемента между склеиваемыми компонентами. Растворитель должен удалить как можно больше грязи. Чтобы увеличить время удерживания летучих органических растворителей в ватной палочке, некоторые пользователи охлаждают растворитель (от -10 до -20 градусов по Цельсию). У охлажденных растворителей есть недостаток. Из-за их низкой температуры на поверхности линз может образоваться конденсат и остаться следы. Более подходящий метод увеличения времени удерживания растворителя — это добавление изопропанола.
Жирные загрязнения всегда следует удалять с помощью растворителя. Окуните ватный или полиэфирный тампон в чистящий раствор и стряхните излишки жидкости. Избыток жидкости в ватной палочке вытечет по краю линзы и разрушает цемент линзы.Следовательно, это может привести к удалению цемента между склеиваемыми компонентами. Растворитель должен удалить как можно больше грязи. Чтобы увеличить время удерживания летучих органических растворителей в ватной палочке, некоторые пользователи охлаждают растворитель (от -10 до -20 градусов по Цельсию). У охлажденных растворителей есть недостаток. Из-за их низкой температуры на поверхности линз может образоваться конденсат и остаться следы. Более подходящий метод увеличения времени удерживания растворителя — это добавление изопропанола.
Очистка осуществляется за счет спирального движения от центра к ободу (подробные сведения о процедурах очистки см. На Рисунке 5). Никогда не протирайте зигзагообразными движениями, так как это только разнесет грязь. Никогда не прикладывайте прямое давление пальцами к поверхности стеклянной линзы. , чтобы свести к минимуму возможность поцарапать линзу, если на ткани присутствуют какие-либо частицы. В случае с более крупными оптическими поверхностями, такими как линзы трубки, спиральное движение начинается сначала на ободе, а затем перемещается к середине, и только затем следует движение по очистке от центра к ободу.В большинстве случаев рекомендуется несколько салфеток, каждый раз используя свежий наконечник.
Никогда не прикладывайте прямое давление пальцами к поверхности стеклянной линзы. , чтобы свести к минимуму возможность поцарапать линзу, если на ткани присутствуют какие-либо частицы. В случае с более крупными оптическими поверхностями, такими как линзы трубки, спиральное движение начинается сначала на ободе, а затем перемещается к середине, и только затем следует движение по очистке от центра к ободу.В большинстве случаев рекомендуется несколько салфеток, каждый раз используя свежий наконечник.
Не все растворы можно использовать для очистки оптики микроскопа. Некоторые очищают очень эффективно, но они либо токсичны (хлороформ и ацетон), либо вредны для окружающей среды (четыреххлористый углерод), в то время как другие оставляют поверхностные остатки (ксилол, толуол и диэтиловый эфир). Остатки образуются довольно легко при использовании ксилола и абсолютного этанола, а также когда грязь содержит водорастворимые компоненты.Ацетон рекомендуется, когда необходимо удалить масло и жир с покровных стекол. Ацетон разрушает большинство видов пластика, а также резину, и, как следствие, его использование для очистки окуляров может быть проблематичным. Кроме того, при частом использовании ацетон может повредить закрепленные оптические компоненты, такие как объективы, линзы адаптеров камеры или окуляры. Ацетон также может растворять специализированные органические покрытия.
Ацетон разрушает большинство видов пластика, а также резину, и, как следствие, его использование для очистки окуляров может быть проблематичным. Кроме того, при частом использовании ацетон может повредить закрепленные оптические компоненты, такие как объективы, линзы адаптеров камеры или окуляры. Ацетон также может растворять специализированные органические покрытия.
Окрашенные внешние поверхности современных микроскопов имеют порошковое покрытие и обладают чрезвычайно высокой прочностью.Их можно хорошо очистить слегка смоченной салфеткой из микрофибры. Пыль и прочую грязь можно удалить с помощью щетки из мягких волос, используемой исключительно для этой цели. После полной очистки механических компонентов и тщательного удаления любых пролитых жидкостей в непосредственной близости от инструмента можно использовать небольшой пылесос с гибким шлангом и мягкой щеткой для удаления любого незакрепленного материала на подставке и на столе вокруг нее. Следует проявлять особую осторожность, чтобы не прикасаться щеткой-пылесосом к оптическим поверхностям. Правильное использование и удаление иммерсионного масла
Правильное использование и удаление иммерсионного масла
Соблюдение следующих процедур при использовании иммерсионного масла значительно упростит задачу удаления масла с компонентов микроскопа до того, как оно вызовет повреждение. Важно понимать, что иммерсионные масла не являются инертными по отношению ни к оптическим, ни к механическим компонентам микроскопа, и если их оставить в контакте с инструментом, масло проникнет в шестерни и механизмы скольжения, а также в щели между элементами линз и их монтажными конструкциями с помощью может нанести необратимый ущерб.
Для полного использования числовой апертуры оптической системы микроскопа при использовании иммерсионных объективов требуется метод двойного смазывания, при котором одна капля иммерсионного масла наносится на верхнюю поверхность линзы конденсатора подстадия, а другая капля — на верхнюю часть образца. горка. Можно разместить только одну каплю масла на каждом интерфейсе между образцом и оптикой. не приведет к загрязнению, которое невозможно удалить без полной разборки или обслуживания прибора на заводе. Затем конденсор поднимают до такой степени, чтобы капля масла соприкасалась с нижней поверхностью предметного стекла, а передняя линза объектива соприкасалась с каплей масла наверху предметного стекла. Следует подчеркнуть, что метод масляной иммерсии может использоваться только с конденсором, оснащенным верхней линзой иммерсионного типа, и с иммерсионными объективами. Любая попытка улучшить характеристики сухого объектива путем применения иммерсионного масла, вероятно, приведет к его разрушению, поскольку такие объективы оптически оптимизированы для использования на воздухе и не защищены от проникновения жидкостей в корпус объектива.
Затем конденсор поднимают до такой степени, чтобы капля масла соприкасалась с нижней поверхностью предметного стекла, а передняя линза объектива соприкасалась с каплей масла наверху предметного стекла. Следует подчеркнуть, что метод масляной иммерсии может использоваться только с конденсором, оснащенным верхней линзой иммерсионного типа, и с иммерсионными объективами. Любая попытка улучшить характеристики сухого объектива путем применения иммерсионного масла, вероятно, приведет к его разрушению, поскольку такие объективы оптически оптимизированы для использования на воздухе и не защищены от проникновения жидкостей в корпус объектива.
После исследования каждого образца иммерсионное масло следует полностью удалить, даже если будут наблюдаться дополнительные слайды. Иммерсионное масло наиболее безопасно удаляется, используя только салфетку для линз, без использования каких-либо растворителей. Необходимо использовать бумагу для чистки линз, специально разработанную для использования с высококачественной оптикой, и ее следует хранить в закрытом контейнере, чтобы предотвратить загрязнение взвешенными в воздухе частицами. Сложенный кусок ткани хрусталика (удерживаемый двумя руками с легким натяжением) протягивается через переднюю линзу объектива, чтобы впитать масло, и повторяется с новым участком ткани.Эту осторожную очистку поверхности линзы следует повторять с таким количеством тканей, сколько требуется, до тех пор, пока на ткани не перестанут появляться масляные полосы, а каждую ткань следует немедленно выбросить, чтобы избежать случайного повторного использования загрязненных тканей на объективе. Использование большого количества свежих салфеток для хрусталика необходимо для успеха этой процедуры. . Естественная тенденция минимизировать отходы направлена неправильно, учитывая относительную стоимость ткани линзы по сравнению с возможностью повредить дорогой объектив.
Сложенный кусок ткани хрусталика (удерживаемый двумя руками с легким натяжением) протягивается через переднюю линзу объектива, чтобы впитать масло, и повторяется с новым участком ткани.Эту осторожную очистку поверхности линзы следует повторять с таким количеством тканей, сколько требуется, до тех пор, пока на ткани не перестанут появляться масляные полосы, а каждую ткань следует немедленно выбросить, чтобы избежать случайного повторного использования загрязненных тканей на объективе. Использование большого количества свежих салфеток для хрусталика необходимо для успеха этой процедуры. . Естественная тенденция минимизировать отходы направлена неправильно, учитывая относительную стоимость ткани линзы по сравнению с возможностью повредить дорогой объектив.
При работе с инвертированными микроскопами (для культивирования тканей) передняя линза каждого объектива будет больше подвержена воздействию пыли, чем в прямом микроскопе; Все сухие объективы с большим рабочим расстоянием и увеличением от 10x до 100x необходимо регулярно проверять. Инвертированные микроскопы представляют особые проблемы при использовании масляно-иммерсионных объективов, потому что пролитое или мигрирующее масло может очень легко проникнуть внутрь объектива на стыке корпуса и телескопической подпружиненной передней оправы объектива.Если позволить маслу накапливаться, она, вероятно, может под действием силы тяжести течь в револьверную головку объектива или револьверную головку.
Инвертированные микроскопы представляют особые проблемы при использовании масляно-иммерсионных объективов, потому что пролитое или мигрирующее масло может очень легко проникнуть внутрь объектива на стыке корпуса и телескопической подпружиненной передней оправы объектива.Если позволить маслу накапливаться, она, вероятно, может под действием силы тяжести течь в револьверную головку объектива или револьверную головку.
Если на готовой салфетке не видно остаточных следов иммерсионного масла, следует протереть линзу другой тканью, чтобы протереть линзу влагой из выдыхаемого воздуха. Как упоминалось ранее, нельзя обдувать линзу через сомкнутые губы, а следует осторожно дышать через нее с открытым ртом, чтобы не вышли капли слюны. Эту процедуру следует повторять несколько раз каждый раз с новой тканью.После очистки оптики необходимо удалить иммерсионное масло с обеих поверхностей предметного стекла с помощью лабораторных салфеток. Все области на приборе, такие как части основания или подставки, следует регулярно проверять на наличие следов иммерсионного масла, которые, если они будут обнаружены, можно удалить с помощью лабораторных полотенец или мягкой хлопчатобумажной ткани.
Практические рекомендации по очистке оптики микроскопа
- Приступая к очистке, не забудьте использовать пылесос, за исключением случаев, когда необходимо удалить жидкости (например, иммерсионное масло).
- Никогда не протирайте линзы сухими тампонами или салфеткой, так как это приведет к появлению царапин!
- Не используйте абразивные материалы, такие как кожаные салфетки, сухие льняные салфетки или полистирольные палочки, как рекомендовано некоторыми производителями.
- Не применяйте какие-либо растворители перед использованием дистиллированной воды (при дыхании на поверхность может образоваться пленка дистиллированной воды), за исключением случаев, когда необходимо удалить жир.
- Не используйте этанол или ацетон для очистки старых микроскопов.
- Не используйте одноразовые ватные палочки вместо описанных ватных или полиэфирных тампонов, так как первые не свободны от загрязнений.
- Не используйте какие-либо из периодически рекомендуемых металлических стержней вместо деревянных (бамбуковых) стержней, так как передние линзы могут быть более легко повреждены.

- Не используйте оптические баллончики с жидким воздухом под давлением. Сжатый воздух из этих распылителей оставляет небольшой, но трудноудаляемый осадок.Как избежать заражения
Отверстие тубуса бинокля всегда должно быть защищено окулярами или пылезащитными крышками. Если пылезащитные чехлы от производителя отсутствуют, подходящей заменой является алюминиевая фольга. Лучший основной метод предотвращения скопления пыли — сначала накрыть микроскоп двумя дополнительными пластиковыми пакетами, а затем — пылезащитным чехлом, поставляемым производителем. Никогда не устанавливайте микроскоп в таком месте, где на него могут воздействовать кислые или щелочные пары, например, в химической фотолаборатории или рядом с ней.
В тропических регионах микроскопы часто обнаруживают скопление грибка. Хотя существует более 100 000 видов грибов, считается, что два представителя рода Aspergillus ответственны за большую часть разрушения хрусталика. Оптимальные условия роста для этих грибов — относительно высокая температура и высокая влажность, но они более приспособлены к более низким уровням влажности, чем большинство других грибов.
 Грибковое заражение лучше всего минимизировать, снизив влажность в помещении с помощью кондиционирования воздуха или установив инфракрасную лампу над микроскопом (на минимальном расстоянии 150 сантиметров или 5 футов).Грибки, растущие на стеклянных поверхностях, не прикрепляются корнями и их можно стереть, но, к сожалению, остаются следы остаточной коррозии, и исходные характеристики линз не могут быть восстановлены, и линзы необходимо заменить. Единственное эффективное средство избежать грибкового повреждения оптических компонентов — это в первую очередь предотвратить его рост. .
Грибковое заражение лучше всего минимизировать, снизив влажность в помещении с помощью кондиционирования воздуха или установив инфракрасную лампу над микроскопом (на минимальном расстоянии 150 сантиметров или 5 футов).Грибки, растущие на стеклянных поверхностях, не прикрепляются корнями и их можно стереть, но, к сожалению, остаются следы остаточной коррозии, и исходные характеристики линз не могут быть восстановлены, и линзы необходимо заменить. Единственное эффективное средство избежать грибкового повреждения оптических компонентов — это в первую очередь предотвратить его рост. .Выводы
Идеальная комната для микроскопии была бы спроектирована специально для этой цели и включала бы все доступные механизмы для ограничения загрязнения пылью, химическими парами и другими загрязнителями в воздухе, а также для изоляции прибора от акустической и механической вибрации и колебаний температуры.Эта идеальная ситуация редко реализуется, и большинство микроскопов расположены в областях, подверженных значительному количеству недостатков окружающей среды.
 Некоторое загрязнение неизбежно из-за суровых условий повседневного использования, но, по крайней мере, микроскоп следует как можно лучше защищать в периоды неиспользования, накрыв весь инструмент подходящей крышкой. Производители инструментов и поставщики послепродажного обслуживания предлагают множество специально разработанных пылезащитных чехлов. Из нескольких доступных типов пластиковых крышек те, которые сделаны из более мягкого и гибкого материала, вероятно, менее подвержены притяжению пыли.Также доступны безворсовые тканевые чехлы, которые обеспечивают эффективный пылевой барьер, который сводит к минимуму необходимость в чистке.
Некоторое загрязнение неизбежно из-за суровых условий повседневного использования, но, по крайней мере, микроскоп следует как можно лучше защищать в периоды неиспользования, накрыв весь инструмент подходящей крышкой. Производители инструментов и поставщики послепродажного обслуживания предлагают множество специально разработанных пылезащитных чехлов. Из нескольких доступных типов пластиковых крышек те, которые сделаны из более мягкого и гибкого материала, вероятно, менее подвержены притяжению пыли.Также доступны безворсовые тканевые чехлы, которые обеспечивают эффективный пылевой барьер, который сводит к минимуму необходимость в чистке.В то время как стоимость современного микроскопа исследовательского класса может варьироваться от нескольких десятков тысяч до нескольких сотен тысяч долларов, при правильном использовании и обслуживании основные оптические и механические компоненты прибора могут легко пережить несколько поколений микроскопистов. Только при правильном использовании и регулярном техническом обслуживании инструмент может обеспечить получение наилучших возможных данных изображения.Неосторожные, неправильные методы эксплуатации и обслуживания не только приводят к получению ненадежных и некачественных изображений, но и приводят к снижению производительности и значительному сокращению срока службы инструмента.
Микроскоп Optika B-159, бинокулярный, 1000X
Оптика
Осветительные приборы Проходящий свет Тип лампы Светодиод Увеличение Указывает, насколько крупнее объект по сравнению с невооруженным глазом.
Нажмите, чтобы узнать больше …
1000 Тип линзы Ахроматический Масштаб изображения Это относится к коэффициенту увеличения одной линзы микроскопа. Объектив с номером 40 обозначается в масштабе 1:40 или просто в 40 раз. Если вы умножите коэффициент линзы на коэффициент окуляра, вы получите увеличение.
Нажмите, чтобы узнать больше …
4,10,40,100 Окуляр Верхний элемент микроскопа.Окуляр состоит из нескольких линз и служит для визуального наблюдения за объектом. В микроскопии степень увеличения выражается как -x.
Нажмите, чтобы узнать больше …
10x / 18 Вайтфельд Источник питания Разъем питания Конденсатор Конденсатор служит для обеспечения равномерного равномерного освещения объекта. Конденсатор Аббе состоит из системы линз и регулируемой диафрагмы. С его помощью вы можете установить оптимальный контраст для объекта.
Нажмите, чтобы узнать больше …
Конденсатор Аббе, NA 1,25 с ирисовой диафрагмой Оптическая система DIN (160 мм) Вместимость
Покрытие оптической системы План (цель плана, скорректированная бесконечность) яркое Поле да Механика
Тип постройки бинокль Просмотр позы (°) Описывает положение, в котором вы смотрите в окуляр, например, под углом 45 ° или прямо.
Нажмите, чтобы узнать больше …
Угол обзора 30 °, вращающаяся на 360 ° головка Фокусировка Грубый и тонкий механизм Стадия образца 125×116 мм Особенности
Работа от аккумуляторной батареи — Держатель фильтра — Встроенная цифровая камера — Диафрагма светового поля да Сумка для пылезащитного чехла да Стадия центрирования да Общие
Длина (мм) 350 Ширина (мм) 170 Рост (мм) 210 Масса (грамм) 4000 Серии В-150 Эта серия — идеальный выбор для студентов, которым нужен инновационный и простой в использовании продукт.
Нажмите, чтобы узнать больше…
Цвет белый Область применения
Образование да Биология и медицина да Область применения
Университет да OMAX Microscope AmScope 3-х компонентный профессиональный набор для чистки микроскопов, фотоаппаратов и ноутбуков
Подробнее
Настоящий профессионал набор для очистки очищает оптические поверхности от мусора, как грязные отпечатки пальцев, грязь и пыль.Неаэрозольный очиститель безопасен для использования на оптических линзах микроскопов, объективов DC и DV профессиональных камеры, экраны ноутбуков, ЖК-экраны и др. поверхности. В комплект для чистки входит неаэрозольный чистящий растворитель, безопасная для оптики ткань и мягкая щетка для очистки углов и боковин экранов и линзы.
Особенности:
- Сейф для оптики поверхности
- Неаэрозольный очиститель может удалить масло и мусор из источников как отпечатки пальцев или пыль
- Растворитель не оставлять водяных следов на поверхности
Технические характеристики:
- Кисть длина: 5-1 / 2 дюйма (13.5 см)
- 100 мл чистящего средства раствор
- Очистка размер ткани: 5-7 / 8 «x 6-3 / 4» (15 x 17см)
- Масса в упаковке:
500 г (1 фунт)
Упаковка Список:
- Одна уборка ткань
- Одна бутылка неаэрозольного чистящего растворителя
- Одна щетка
Лабораторная установка для нанесения покрытий на поверхность образца с помощью сканирующего электронного микроскопа — Китайская установка для нанесения покрытий на золото, установка для плазменного распыления
Лабораторная установка для нанесения покрытий на поверхность образца для сканирующего электронного микроскопа с золотым напылением
Небольшая машина для плазменного распыления и испарения два-в-одном оборудована Мишень для распыления постоянного тока и узел термического испарения, который можно использовать не только для нанесения металлической пленки плазменным напылением, но также для получения углеродных или других металлических элементарных пленок путем испарения.
Компоненты прибора сильно интегрированы, что позволяет выполнять два вида покрытий в одной камере. Эта машина для нанесения покрытий использует кварцевую камеру высокой чистоты в качестве вакуумной камеры, и процесс нанесения покрытия полностью виден. Прибор оснащен двухступенчатым роторно-пластинчатым вакуумным насосом, который может быстро достичь степени вакуума 1,0E-1 Па и может соответствовать условиям вакуума, требуемым для большинства экспериментов по нанесению напыления и экспериментов по диодному напылению. Этот прибор имеет небольшие размеры, что позволяет сэкономить место и может использоваться на испытательном стенде.Одна машина предназначена для нескольких целей, что рентабельно и очень удобно для крупных университетов и исследовательских институтов.
Применение Установка для плазменного напыления и нанесения покрытий термическим испарением:
Распыление золота на поверхность образца с помощью сканирующего электронного микроскопа, напыление углерода с паром золота и другие операции, а также производство испытательного электрода из непроводящего материала.
Машина для нанесения покрытий с плазменным напылением и термическим испарением Технические параметры:Малая двухкомпонентная машина для нанесения покрытий Пробный столик Размер 80 мм мм Расстояние до источника испарения 50 мм регулируетсяРаспылительная головка постоянного тока Номер 2 дюйма × 1 Система испарения Источник испарения Корзина с вольфрамовой проволокой Макс.
Термопара типа S Вакуумная камера Размер камеры φ180 мм × 100 мм Окно часов Всенаправленная прозрачность 9025 9025 Материал верхней части 9024 9024 Кварцевый материал 9024 Высокая чистота крышка re подвижный Вакуумная система Механический насос Пластинчато-роторный насос Насосный соединитель KF16 Измерение вакуума Датчик сопротивления Выхлопной патрубок 9024 902 9025 9020E-1Pa Источник питания AC; 220 В 50/60 Гц Скорость откачки Пластинчатый насос: 1,1 л / с Конфигурация мощности распылителя Количество Источник питания постоянного тока 9025 x1 9024 Выходная мощность 150 Вт Другое Напряжение питания AC220V, 50 Гц Габаритные размеры 360 мм × 300 мм × 470 мм Общая мощность 1,5 кВт 9024 9024 9024
Другая машина для нанесения покрытий:
Основанная в 2005 году компания Zhengzhou CY Scientific Instrument Co., Ltd. — компания, специализирующаяся на разработке и производстве оборудования для лабораторных исследований. Продукция смешивается, прессуется, обжигается, режется, шлифуется, полируется, покрывается, аналитическое оборудование и сопутствующие расходные материалы. Продукция включает лабораторное оборудование для спекания, оборудование для нанесения покрытий и так далее. В настоящее время он экспортируется в 25 стран и регионов, таких как США, Европа и Юго-Восточная Азия, и был хорошо принят различными научно-исследовательскими подразделениями.
У нас есть зрелая команда по исследованию и развитию технологий, количество технических специалистов составляет 33, в компании 150 человек, более 500 квадратных метров офисных помещений, завод занимает площадь около 1500 квадратных метров, расположенный в Чжэнчжоу High-tech Зона Электронного Индустриального Парка.Продукты в основном расположены на исследовательском рынке, обслуживают научные исследования в лабораториях университетов и колледжей, а также могут настраивать продукты в соответствии с вашими потребностями.
В. Вы производитель или торговая компания?A. Мы являемся профессиональными производителями лабораторного оборудования, имеем собственную проектную группу и завод, обладаем зрелым техническим опытом и можем гарантировать качество продукции и оптимальную цену.
В.Как у вашей компании система послепродажного обслуживания продуктов?
A. Гарантийный срок на продукцию 12 месяцев, можем обеспечить пожизненное обслуживание. У нас есть профессиональные отделы предпродажного и послепродажного обслуживания, которые могут ответить вам в течение 24 часов для решения любых технических проблем.
В. Как долго ваш срок доставки? Если я хочу настроить инструмент, сколько времени это займет?
A. 1. Если товар есть на складе, то это 5-10 дней.2. Мы можем предоставить нашим клиентам индивидуальные услуги. Обычно это занимает 30-60 дней в зависимости от технических характеристик индивидуального инструмента.
В. Блок питания и вилка в нашей стране разные. Как решить эту проблему?
A. Мы можем поставить трансформатор и вилку в соответствии с вашими местными требованиями в соответствии с вилками питания в разных странах.
В. Как платить?
A. T / T, L / C, D / P и т. Д. Рекомендуется использовать торговую гарантию Alibaba.
В. Как упаковка товаров? Способы доставки?
A. 1. Стандартный экспортный знак фумигации деревянный ящик упаковка 2. Экспресс, воздушная, морская доставка в соответствии с требованиями заказчика, найдите наиболее подходящий способ.
Дополнительные вопросы, обращайтесь в службу поддержки клиентов
Покрытие методом распыления — SEM — Подготовка образцов
Сложные образцы для SEM
Сканирующие электронные микроскопы (SEM) — это универсальные инструменты, которые могут предоставлять информацию на наноразмерном уровне о широком диапазоне образцов с минимальной подготовкой образцов или без нее.В некоторых случаях, однако, распыление покрытия на образцы перед работой с SEM необходимо для получения высококачественного изображения SEM.
СЭМможет отображать все виды образцов: керамику, металлы и сплавы, полупроводники, полимеры, биологические образцы и многое другое. Однако некоторые типы образцов являются более сложными и требуют дополнительного шага, поскольку образец готовится для сбора высококачественной информации. Этот дополнительный шаг включает покрытие вашего образца дополнительным тонким слоем около 10 нанометров (нм) из проводящего материала, такого как золото, серебро, платина или хром.
При необходимости напыленияБлагодаря своей высокой проводимости материалы покрытия могут увеличивать отношение сигнал / шум во время визуализации с помощью SEM и, следовательно, создавать изображения более высокого качества. Среди сложных образцов, требующих нанесения покрытия методом распыления, есть светочувствительные и непроводящие материалы.
- Образцы, чувствительные к лучу : Образцы, чувствительные к лучу, в основном являются биологическими образцами, но могут быть и других типов, например, материалы из пластмасс.Электронный пучок в сканирующем электронном микроскопе обладает высокой энергией и во время взаимодействия с образцом передает часть своей энергии образцу в основном в виде тепла. Если образец состоит из материала, чувствительного к электронному лучу, это взаимодействие может повредить часть или всю структуру. В этом случае покрытие методом распыления материала, не чувствительного к лучу, может действовать как защитный слой от такого рода повреждений.
- Непроводящие материалы : Из-за своей непроводящей природы поверхность непроводящих материалов действует как ловушка для электронов.Возникающее в результате накопление электронов на поверхности называется «зарядкой» и создает на образце очень белые области, которые могут влиять на информацию об изображении. Когда используется напыление, проводящий материал покрытия действует как канал, который позволяет заряжающим электронам удаляться из материала.
Недостатки напыления для РЭМ(слева) Эффект зарядки непроводящего образца. (Справа) Изображение этого образца с помощью детектора обратного рассеяния электронов после нанесения золотого покрытия толщиной 10 нм.
Покрытие методом распыления образцов для РЭМ имеет свои недостатки.Во-первых, требуется дополнительное время и усилия для определения оптимальных параметров покрытия. Что еще более важно, поверхность образца содержит не исходный материал, а материал, покрытый напылением, и, следовательно, контраст атомных номеров теряется. В некоторых крайних случаях этот метод может привести к изменению топографии поверхности или к ложной элементарной информации об образце.
Однако в большинстве случаев параметры процедуры нанесения покрытия методом распыления тщательно выбираются, и эти проблемы не возникают, что позволяет пользователю получать необходимые точные и высококачественные изображения.
Материалы, использованные для нанесения покрытия на ваш образецИсторически наиболее часто используемым материалом покрытия для распыления было золото из-за его высокой проводимости и относительно небольшого размера зерна, что делает его идеальным для получения изображений с высоким разрешением. Если требуется энергодисперсионный рентгеновский анализ (EDX), пользователи SEM обычно покрывают свои образцы углеродом из-за того, что пик рентгеновского излучения углерода не конфликтует с пиком любого другого элемента.
В настоящее время люди также используют другие материалы покрытия с еще более мелким размером зерна, такие как вольфрам, иридий и хром, когда требуется получение изображений сверхвысокого разрешения.Другие материалы покрытия включают платину, палладий и серебро, причем последнее имеет преимущество обратимости.
Для получения наилучших изображений, полученных с помощью SEM, образцов определенного типа требуют дополнительной подготовки образцов. Покрытие методом распыления может быть эффективным методом для получения высококачественных изображений, полученных с помощью SEM, при работе со сложными образцами, такими как светочувствительные и непроводящие материалы.
Чтобы узнать больше о нанесении покрытия распылением как о методе подготовки образцов на сканирующем электронном микроскопе, заполните эту форму и поговорите с экспертом.
Эрик Луйк — специалист по маркетинговым коммуникациям в Thermo Fisher Scientific. Подпишитесь сейчас, чтобы получать обновления Accelerating Microscopy прямо на ваш почтовый ящик.
Поделиться статьей
Введение в подготовку образцов и визуализацию с помощью криоэлектронной микроскопии для структурной биологии
Методы. 2016 1 мая; 100: 3–15.
Ребекка Ф. Томпсон
a Astbury Center for Structural Molecular Biology, University of Leeds, Leeds LS2 9JT, United Kingdom
Matt Walker
b MLW Consulting, 11 Race Hill, Launceston, Cornwall PL15 9 Соединенное Королевство
C.Алистер Зиберт
c Центр электронной био-визуализации, Harwell Science and Innovation Campus, Didcot, Oxfordshire OX11 0DE, United Kingdom
Stephen P. Muench
a Astbury Center for Structural Molecular Biology, University of Leeds, Leeds LS2 9JT, Великобритания
Neil A. Ranson
a Astbury Center for Structural Molecular Biology, University of Leeds, Leeds LS2 9JT, United Kingdom
a Astbury Center for Structural Molecular Biology, University of Leeds, Leeds LS2 9JT, Великобритания
b MLW Consulting, 11 Race Hill, Launceston, Cornwall PL15 9BB, United Kingdom
c Центр электронного био-визуализации, Harwell Science and Innovation Campus, Didcot, Oxfordshire OX11 0DE, Великобритания
Поступила 01.12.2015; Пересмотрено 11 февраля 2016 г .; Принята в печать 25 февраля 2016 г.
Это статья в открытом доступе по лицензии CC BY (http://creativecommons.org/licenses/by/4.0/).
Эта статья цитируется в других статьях в PMC.Abstract
Просвечивающая электронная микроскопия (ЭМ) — это универсальный метод, который можно использовать для получения изображений биологических образцов, начиная от интактных эукариотических клеток и заканчивая отдельными белками> 150 кДа. Существует несколько стратегий подготовки образцов для визуализации с помощью ЭМ, включая отрицательное окрашивание и криогенное замораживание.За последние несколько лет крио-ЭМ претерпела «революцию в разрешении» благодаря как достижениям в аппаратном обеспечении для визуализации, программному обеспечению для обработки изображений, так и улучшениям в подготовке образцов, что привело к увеличению числа исследователей, использующих крио-ЭМ в качестве инструмента исследования. Тем не менее, крио-ЭМ по-прежнему является быстро развивающейся областью, в которой возникают уникальные проблемы. Здесь мы суммируем соображения по визуализации ряда образцов от макромолекулярных комплексов до клеток с помощью ЭМ.
Ключевое слово: Электронная микроскопия
1.Введение
Просвечивающая электронная микроскопия (ЭМ) может использоваться для получения структурной информации о различных биологических образцах, от клеток до макромолекул. Разрешающая способность информации, которую можно получить с помощью ЭМ, зависит от свойств образца, используемого метода подготовки образца, технических характеристик электронного микроскопа и параметров изображения. Трехмерная информация может быть получена из двумерных ЭМ-данных, собранных различными способами, включая анализ отдельных частиц [1], [2], спиральную реконструкцию [3], электронную томографию (с усреднением субтомограммы или без нее) [4], [5 ] и 2D кристаллография [6], [7].Эти методы обработки данных подходят для разных выборок; анализ отдельных частиц для очищенных, «гомогенных» белковых комплексов (таких как рибосома [8]), спиральная реконструкция для белковых сборок со спиральной симметрией (например, микротрубочек [9]), томография для «уникальных» сборок (таких как органеллы и клетки) [10]), а также 2D-кристаллография для белков, значительно меньше 150 кДа, которые образуют упорядоченные 2D-массивы (такие как бактериородопсин [11]). При анализе одиночных частиц используются множественные двумерные проекционные изображения без наклона, которые содержат множество «одиночных частиц» с разной угловой ориентацией.Угловые отношения между каждым видом образца можно рассчитать на изображениях, чтобы получить трехмерную информацию. Электронная томография и двумерная кристаллография позволяют получить разные угловые изображения, многократно наклоняя один и тот же образец (обычно наклоняя образец на ± 65 ° и делая изображение каждые 2 °, что дает 65 изображений одной и той же области). Угловое соотношение между каждым изображением известно, поскольку определено приращение наклона, и поэтому его можно использовать для восстановления трехмерной информации. Создание трехмерной структурной информации из двумерных микрофотографий и электронограмм с использованием описанных выше методов обработки подробно рассматривалось в других работах [1], [2], [6], [7], [12].
Здесь шаги к определению биологической структуры с помощью ЭМ обсуждаются с упором на подготовку образцов и визуализацию образцов для анализа отдельных частиц (пример рабочего процесса показан на) и электронной томографии, хотя многие из обсуждаемых концепций и соображений можно переносить.
Пример рабочего процесса для определения структуры с помощью ЭМ одиночных частиц.
2. Подготовка образца
При создании образца для визуализации с помощью ЭМ методика окончательной подготовки образца может повлиять на соображения на этапе подготовки или очистки образца ().Чтобы выполнить ЭМ одной частицы, тысячи идентичных частиц визуализируются и вычисляются вместе. Таким образом, идеальный образец, состоящий из одной частицы, должен быть максимально однородным. Гетерогенность может быть результатом как конформационной изменчивости и гибкости, так и изменений состава, таких как присутствие или отсутствие различных субъединиц или партнеров по связыванию. Вариации состава можно уменьшить биохимически, используя соответствующие методы очистки белка, хотя биохимически «чистый» образец не гарантирует, что образец будет выглядеть гомогенным в ЭМ; структурные устройства и внутренняя гибкость могут создавать широкий спектр конформаций.В случае конформационных вариаций и в некоторых случаях неоднородности состава буферные условия в растворе могут резко изменить внешний вид образца в микроскопе; Высокопроизводительный скрининг может использоваться для определения оптимальных составов буфера [13]. Химическое сшивание также может быть полезным инструментом для уменьшения неоднородности образца; были разработаны такие методы, как GRAFIX, которые позволяют очищать образец на основе стехиометрии (рассмотрено в [14]), однако химическое сшивание может привести к появлению артефактов, таких как захват комплекса в неродной или нефункциональной форме.Другие подходы к снижению конформационной гибкости включают лиганд-индуцированную стабилизацию, когда молекулы, такие как субстрат, лиганд, ингибитор или партнеры связывания белок / нуклеиновая кислота, могут способствовать образованию стабильного комплекса, стратегия, которая хорошо известна в рентгеновской кристаллографии [15].
Таблица 1
Типичное использование стандартных методов подготовки сетки.
Метод подготовки сетки Типичные образцы Типичное оборудование Типичные результаты Вспомогательное оборудование Дополнительные соображения Визуализация отрицательных окрашивающих комплексов, проксиметрических молекул ячейки EM с вольфрамовой нитью Визуализация образца с высокой контрастностью - — Блок тлеющего разряда / УФ-лампа для обработки углеродных поверхностей
- — Различные пятна, такие как уранилацетат или молибдат аммония, могут быть оптимальными для разные образцы
- — Некоторые буферы для образцов могут вызывать проблемы, в том числе присутствие детергента, фосфата, восстановителя или глицерина
- — Образец может (иногда сильно) деформироваться пятном
- — — Образец может принимать предпочтительную ориентацию на угле
- — Оптимизированное пятно глубина важна для получения наилучших результатов
Реконструкция с негативным окрашиванием Макромолекулярные комплексы, которые кажутся достаточно однородными EM с нитью LaB6, детектор CCD Разрешение ограничено размером зерна образца, обычно до ∼20 Å в лучшем случае - — Программное обеспечение и компьютерное оборудование для обработки данных
Криогенная визуализация Макромолекулярные комплексы (> 150 кДа, липосомы, органеллы, прокариотические и эукариотические клетки EM с LaB6 или FEG, филамент DED, криодержатель и станция переноса образца Визуализация образца с низким контрастом - — Программное обеспечение и компьютерное оборудование для обработки данных
- — Контраст образца низкий по сравнению с образцами с отрицательным окрашиванием
- — Буфер для образца компоненты могут снизить контраст образца, например глицерин, сахароза и детергент
- — Процесс витрификации может потребовать оптимизации для достижения наилучших результатов, включая оптимизацию условий блоттинга и поддерживающих пленок.Когда используется тонкая непрерывная углеродная поддерживающая пленка, образец может принимать предпочтительные ориентации на угле.
- — Образцы менее ∼ 500 кДа могут быть очень сложными для визуализации
- — Как правило, образцы должны быть в 10–50 раз более концентрированными, чем используемые в визуализация отрицательного окрашивания для достижения аналогичного распределения частиц
Криогенная реконструкция (одиночная частица) Макромолекулярные комплексы (> 150 кДа В качестве криогенной визуализации предпочтительнее DED В зависимости от образца реконструкция составляет ∼3–20 Å - — ЭМ с временным разрешением, если применимо
- — Несущая пленка может существенно повлиять на распределение частиц.Сплошная углеродная пленка может способствовать распределению частиц, но это может внести предпочтительную ориентацию частиц и шум в изображение
Криогенная реконструкция (томография) Органеллы, прокариотические клетки, тонкие края или пластинки эукариотических клеток Как криогенные визуализация, предпочтение отдается DED, энергетические фильтры и фазовые пластины могут принести большую пользу Разрешение томограмм <10 нм, усреднение субтомограмм может дать реконструкцию> 10 Å - — CLEM
- — Фрезерование FIB или HPF и секционирование, где образец слишком толстый для прямой визуализации
- — Используйте поддерживающие пленки с размером ячеек 200, чтобы обеспечить высокий наклон
- — Дополнительные золотые реперные маркеры могут быть полезны для выравнивания изображений серии наклона
Часто встречающаяся проблема для некоторых образцов — получение достаточной концентрации белка. нс для подготовки ЭМ сеток.Хотя общий объем, необходимый для изготовления сетки, невелик (∼3–5 мкл), достижение достаточно высоких концентраций на электромагнитной сетке может оказаться сложной задачей. Эти проблемы специфичны для производимого белка / образца и обычно решаются во «влажной лаборатории». Однако некоторые стратегии во время подготовки проб для ЭМ могут использоваться для увеличения плотности частиц, например, обработка поверхности решетки (раздел 3.3).
Хотя оптимизация образца перед попыткой изображения остается жизненно важной, улучшенное качество данных с камер прямого обнаружения электронов и новые алгоритмы обработки изображений означают, что некоторая неоднородность в наборе данных может быть устранена на этапах обработки [16].В самом деле, устранение этой неоднородности, вызванной функциональным циклом интересующего белка, может дать неоценимую информацию о биологических механизмах [8], [17].
3. Подготовка сетки
Когда образец готов, его необходимо подготовить для получения изображений с помощью ЭМ. Для получения изображений с помощью электронов микроскоп находится в высоком вакууме, в котором гидратированные биологические образцы быстро обезвоживаются. Таким образом, чтобы получить изображение биологического образца, его необходимо зафиксировать, желательно в нативном (или нативном) состоянии.Еще одно соображение — это толщина образца. В некоторых случаях образец может быть слишком толстым для «передачи» электронов, что является предпосылкой для передачи ЭМ, и поэтому образец может нуждаться в обработке, чтобы сделать его тоньше. Выбор метода подготовки в конечном итоге определяется природой образца и разрешением, необходимым для предполагаемого биологического исследования, но общие методы включают отрицательное окрашивание, вложение / срезы пластика и стеклование.
ЭМ сеток традиционно 3.Диаметр 05 мм, изготовлен из металлической сетки, такой как медь, золото, никель, молибден или родий. Чаще всего используются медные сетки, но все чаще встречаются золотые опоры, особенно когда клетки должны быть выращены непосредственно на сетке, поскольку они нетоксичны для клеток. Металлическая сетка поддерживает пленку сверху. Размер ячейки или количество квадратов в сетке определяется как количество квадратов в одном дюйме. Например, сетка с ячейками 200 содержит 20 квадратов в каждом направлении, а сетка с ячейками 300 — 30 квадратов.Сетки 200–400 меш чаще всего используются для крио-ЭМ. Поверх металлической подложки осаждается поддерживающая пленка, разные поддерживающие пленки используются для разных целей (раздел 3.3). Более мелкие размеры ячеек обеспечивают лучшую опору для пленки, но когда сетка наклонена, стержни могут блокировать луч. Поэтому сетки 200 ячеек чаще всего используются для сбора данных рядов наклона.
3.1. Отрицательное окрашивание
Типичное применение: Высокая контрастность и скорость подготовки сетки отрицательно окрашенных образцов делают его идеальным для оценки чистоты, концентрации, неоднородности и конформационной гибкости образцов.Трехмерные реконструкции с низким разрешением из окрашенных данных также могут предоставить исходные модели для крио-ЭМ исследований с более высоким разрешением .
Преимущества: Высокая скорость подготовки и хороший контраст образца. Кроме того, существует возможность мечения антителами или золотом для дальнейшего облегчения функциональных исследований и определения стехиометрии. Сетка может быть легко сохранена в течение многих лет и преобразована в образ .
Недостатки: структуры с ограниченным разрешением (∼> 20 Å), только топология поверхности, возможность окрашивания артефактов, несовместимость с некоторыми буферами и / или реагентами .
Отрицательное окрашивание — это распространенный метод исследования образца, особенно макромолекулярных комплексов, при комнатной температуре. С конца 1950-х годов было задокументировано множество вариантов метода отрицательного окрашивания с использованием нескольких различных красителей тяжелых металлов [18]. Обычно образцы адсорбируются на тонкую (~ 10 нм) непрерывную углеродную поддерживающую пленку, которая становится гидрофильной (раздел 3.3). Затем его окрашивают раствором соли тяжелых металлов, обычно 1-2% (мас. / Об.) Уранилацетата или уранилформиата, и промокают, чтобы получить тонкий слой пятна, при этом пятно не мигрирует на обратную сторону сетки.Известно, что некоторые общие компоненты буфера () отрицательно влияют на качество окрашивания. Тем не менее, большое разбавление концентрированного образца совместимым буфером непосредственно перед нанесением на сетку — самый простой способ улучшить это. Если это невозможно, можно также промыть сетку перед окрашиванием. Процесс окрашивания быстро обезвоживает образец и окутывает его пятном (когда образец визуализируется отсутствием пятна, происходит отрицательное окрашивание; когда сам образец окрашивается, происходит положительное окрашивание) ().Получающаяся в результате оболочка из атомов тяжелых металлов создает амплитудный контраст и относительно высокое отношение сигнал / шум (SNR) (формирование изображения в ПЭМ было рассмотрено в [12]). Для получения оптимального изображения должна быть достигнута правильная глубина пятна, при этом информация теряется, когда пятно слишком глубокое или слишком мелкое. Обезвоживание образца и его деформация при адсорбции являются недостатками подготовки образца с отрицательной окраской. Кроме того, разрешение окрашенных изображений ограничено размером зерна пятна, который определяет, насколько хорошо оболочка пятна отражает структуру объекта [19].Использование непрерывной углеродной поддерживающей пленки может привести к тому, что образцы будут иметь предпочтительную ориентацию на сетке, что усложнит определение трехмерной структуры из-за отсутствия изображений. Несмотря на эти проблемы, отрицательно окрашенные образцы могут генерировать трехмерные данные и предоставлять неоценимую биологическую информацию [20], [21]. Например, отрицательное окрашивание можно использовать для выяснения связывания низкомолекулярных ингибиторов в течение нескольких недель [22], оценки конформационных изменений [23], [24], стабильности комплекса [25] и стехиометрии / положения субъединицы [26], [27].Полный обзор процесса отрицательного окрашивания приведен в [28].
Положительное и отрицательное окрашивание с использованием солей тяжелых металлов. При отрицательном окрашивании (А) пятно полностью покрывает макромолекулярный комплекс; на микрофотографии комплекс выглядит белым на темном фоне. Положительное окрашивание (B) приводит к тому, что небольшое количество пятна образует тонкую оболочку вокруг молекулы, что означает, что образец выглядит темным на светлом фоне.
Отрицательное окрашивание также можно сочетать с витрификацией (Раздел 3.2), в методике пробоподготовки, известной как криоотрицательное окрашивание. Этот метод сочетает в себе высокую контрастность окрашивания тяжелыми металлами с защитными эффектами криогенной консервации (см. Обзор [29]).
3.2. Витрификация
Методы подготовки образцов, такие как окрашивание и заливка пластмасс, включают обезвоживание биологических образцов, в результате чего они в основном удаляются из их естественной водной среды. Криоиммобилизация сохраняет эту водную среду, а также уменьшает радиационные повреждения [30].Визуализация криогенно иммобилизованных образцов с помощью ЭМ известна как крио-ЭМ. Образец необходимо замораживать очень быстро, со скоростью ∼10 6 ° C / с, чтобы вода в образце и вокруг него оставалась в стекловидном состоянии [31]. Если замерзание происходит слишком медленно или образец впоследствии нагревается выше -137 ° C, температура, при которой вода расстекловывается [31], образуется кристаллический лед. По нашему опыту, нагревание образца более чем на ~ 160 ° C может привести к образованию льда низкого качества. Загрязнение льда нарушает структурную целостность образца, поскольку кристаллы отводят молекулы воды из гидратных оболочек образца или самого образца ().Образование кристаллического льда также ухудшает качество изображения, поскольку они дифрагируют электроны. Загрязнение также может происходить во время процесса замораживания, например, гексагональный лед, который можно уменьшить, работая в среде с контролируемой влажностью и минимизируя загрязнение льда в жидком азоте.
Примеры стекловидного и не стекловидного льда. A) Пустой стекловидный лед (шкала 50 нм). Б) Гексагональный лед (шкала 400 нм). C) Большой кристалл льда (белая стрелка) (шкала 400 нм). D) Вероятное загрязнение этаном (шкала 200 нм).
Хотя крио-ЭМ разрабатывается с 1970-х годов, большое количество структур высокого разрешения, депонированных за последние два года, способствовало повышенному интересу к этой технике [32], [33], [34], [35] , [36]. Здесь обсуждаются методы криоиммобилизации.
3.2.1. Погружное замораживание
Типичное применение: с помощью крио-EM можно витрифицировать и визуализировать широкий спектр образцов, от небольших (~ 150 кДа) макромолекул до целых эукариотических клеток.
Преимущества: Образец визуализируется в родном состоянии.Обработка данных может дать трехмерную структурную информацию с высоким разрешением .
Недостатки: биологические образцы должны визуализироваться с использованием низких доз электронов, чтобы предотвратить радиационное повреждение, приводящее к плохому контрасту. Иногда нетривиально оптимизировать распределение пробы и толщину льда .
Для тонких образцов, таких как суспензии макромолекул, 2D или очень маленькие 3D кристаллы, маленькие ячейки и тонкий край больших ячеек, криоиммобилизация может быть достигнута путем блоттинга для создания тонкой пленки жидкости, содержащей образец, а затем быстро заморозить его, погрузив в криоген ().Наиболее широко используемые криогены — жидкий этан или пропан, охлаждаемые жидким азотом [37]. Погружное замораживание тонких образцов используется для широкого диапазона образцов. Для каждого из них слой льда должен быть как можно более тонким, не искажая образец, и при этом полностью погружая частицу, чтобы максимизировать контраст образца. Отсутствие полного погружения образца может привести к преимущественному радиационному повреждению образца за пределами слоя льда. Промокания и погружение могут быть выполнены с помощью простых устройств, которые часто изготавливаются собственными силами [38].Однако эти устройства часто не могут обеспечить согласованные результаты внутри и между партиями подготовленных сеток. Доступно несколько коммерческих инструментов, позволяющих достичь более воспроизводимых результатов, включая модели FEI, Leica и Gatan (). Имеющиеся в продаже устройства для замораживания предлагают различные функции, которые могут быть полезны при работе с определенными образцами. Например, односторонний блоттинг может быть полезным при приготовлении сеток из прикрепленных клеток. Двустороннее промокание может привести к удалению некоторых ячеек с сетки на промокательную бумагу.Односторонний блоттинг можно проводить с «тыльной стороны» пояса, где клетки не прилипают, что позволяет избежать проблем, вызванных двусторонним блоттингом. Кроме того, некоторые макромолекулярные комплексы могут выиграть от низкой (<5 ° C) температуры и / или контроля влажности в морозильной камере. Эти соображения могут повлиять на выбор морозильного аппарата, если такой выбор имеется.
Крио-ЭМ визуализация в нескольких масштабах. А) Эукариотические клетки (шкала 6 мкм). Б) Прокариотические клетки (шкала 0.5 мкм). C) Изолированные органеллы, в данном случае микросомы (шкала 200 нм). D) Синтетические липосомы (шкала 100 нм) E) Вирусы (шкала 50 нм). F) Макромолекулярные комплексы (шкала 25 нм).
Таблица 2
Сравнение имеющихся в продаже устройств глубокой заморозки.
Модель Контроль влажности в камере Контроль температуры в камере Автоматический контроль температуры этана Режим блоттинга Дополнительная информация Leica EM GP ✓ ✓ Односторонний Дополнительный стереомикроскоп для наблюдения за блоттингом Gatan Cryo-plunge 3 ✕
(Камера установлена на 98%)✕
(Работает при температуре окружающей среды)✓ Одинарный и двойной 9024 односторонняя Съемная камера влажности FEI Vitrobot ✓ ✓ ✕ Двусторонняя В настоящее время наиболее распространенное устройство глубокой заморозки. На многих предприятиях широкий спектр образцов готовится с использованием одного и того же прибора для глубокой заморозки. После использования необходимо тщательно обеззаразить устройство, например, с помощью 70% (об. / Об.) Этанола. Для образцов, представляющих биологическую опасность, погружные морозильные камеры могут быть помещены в шкаф биобезопасности. Это защищает пользователя от аэрозолей и позволяет дезинфицировать устройство, повышая биобезопасность.
3.2.2. Замораживание под высоким давлением
Типичное применение: Толстые образцы, такие как ядерная область эукариотических клеток, срезы тканей и целые организмы, такие как Caenorhabditis elegans, которые нельзя получить путем глубокой заморозки .
Преимущества: Образец сохраняется в нативном состоянии. Может приводить к отображению структурной информации в 3D с высоким разрешением .
Недостатки: для визуализации с помощью просвечивающей электронной микроскопии, т.е. для того, чтобы образец стал прозрачным для электронов, после замораживания образец должен быть разрезан или утончен с помощью измельчения сфокусированным ионным пучком (FIB). В этом процессе есть возможность генерировать артефакты, и это может быть технически сложной задачей .
В то время как образцы тоньше края крупных клеток могут быть остеклованы путем замораживания погружением, более толстые образцы (<1 мкм), такие как ядерные и перинуклеарные области эукариотических клеток или срезы тканей, вероятно, будут испытывать некоторое образование кристаллического льда во время погружения. замораживание.Для этих образцов эффективной альтернативой является замораживание под высоким давлением (HPF). HPF включает повышение давления образца до ~ 2000 бар при понижении температуры с помощью жидкого азота [39]. Для образцов толщиной> 100 мкм и до ∼300 мкм они могут быть остеклованы с использованием HPF, но впоследствии их необходимо разрезать, чтобы они были достаточно тонкими для ПЭМ. Разделение можно проводить в криогенных условиях, что обеспечивает наилучшую сохранность образца. Этот метод, известный как криоэлектронная микроскопия срезов стекловидного тела (CEMOVIS), использует крио-ультрамикротомию с алмазным ножом для получения срезов толщиной 40–100 нм [40], [41], [42].Это полезный метод, позволяющий получать изображения толстых образцов в естественном состоянии, но он технически чрезвычайно сложен. Распространенным альтернативным подходом является выполнение замораживания образца, что позволяет делать срезы и визуализацию при комнатной температуре [43], [44]. Замораживание включает постепенное нагревание образца и замену воды ацетоном. Затем образец можно окрасить, залить смолой и разрезать. Замораживание приводит к меньшему количеству артефактов, чем традиционная пластиковая заливка, но маленькие кристаллы льда действительно образуются, вызывая перестройку клеточных структур, а окрашивание неоднородно, поэтому интерпретация изображений может быть сложной задачей.
Альтернативой секционированию является использование фрезерования FIB для уменьшения толщины образца [45], [46]. Измельчение FIB выполняется на замороженных гидратированных образцах с помощью двухлучевого сканирующего прибора EM / FIB [47]. Сфокусированный пучок ионов распространяется по поверхности образца, удаляя поверхностные атомы в процессе, известном как распыление. Сканирующий электронный микроскоп (СЭМ) позволяет одновременно осуществлять неразрушающий контроль за процессом измельчения [47]. Ионы галлия широко используются из-за их летучести и низкой температуры плавления [47].Пучок ионов генерируется источником ионов жидкого металла и высвобождается вытяжным электродом. Электромагнитные линзы и диафрагмы используются для фокусировки ионного пучка, а дефлекторы — для управления схемой фрезерования. Фрезерование FIB может привести к появлению артефактов, поскольку распыленный материал может повторно отложиться на поверхности образца, хотя правильно расположенное охлаждаемое устройство защиты от загрязнений может уменьшить это. Дифференциальная скорость измельчения также может привести к образованию полос или завес на поверхности, а также может происходить местное нагревание / расстекловывание.Однако созданы условия, при которых температура не поднимается настолько, чтобы это стало обычной проблемой [48]. Для обеспечения гладкой поверхности во время фрезерования могут быть предприняты конкретные шаги, такие как использование системы впрыска газа для создания металлоорганического слоя платины, покрывающего образец, который защищает его от некоторых артефактов, вызванных неравномерным распылением во время фрезерования [49]. Измельчение FIB может использоваться либо в сочетании с визуализацией с помощью SEM, как при серийной визуализации поверхности блока, либо измельченный образец переносится на TEM [45], [46].После первого успешного эксперимента с крио-ФИП в 2003 году [50] были разработаны рабочие процессы для улучшения и оптимизации техники, включая in situ криоламелл для приготовления клеток, выращенных на ЭМ сетках. Технология Cryo-FIB все еще развивается; Одним из особенно интересных достижений является реализация корреляционной световой микроскопии в сочетании с фрезерованием FIB [51].
3.3. Поддерживающие пленки
Ключевым моментом при подготовке сетки является выбор сетки и поддерживающей пленки.Для крио-ЭМ обычно используются перфорированные углеродные пленки, позволяющие визуализировать образец во льду, подвешенном между отверстиями в углеродной опорной пленке. Для негативного окрашивания используются сплошные углеродные пленки. Однако, по нашему опыту, сродство образцов к углеродным пленкам может резко различаться. Поверхностные свойства углерода можно изменить с помощью различных процессов, включая воздействие УФ-излучения, тлеющего разряда, поли-L-лизина или обработки моющими средствами [52], [53]. В крио-ЭМ изменение зарядовых свойств углеродной пленки может изменить разделение образца на отверстия, но это необходимо оптимизировать для каждого образца.Некоторые образцы обладают очень высоким сродством к углеродной пленке, для этих образцов иногда выгодна тонкая непрерывная углеродная пленка, наложенная на перфорированную пленку. Такой углеродный слой может улучшить распределение частиц, но должен быть тонким (<10 нм), чтобы предотвратить добавление чрезмерного шума к изображениям. Такие тонкие углеродные пленки также могут быть чрезвычайно хрупкими, поэтому существует компромисс между стабильностью углерода и толщиной. Пленки из перфорированного аморфного углерода доступны в продаже и могут состоять из регулярных массивов отверстий одинакового размера, как в случае сеток Quantifoil® и C-Flat ™, или из нерегулярных, как в пластинчатом углероде.Решетки из перфорированной углеродной пленки с ультратонкой (3–5 нм) сплошной углеродной пленкой также можно приобрести на рынке или изготовить на месте.
Несущие пленки из аморфного углерода широко используются, но не без проблем. Они могут быть несовместимыми между партиями, и качество аморфной углеродной пленки со временем может ухудшиться. Кроме того, нестабильность пленок из аморфного углерода способствует движению частиц, индуцированному пучком, размывая изображение образца [54]. Для решения этих проблем разрабатываются новые материалы, в том числе золотые опорные пленки, графен и легированные пленки карбида кремния, которые, по-видимому, уменьшают движение частиц, индуцированное пучком [55], [56], [57].Усовершенствования для поддерживающих пленок могут значительно повысить качество сбора криоЭМ-данных как без наклона, так и под наклоном.
4. Визуализация
Как показано на, оптимальное оборудование для ЭМ сильно зависит от запланированного эксперимента по визуализации. Часто приходится искать компромисс между производительностью, стоимостью, удобством и доступностью инструмента. Здесь обсуждается выбор источника электронов, детектора электронов и оборудования для увеличения отношения сигнал / шум на изображениях.
4.1. Источник электронов
Электронная пушка электронного микроскопа извлекает и ускоряет электроны и обычно представляет собой термоэмиссионный источник электронов или полевой термоэлектронный эмиттер, такой как эмиссионная пушка Шоттки, широко известная как автоэмиссионная пушка (FEG) [58 ]. Обычные традиционные термоэлектронные источники включают в себя вольфрамовые нити или кристаллы гексаборида лантана (LaB6), которые нагреваются так, что потенциал напряжения превышает работу выхода, необходимую для освобождения электронов, и работают при напряжениях от 80 до 200 кВ [58].Для сравнения, FEG представляет собой чрезвычайно тонкую вольфрамовую нить, покрытую оксидом циркония, обычно работающую при напряжении извлечения 200–300 кВ и при 1800 K (1526 ° C) [58]. ФЭГ намного ярче и когерентнее по сравнению с обычными термоэлектронными источниками, и поэтому они предпочтительнее для электромагнитных исследований с высоким разрешением. Однако они значительно дороже как в покупке, так и в обслуживании. Поэтому выбор пистолета должен отражать проводимый эксперимент. Например, отрицательная окраска EM не требует яркости и когерентности источника FEG.
4.2. Электронные детекторы
Электроны высокой энергии, используемые в ПЭМ-изображении, регистрируются с помощью детектора. Записывающие устройства включают фотопленку, камеры с заряженной связью (CCD) или прямые электронные детекторы (DED). Крио-ЭМ-изображения биологических образцов изначально зашумлены из-за низких доз электронов, используемых для предотвращения радиационного повреждения образца. Идеальный детектор не добавил бы шума, но на практике все детекторы добавляют. Это может быть выражено как детективная квантовая эффективность (DQE) детектора, квадрат отношения выходного сигнала к шуму (SNR o ) по отношению входного сигнала к шуму (SNR i ) [59].Идеальный детектор имел бы DQE равный 1 по всем пространственным частотам.
Исторически для сбора электромагнитных данных использовалась пленка из-за ее большого поля зрения и чрезвычайно маленького «пикселя» (размер зерна кристаллов галогенида серебра в эмульсии). Однако запись больших наборов данных на пленку неудобна и требует много времени. Пленочная эмульсия содержит воду и вносит загрязнения в колонку электронного микроскопа, поэтому требует осушения перед загрузкой и устройств защиты от загрязнений в микроскопе.Это также ограничивало количество изображений, которые можно было собрать за один день, до ~ 100. Пленка также должна быть проявлена и оцифрована с использованием чрезвычайно точного и, следовательно, дорогостоящего денситометра. Камеры CCD были разработаны как более удобное решение, которое также позволило разработать процедуры автоматической юстировки микроскопа и получения изображений, а также значительно улучшить возможность сбора серий наклона. В ПЗС-матрице используется люминофор (или аналогичный) сцинтиллятор, который вызывает испускание фотонов при ударе электронов.Затем камера CCD преобразует эти фотоны в электрические сигналы. Чип CCD имеет массив светочувствительных элементов, в которых накапливается электрический заряд. Заряд передается в считывающий регистр, усиливается и оцифровывается для формирования изображения. DQE камеры CCD уступает пленке при энергиях электронов, обычно используемых для получения изображений. Сцинтилляционный слой приводит к рассеянию электронов и, следовательно, фотонов, вызывает потерю чувствительности, а также вводит функцию рассеяния точки, зависящую от ускоряющего напряжения.Несмотря на эти проблемы, данные, собранные на камеру CCD при соответствующих условиях изображения, могут быть обработаны до субнанометрового разрешения [60].
За последние несколько лет использование DED произвело революцию в биологических ТЕА. Сочетая преимущества детектора с высоким DQE с удобством электронного считывания, DED теперь являются предпочтительным детектором для ЭМ высокого разрешения [61]. Детекторы MAPS в настоящее время являются наиболее распространенными; они обнаруживают падающие электроны непосредственно, когда они проходят через полупроводниковую пластину глубиной ∼10 мкм, где они выделяют энергию.Некоторые электроны обратно рассеиваются от несущей матрицы и снова проходят через полупроводник, создавая шум. В результате DED с высоким DQE значительно «истончаются», что подразумевает удаление максимально возможной части опорной матрицы (до <50 мкм). Это резко снижает обратное рассеяние и, следовательно, шум, поскольку большинство электронов проходит прямо через детектор. Моделирование методом Монте-Карло показывает, что чем тоньше подложка, тем меньше наблюдается рассеяние [62]. DED коммерчески доступны от трех производителей, FEI, Direct Electron и Gatan, каждый из которых имеет профиль DQE лучше, чем пленка [59].
Основным дополнительным преимуществом DED является их способность распределять дозу по нескольким кадрам, создавая фильм с экспозицией. Это достижение стало возможным благодаря высокой частоте кадров DED. Это бесценно, так как каждая рамка может быть выровнена относительно друг друга, что позволяет корректировать движение образца (вызванное как механическим дрейфом, так и движением, вызванным лучом) [63], [64], [65]. Структуры с разрешением, близким к атомному, были определены с использованием DED всех трех производителей [16], [36], [66], [67].
4.3. Энергетические фильтры и фазовые пластины
Получение изображений с низкой дозой означает, что крио-ЭМ создает изображения с низким отношением сигнал / шум. Чтобы получить максимальную информацию с высоким разрешением в изображениях, они должны быть взяты близко к фокусу, где контраст изображения минимален [12]. Для борьбы с этим были разработаны две дополнительные технологии для увеличения отношения сигнал / шум в изображениях: фазовые пластины и энергетические фильтры.
При визуализации с использованием электронов часть электронов, которые взаимодействуют с образцом, неупруго рассеиваются, т.е.е. они передают энергию в образец. Их результирующая более низкая энергия и, следовательно, большая длина волны означает, что они сфокусированы в плоскости, отличной от упруго рассеянных электронов [12]. Неупруго рассеянные электроны можно рассматривать как одну из форм хроматической аберрации, вносящей шум. Энергетическая фильтрация может предотвратить влияние неупруго рассеянных электронов на записанное изображение. В настоящее время доступны два энергетических фильтра: омега-фильтр в колонке (Ом) и энергетический фильтр Гатана после колонки (GIF) [58].Оба работают по принципу, согласно которому электроны с разной энергией / длиной волны могут отклоняться по разным траекториям, а это означает, что только электроны, которые упруго взаимодействуют (или не взаимодействуют вообще) с образцом, вносят вклад в изображение. Это может значительно улучшить отношение сигнал / шум. Энергетическая фильтрация особенно полезна для сбора серий наклона, так как при больших наклонах образец становится толще в направлении луча, а величина неупругого рассеяния пропорциональна толщине.
При визуализации неокрашенных биологических образцов наблюдается небольшой амплитудный контраст [12].Однако эту проблему можно решить, расфокусировав микроскоп и введя фазовый контраст, хотя и за счет потери информации, зависящей от разрешения. Чтобы решить эту проблему, были разработаны фазовые пластины. Они работают, внося дополнительный фазовый сдвиг в более сильно рассеянные компоненты луча. Фазовые пластины позволяют получать изображения в фокусе (или близком к нему), сохраняя информацию и создавая достаточный контраст для визуализации образца. Хотя концепция разрабатывалась в течение многих лет, практическое применение фазовых пластин было реализовано только в последние несколько лет.Выделяют два основных типа: потенциал Цернике и потенциал Вольта.
Фазовая пластина Цернике (ZPP) представляет собой тонкую углеродную пленку с небольшим (~ 1 мкм) отверстием, которое выровнено так, чтобы через него проходил нерассеянный луч [68]. Рассеянные электроны проходят через углеродную пленку и претерпевают примерно сдвиг на π / 2 относительно нерассеянного пучка. Это вызывает переключение функции передачи контраста (CTF) с синусоидальной на косинусоидальную, повышая отношение сигнал / шум на низких пространственных частотах и обеспечивая контраст изображения. ZPP коммерчески доступны в JEOL EM и с прекрасным эффектом использовались в томографических экспериментах [10].Однако изображения, полученные с помощью ZPP, могут страдать от артефактов окаймления вокруг высококонтрастных элементов из-за внезапного появления CTF [69]. ZPP также требует времени на настройку и имеет короткий непредсказуемый срок службы (около 1 недели), который не зависит от использования.
Фазовые пластины с вольта-потенциалом (VPPP) используют пленку аморфного углерода толщиной ∼12 нм, нагретую до 200 ° C для введения необходимого фазового сдвига [70]. Физика, лежащая в основе этого явления, остается неясной, но предполагается, что он функционирует за счет индуцированного пучком Вольта-потенциала [70].Это может происходить из-за модификации поверхности углерода, индуцированной пучком, вместе с химическим равновесием между поверхностью углерода и остаточными газами в колонне микроскопа. VPPP не привносят окаймляющих артефактов, и, как сообщается, они остаются стабильными в течение нескольких месяцев [70]. Поскольку VPPP были разработаны недавно, они не подвергались всестороннему тестированию, но теперь коммерчески доступны в микроскопах FEI.
Поскольку обе конструкции фазовых пластин увеличивают отношение сигнал / шум на низких пространственных частотах, они особенно полезны при выполнении электронной томографии.Для работы с отдельными частицами еще предстоит увидеть, сколько пластин полезной фазы принесут. В принципе, однако, пока они эффективно передают информацию на высоких пространственных частотах, они могут уменьшить объем данных, необходимых для создания структуры, до того же разрешения по сравнению с набором данных, собранным без фазовой пластины [71], и могут быть полезны. для образцов, которые очень малы или трудно выравниваются [72].
4.4. Автоматический сбор данных
Отношение сигнал / шум крио-ЭМ изображений очень низкое, поэтому для создания структуры с использованием методов обработки отдельных частиц обычно требуется очень много изображений отдельных частиц (> 1000 с) [2].Количество требуемых микрофотографий сильно варьируется и зависит от образца (например, его размера, предпочтительной ориентации и симметрии), количества частиц на микрофотографии, желаемого разрешения и уровней неоднородности в наборе данных. В результате было разработано несколько пакетов программного обеспечения для автоматизации сбора данных и более эффективного использования времени микроскопа. Одним из часто используемых пакетов является программное обеспечение для автоматического сбора данных FEI EPU, или «E Pluribus Unum». Были разработаны программы с открытым исходным кодом с аналогичной функциональностью, такие как Leginon [73], [74], TOM 2 [75], [76] и SerialEM [77].Также было разработано программное обеспечение для автоматического сбора серий наклона, включая SerialEM [77], UCSF Tomo [78], Xplore3D (FEI) и Leginon [79]. Также предпринимаются усилия по внедрению полуавтоматических конвейеров обработки данных для крио-ЭМ данных [80].
4.5. Доступ к объектам
Несмотря на то, что последние достижения в области аппаратного обеспечения впечатляют, современные микроскопы, DED и сопутствующее оборудование дороги в приобретении, эксплуатации и обслуживании. MRC LMB, Кембридж, Великобритания, оценивает свои текущие расходы в 3000 фунтов стерлингов в день плюс еще 1000 фунтов стерлингов на электроэнергию [81].Сложность и затраты на приобретение и обслуживание современного микроскопа становятся недоступными для многих лабораторий.
Централизованные помещения с научным оборудованием имеют много преимуществ, число которых выросло по мере роста размеров, сложности и стоимости оборудования. Чтобы сделать высококачественные крио-ЭМ более доступными, становятся доступными некоторые общие помещения, такие как Медицинский институт Говарда Хьюза (HHMI) в кампусе Janelia Farm, штат Вирджиния, США, который открыт для исследователей, финансируемых HHMI и находящихся в других местах.В Нидерландах NeCEN — это крио-ЭМ-центр открытого доступа. В Великобритании Центр электронного био-визуализации (eBIC) в Diamond Light Source (Харвелл, Великобритания) является национальным крио-ЭМ центром, финансируемым за счет грантов Wellcome Trust и UK Research Councils [82].
Для успешной и эффективной работы полной 24-часовой внешней пользовательской программы на нескольких высокотехнологичных электронных микроскопах требуется оборудование, которое остается открытым, доступным и безопасным в течение всего периода времени. Материально-техническое обеспечение и затраты на это выходят за рамки возможностей большинства университетов.Эффективная организация внешней пользовательской программы на нескольких высокопроизводительных микроскопах — серьезная задача, требующая большого количества обслуживающего персонала. Требования к хранению и обработке данных также представляют собой серьезные проблемы, и они значительно упрощаются за счет доступа к крупномасштабному централизованному хранилищу данных и вычислительной инфраструктуре. Наличие на месте и круглосуточной дежурства квалифицированного персонала для поддержки этих возможностей имеет решающее значение для оптимальной работы. Финансирование и строительство ЭМ-установок в США и Европе облегчили доступ к микроскопам высокого класса для всех в научном сообществе [82].Мы надеемся, что размещение eBIC в Diamond Light Source выиграет от обширного опыта на месте в области автоматизации оборудования, обработки образцов, корреляционных микроскопий, а также специального программного обеспечения и групп детекторов, что позволит добиться значительных научных достижений в этих областях, таких как были недавно достигнуты. в сообществе макромолекулярной кристаллографии (MX) [83].
5. Дополнительные методы
В то время как ЭМ может быть мощным инструментом для исследования структуры и функции как таковых, ЭМ все чаще используется в сочетании с другими методами или техниками для внесения дополнительных измерений в эксперименты.Это включает стыковку, а иногда и уточнение существующих структур высокого разрешения из рентгеновской кристаллографии или ЯМР в карты плотности [84]. Здесь обсуждаются два новых метода, которые добавляют дополнительные измерения к структурным исследованиям ЭМ: корреляционная световая электронная микроскопия и методы ЭМ с временным разрешением.
5.1. Корреляционная электронная микроскопия
Криоэлектронные томограммы клетки могут быть очень сложными для интерпретации. Как можно однозначно идентифицировать особенности? Хотя в некоторых случаях морфологическая идентификация может быть сделана с высокой степенью уверенности, например, при визуализации митохондрий и цитоскелета, многие особенности томограмм нельзя идентифицировать исключительно на основе морфологии.Кроме того, ЭМ все чаще используется для изучения пространственно и временных редких событий, таких как эндоцитоз и проникновение вируса в клетки [85], [86]. В результате были разработаны методы, позволяющие найти «иголку в стоге сена» или конкретный интересующий объект и дать функциональные интерпретации.
Флуоресцентная микроскопия в сочетании с флуоресцентными маркерами и клонируемыми флуоресцентными метками привела к огромным успехам в клеточной биологии [87], [88], [89]. За счет использования различных флуоресцентных меток можно одновременно отслеживать пространственное и временное расположение многих белков или клеточных компонентов.Существуют два основных подхода к воспроизведению такого рода функций в EM: создание клонируемых меток / маркеров точек интереса и корреляционная световая электронная микроскопия (CLEM).
Два ключевых вопроса при разработке эксперимента CLEM: какие методы флуоресцентного микроскопа (FM) и ЭМ комбинировать, и как проводить корреляции. Было объединено множество различных методов микроскопии и разработаны решения для определения корреляции, ограниченный выбор из которых будет обсуждаться здесь ().Методы корреляции информации из двух или более методов микроскопии делятся на две категории. Первые — это интегрированные микроскопы, способные работать с двумя режимами визуализации. Поскольку образец не перемещается между инструментами, риск повреждения и загрязнения снижается, а интересующая область может быть расположена в одном режиме визуализации, а затем визуализирована непосредственно с использованием другого. Одним из имеющихся в продаже вариантов является система FEI iCorr, которая объединяет FM в микроскоп Tecnai G 2 [90]. А 15 × 0.5 линз NA интегрирован; одна лазерная линия позволяет получать изображения GFP, AlexaFluor488 или других спектрально схожих флуорофоров. FM находится в вакууме ЭМ и устанавливается перпендикулярно электронному пучку ПЭМ, то есть сетка поворачивается на 90 ° для переключения между режимами визуализации. Хотя встроенные двухрежимные микроскопы удобны, они могут быть чрезмерно дорогими.
Таблица 3
Темы исследований и методы микроскопии объединены в CLEM.
Исследование Техника визуализации 1 Техника визуализации 2 Ссылка Внутриклеточная динамика Живые клетки FM Иммуноголд, маркирующий смолу, залитую секциями клеток меченые белкиFM живых клеток ET срезов, залитых смолой (фотопреобразование диаминобензидина с использованием отбеливания GFP) [102] Динамика эндосом FM живых клеток Ультратонкие криосрезы с маркировкой иммунным золотом [103] Эндоцитоз в дрожжах FM на срезах, залитых смолой ET на срезах, залитых смолой [104] Инфекция ВИЧ-1 Интервал живых клеток FM / cryo-FM Cryo-ET на тонком краю целых клеток HeLa [105] Митохондрии 9 0249 Cryo-FM Cryo-ET на тонком краю клеток HUVEC [106] Herpesviridae белков Cryo-FM (в колонке) Крио-мягкая рентгеновская микроскопия [107]Эндосомы Крио-FM (крио-стадия Linkam) Криомягкая рентгеновская микроскопия [108] Частицы аденовируса CryoFM (FEICryostage 908) -EM[96] Вторая категория включает создание изображения на двух отдельных инструментах и систему реперных маркеров для навигации к интересующей области во втором режиме визуализации.Хотя такие корреляции сложнее реализовать, они могут быть менее дорогими и более гибкими, чем интегрированные системы. FM криогенно закрепленных образцов (крио-FM) в настоящее время все чаще используется в сочетании с ПЭМ. Было продемонстрировано, что флуорофоры все еще флуоресцируют в крио-условиях, и фактически обесцвечивание флуорофоров замедляется [91].
Несколько столиков микроскопа были разработаны для выполнения FM в криогенных условиях как в вертикальных, так и в перевернутых оптических системах, и широкий спектр методов микроскопии может быть выполнен в криогенных условиях, включая конфокальную микроскопию и визуализацию z-стека [91], [92], [93].Очень дешевые столики для крио-световой микроскопии (<40 долларов США) были разработаны из материалов, которые обычно можно найти в хозяйственных магазинах, хотя их функциональность и стабильность ограничены по сравнению с коммерческими моделями [94]. Наиболее часто используемые коммерческие стадии крио-FM - это криостадия 2 от FEI, разработанная совместно с Баумейстером и его коллегами [95], и криостадия Linkam (Linkam Scientific Instruments) в сотрудничестве с Костером и коллегами, а также криогенная стадия Leica EM cryo CLEM, разработанная с участием Джон Бриггс.
При использовании крио-FM-этапов для перехода к интересующей области между FM и TEM необходимо использовать маркеры на несколько порядков в масштабе. Сетки с большими визуальными маркерами, такими как цифры, буквы или символы, могут использоваться для грубой навигации (). Элементы внутри квадрата сетки, такие как обычные углеродные отверстия Quantifoil, также могут использоваться для грубых корреляций. Для более точных корреляций в крио-FM / EM можно использовать комбинацию флуоресцентных микросфер TetraSpek и флуоресцентных электронно-плотных микросфер для выполнения точных корреляций до ~ 60 нм [96].
Примеры поддерживающих ЭМ пленок. A) Углерод с отверстиями, например Quantifoil ® R2 / 2 (отверстия 2 мкм, разделенные на 2 мкм), масштабная линейка 1 мкм. Б) Ажурная углеродная пленка (неравномерная сетка из тонкого углерода), шкала 1 мкм. C) Сетка Finder (здесь с углем Quantifoil ® R2 / 2), масштабная линейка 10 мкм.
Флуоресцентные электронно-плотные маркеры, такие как квантовые точки (КТ), идеально подходят для корреляций. КТ обычно изготавливаются из селенида кадмия или аналогичного материала с оболочкой, такой как сульфид цинка [97].Они могут быть покрыты полимером, который допускает широкий диапазон функционализации, например, стрептавидином или фрагментами Fab 2 , что означает, что они также подходят для мечения белков [97]. Флуоресцентные свойства квантовых точек «настраиваются» по их размеру, при этом более мелкие квантовые точки обычно флуоресцируют на более коротких длинах волн [98]. Теоретически это позволяет различать различные квантовые точки в ПЭМ, однако на практике это может быть проблематичным, поскольку их ядро не очень электронно-плотное [98].Было показано, что в пластиковых закладных частях можно выделить до трех размеров квантовых точек [97]. КТ фотостабильны и яркие, что делает их идеальными для методов флуоресцентной визуализации [99].
CLEM — это развивающаяся область, и в ближайшие годы, вероятно, будут объединены многие другие методы визуализации. Например, в стадии разработки находятся этапы, позволяющие получать изображения со сверхвысоким разрешением (например, PALM / STORM) замороженных гидратированных образцов [100]. Еще одна интересная область, которая, вероятно, будет расширяться, — это использование крио-ФМ для управления измельчением крио-ФИП и крио-ЭТ, что уже было продемонстрировано как технически осуществимое [95].Используя эту комбинацию методов, можно получить представление о молекулярном разрешении редких пространственных или временных событий в толстых областях клетки, таких как ядро или перинуклеарная область [47].
5.2. Разрешенные во времени EM
Макромолекулярные комплексы могут быть динамическими, претерпевая конформационные изменения под действием определенных стимулов, таких как связывание с лигандом. Эти конформационные изменения могут происходить в различных временных масштабах, от фемтосекунд до часов [109]. Изучение конформационных изменений, которые происходят в коротких временных масштабах, может быть особенно сложной задачей, поэтому методы подготовки образцов для крио-ЭМ были адаптированы для обеспечения анализа макромолекулярных комплексов с временным разрешением до <10 мс [110].Путем замораживания образцов для крио-ЭМ они захватываются в определенных конформациях, и, таким образом, путем смешивания двух реагентов, например фермента и его субстрата, заданное время до стеклования, временное измерение может быть включено в эксперимент.
Один из наиболее распространенных подходов к достижению временного разрешения использует технику распыления, основанную на ранних работах Анвина и Берримана, где один реагент распыляется на сетку, а второй реагент распыляется перед замораживанием [111].В альтернативном подходе выполняется быстрое смешивание двух реагентов, которые затем распыляются на тонкую пленку, которая быстро остекловывается. Самое быстрое разрешение по времени, о котором сообщалось, было достигнуто с использованием монолитного микроволоконного кремниевого устройства, которое включает в себя механизм смешивания, инкубационный канал и пневматический распылитель в одном чипе [110], [112]. Он способен обеспечить перемешивание за 0,4 мс и минимальное время реакции 9,4 мс [110]. С помощью этой методологии была исследована динамика мостиков, связывающих 30S- и 50S-субъединицы бактериальных рибосом [110].Это будущее развитие, вероятно, значительно улучшится в следующем десятилетии с повышенным интересом и развитием в области ЭМ. Также разрабатывается дополнительный подход — отображение непрерывных состояний, в которых определенные целочисленные состояния не существуют [113].
6. Вычислительные аспекты
Для многих биологических образцов сбор набора данных хорошего качества — это только начало. Обработка крио-ЭМ данных может представлять серьезную проблему. Здесь обсуждаются вопросы хранения данных и вычислений.ЭМ-структуры основаны на усреднении тысяч молекулярных изображений после получения изображений при обработке отдельных частиц или на сборе множества изображений как части серии наклона в томографических экспериментах. Таким образом, ЭМ всегда была неизбежно дорогостоящей в вычислительном отношении. Хотя недавнее появление камер прямого обнаружения электронов с их высокой частотой кадров произвело революцию в определении крио-ЭМ структуры, это требует дополнительных огромных затрат на хранение данных и вычислительные ресурсы.
При использовании традиционных камер CCD проблема хранения данных значительна, но решаема.Размер 32-битного изображения формата MRC 4k × 4k, снятого высококлассной камерой CCD, такой как Gatan US4000, составляет ∼64 Мб. Если требуется набор данных из 10 000 частиц и на каждой микрофотографии фиксируется 100 частиц, это составляет ∼6,4 Гб необработанных данных изображения. Однако, хотя типичная камера DED, такая как FEI Falcon 2, может по-прежнему быть сенсором 4k × 4k, она работает на частоте 17 Гц. Типичная двухсекундная экспозиция на микроскопе на самом деле снимается как 35-кадровый фильм размером ∼2,2 Гб. Также требуются большие наборы данных для определения структуры с высоким разрешением.Наконец, чтобы обеспечить более высокое разрешение, увеличение изображений, вероятно, будет значительно выше, чтобы получить более точную выборку объекта, которая может описывать функции с высоким разрешением. Такое увеличение увеличения уменьшает поле зрения и, таким образом, улавливает меньше частиц на микрофотографию. Типичный собранный набор данных может легко превысить 5 ТБ данных. Следовательно, на уровне отдельного набора данных DED увеличивают требования к хранению данных на 2–3 порядка. Однако следует отметить, что детектор на высшем уровне Gatan K2 может захватывать изображения размером 8k × 8k с частотой кадров до 40 Гц, что может добавить к этому расчету дополнительную разницу в величине.
На уровне ЭМ-объекта при 24-часовом автоматическом сборе данных с использованием программного обеспечения для автоматизации обычно может быть захвачено около 1800 таких видеороликов с экспозицией или около 4 Тб данных. При 300 рабочих днях в году это составит 1,2 петабайта необработанных данных изображения. Это дополнительно увеличивается с последующей обработкой, такой как коррекция дрейфа. Поэтому необходимо тщательно продумать проектирование инфраструктуры хранения данных для поддержки таких объектов и применяемых ими политик хранения данных.Практически все начинается с базовой сетевой инфраструктуры. Соединения Ethernet на 10 Гбит / с — разумное минимальное требование для перемещения такого объема данных, и 40 Гбит может быть желательным. Требуются модульные серверы хранения данных и файловые системы, которые могут масштабироваться до размеров в несколько петабайт, но необходимо принимать осторожные решения о том, что и как долго хранится, потому что долгосрочное архивирование каждого сгенерированного байта будет непомерно дорогостоящим при минимальной выгоде. Более разумным подходом может быть сохранение всех данных, включая кадры фильма, пока проект находится в режиме реального времени, но при этом долгосрочное хранение только средних значений с коррекцией движения.Это уменьшит масштаб исходных данных примерно в 30–60 раз.
Предоставление вычислительных ресурсов для поддержки определения структуры — отдельная важная задача. Требуемые ресурсы быстро масштабируются в зависимости от физического размера объекта и довольно сильно различаются между пакетами обработки изображений. Используя обычно используемый пакет RELION в качестве эталона, структуры в лаборатории Ranson обычно определялись с использованием одноядерных многоядерных серверов на базе процессоров Intel и AMD.Например, четырехпроцессорный, 64-ядерный, 256 Гбайт сервер использовался для определения структуры в объеме 480 × 480 × 480 с разрешением 3,0 Å, включая обработку фильмов [36]. Однако для более крупных структур, более быстрого определения структуры и одновременного определения нескольких структур мы теперь обычно используем большие кластеры Linux. Кластеры с межсоединениями 10 Гбит и Infiniband работают очень хорошо, а большие структуры обычно используют сотни ядер. Следует отметить, что наш опыт показывает, что уточнение «средней структуры» приводит к генерации 2–5 Тб данных в дополнение к необработанным данным.Для тех, у кого нет доступа к компьютерам, достаточно мощным для выполнения задач обработки, услуги облачных вычислений могут представлять собой гибкое и экономичное решение [114], хотя необходимо следить за тем, чтобы такие решения соответствовали местным политикам защиты данных.
7. Проблемы и перспективы
Возникает тенденция к интеграции информации, полученной с помощью различных структурных методов, включая рентгеновскую кристаллографию и ЯМР. Банк данных по белкам (PDB) содержит> 100000 структур, выявленных с помощью рентгеновской кристаллографии, и> 11000 с помощью ЯМР, включая как мультибелковые комплексы, так и одноцепочечные белки и пептиды.Однако широкий спектр биологически интересных белков и белковых комплексов сопротивляется структурному определению с помощью этих методов либо из-за трудности кристаллизации, либо из-за того, что их размер или динамические свойства в настоящее время препятствуют определению структуры с помощью ЯМР. Для сравнения, крио-ЭМ — это быстро развивающийся метод определения структуры с высоким разрешением. Банк данных электронной микроскопии (EMDB) содержит> 2500 карт плотности, выпущенных обработкой отдельных частиц, спиральной реконструкцией и дифракцией электронов; Тенденции показывают, что количество осаждений растет из года в год, при этом выпускается гораздо больше структур с высоким разрешением ().Однако остаются проблемы с проверкой и подтверждением заявленных значений разрешения. В отличие от значения R-free для рентгеновской кристаллографии, в настоящее время не существует объективного и однозначного критерия качества, который был бы простым и легким в использовании. Даже сообщение о разрешении карты плотности является предметом интенсивных и непрекращающихся споров и споров.
Количество структур в EMDB. A) Совокупные выпуски карт в EMDB за период с 2002 по 2015 год. B) Выпуски карт с заданными уровнями разрешения в период с 2002 по 2015 год.
В то время как появление крио-ЭМ и методов одиночных частиц в качестве мощного инструмента для определения структуры с высоким разрешением (<5 Å) является захватывающим и меняет наше понимание ряда макромолекулярных комплексов, определение структуры методами ЭМ для более низкого разрешения может также быть невероятно проницательным. Криоэлектронная томография выявляет структурные свойства комплексов, иногда in situ, , в диапазоне 5–10 нм, в то время как усреднение субтомограмм позволяет получить структуры лучше 10 Å [115].Для карт плотности ∼8–20 Å кристаллические структуры или структуры ЯМР отдельных компонентов комплекса могут быть подогнаны к картам электронной плотности для получения биологической информации [116], [117]. При еще более низком разрешении можно использовать отрицательное окрашивание EM, чтобы получить представление о конформационной гибкости или расположении сложных субъединиц. В заключение, ЭМ — это очень гибкий метод, способный предложить биологическое понимание ряда различных биологических вопросов с разным размером и масштабом разрешения, и в сочетании с дополнительными методами определения структуры и визуализации представляет собой мощный инструмент в новую эпоху интегративных технологий. структурная биология.
Благодарности
Мы благодарны Wellcome Trust за финансирование этой работы в виде стипендий для аспирантов в RT (096685 / Z / 11 / Z).
Ссылки
1. Lau W.C.Y., Rubinstein J.L. Электронная микроскопия одиночных частиц. Методы Мол. Биол. 2013; 955: 401–426. [PubMed] [Google Scholar] 4. Бриггс Дж.А.Г. Структурная биология in situ — возможности усреднения субтомограмм. Curr. Opin. Struct. Биол. 2013; 23: 261–267. [PubMed] [Google Scholar] 5. Лючич В., Форстер Ф., Баумейстер В. Структурные исследования с помощью электронной томографии: от клеток к молекулам.Анну. Rev. Biochem. 2005; 74: 833–865. [PubMed] [Google Scholar] 6. Шенк А.Д., Кастаньо-Диез Д., Гипсон Б., Архейт М., Зенг X., Штальберг Х. Трехмерная реконструкция из двумерного изображения кристалла и данных дифракции. Meth. Энзимол. 2010. 482: 101–129. [PubMed] [Google Scholar] 7. Arheit M., Castaño-Diez D., Thierry R., Gipson B.R., Zeng X., Stahlberg H. Бактериофаги. Humana Press; Тотова, Нью-Джерси: 2012. Обработка двумерных изображений кристаллов. С. 171-194. [Google Scholar] 8. Бай X.С., Фернандес И.С., Макмаллан Г., Шерес С.Х., Кульбрандт В. Рибосомные структуры с разрешением, близким к атомному, из тридцати тысяч крио-ЭМ-частиц. eLife. 2013; 2 [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Лю Дж. С., Шуберт С. Р., Фу Х., Фурниол Ф. Дж., Джайсвал Дж. К., Худусс А. Молекулярные основы специфической регуляции нейрональных моторов кинезина-3 с помощью белков семейства даблкортина. Мол. Клетка. 2012; 47: 707–721. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Dai W., Fu C., Raytcheva D., Flanagan J., Khant H.A., Liu X., Rochat R.H., Haase-Pettingell C., Пирет Дж., Лудтке С.Дж., Нагаяма К., Шмид М.Ф., Кинг Дж. А., Чиу В. Визуализация промежуточных продуктов сборки вируса внутри морских цианобактерий. Природа. 2013; 502: 707. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Хендерсон Р., Болдуин Дж. М., Ческа Т. А., Землин Ф., Бекманн Э., Даунинг К. Х. Модель структуры бактериородопсина на основе электронной криомикроскопии высокого разрешения. J. Mol. Биол. 1990; 213: 899–929. [PubMed] [Google Scholar] 13. Chari A., Haselbach D., Kirves J.-M., Ohmer J., Paknia E., Фишер Н. ProteoPlex: оптимизация стабильности макромолекулярных комплексов путем скрининга разреженной матрицы химического пространства. Nat. Методы. 2015; 12: 859–865. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Старк Х. GraFix: стабилизация хрупких макромолекулярных комплексов для крио-ЭМ одиночных частиц. Meth. Энзимол. 2010. 481: 109–126. [PubMed] [Google Scholar] 15. Ведади М., Низен Ф.Х., Аллали-Хассани А., Федоров О.Ю., Финерти П.Дж., Васни Г.А. Методы химического скрининга для выявления лигандов, которые способствуют стабильности белка, кристаллизации белка и определению структуры.Proc. Natl. Акад. Sci. США, 2006 г .; 103: 15835–15840. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Вурхиз Р.М., Фернандес И.С., Шерес С.Х.В., Хегде Р.С. Структура комплекса рибосома-Sec61 млекопитающих с разрешением 3,4 ангстрем. Клетка. 2014; 157: 1632–1643. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Чжао Дж., Бенлекбир С., Рубинштейн Дж. Л. Наблюдение с помощью электронной криомикроскопии вращательных состояний эукариотической V-АТФазы. Природа. 2015 [PubMed] [Google Scholar] 18. Бреннер С., Хорн Р.В. Метод отрицательного окрашивания для электронной микроскопии вирусов высокого разрешения.Биохим. Биофиз. Acta. 1959; 34: 103–110. [PubMed] [Google Scholar] 19. Бут Д.С., Авила-Сакар А., Ченг Ю. Визуализация белков и макромолекулярных комплексов с помощью отрицательного окрашивания EM: от подготовки сетки до получения изображения. J. Vis. Exp. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Берджесс С.А., Уокер М.Л., Сакакибара Х., Оива К., Найт П.Дж. Структура динеина-c с помощью электронной микроскопии с отрицательным окрашиванием. J. Struct. Биол. 2004. 146: 205–216. [PubMed] [Google Scholar] 21. Баккер С.Е., Дакеррой С., Галлу М., Лони К., Коннер Э., Элеуэ Ж.-Ф. Нуклеопротеин-РНК комплекс респираторно-синцитиального вируса образует левосторонний спиральный нуклеокапсид. J. Gen. Virol. 2013; 94: 1734–1738. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Muench S.P., Rawson S., Eyraud V., Delmas A.F., Da Silva P., Phillips C. Связывание ингибитора PA1b с субъединицами c и e вакуолярной АТФазы показывает его инсектицидный механизм. J. Biol. Chem. 2014 [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Хескет Э.Л., Паркер-Мануэль Р.П., Чабан Ю., Сатти Р., Коверли Д., Орлова Е.В. ДНК индуцирует конформационные изменения в рекомбинантном комплексе поддержания минихромосомы человека. J. Biol. Chem. 2015; 290: 7973–7979. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Робертс А.Дж., Нумата Н., Уокер М.Л., Като Ю.С., Малкова Б., Кон Т. Кольцо AAA + и механизм поворота линкера в динеиновом двигателе. Клетка. 2009. 136: 485–495. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Wu S., Avila-Sakar A., Kim J., Booth D.S., Greenberg C.H., Rossi A. Fabs позволяют проводить криоЭМ-исследования отдельных частиц малых белков.Состав. 2012; 20: 582–592. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Расмуссен С.Г.Ф., Девре Б.Т., Цзоу Ю., Круз А.С., Чунг К.Ю., Кобылка Т.С. Кристаллическая структура комплекса β2-адренорецептор – Gs-белок. Природа. 2011; 477: 549–555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Низкий Х. Х., Губеллини Ф., Ривера-Кальсада А., Браун Н., Коннери С., Дужанкур А. Структура системы секреции типа IV. Природа. 2014; 508: 550–553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Охи М., Ли Ю., Cheng Y., Walz T. Негативное окрашивание и классификация изображений — мощные инструменты современной электронной микроскопии. Биол. Процедуры. Онлайн. 2004; 6: 23–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Де Карло С., Старк Х. Крионегативное окрашивание макромолекулярных ансамблей. Методы Энзимол. 2010. 481: 127–145. [PubMed] [Google Scholar] 30. Бейкер Л.А., Рубинштейн Дж. Л. Радиационные повреждения в электронной криомикроскопии. Методы Энзимол. 2010; 481: 371–388. [PubMed] [Google Scholar] 31. Дубоче Дж., Адриан М., Чанг Дж.-J., Homo J.-C., Lepault J., McDowall A.W. Криоэлектронная микроскопия застеклованных образцов. Q. Rev. Biophys. 1988. 21: 129–228. [PubMed] [Google Scholar] 32. Бартесаги А., Мерк А., Банерджи С., Мэттис Д., Ву Х., Милн Дж. Л.С. Крио-ЭМ-структура бета-галактозидазы с разрешением 2,2 ангстрем в комплексе с ингибитором проницаемости клеток. Наука. 2015; 348: 1147–1151. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Кэмпбелл М.Г., Вислер Д., Ченг А., Поттер С.С., Каррагер Б. Реконструкция протеасомы Thermoplasma acidophilum 20S с разрешением 2,8 ангстрем с использованием криоэлектронной микроскопии.eLife. 2015; 4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Кюльбрандт В. Революция в разрешении. Наука. 2014; 343: 1443–1444. [PubMed] [Google Scholar] 35. Ху З., Чжоу К., Чжан С., Фань С., Ченг В., Чжао Ю. Структурные и биохимические основы индуцированного самораспространения NLRC4. Science (Нью-Йорк, Нью-Йорк), 2015; 350: 399–404. [PubMed] [Google Scholar] 36. Хескет Е.Л., Мещерякова Ю., Дент К.С., Саксена П., Томпсон Р.Ф., Кокберн Дж. Дж. Механизмы сборки и упаковки генома в РНК-вирусе, выявленные с помощью крио-ЭМ высокого разрешения.Nat. Commun. 2015; 6: 10113. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Добро М.Дж., Мелансон Л.А., Дженсен Г.Дж., МакДауэлл А.В. Погружное замораживание для электронной криомикроскопии. Методы Энзимол. 2010; 481: 63–82. [PubMed] [Google Scholar] 39. Макдональд К.Л., Ауэр М. Замораживание под высоким давлением, клеточная томография и структурная клеточная биология. Биотехники. 2006 [PubMed] [Google Scholar] 40. Аль-Амуди А., Норлен Л., Дубочет Дж. Криоэлектронная микроскопия срезов стекловидного тела нативных биологических клеток и тканей.J. Struct. Биол. 2004. 148: 131–135. [PubMed] [Google Scholar] 41. Аль-Амуди А., Чанг Дж.Дж., Лефорестье А., МакДауэлл А., Саламин Л.М., Норлен Л. Криоэлектронная микроскопия срезов стекловидного тела. EMBO J. 2004; 23: 3583–3588. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Хланда П., Сакс М. Криоэлектронная микроскопия срезов стекловидного тела. Методы Мол. Биол. 2014; 1117: 193–214. [PubMed] [Google Scholar] 43. Walther P., Ziegler A. Замораживание замороженных образцов под высоким давлением: видимость биологических мембран улучшается, когда замещающая среда содержит воду.J. Microsc. 2002; 208: 3–10. [PubMed] [Google Scholar] 44. Мацко Н., Мюллер М. Эпоксидная смола как фиксатор при замораживании. J. Struct. Биол. 2005. 152: 92–103. [PubMed] [Google Scholar] 45. Шертель А., Снайдеро Н., Хан Х.-М., Рухведель Т., Лауэ М., Грабенбауэр М. Крио FIB-SEM: объемная визуализация клеточной ультраструктуры в нативных замороженных образцах. J. Struct. Биол. 2013; 184: 355–360. [PubMed] [Google Scholar] 46. Ван К., Странк К., Чжао Г., Грей Дж. Л., Чжан П. Определение трехмерной структуры нативных клеток млекопитающих с использованием крио-ФИП и криоэлектронной томографии.J. Struct. Биол. 2012; 180: 318–326. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Ригорт А., Плитцко Дж.М. Применение криофокусированного ионного пучка в структурной биологии. Arch. Биохим. Биофиз. 2015; 581: 122–130. [PubMed] [Google Scholar] 48. Марко М., Хси К., Моберличан В., Маннелла С.А., Фрэнк Дж. Фокусированное ионно-лучевое измельчение стекловидной воды: перспективы альтернативы крио-ультрамикротомии замороженных гидратированных биологических образцов. J. Microsc. 2006; 222: 42–47. [PubMed] [Google Scholar] 49. Вилла Э., Шаффер М., Плитцко Дж. М., Баумейстер В. Открытие окон в ячейке: измельчение сфокусированным ионным пучком для криоэлектронной томографии. Curr. Opin. Struct. Биол. 2013; 23: 771–777. [PubMed] [Google Scholar] 50. Малдерс Х. Использование двойного луча SEM / FIB для биологических образцов. GIT Imaging Microsc. 2003 [Google Scholar] 51. Ригорт А., Вилла Э., Бойерлейн Ф. Дж. Б., Энгель Б. Д., Плитцко Дж. М. Интегративные подходы к клеточной криоэлектронной томографии: корреляционная визуализация и микрообработка сфокусированным ионным пучком. Методы Cell Biol.2012; 111: 259–281. [PubMed] [Google Scholar] 52. Грассуччи Р.А., Тейлор Д.Дж., Франк Дж. Приготовление макромолекулярных комплексов для криоэлектронной микроскопии. Nat. Protoc. 2007; 2: 3239–3246. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Чунг М., Каджимура Н., Макино Ф., Ашихара М., Мията Т., Като Т. Метод достижения однородной дисперсии больших трансмембранных комплексов в отверстиях углеродных пленок для электронной криомикроскопии. J. Struct. Биол. 2013; 182: 51–56. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54.Руссо К.Дж., Пассмор Л.А. Электронная микроскопия. Ультрастабильные золотые подложки для электронной криомикроскопии. Science (Нью-Йорк, Нью-Йорк), 2014; 346: 1377–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Йошиока К., Каррагер Б., Поттер К.С. Криомеш: новый субстрат для криоэлектронной микроскопии. Microsc. Микроанал. 2010; 16: 43–53. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Руссо К.Дж., Пассмор Л.А. Управление адсорбцией белка на графене для крио-ЭМ с использованием низкоэнергетической водородной плазмы. Nat. Методы.2014 [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Руссо К.Дж., Пассмор Л.А. Ультрастабильные золотые подложки: свойства носителя для электронной криомикроскопии с высоким разрешением биологических образцов. J. Struct. Биол. 2016; 193: 33–44. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Уильямс Д. Б., Картер С. Б. Springer Science & Business Media; 2009. Просвечивающая электронная микроскопия. [Google Scholar] 59. Макмаллан Г., Фаруки А.Р., Клэр Д., Хендерсон Р. Сравнение оптимальных характеристик при 300 кэВ трех прямых детекторов электронов для использования в малодозовой электронной микроскопии.Ультрамикроскопия. 2014; 147: 156–163. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Cheng L., Zhu J., Hui W.H., Zhang X., Honig B., Fang Q. Модель скелета вириона акваровируса с помощью криоэлектронной микроскопии и биоинформатики. J. Mol. Биол. 2010; 397: 852–863. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Бай X.-C., Макмаллан Г., Scheres S.H.W. Как крио-ЭМ революционизирует структурную биологию. Тенденции Биохим. Sci. 2015; 40: 49–57. [PubMed] [Google Scholar] 62. Макмаллан Г., Фаруки А.Р., Хендерсон Р., Геррини Н., Турчетта Р., Джейкобс А. Экспериментальное наблюдение улучшения MTF от обратного утончения прямого электронного детектора КМОП. Ультрамикроскопия. 2009; 109: 1144–1147. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Ли X., Муни П., Чжэн С., Бут C.R., Браунфельд М. Nat. Методы. 2013; 10: 584–590. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Рубинштейн Дж. Л., Брубейкер М.A. Выравнивание крио-ЭМ фильмов отдельных частиц путем оптимизации переводов изображений. J. Struct. Биол. 2015 [PubMed] [Google Scholar] 66. Parent K.N., Tang J., Cardone G., Gilcrease E.B., Janssen M.E., Olson N.H. Трехмерные реконструкции вириона бактериофага CUS-3 выявляют консервативный I-домен белка оболочки, но отдельный домен, связывающий рецептор хвостового шипа. Вирусология. 2014; 464: 55–66. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Данев Р., Нагаяма К. Просвечивающая электронная микроскопия с фазовой пластиной Цернике.Ультрамикроскопия. 2001; 88: 243–252. [PubMed] [Google Scholar] 69. Данев Р., Нагаяма К. Оптимизация фазового сдвига и периодичности включения фазовых пластин для ПЭМ. Ультрамикроскопия. 2011; 111: 1305–1315. [PubMed] [Google Scholar] 70. Данев Р., Буйссе Б., Хошоуи М., Плитцко Дж. М., Баумейстер В. Потенциальная фазовая пластина Вольта для фокусированной фазово-контрастной просвечивающей электронной микроскопии. Proc. Natl. Акад. Sci. 2014 [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Мурата К., Лю X., Данев Р., Якана Дж., Шмид М.Ф., Кинг Дж. Зернике, фазово-контрастная криоэлектронная микроскопия и томография для определения структуры с нанометровым и субнанометрическим разрешением. Состав. 2010; 18: 903–912. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Chang W.-H., Chiu M.T.K., Chen C.-Y., Yen C.-F., Lin Y.-C., Weng Y.-P. Криоэлектронная микроскопия на фазовой пластине Цернике облегчает анализ отдельных частиц неокрашенных асимметричных белковых комплексов. Состав. 2010; 18: 17–27. [PubMed] [Google Scholar] 73. Каррагер Б., Киссеберт Н., Кригман Д., Миллиган Р.А., Поттер К.С., Пулокас Дж. Легинон: автоматизированная система для получения изображений с образцов стекловидного льда. J. Struct. Биол. 2000; 132: 33–45. [PubMed] [Google Scholar] 74. Stagg S.M., Lander G.C., Pulokas J., Fellmann D., Cheng A., Quispe J.D. Автоматизированный сбор данных криоЭМ и анализ 284742 частиц GroEL. J. Struct. Биол. 2006; 155: 470–481. [PubMed] [Google Scholar] 75. Unverdorben P., Beck F., ledź P., Schweitzer A., Pfeifer G., Plitzko J.M. Глубокая классификация большого набора крио-ЭМ данных определяет конформационный ландшафт протеасомы 26S.Proc. Natl. Акад. Sci. 2014; 111: 5544–5549. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Коринек А., Бек Ф., Баумейстер В., Никелл С., Плитцко Дж. М. Компьютерная криоэлектронная микроскопия — TOM2 — программный пакет для высокопроизводительных приложений. J. Struct. Биол. 2011; 175: 394–405. [PubMed] [Google Scholar] 77. Мастронарде Д.Н. Автоматизированная электронно-микроскопическая томография с надежным прогнозированием движений образца. J. Struct. Биол. 2005; 152: 36–51. [PubMed] [Google Scholar] 78. Чжэн С.К., Седат Дж.В., Агард Д.А. Автоматический сбор данных для электронной микроскопической томографии. Методы Энзимол. 2010; 481: 283–315. [PubMed] [Google Scholar] 79. Suloway C., Shi J., Cheng A., Pulokas J., Carragher B., Potter C.S. Полностью автоматизированный последовательный сбор данных с использованием серии наклона с помощью Leginon. J. Struct. Биол. 2009; 167: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Lander G.C., Stagg S.M., Voss N.R., Cheng A., Fellmann D., Pulokas J. Appion: интегрированный конвейер, управляемый базой данных, для облегчения обработки ЭМ изображений.J. Struct. Биол. 2009. 166: 95–102. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Каллавей Э. Революция не будет кристаллизоваться: новый метод пронизывает структурную биологию. Природа. 2015; 525: 172–174. [PubMed] [Google Scholar] 82. Сайбил Х. Р., Грюневальд К., Стюарт Д. И. Национальный центр биологической криоэлектронной микроскопии. Acta Crystallogr. D Biol. Кристаллогр. 2015; 71: 127–135. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Аллер П., Санчес-Уэзерби Дж., Фоади Дж., Винтер Г., Лобли К.M.C., Axford D. Применение дифракции на месте в платформах для определения структуры с высокой пропускной способностью. Методы Мол. Биол. 2015; 1261: 233–253. [PubMed] [Google Scholar] 84. DiMaio F., Song Y., Li X., Brunner M.J., Xu C., Conticello V. Модели атомной точности на основе данных криоэлектронной микроскопии 4.5-A с итеративным локальным уточнением на основе плотности. Nat. Методы. 2015; 12: 361–365. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Ibiricu I., Huiskonen J.T., Döhner K., Bradke F., Sodeik B., Grünewald K. Криоэлектронная томография вируса простого герпеса во время аксонального транспорта и вторичной оболочки в первичных нейронах.PLoS Pathog. 2011; 7: e1002406. [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Ган Л., Дженсен Г.Дж. Электронная томография клеток. Q. Rev. Biophys. 2012; 45: 27–56. [PubMed] [Google Scholar] 87. Цзянь Р.Ю. Зеленый флуоресцентный белок. Анну. Rev. Biochem. 1998. 67: 509–544. [PubMed] [Google Scholar] 88. Чанг Ю.В., Чен С., Точева Е.И., Тройнер-Ланге А., Лебах С., Согаард-Андерсен Л. Коррелированная криогенная фотоактивированная локализационная микроскопия и криоэлектронная томография. Nat. Методы. 2014; 11: 737–739.[Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Паез-Сегала М.Г., Сан М.Г., Штенгель Г., Вишванатан С., Бэрд М.А., Маклин Дж. Дж. Устойчивые к фиксации фотоактивируемые флуоресцентные белки для CLEM. Nat. Методы. 2015; 12: 215. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Агронская А.В., Валентийн Я.А., Ван Дриэль Л.Ф., Шнайденберг К.Т., Хумбель Б.М., ван Берген эн Хенегувен П.М., Верклей А.Дж., Костер А.Дж., Герритсен Х.С. Интегрированная флуоресцентная и просвечивающая электронная микроскопия. J. Struct.Биол. 2008. 164: 183–189. [PubMed] [Google Scholar] 91. Шварц С.Л., Сарбаш В.И., Атауллаханов Ф.И., Макинтош Дж.Р., Никастро Д. Крио-флуоресцентная микроскопия облегчает корреляцию между световой и криоэлектронной микроскопией и снижает скорость фотообесцвечивания. J. Microsc. 2007. 227: 98–109. [PubMed] [Google Scholar] 92. Сартори А., Гатц Р., Бек Ф., Ригорт А., Баумейстер В., Плитцко Дж. М. Корреляционная микроскопия: устранение разрыва между флуоресцентной световой микроскопией и криоэлектронной томографией.J. Struct. Биол. 2007. 160: 135–145. [PubMed] [Google Scholar] 93. Ван Дриэль Л.Ф., Валентийн Дж.А., Валентийн К.М., Конинг Р.И., Костер А.Дж. Инструменты для корреляционной крио-флуоресцентной микроскопии и криоэлектронной томографии, применяемые к целым митохондриям в эндотелиальных клетках человека. Евро. J. Cell Biol. 2009. 88: 669–684. [PubMed] [Google Scholar] 94. Карлсон Д. Б., Эванс Дж. Изготовление недорогого столика для крио-световой микроскопии для коррелированной световой / электронной микроскопии. J. Vis. Exp. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 95.Rigort A., Bäuerlein F.J.B., Leis A., Gruska M., Hoffmann C., Laugks T. Инструменты для микрообработки и соответствующие подходы для клеточной криоэлектронной томографии. J. Struct. Биол. 2010. 172: 169–179. [PubMed] [Google Scholar] 96. Schellenberger P., Kaufmann R., Siebert C.A., Hagen C., Wodrich H., Grünewald K. Высокоточная корреляционная флуоресценция и электронная криомикроскопия с использованием двух независимых маркеров выравнивания. Ультрамикроскопия. 2014; 143: 41–51. [Бесплатная статья PMC] [PubMed] [Google Scholar] 97. Гипманс Б.Н.Г., Диринк Т.Д., Смарр Б.Л., Джонс Ю.З., Эллисман М.Х. Коррелированная световая и электронно-микроскопическая визуализация множества эндогенных белков с использованием квантовых точек. Nat. Методы. 2005; 2: 743–749. [PubMed] [Google Scholar] 98. Браун Э., Веркаде П. Использование маркеров для корреляционной световой электронной микроскопии. Протоплазма. 2010; 244: 91–97. [PubMed] [Google Scholar] 99. Мединц И.Л., Уеда Х.Т., Гольдман Э.Р., Маттусси Х. Биоконъюгаты с квантовыми точками для визуализации, мечения и зондирования. Nat. Матер. 2005. 4: 435–446.[PubMed] [Google Scholar] 100. Кауфманн Р., Шелленбергер П., Сейрадак Э., Добби И.М., Джонс Э.Ю., Дэвис И. Микроскопия сверхвысокого разрешения с использованием стандартных флуоресцентных белков в интактных клетках в криоусловиях. Nano Lett. 2014; 14: 4171–4175. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Полищук Р.С., Полищук Е.В., Марра П., Альберти С., Буччионе Р., Луини А. Корреляционная свето-электронная микроскопия выявляет трубчато-мешковидную ультраструктуру носителей, действующих между аппаратом Гольджи и плазматической мембраной.J. Cell Biol. 2000. 148: 45–58. [Бесплатная статья PMC] [PubMed] [Google Scholar] 102. Grabenbauer M., Geerts W.J.C., Fernadez-Rodriguez J., Hoenger A., Koster A.J., Nilsson T. Корреляционная микроскопия и электронная томография GFP посредством фотоокисления. Nat. Методы. 2005; 2: 857–862. [PubMed] [Google Scholar] 103. van Rijnsoever C., Oorschot V., Klumperman J. Корреляционная световая электронная микроскопия (CLEM), сочетающая визуализацию живых клеток и иммуномечение ультратонких криосрезов. Nat. Методы. 2008; 5: 973–980.[PubMed] [Google Scholar] 104. Кукульски В., Шорб М., Каксонен М., Бриггс Дж. А.Г. Изменение формы плазматической мембраны во время эндоцитоза выявляется с помощью электронной томографии с временным разрешением. Клетка. 2012; 150: 508–520. [PubMed] [Google Scholar] 105. Джун С., Ке Д., Дебек К., Чжао Г., Мэн Х., Амброуз З. Прямая визуализация ВИЧ-1 с помощью корреляционной микроскопии живых клеток и криоэлектронной томографии. Состав. 2011; 19: 1573–1581. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Ван Дриэль Л.Ф., Валентийн Я.А., Валентийн К.М., Конинг Р.И., Костер А.Дж. Инструменты для корреляционной крио-флуоресцентной микроскопии и криоэлектронной томографии, применяемые к целым митохондриям в эндотелиальных клетках человека. Евро. J. Cell Biol. 2009. 88: 669–684. [PubMed] [Google Scholar] 107. Hagen C., Guttmann P., Klupp B., Werner S., Rehbein S., Mettenleiter T.C. Корреляционная VIS-флуоресценция и мягкая рентгеновская криомикроскопия / томография адгезивных клеток. J. Struct. Биол. 2012; 177: 193–201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 108. Герцог Э.М., Рази М., Уэстон А., Гуттманн П., Вернер С., Хенцлер К. Визуализация эндосом и аутофагосом в целых клетках млекопитающих с использованием корреляционной криофлуоресцентной и криомягкой рентгеновской микроскопии (крио-CLXM) ультрамикроскопии. 2014; 143: 77–87. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Эванс Дж. Э., Браунинг Н. Д. Обеспечение прямых наномасштабных наблюдений за биологическими реакциями с помощью динамического ПЭМ. Микроскопия. 2013; 62: 147–156. [Бесплатная статья PMC] [PubMed] [Google Scholar] 110. Шейх Т.Р., Ясин А.С., Лу З., Барнард Д., Мэн Х., Лу Т.-M. Первоначальные мосты между двумя субъединицами рибосом образуются в течение 9,4 мс, как было исследовано с помощью крио-ЭМ с временным разрешением. Proc. Natl. Акад. Sci. 2014; 111: 9822–9827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 111. Берриман Дж., Анвин Н. Анализ переходных структур с помощью криомикроскопии в сочетании с быстрым перемешиванием капель спрея. Ультрамикроскопия. 1994; 56: 241–252. [PubMed] [Google Scholar] 112. Лу З., Шейх Т.Р., Барнард Д., Менг Х., Мохамед Х., Яссин А. Монолитные микрожидкостные устройства для смешивания и распыления для криоэлектронной микроскопии с временным разрешением.J. Struct. Биол. 2009. 168: 388–395. [Бесплатная статья PMC] [PubMed] [Google Scholar] 113. Чен Б., Фрэнк Дж. Два многообещающих будущих развития крио-ЭМ: захват короткоживущих состояний и отображение континуума состояний макромолекулы. Микроскопия. 2015: dfv344. [Бесплатная статья PMC] [PubMed] [Google Scholar] 114. Cianfrocco M.A., Leschziner A.E., Scheres S.H. Недорогая, высокопроизводительная обработка данных криоэлектронной микроскопии одиночных частиц в облаке. eLife. 2015; 4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 115.Шур Ф.К.М., Дик Р.А., Хаген В.Дж.Х., Фогт В.М., Бриггс Дж.А.Г. Структура незрелых вирусоподобных частиц gag вируса саркомы Рауса показывает структурную роль домена p10 в сборке. J. Virol. 2015; 89: 10294–10302.
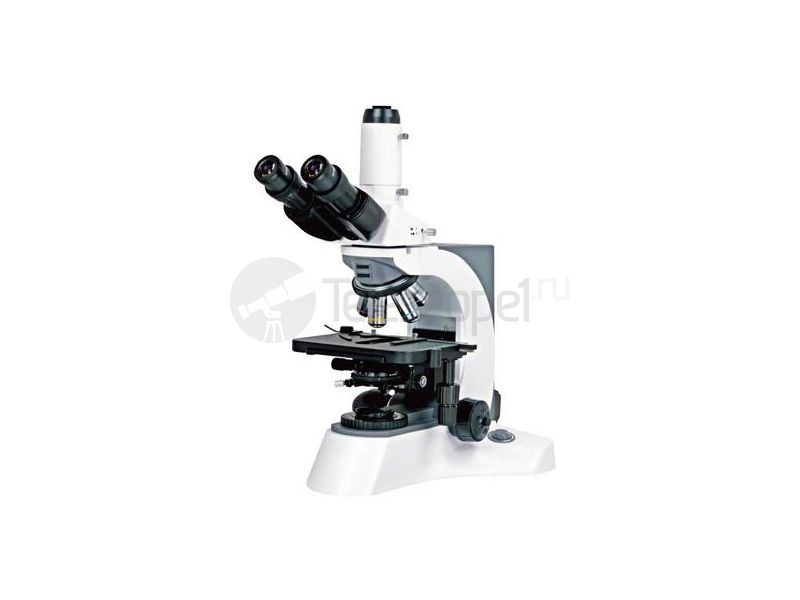

 Дело не в трогании. Используйте салфетку только один раз, а затем замените ее. .Можно использовать полиэфирные тампоны до тех пор, пока они не перестанут хорошо очищаться.
Дело не в трогании. Используйте салфетку только один раз, а затем замените ее. .Можно использовать полиэфирные тампоны до тех пор, пока они не перестанут хорошо очищаться. Все остальные очищаемые оптические компоненты должны быть максимально доступны.
Все остальные очищаемые оптические компоненты должны быть максимально доступны. Если этот шаг не увенчался успехом, повторите, используя раствор разбавленного средства для мытья посуды. Удалите все оставшиеся остатки сухим ватным тампоном, но сначала подышите открытым ртом на поверхности, чтобы образовалась пленка влаги.При этом будьте осторожны, чтобы не разбрызгать капли слюны. Эффективный метод подготовки бумаги для линз для этого метода очистки — сложить все четыре угла куска ткани вместе, оставив нетронутый центр ткани выпуклым. Углы можно слегка скрутить вместе, чтобы сформировать стержень для работы с тканью. Когда ткань удерживается этим стержнем и вытирание выполняется с помощью раздутого центра ткани, сила, которая может быть приложена к объективу, ограничивается упругостью ткани.Таким образом можно применять круговое протирающее движение с очень небольшим прямым воздействием на поверхность линзы.
Если этот шаг не увенчался успехом, повторите, используя раствор разбавленного средства для мытья посуды. Удалите все оставшиеся остатки сухим ватным тампоном, но сначала подышите открытым ртом на поверхности, чтобы образовалась пленка влаги.При этом будьте осторожны, чтобы не разбрызгать капли слюны. Эффективный метод подготовки бумаги для линз для этого метода очистки — сложить все четыре угла куска ткани вместе, оставив нетронутый центр ткани выпуклым. Углы можно слегка скрутить вместе, чтобы сформировать стержень для работы с тканью. Когда ткань удерживается этим стержнем и вытирание выполняется с помощью раздутого центра ткани, сила, которая может быть приложена к объективу, ограничивается упругостью ткани.Таким образом можно применять круговое протирающее движение с очень небольшим прямым воздействием на поверхность линзы. Жирные загрязнения всегда следует удалять с помощью растворителя. Окуните ватный или полиэфирный тампон в чистящий раствор и стряхните излишки жидкости. Избыток жидкости в ватной палочке вытечет по краю линзы и разрушает цемент линзы.Следовательно, это может привести к удалению цемента между склеиваемыми компонентами. Растворитель должен удалить как можно больше грязи. Чтобы увеличить время удерживания летучих органических растворителей в ватной палочке, некоторые пользователи охлаждают растворитель (от -10 до -20 градусов по Цельсию). У охлажденных растворителей есть недостаток. Из-за их низкой температуры на поверхности линз может образоваться конденсат и остаться следы. Более подходящий метод увеличения времени удерживания растворителя — это добавление изопропанола.
Жирные загрязнения всегда следует удалять с помощью растворителя. Окуните ватный или полиэфирный тампон в чистящий раствор и стряхните излишки жидкости. Избыток жидкости в ватной палочке вытечет по краю линзы и разрушает цемент линзы.Следовательно, это может привести к удалению цемента между склеиваемыми компонентами. Растворитель должен удалить как можно больше грязи. Чтобы увеличить время удерживания летучих органических растворителей в ватной палочке, некоторые пользователи охлаждают растворитель (от -10 до -20 градусов по Цельсию). У охлажденных растворителей есть недостаток. Из-за их низкой температуры на поверхности линз может образоваться конденсат и остаться следы. Более подходящий метод увеличения времени удерживания растворителя — это добавление изопропанола.
 Грибковое заражение лучше всего минимизировать, снизив влажность в помещении с помощью кондиционирования воздуха или установив инфракрасную лампу над микроскопом (на минимальном расстоянии 150 сантиметров или 5 футов).Грибки, растущие на стеклянных поверхностях, не прикрепляются корнями и их можно стереть, но, к сожалению, остаются следы остаточной коррозии, и исходные характеристики линз не могут быть восстановлены, и линзы необходимо заменить. Единственное эффективное средство избежать грибкового повреждения оптических компонентов — это в первую очередь предотвратить его рост. .
Грибковое заражение лучше всего минимизировать, снизив влажность в помещении с помощью кондиционирования воздуха или установив инфракрасную лампу над микроскопом (на минимальном расстоянии 150 сантиметров или 5 футов).Грибки, растущие на стеклянных поверхностях, не прикрепляются корнями и их можно стереть, но, к сожалению, остаются следы остаточной коррозии, и исходные характеристики линз не могут быть восстановлены, и линзы необходимо заменить. Единственное эффективное средство избежать грибкового повреждения оптических компонентов — это в первую очередь предотвратить его рост. . Некоторое загрязнение неизбежно из-за суровых условий повседневного использования, но, по крайней мере, микроскоп следует как можно лучше защищать в периоды неиспользования, накрыв весь инструмент подходящей крышкой. Производители инструментов и поставщики послепродажного обслуживания предлагают множество специально разработанных пылезащитных чехлов. Из нескольких доступных типов пластиковых крышек те, которые сделаны из более мягкого и гибкого материала, вероятно, менее подвержены притяжению пыли.Также доступны безворсовые тканевые чехлы, которые обеспечивают эффективный пылевой барьер, который сводит к минимуму необходимость в чистке.
Некоторое загрязнение неизбежно из-за суровых условий повседневного использования, но, по крайней мере, микроскоп следует как можно лучше защищать в периоды неиспользования, накрыв весь инструмент подходящей крышкой. Производители инструментов и поставщики послепродажного обслуживания предлагают множество специально разработанных пылезащитных чехлов. Из нескольких доступных типов пластиковых крышек те, которые сделаны из более мягкого и гибкого материала, вероятно, менее подвержены притяжению пыли.Также доступны безворсовые тканевые чехлы, которые обеспечивают эффективный пылевой барьер, который сводит к минимуму необходимость в чистке.