Методы стерилизации
Различают термические методы — физический: паровой, воздушный, гласперленовый (в среде нагретых шариков), а также ультрафиолетовое облучение воздуха помещений: перевязочных, процедурных, операционных. В клинической практике чаще всего применяются термические методы стерилизации, которые заключаются в воздействии пара под избыточным давлением и температуры стерилизации (автоклавирование) и воздействии сухого горячего воздуха, достигающего температуры стерилизации (используются сухожаровые шкафы разной модификации).
Химические
методы стерилизации
осуществляются растворами
дезинфицирующих средств или газами
изделий из полиэтилена, аппаратуры для
искусственной вентиляции легких
(ИВЛ), различных эндоскопов с волоконной
оптикой.
К химическому методу относится газовая
стерилизация
оксидом этилена, окисью пропилена,
бромистым
метилом и их смесью, а также
пароформальдегид-ный
метод.
Ультразвуковой метод стерилизации.
Стерилизация инфракрасным излучением.
Радиационный метод в (установке с источником излучения для промышленной стерилизации изделий однократного применения).
Выбор метода зависит от многих факторов, основными из которых являются:
324
Метод стерилизации
Критические параметры
Паровая
Время, температура, насыщенный пар
Воздушная (сухим теплом)
Время и температура
Оксидом этилена (ЭО)
Время, температура, влажность и концентрация ЭО
Радиационная
Полная поглощенная доза
Пароформальдегидная
Время, температура, влажность иконцентрация паров формальдегида
Централизованное стерилизационное отделение (ЦСО)
Стерилизация
изделий медицинского назначения
осуществляется
в централизованных стерилизационных
отделениях
ЛПУ.
ЦСО имеет три зоны: «грязную», «чистую» и «стерильную». Все зоны отделены стенами. Поступление материалов, изделий осуществляется через шлюзы в одном направлении по принципу «от грязного к чистому, стерильному» .
В «грязную» зону ЦСО поступает использованный материал, в том числе и прошедший этап дезинфекции на рабочих местах согласно требованиям нормативных документов. Тележки, на которых доставляется этот материал,
325
моются
и дезинфицируются в специальной комнате
ЦСО. Весь
загрязненный материал принимается и
сортируется, затем перемещается в
комнаты для подготовки специальных
инструментов, мойки, дезинфекции и
предстерилиза-ционной
очистки. Проводится контроль каждого
этапа обработки изделий медицинского
назначения, и изделия передаются в
«чистую» зону. Хирургические перчатки
после сортировки стираются и упаковываются
вместе с тест-индикаторами
процесса стерилизации. Все инструменты
в «чистой» зоне проходят технический
контроль изделий
и упаковку в: биксы (стерилизационные
коробки),
бязевые упаковки, современные упаковочные
материалы
(см. далее) с размещением в контрольные
точки термовременных
индикаторов процесса стерилизации 4-го
класса (см. далее). Укладка белья, склад
чистых изделий проводится
в «чистой» зоне. Пройдя технический
контроль,
упакованное белье и изделия автоклавируются
и перемещаются
через шлюз на стерильный склад, откуда
производится
выдача готовой стерильной продукции
или ее складирование
в пределах сроков стерилизации.
Весь
загрязненный материал принимается и
сортируется, затем перемещается в
комнаты для подготовки специальных
инструментов, мойки, дезинфекции и
предстерилиза-ционной
очистки. Проводится контроль каждого
этапа обработки изделий медицинского
назначения, и изделия передаются в
«чистую» зону. Хирургические перчатки
после сортировки стираются и упаковываются
вместе с тест-индикаторами
процесса стерилизации. Все инструменты
в «чистой» зоне проходят технический
контроль изделий
и упаковку в: биксы (стерилизационные
коробки),
бязевые упаковки, современные упаковочные
материалы
(см. далее) с размещением в контрольные
точки термовременных
индикаторов процесса стерилизации 4-го
класса (см. далее). Укладка белья, склад
чистых изделий проводится
в «чистой» зоне. Пройдя технический
контроль,
упакованное белье и изделия автоклавируются
и перемещаются
через шлюз на стерильный склад, откуда
производится
выдача готовой стерильной продукции
или ее складирование
в пределах сроков стерилизации.
Невостребованные
стерильные материалы возвращаются
на склад чистых изделий.
Условия, обеспечивающие стерильность медицинских изделий в ЦСО
Основными условиями, обеспечивающими стерильность медицинских изделий в ЦСО, являются:
Зонирование технологического процесса и наличие разграничительных стен в отделении.
Транспортные потоки не пересекаются, исключается риск повторной контаминации стерильных медицин ских изделии.
326
мируемых режимов стерилизации и т.п.), обеспечивает 100% стерильность.
Стерилизационная камера и основные узлы изготов лены из высоколегированной нержавеющей во избе жание коррозии в процессе эксплуатации стали.

Профессиональная подготовка обслуживающего пер сонала должна соответствовать требованиям к эксп луатации используемого оборудования.
Использование современных средств контроля каче ства каждого этапа обработки и процесса стерили зации.
Обеспечение соответствующего санитарного режима на выполняемых технологических операциях и в со ответствующих зонах ЦСО.
Стерилизационные упаковки
Эффективность
стерилизации зависит от упаковки.
Основная
функция упаковки — защита стерильного
материала
от повторного обсеменения микроорганизмами
(рекон-таминации).
Стерильный материал и стерильная
упаковка
не должны рассматриваться отдельно
друг от друга. Без
соответствующей упаковки стерильный
материал бесполезен,
так как нестерилен. Изделия,
простерилизован-ные
без упаковки, должны быть использованы
непосредственно
после стерилизации.
Для упаковки используются многоразовые стерилизационные коробки (биксы), различные крафт-пакеты, современные упаковочные материалы.
Стерилизации подвергаются сухие изделия в упаковках из бумаги (крафт-пакеты) мешочной непропитанной,
327
бумаги
мешочной влагопрочной. Существуют
упаковки из
двуслойной х.-б. ткани, соответствующей
ОСТу 42-21-2-85.
Сроки сохранения стерильности зависят
от упаковки.
Биксы без фильтра хранятся трое суток,
с фильтром — 20
суток. Упаковки из двуслойной х.-б. ткани
или крафт-пакеты
хранятся до трех суток в стерильных
условиях. Все упаковки маркируют.
В зависимости от химического индикатора с 1994 года пакеты изготавливаются трех разновидностей:
с химическим индикатором паровой стерилизации ИСПС;
с химическим индикатором воздушной стерилизации ИСВС;
с химическим индикатором паровой и воздушной сте рилизации ИЭ «ВИНАР».
С 1998 года Минздравом РФ разрешены к применению импортные бумажные пакеты, соответствующие требованиям международного стандарта. Срок хранения таких пакетов 20 дней. Сегодня применяются самоклеящиеся пакеты из влагопрочной бумаги для паровой и воздушной стерилизации. На внешней стороне пакета нанесен химический индикатор 1 класса с указанием соответствующего метода стерилизации и описанием конечного цвета индикатора, приобретаемого после стерилизации. Пакеты герметично закрывают с помощью самоклеящейся ленты, нанесенной на клапан пакета, без использования дополнительного оборудования.
В
ВНИМАНИЕ!
Изменение
цвета
индикатора
1 класса
не
позволяет
судить
о
соблюдении
параметров
стерилизации
и
достижении
условий,
достаточных
для
надежной
стерилизации
изделий. Для
этой
цели
необходимо
использовать
химические
индикаторы
4—6
классов
и
другие
методы
контроля,
разрешенные
к
применению.
Для
этой
цели
необходимо
использовать
химические
индикаторы
4—6
классов
и
другие
методы
контроля,
разрешенные
к
применению.
Применение пакетов для стерилизации
1. Перед применением пакеты осматривают, проверяя их целостность и срок годности по маркировке тары. Нельзя пользоваться поврежденными пакетами и с истекшим сроком годности!
зга
Размер пакета выбирают с учетом габаритов стери лизуемого медицинского изделия. Во избежание разрыва швов пакетов в процессе стерилизации пакеты не следует заполнять более чем на 2/3 объема или длины пакета.
Медицинские изделия размещают рабочими частями к закрытой стороне пакета.
Для предотвращения повреждения пакетов колющи ми и режущими инструментами могут быть использованы следующие приемы: упаковывание изделий последователь но в два пакета или обертывание рабочих частей таких изделий чистыми марлевыми или бумажными салфетками.

Укомплектованный изделием пакет закрывают сле дующим образом:
• снимают антиадгезивное покрытие с липкого слоя клапана;
• перегибают по линии сгиба клапан и прижимают его
к лицевой стороне пакета, проглаживая рукой от центра к краям пакета. Перед закрытием пакета из него следует удалить воздух путем проглаживания в сторону открытого конца.
Пакеты с упакованными изделиями укладывают в корзины для стерилизации.
Стерилизацию изделий, упакованных в пакеты, осу ществляют в стерилизаторах, разрешенных в установлен ном порядке к применению в Российской Федерации, со блюдая требования инструкции по эксплуатации стерили заторов и правила загрузки стерилизационной камеры.
Изделия, оставшиеся влажными после стерилизации паровым методом, подсушивают непосредственно при сте рилизации.
При стерилизационной обработке происходит визу ально различимое изменение цвета химического индикато ра на лицевой стороне пакета: индикатор ИСПС — для паровой стерилизации, меняет свой цвет с желтого на ко ричневый;
индикатор ИСВС — для воздушной стерилизации ме няет свой цвет с фиолетового на коричневый;
индикатор ИЭ «ВИНАР» — для паровой и воздушной стерилизации, меняет исходный цвет после воздей-
329
ствия
водяного насыщенного пара на темно-розовый,
а
в сухом горячем воздухе — на коричневый.
Срок хранения медицинских изделий после стери лизации в пакетах составляет 20 дней.
Запрещается использовать изделия из пакетов если:
нарушена целостность пакета;
химический индикатор не изменил свой цвет;
пакет находится во влажном состоянии.
При отсутствии нарушений пакет вскрывают при помощи ножниц со стороны клапана с соблюдением мер асептики. Изделие выкладывают на «стерильный стол» или сразу используют по назначению.
Хранятся пакеты в защищенном от света месте.
После использования пакеты подлежат утилизации как бытовые отходы.
Современные
прозрачные упаковочные материалы
компании
«Медтест» предназначены для сохранения
стерильности
медицинских изделий в течение длительного
времени
после стерилизации. Они выполнены из
специальной стерилизационной
бумаги с фильтрующим эффектом, отвечающей
требованиям международного стандарта. Вовнутрь
прозрачной упаковки закладывается
индикатор стерильности,
но и на внешней стороне пакета имеется
индикатор
процесса, обеспечивающий двойной
контроль.
Вовнутрь
прозрачной упаковки закладывается
индикатор стерильности,
но и на внешней стороне пакета имеется
индикатор
процесса, обеспечивающий двойной
контроль.
Понятие об автоклавировании
Автоклав (от греч. ауто — сам и лат. клавис — ключ) — означает «самозапирание». Автоклавирование, или стерилизация в паровом стерилизаторе, применяется для процесса стерилизации инструмента, любых ИМН из металла, стекла, резины и текстиля, растворов, лигатурного шовного материала. Стерилизаторы паровые имеют различные габариты с различной степенью автоматизации. Объем рабочей камеры составляет 10, 25, 75, 120 л.
В паровых стерилизаторах создается высокая температура (до 138 °С) и высокое давление (до 2,5 атм.), благо-
330
даря
которым обеспечиваются условия для
вытеснения воздуха
из всей стерилизационной камеры, а,
следовательно, и оптимальное насыщение
паром. Простейший паровой стерилизатор
состоит из котла с двойной стенкой и
герметически
закрывающейся крышки, позволяющей
поднять давление
пара до определенного предела. Устройство
современных паровых стерилизаторов
соответствуют требованиям нового
стандарта 2002 года, который можно сравнить
с международным стандартом EN285-96.
В них существует
высокоэффективная система вакуумной
сушки, возможность
выбора режимов стерилизации (3 режима,
а
не 2), имеется короткий режим стерилизации
при полной
автоматизации процесса стерилизации,
которые обеспечивают
высокое качество стерилизации. Выполняются
тестовые (контрольные) автоматические
режимы. Для документирования параметров
процесса стерилизации имеется
принтер и самописец (регистратор),
фиксирующий результаты
стерилизации каждой конкретной партии.
Простейший паровой стерилизатор
состоит из котла с двойной стенкой и
герметически
закрывающейся крышки, позволяющей
поднять давление
пара до определенного предела. Устройство
современных паровых стерилизаторов
соответствуют требованиям нового
стандарта 2002 года, который можно сравнить
с международным стандартом EN285-96.
В них существует
высокоэффективная система вакуумной
сушки, возможность
выбора режимов стерилизации (3 режима,
а
не 2), имеется короткий режим стерилизации
при полной
автоматизации процесса стерилизации,
которые обеспечивают
высокое качество стерилизации. Выполняются
тестовые (контрольные) автоматические
режимы. Для документирования параметров
процесса стерилизации имеется
принтер и самописец (регистратор),
фиксирующий результаты
стерилизации каждой конкретной партии.
Режимы стерилизации
1-й режим — температура 132 °С, давление 2 атм., время 20 мин.
Первый
режим (основной) предназначен для
стерилизации
изделий из бязи, марли (перевязочного
материала, белья и т. д.), стекла, включая
шприцы с пометкой «200 «С», изделий
из коррозийностойкого металла.
д.), стекла, включая
шприцы с пометкой «200 «С», изделий
из коррозийностойкого металла.
2-й режим — температура 120 °С, давление 1,1 атм., время 45 мин.
Второй режим (щадящий) рекомендуется для изделий из тонкой резины, латекса (хирургические перчатки и т.д.) и отдельных видов полимеров (полиэтилен высокой плотности).
3-й режим — температура 134 «С — 5 мин, 2 атм.
Условия проведения стерилизации: все изделия, стерилизуемые паром под давлением, предварительно помещают в упаковку — стерилизационные коробки (биксы или контейнеры) с фильтром или без фильтров, крафт-пакеты и другую упаковку, предназначенную для паровой стерилизации.
331
Соблюдаются требования ведения журнала контроля работы парового стерилизатора (форма работы стерилизаторов — 257/у).
Воздушный метод стерилизации
Проводится
в воздушном стерилизаторе сухим горячим
воздухом. Рекомендуется для стерилизации любых
ИМН из металла, стекла, силиконовой
резины. Воздушные стерилизаторы
(сухожаровые шкафы) имеют различные
габариты
с различной степенью автоматизации и
объемом рабочей камеры, как с односторонней
загрузкой, так и проходного типа. В
стерилизационной камере создается
однородная
рабочая температура от 160 °С до 180 °С с
предельными
отклонениями от —10 до +5 °С, благодаря
принудительной
циркуляции воздуха и автоматическому
поддержанию
температуры. Современные воздушные
стерилизаторы имеют высокоэффективную
систему охлаждения
и эффективную теплоизоляцию.
Рекомендуется для стерилизации любых
ИМН из металла, стекла, силиконовой
резины. Воздушные стерилизаторы
(сухожаровые шкафы) имеют различные
габариты
с различной степенью автоматизации и
объемом рабочей камеры, как с односторонней
загрузкой, так и проходного типа. В
стерилизационной камере создается
однородная
рабочая температура от 160 °С до 180 °С с
предельными
отклонениями от —10 до +5 °С, благодаря
принудительной
циркуляции воздуха и автоматическому
поддержанию
температуры. Современные воздушные
стерилизаторы имеют высокоэффективную
систему охлаждения
и эффективную теплоизоляцию.
Режимы стерилизации
1-й режим — температура 180 «С, время 60 мин.
Первый режим (основной) предназначен для стерилизации изделий из стекла, включая шприцы с пометкой «200 «С», изделий из металла: хирургические, стоматологические, гинекологические инструменты, в том числе кор-розийнонестойких металлов.
2-й
режим —
температура 160 ‘С, время 150 мин. Второй
режим (щадящий) предназначен для
стерилизации изделий
из силиконовой резины, а также деталей
некоторых
аппаратов и приборов.
Второй
режим (щадящий) предназначен для
стерилизации изделий
из силиконовой резины, а также деталей
некоторых
аппаратов и приборов.
Условия проведения стерилизации: изделия стерилизуются без упаковки на сетках или упакованными в бумагу упаковочную, соответствующую требованиям действующего Отраслевого стандарта, а также в разрешенные зарубежные упаковочные материалы.
Соблюдаются требования ведения журнала контроля работы воздушного стерилизатора (форма 257/у).
332
Порядок работы на воздушных стерилизаторах (сухожаровые шкафы)
Загрузка производится в холодный стерилизатор.
Нагревание.
Стерилизация: отсчет времени стерилизации начи нать от достижения нужной температуры стерилизации (180 °С) до истечения срока экспозиции (60 минут).
Охлаждение: до 40-50 °С.
5. Разгрузка. Последовательность действий:
Разложить на металлические сетки хирургический инструментарий так, чтобы часть отверстий была от крыта для циркуляции нагретого воздуха.

Поместить в пяти точках индикаторы стерильности (см. таблицу 23).
Закрыть дверцу шкафа, включить рубильник.
Прогреть стерилизационную камеру в течение 5— 10 минут.
Открыть дверцу сухожарового шкафа, установить сетки с хирургическими инструментами на полки шкафа.
Закрыть дверцу сухожарового шкафа.
Установить ручку реле времени на требуемую дли тельность стерилизации.
Примечание. По достижении заданной температуры в стерилизаторе на пульте управления загорится сигнальная лампа, указывающая начало стерилизации.
При автоматической стерилизации электронагреватели по окончании заданного цикла автоматически отключаются и сигнальная лампа гаснет.
При
полуавтоматическом режиме работы шкафа
медицинская
сестра по окончании стерилизации
отключает его от
сети, выключив рубильник или выключатель.
Стерилизация растворами химических веществ
Перекись водорода обладает выраженным обеззараживающим свойством. Для стерилизации используется 6%
333
раствор перекиси водорода — экспозиция 180 мин, температура 50 °С; при полном погружении для стерилизации изделий из полимеров, резины, стекла и коррозийно-нестойких металлов экспозиция — 360 мин при температуре 18 °С.
По окончании срока экспозиции изделия промывают двукратно стерильной водой и переносят в стерильные контейнеры, например, стерилизационные коробки, выстланные стерильной простыней (полотенцем), и плотно закрывают (срок стерильности — трое суток) или выкладывают на стерильный инструментальный стол для использования.
Примечание: 6%
раствор
перекиси
водорода
может
использоваться
в
течение
7 суток
со
дня
приготовления
при
условии
хранения
его
в
закрытой
таре
в
темном
месте.
Использовать
в
дальнейшем
можно
только
при
условиях
контроля
содержания
активно
действующих
веществ.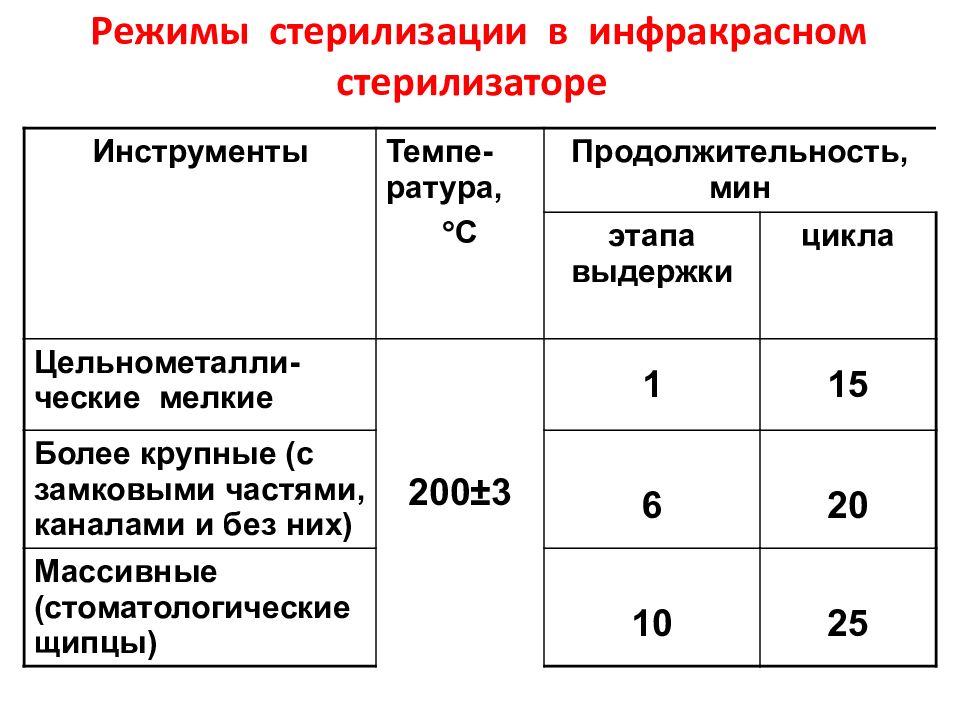
«Дезоксон-1» — бесцветная жидкость с характерным запахом уксусной кислоты, хорошо растворима в воде, спирте. Выпускается во флаконах из темного стекла и при температуре 10 °С сохраняет активность в течение года.
Для стерилизации используются рабочие растворы 1% (по надуксусной кислоте), для чего разводят 200 мл препарата в 800 мл водопроводной воды. Используется только один раз.
Условия проведения стерилизации: при полном погружении на время стерилизационной выдержки 45 мин при температуре 18 °С. Затем стерильные изделия промывают в стерильной воде, погружая на 5 мин, с троекратной сменой воды, а затем помещают в стерильную стери-лизационную коробку на стерильную простыню. Срок сохранения изделия стерильным — 3 суток.
«Дезоксон-1* обладает выраженным коррозийным действием, а поэтому не всегда годен для стерилизации инструментов. Работают, соблюдая меры предосторожности.
Тест с ответами: “Стерилизация” | Образовательный портал
I вариант.
1. Перевязочный материал стерилизуют:
а) автоклавированием +
б) сухожаровым способом
в) кипячением
2. Методом кипячения стерилизуют шприцы, иглы, боры:
а) 20 минут
б) 30-40 минут +
в) 10 минут
3. Холодной стерилизации подвергаются:
а) боры
б) пинцеты
в) зеркала +
4. Стерилизация в сухожаровом шкафу при температуре 1800 С проводится в течении:
а) 60 минут +
б) 120 минут
в) 90 минут
5. Для дезинфекции стоматологического инструментария можно использовать растворы:
а) перекиси водорода 3%
б) гипохлорида кальция 4,5%
в) хлорамина 3% +
6. Целью предстерилизационной очистки медицинского инструментария является:
а) уничтожение только патогенных микробов
б) удаление различных загрязнений и остатков лекарственных средств +
в) обезвреживают источник инфекции
7. Предстерилизационной очистке инструментария предшествует:
а) пастерилизация
б) стерилизация
в) дезинфекция +
8. При проведении предстерилизационной очистки изделий медицинского назначения:
При проведении предстерилизационной очистки изделий медицинского назначения:
а) удаляют различные загрязнения +
б) обезвреживают источник инфекции
в) уничтожают вегетативные формы микроорганизмов
9. Инструменты, поступающие в ЦСО, должны быть:
а) вымытыми под проточной водой после их использования
б) стерильными
в) продезинфицированными +
10. Детергенты – это:
а) дезинфекционные средства
б) моющие средства +
в) кожные антисептики
11. Концентрация перекиси водорода в составе моющего раствора (%):
а) 3 +
б) 5
в) 7
12. Состав 1л моющего раствора с использованием 27,5% пергидроля при предстерилизационной обработке:
а) 14 мл пергидроля + 2,5 г CMC + до 1 л воды
б) 17 мл пергидроля + 5 г CMC + до 1 л воды +
в) 33 мл пергидроля + 5 г CMC + до 1 л воды
13. Для приготовления 1 л моющего раствора при предстерилизационной обработке инструментария необходимо взять 3% раствор перекиси водорода (в мл):
а) 160 +
б) 170
в) 130
14. Состав 1л моющего раствора с использованием 3% раствора перекиси водорода при предстерилизационной обработке:
Состав 1л моющего раствора с использованием 3% раствора перекиси водорода при предстерилизационной обработке:
а) 100 мл перекиси водорода + 10 г CMC и до 1 л воды
б) 220 мл перекиси водорода + 15 г CMC и до 1 л воды
в) 160 мл перекиси водорода + 5 г CMC и до 1 л воды +
15. Для приготовления 1 л моющего раствора при предстерилизационной обработке инструментария необходимо взять пергидроль 33% раствор (в мл):
а) 14 +
б) 18
в) 24
16. Виды дезинфекции:
а) однократная
б) очаговая и профилактическая +
в) влажная уборка
17. Стерилизация – это:
а) предупреждение попадания микроорганизмов в рану
б) удаление микроорганизмов с поверхности МИ
в) уничтожение вегетативных и спорообразующих микроорганизмов +
18. Режимы стерилизации паровым методом:
а) давление 1,1 атм. Темп. = 120 гр.С – 20 мин
б) давление 2 атм. Темп. = 132 гр. С – 20 мин +
в) давление 1,1 атм. Темп. = 120 гр.С – 60 мин
19. Основной режим стерилизации воздушным методом:
а) 120 гр. С – 40 мин
С – 40 мин
б) 180 гр. С – 60 мин
в) 180 гр. С -180 мин +
20. Время химической стерилизации МИ 6% раствором перекиси водорода:
а) Т – 20 гр. С – 40 мин
б) Т – 18 гр. С – 360 мин +
в) Т – 50 гр. С – 60 мин
II вариант.
1. Проба на качество предстерилизационной обработки:
а) азопирамовая +
б) никотинамидовая
в) бензойная
2. Гигиеническая обработка рук показана:
а) до и после снятия перчаток
б) после контакта с биожидкостями
в) перед инвазивными процедурами
3. Дезинфекция матраца, одеяла, подушки после выписки больного:
а) вытряхивание, выхлапывание
б) проветривание
в) обеззараживание в дезинфекционной камере +
4. Срок хранения стерильного материала в закрытом биксе:
а) 2 дня
б) 3 дня +
в) 3 месяца
5. Один из методов стерилизации:
а) капельный
б) переносной
в) воздушный +
6. Один из методов стерилизации:
а) жидкий
б) плазменный +
в) переносной
7. Один из методов стерилизации:
Один из методов стерилизации:
а) паровой +
б) газообразный
в) капельный
8. Обработка рук хирургов проводится:
а) после контакта с неповрежденной кожей пациента
б) до и после контакта с инфекционным больным
в) перед операционным вмешательством +
9. Выбор метода стерилизации зависит от:
а) конфигурации изделия
б) степени загрязненности изделия
в) особенностей стерилизуемого изделия +
10. Методами стерилизации являются:
а) сжигание, обжигание
б) химический +
в) кипячение в 2% растворе соды
11. Какие существуют виды дезинфекции?
а) местная
б) очаговая и профилактическая+
в) однократная
г) влажная уборка
12. Когда должна проводиться влажная уборка палат в ЛПУ?
а) не реже 2-х раз в день+
б) по просьбе пациентов
в) тогда, когда у санитарки есть время
г) частота влажных уборок не имеет значения
13. Отметьте способы и режимы стерилизации клизменных наконечников (пластмасса):
а) замачивание в 3% растворе хлорамина на 30 мин. , высушить
, высушить
б) паром под давлением при температуре 120о С, давление 1,1 атм. в течение 45 мин.+
в) паром под давлением при температуре 132о С, давление 2 атм. в течение 20 мин.
г) сухим жаром при температуре 180о С в течение 60 мин.
14. Какая должна быть укладка биксов для стерилизации?
а) рыхлой, чтобы проходил пар между слоями+
б) плотной, чтобы в бикс вместилось как можно больше стерилизуемого материала
в) плотность укладки бикса значения не имеет, самое главное – режим работы стерилизующей аппаратуры
15. Определите способы контроля работы стерилизующей аппаратуры при паровой стерилизации изделий из текстиля, стекла, металла:
а) мочевина, термоиндикаторная лента на 132о С+
б) бензойная кислота, сера, термоиндикаторная лента на 120о С
в) перекись водорода 4%
г) калия перманганат (кристаллы)
16. Выберите способы контроля работы стерилизующей аппаратуры при стерилизации изделий из латекса, резины, полимеров:
а) мочевина, термоиндикаторная лента на 132о С
б) бензойная кислота, сера, термоиндикаторная лента на 120о С+
в) фенолфталеин
г) азопирам
17. Отметьте самый точный способ контроля стерильности:
Отметьте самый точный способ контроля стерильности:
а) посев смывов на питательную среду (бактериологический анализ)+
б) термохимическая лента в зависимости от режима стерилизации
в) нет способов контроля стерильности
18. Что способствует распространению внутрибольничной инфекции?
а) Инвазивные процедуры;+
б) Осложненные заболевания;
в) Слабое материальное обеспечение лечебно-профилактического учреждения.
19. Как называется заболевание инфекционного характера, которым пациент заражается в процессе оказания медицинской помощи, а медицинский персонал в процессе оказания медицинских услуг?
а) Карантинным;
б) Внутрибольничным;+
в) Эндемичным.
20. Что такое артифициальный путь передачи?
а) Естественный через кровь;
б) Естественный контактно-бытовой;
в) Искусственный.+
Информио
×Неверный логин или пароль
×Все поля являются обязательными для заполнения
×Сервис «Комментарии» — это возможность для всех наших читателей дополнить опубликованный на сайте материал фактами или выразить свое мнение по затрагиваемой материалом теме.
Редакция Информио.ру оставляет за собой право удалить комментарий пользователя без предупреждения и объяснения причин. Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
- Не стоит размещать бессодержательные сообщения, не несущие смысловой нагрузки.
- Не разрешается публикация комментариев, написанных полностью или частично в режиме Caps Lock (Заглавными буквами). Запрещается использование нецензурных выражений и ругательств, способных оскорбить честь и достоинство, а также национальные и религиозные чувства людей (на любом языке, в любой кодировке, в любой части сообщения — заголовке, тексте, подписи и пр.)
- Запрещается пропаганда употребления наркотиков и спиртных напитков. Например, обсуждать преимущества употребления того или иного вида наркотиков; утверждать, что они якобы безвредны для здоровья.
- Запрещается обсуждать способы изготовления, а также места и способы распространения наркотиков, оружия и взрывчатых веществ.
- Запрещается размещение сообщений, направленных на разжигание социальной, национальной, половой и религиозной ненависти и нетерпимости в любых формах.
- Запрещается размещение сообщений, прямо либо косвенно призывающих к нарушению законодательства РФ. Например: не платить налоги, не служить в армии, саботировать работу городских служб и т.д.
- Запрещается использование в качестве аватара фотографии эротического характера, изображения с зарегистрированным товарным знаком и фотоснимки с узнаваемым изображением известных людей. Редакция оставляет за собой право удалять аватары без предупреждения и объяснения причин.
- Запрещается публикация комментариев, содержащих личные оскорбления собеседника по форуму, комментатора, чье мнение приводится в статье, а также журналиста.
Претензии к качеству материалов, заголовкам, работе журналистов и СМИ в целом присылайте на адрес
×Информация доступна только для зарегистрированных пользователей.
×Уважаемые коллеги. Убедительная просьба быть внимательнее при оформлении заявки. На основании заполненной формы оформляется электронное свидетельство. В случае неверно указанных данных организация ответственности не несёт.
Современное стерилизационное оборудование
Обязательным условием успешного оказания медицинской помощи является отсутствие рисков инфицирования пациента через используемые медицинские инструменты, инъекционные растворы, имплантаты, а так же перевязочный материал и предметы ухода. В соответствии с требованиями международных стандартов, при поставке стерильной продукции микробиологическое загрязнение медицинских изделий от любых источников должно быть сведено к минимуму всеми доступными средствами. Цель процесса стерилизации и стерилизующих агентов (стерилизантов) заключается в уничтожении микробиологических контаминантов. Таким образом, осуществляется преобразование нестерильных изделий в стерильные.
Термин «стерилизация» (от лат. sterilis — бесплодный) обозначает полное освобождение различных веществ и предметов от живых микроорганизмов. В ходе стерилизации производится уничтожение всех способных к размножению микробов и спор. Большим преимуществом стерилизации, помимо ее действенности, является возможность ее автоматизированного проведения, а также сравнительно непродолжительное время процесса.
Способы стерилизации
Стерилизация основана на губительном для микроорганизмов и их спор воздействии разнообразных физических или химических агентов (стерилизантов). Ниже приведена наиболее общая классификация методов стерилизации:
- Термическая: паровая и воздушная (сухожаровая)
- Химическая: газовая или химическими растворами (стерилянтами)
- Радиационная стерилизация: применяется в промышленном варианте
- Метод мембранных фильтров: применяется для получения небольшого количества стерильных растворов, качество которых может резко ухудшиться при действии других методов стерилизации
Термические методы стерилизации
Термические методы стерилизации исторически являются одними из самых старых, применяемых в медицине длительное время. Они по-прежнему широко применяются и имеют ряд преимуществ:
- Надёжность
- Отсутствие необходимости удаления стерилянтов с предметов медицинского назначения
- Удобство работы персонала
- Стерилизация проводится в упаковках, что позволяет сохранить стерильность некоторый период времени
Паровая стерилизация осуществляется подачей насыщенного водяного пара под давлением в паровых стерилизаторах (автоклавах). Такая методика считается наиболее эффективным методом, так как чем выше давление, тем выше температура пара, стерилизующего материал.
Паровой стерилизации подвергают изделия из текстиля (бельё, вату, бинты, шовный материал), из резины, стекла, некоторых полимерных материалов, питательные среды, лекарственные препараты.
В настоящее время паровая стерилизация продолжает оставаться самым распространенным в мире способом стерилизации. Данный метод высокоэффективен, экономичен и приемлем для многих медицинских изделий. По данным статистики, 75% общего объема госпитальной стерилизации в мире приходится на паровой метод. В России продолжает широко использоваться воздушная, или сухожаровая, стерилизация. В развитых странах высокое энергопотребление такого оборудования, отсутствие надежных методов упаковки и высокая температура воздействия свели применение данного метода к минимуму.
В современной медицине термическая стерилизация встречает все больше ограничений. Использование температуры рабочего цикла от 120° до 180°С вызывает повреждение термочувствительных материалов (полимеры, оптика, электронные блоки). Активное использование не термостойких компонентов (полимерных материалов, оптического волокна и микроэлектроники) в конструкции хирургических и диагностических инструментов заметно сократило перечень изделий, пригодных к стерилизации температурными методами.
Количество сложного, дорогостоящего оборудования, инструментов, имплантатов и материалов в отечественных клиниках постоянно увеличивается, что требует перехода на нетермические методы стерилизации, а значит и соответствующего переоснащения парка стерилизационного оборудования.
Химические методы стерилизации
Для газовой (холодной) стерилизации используют герметичные контейнеры или специальные аппараты с камерами, заполняемыми парами окиси этилена, формальдегида или специализированными многокомпонентными системами. Используются при обработке приборов, аппаратов, сложных оптических систем, крупногабаритных изделий или изделий из титана, полимерных смол, резин.
Для химической стерилизации растворами применяются основных четыре группы веществ:
- Кислота+окислитель (например, «Первомур»)
- Альдегид (например, формалин)
- Детергент (например, хлоргексидина биглюконат)
- Галоид (например, Повидон-йод)
Концентрация стерилизанта и время экспозиции зависит от используемого химического вещества.
Наиболее широко в мире применяется стерилизация с помощью этиленоксида. Для сравнения, в 1999г. в США 52,2% всех одноразовых медицинских изделий было простерилизовано с помощью этиленоксида, 45,5% — гамма-радиацией, 1,8% — паром и только 0,5% — другими методами.
Этиленоксидная стерилизация прекрасно зарекомендовала себя в большинстве стран мира, оборудование для ее проведения выпускается большим количеством производителей в различных странах Европы и Америки. Этиленоксидный метод обеспечивает самый щадящий температурный режим стерилизации.
Формальдегид нашел широкое применение в качестве стерилизанта высокого уровня с использованием специальных камер. Для стерилизации же он не является самым удачным выбором. Низкая проникающая способность формальдегида приводит к тому, что данный метод требует применения рабочей температуры в пределах 65 – 80°С, и многие специалисты вообще не считают этот метод низкотемпературным. Для формальдегида имеются существенные ограничения в отношении стерилизации полых изделий, изделий с отверстиями и каналами. Весьма существенно, что для формальдегида не разработано нейтрализаторов и полного мониторинга процесса стерилизации. Химические методы стерилизации показали себя надежными и эффективными методами. Однако и они не лишены определенных недостатков. В первую очередь, к ним следует отнести высокую токсичность используемых стерилизантов, что требует выполнения очистки стерилизуемого оборудования и материалов от остатков стерилизационного агента, сохраняющихся на поверхности и в порах материала после цикла стерилизации. Также необходимо учесть тот факт, что не все материалы, используемые для производства медицинских изделий, выдерживают химическое воздействие стерилизантов.
Стерилизация ионизирующим излучением
Радиационный метод (лучевую стерилизацию γ-лучами) применяют в специальных установках при промышленной стерилизации однократного применения — полимерных шприцев, систем переливания крови, чашек Петри, пипеток и других хрупких и термолабильных изделий.
Некоторое время в фармтехнологии для стерилизации используется ультрафиолетовое (УФ) (длина волны 253,7 нм). Источником УФ-излучения являются ртутные кварцевые лампы. Их мощное бактериостатическое действие основано на совпадении спектра испускания лампы и спектра поглощения ДНК микроорганизмов, что является причиной их гибели при длительной обработке излучением кварцевых ламп. При недостаточно мощном действии УФ в клетках микроорганизмов активизируются процессы репарации и клетка может восстановиться. Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды. Радиационная стерилизация – эффективный метод стерилизации, подходящий для многих инструментов, имплантатов и материалов. Его промышленное применения для стерилизации одноразовых медицинских инструментов и материалов является наиболее оправданным. Однако, подобные установки не используются в отделениях стерилизации ЛПУ, следовательно, не могут обеспечивать рутинную обработку многоразовых инструментов и материалов.
Плазменная стерилизация
В настоящее время в большинстве медицинских учреждений наиболее часто используются относительно недорогая паровая и воздушная стерилизация, но эти способы допускают обработку только тех изделий, которые устойчивы к действию высокой температуры и влажности. Количество таких изделий среди всего набора медицинских изделий не превышает 60-70%.
Ранее этот процент был значительнее, но с каждым годом в медицине стабильно увеличивается процент изделий сделанных из материалов, критично относящихся к высокой температуре стерилизации. Кроме того эти изделия очень плохо переносят и химическую стерилизацию. При низкотемпературной химической стерилизации погружением в растворы химических препаратов по утвержденным методикам происходит агрессивное воздействие на материал изделий, что часто приводит к их преждевременному износу и выходу из строя. Кроме того при низкотемпературной химической стерилизации по-прежнему высока вероятность плохой стерилизации из-за влияния человеческого фактора, из-за сложности рельефа изделия, а то и небрежности со стороны персонала в обработки изделия.
При расследовании ряда эпидемий в больницах и родильных домах было выявлено, что контролирующая, поддерживающая и лечебная аппаратура могут играть роль резервуара инфекций, особенно в отношении детей в тяжелом состоянии, находящихся под действием такой аппаратуры в течение длительного времени.
Дыхательные аппараты, датчики для контроля артериального давления, пупочные катетеры, центральные венозные катетеры, устройства для парентерального питания, назотрахеальные и эндотрахеальные трубки создают для новорожденных риск инфицирования даже более значительный, чем для взрослых. Поэтому их необходимо относить к «критическим» медицинским изделиям, которые перед использованием должны быть гарантированно стерильными.
Плазменный метод стерилизации был разработан в ответ на возрастающую потребность ЛПУ в стерилизации медицинских изделий и материалов, надежная и бережная стерилизация которых невозможна с использованием всех перечисленных выше способов стерилизации. В настоящее время плазменная стерилизация является наиболее современным методом стерилизации, который широко применяют в крупных госпиталях и клиниках мира. Только в клиниках США за 2012 год проведено 1,5 млн циклов плазменной стерилизации. Отечественные клиники также активно внедряют плазменные стерилизаторы в повседневной работе отделений ЦСО, а портативные модели устанавливаются непосредственно в предоперационных помещениях.
Стерилизация медицинских изделий производится за счет действия особого стерилизующего агента (плазмы перекиси водорода). Уничтожаются все формы микроорганизмов, включая их условно-патогенные виды, которые активно проявляют себя в госпитальной инфекции. Формирование плазмы и сам процесс стерилизации протекают при нормальном давлении и температуре порядка 50-60С. Такая технология отличается максимально щадящим воздействием на конструкционные материалы медицинских изделий, что дает уникальные возможности для многократной стерилизации прецизионных изделий, систем, содержащих высококачественную оптику, электронику, а также изделий со специальными покрытиями или красками.
Физическая основа плазменной стерилизации
Метод плазменной стерилизации основан на действии плазмы перекиси водорода (Н2О2). Она состоит из ионов, электронов, нейтральных атомов и молекул и образуется под действием внешних источников энергии, таких как температура, радиационное излучение, электрическое поле и др. При этом методе после впрыскивания раствора перекиси водорода в стерилизационную камеру включается источник электромагнитного излучения, под воздействием которого одновременно происходит деление одной части молекул Н2О2 на две группы (ОН-), а другой части — на одну гидропероксильную группу (ООН-) и один атом водорода, сопровождающееся выделением видимого и ультрафиолетового излучения. В результате создается биоцидная среда, состоящая из молекул перекиси водорода, свободных радикалов и ультрафиолетового излучения. При отключении электромагнитного поля свободные радикалы преобразуются в молекулы воды и кислорода, не оставляя никаких токсичных отходов.
Плазменная стерилизация является единственным экономически эффективным методом стерилизации медицинских изделий из материалов, чувствительных к действию высокой температуры и влаги, а также инструментов и изделий, содержащих узкие, с трудом поддающиеся стерилизации каналы, которые могут стать входными воротами для инфицирования больного в стационаре. В плазменном стерилизаторе допускается обрабатывать практически всю номенклатуру применяемых в ЛПУ медицинских изделий. К ним относятся изделия из полимеров, электроинструменты и кабели, оптоволоконные световодные системы, электронные устройства, электрофизиологические катетеры, изделия из оптического стекла, металлические инструменты для микрохирургии и многое другое.
Согласно исследованиям НИИ дезинфектологии Роспотребнадзора, а также Института гигиены Хейдельбергского университета (Германия), технология плазменной стерилизации допускает стерилизацию инструментов для минимально инвазивной хирургии, включая эндоскопы. Это открывает перспективу для 100%-ной стерилизации инструментов, применяемых в ЛПУ для эндоскопических и малоинвазивных операций.
Во многих ЛПУ часто ощущается дефицит готовых к немедленному использованию дорогостоящих хирургических инструментов, так как приобретение и хранение нескольких комплектов одинаковых инструментов часто бывает экономически непосильно. Эта проблема перестает существовать при использовании плазменного стерилизатора. В современных системах плазменной стерилизации минимальная продолжительность цикла достигает 35 мин, а максимальное время не превышает 70 мин.
Стоит особо отметить, что современные плазменные стерилизаторы полностью вписываются в структуру существующих ЦСО отечественных ЛПУ. Для их функционирования требуется только подводка электрической линии, а автоматический режим работы не требует специальной квалификации обслуживающего персонала.
Дополнительное преимущество плазменной стерилизации состоит в высокой степени экологичности данного метода. В отличие от высокотоксичных отходов газовой стерилизации, отходами плазменной стерилизации являются кислород и пары воды.
Первые плазменные стерилизаторы, появившиеся на отечественном рынке, отличались высокой стоимостью, что заметно ограничивало их повсеместное распространение. В последнее время на отечественный рынок вышли новые производители, предлагающие широкий модельный ряд плазменных стерилизаторов с объемом рабочей камеры от 35 до 120 литров, которые могут устанавливаться не только в ЦСО, но и непосредственно в предоперационных помещениях, обеспечивая максимально оперативный стерилизацию хирургических инструментов и материалов за время перерыва между хирургическими операциями в течение дня. Например, стерилизаторы серии Crystal компании LowTem представлены моделями с полезным объемом стерилизационной камеры от 35 до 108 л. Меню аппаратов позволяют производить стерилизацию по различным программам, в зависимости от типа загруженного оборудования. В зависимости от выбранной программы, продолжительность цикла составляет от 35 до 55 минут, а температура не превышает 60С.
Заключение
Прогресс медицины предъявляет все более строгие требования к стерилизационному оборудованию, рутинно используемому для обеспечения стерилизации хирургического и диагностического оборудования, различных медицинских материалов, имплантатов, инфузионных растворов и пр. Прогресс медицинских технологий привел к увеличению количества полимерных, оптических и электронных блоков в составе сложного, дорогостоящего оборудования, стерильность которого должна быть обеспечена перед применением. Проверенные временем паровая, воздушная стерилизация и химическая технологии стерилизации оказались не в состоянии обеспечить сохранность чувствительных элементов нового оборудования, а лучевые стерилизационные установки являются «привилегией» промышленных предприятий и не применяются в клинической практике.
Плазменная стерилизация является современной методикой, не имеющей «узких мест», характерных для более ранних способов стерилизации. В плазменных стерилизаторах на объект стерилизации не воздействуют высокая температура, давление, агрессивные химикаты. Отходами плазменных стерилизаторов являются неопасные продукты – углекислый газ и вода.
В модельных рядах современных производителей (таких как аппараты Crystal компании Lowtem) присутствуют как большие высокопроизводительные, так и компактные портативные модели. ЛПУ получили возможность весьма гибкого оснащения своих подразделений этими стерилизаторами. Появилась возможность установить компактный стерилизатор в предоперационной для быстрой стерилизации инструмента в перерыве между операциями. Такой подход существенно сокращает нагрузку на ЦСО и уменьшает трудозатраты персонала оперблока.
Можно с уверенностью утверждать, что технология плазменной стерилизации является исключительно востребованным и экономически оправданным высокотехнологичным процессом, необходимым для выполнения всех требований, направленных на санитарно-эпидемиологическое благополучие населения.
Преимущества и недостатки различных методов стерилизации | ||
Метод | Преимущества | Недостатки |
Паровая стерилизация | Наиболее распространенный метод стерилизации в стационарах. Безопасен для окружающей среды и персонала. Короткая экспозиция. Не обладает токсичностью. Низкая стоимость. Не требует аэрации. | Качество стерилизации может быть нарушено при неполном удалении воздуха, повышенной влажности материалов и плохом качестве пара. Могут повреждаться изделия, чувствительные к действию температуры и влажности. |
Воздушная стерилизация | Низкие коррозийные свойства. Глубокое проникновение в материал. Безопасен для окружающей среды. Не требует аэрации. | Длительная экспозиция. Очень высокая энергопотребляемость. Могут повреждаться термочувствительные изделия. |
Стерилизация окисью этилена | Проникновение в упаковочные материалы и пластиковые пакеты. Можно использовать для стерилизации большинства медицинских изделий. Прост в обращении и контроле. | Требуется время для аэрации. Маленький размер стерилизационной камеры. Окись этилена токсична, является вероятным канцерогеном, легко воспламеняется. |
Стерилизация плазмой перекиси водорода | Низкотемпературный режим. Не требует аэрации. Безопасен для окружающей среды и персонала. Конечные продукты нетоксичны. Прост в обращении, работе и контроле. | Нельзя стерилизовать бумажные изделия, белье и растворы. Маленький размер стерилизационной камеры. Нельзя стерилизовать изделия с длинными или узкими внутренними каналами. Требуется синтетическая упаковка. |
Стерилизация парами раствора формальдегида | Пожаро- и взрывобезопасен. Можно использовать для стерилизации большинства медицинских изделий. | Необходимость отмывания поверхности от остатков формальдегида. Обладает токсичностью и аллергенностью. Длительная экспозиция. Длительная процедура удаления формальдегида после стерилизации. |
Методы стерилизации — Особенности
Как проводится стерилизация?
Стерилизации подлежат все инструменты многократного использования, которые контактируют с кожей и слизистыми оболочками клиента и могут их травмировать, а также изделия, непосредственно контактирующие с кровью.
Исходя из этого утверждения, стерилизационной обработке подлежат:
- Хирургический инструментарий;
- Стоматологический инструментарий;
- Маникюрный инструментарий;
- Инструменты для тату, перманентного макияжа и пирсинга;
- Косметологические инструменты.
Кроме того, в медицинских учреждениях обработке подвергаются белье, перевязочные материалы, медицинские тапочки и перчатки, дренажные трубки, зонды и пр.
Добиться полной стерильности инструментов можно лишь путем проведения последовательной обработки, включающей дезинфекцию, предстерилизационную очистку (ПСО) и стерилизацию. Каждый из этих этапов выполняет свою функцию. Нельзя приступать сразу же к стерилизации, игнорируя предварительное проведение дезинфекции и ПСО. Такой подход лишь помешает качественному проведению обеззараживания инструментов. А это чревато заражением инфекциями, как клиентов, так и сотрудников.
Методы стерилизации
Существует несколько методов. При выборе метода необходимо учитывать материал, из которого изготовлено изделие/инструмент, количество обрабатываемых изделий, финансовые возможности учреждения и прочие факторы.
Различают такие методы стерилизации изделий и инструментов:
- Физический;
- Химический;
- Газовый.
Каждый из методов обладает своими преимуществами и недостатками.
Особенности физических методов стерилизации
Физические методы, по сути, представляют собой обработку инструментов высокой температурой. К этой категории относят паровую, воздушную и гласперленовую стерилизацию. Проведение физической стерилизации требует использования определенного оборудования. В целом, это наиболее часто используемый метод обработки, который помогает добиться качественного обеззараживания инструментов.
Суть паровой стерилизации заключается в обработке инструментария водяным паром, подаваемым под высоким давлением. Для этого используют паровые стерилизаторы — автоклавы. Это достаточно громоздкое и дорогое оборудование, которое могут себе позволить большие учреждения, например, больницы. Температурный режим в автоклавах варьирует в пределах 110-135°С, время обработки — всего лишь 5-20 минут. Это самый эффективный и быстрый метод стерилизации.
Воздушный метод обработки это не что иное, как обработка инструментов сухим горячим воздухом. Стоит отметить, что воздушные стерилизаторы (они же сухожаровые шкафы) меньше в размере и дешевле автоклавов. Поэтому большинство салонов красоты и студий ногтевого сервиса практикуют этот вид дезинфекции. Впрочем, у воздушного метода есть и свои относительные недостатки. Так, для стерилизации сухим воздухом требуются еще большие значения температуры — 160-180°С, а время стерилизации увеличивается до 30-150 минут.
Особенность проведения гласперленовой стерилизации заключается в использовании аппарата, заполненного кварцевыми шариками. При включении аппарата шарики нагреваются до 180-240°С, благодаря чему происходит оббезараживание. Гласперленовые стерилизаторы имеют небольшие размеры, а поэтому подходят для обеззараживания только мелких инструментов. Этот метод обладает существенными недостатками. Во-первых, в аппарат невозможно погрузить большой инструмент целиком, а значит, его обработка будет неполной. Во-вторых, не существует методов контроля работы гласперленовых стерилизаторов. Учитывая эти нюансы, контролирующие органы не рекомендуют использовать этот вид стерилизации в профессиональной деятельности.
Особенности химического метода стерилизации
Химический метод — обеззараживание инструментов и изделий различными химическими средствами. Этот метод особенно ценен для обработки изделий, изготовленных из термолабильных материалов (к примеру, из стекла, пластмасс или резины). В частности его применяют для стерилизации эндоскопов. Еще одним преимуществом метода можно назвать его дешевизну. Однако химический метод стерилизации достаточно трудоемкий, что можно расценивать как недостаток.
Для проведения стерилизации используют контейнер, который наполняют раствором химического средства. В наполненную емкость полностью погружают использованные инструменты, при этом они не должны лежать плотно друг к другу. Время экспозиции зависит от используемого химического средства и может составлять от 60 до 600 минут. По завершению обработки инструменты вынимают стерильными пинцетами и промывают в стерильной воде. Обработанные изделия хранят в стерильных контейнерах не более трех дней.
Особенности газового метода
Газовый метод в РФ нельзя назвать популярным. Обработка в газовых стерилизаторах производится при температурах до 80°С и с использованием газов: оксида этилена, озона, паров раствора формальдегида. Одной из причин непопулярности газовой стерилизации можно назвать дороговизну самого стерилизационного оборудования.
Газовую стерилизацию, главным образом, проводят для обработки термолабильных изделий из резины и пластмассы, инструментов с зеркальной поверхностью, оптических эндоскопов, кардиостимуляторов. Но стоит отметить и тот факт, что обработка газом требует значительного времени экспозиции. Так, время стерилизационной выдержки при обработке парами формальдегида составляет 120-180 минут, озоном — 240-960 минут. Еще одним недостатком метода является токсичность газов.
Контроль качества стерилизации
От соблюдения методики проведения стерилизации и исправности оборудования зависит качество обеззараживания инструментов. Оценить качество проведения позволяют методы контроля.
Проведение физического метода контроля невозможно без использования приборов, фиксирующих показатели температуры, давления и времени. Например, соответствие температурного режима нормам оценивают с помощью максимальных термометров, которые помещают в стерилизатор вместе с обрабатываемыми инструментами.
Химический метод контроля базируется на использовании специально разработанных химических полосок с индикаторами. Тест-полоски укладывают в стерилизаторе в определенных точках. После проведения стерилизационной обработки осматривают тест-полоски, которые при правильном проведении стерилизации меняют цвет. Если же тест-полоски не изменили цвет — значит, инструменты остались нестерильными.
Биологический метод контроля представляет собой использование биотестов. Это флаконы, обсемененные тест-микроорганизмами, которые во время проверки размещают в стерилизаторе. Далее биотесты подвергаются бактериологическому исследованию. Если на исследуемых образцах отсутствует рост культур — это говорит в пользу эффективного проведения стерилизации.
Контроль качества — это один из основных моментов, на который обращают внимание контролирующие органы. Стоит отметить, что руководителям медицинских учреждений и салонов красоты стоит внедрить эти методы контроля в свою будничную практику. Это позволит выявить и устранить возможные ошибки при проведении стерилизации, а также гарантировать клиентам стопроцентную стерильность используемых инструментов.
Вернуться к списку публикаций
Методы стерилизации питательных сред и посуды, микробиология
Методы стерилизации питательных сред и посуды, микробиология / Methods of sterilization of nutrient media and dishes, microbiology
Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает обеспложивание. В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Различают термическую и холодную стерилизацию. Способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Методы холодной стерилизации: стерилизация фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений.
Физико-химические свойства материала и стерилизация / Physical and chemical properties of the material and sterilization
Возможность и целесообразность применения того или иного способа определяется в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования.
Стерилизация питательных сред насыщенным паром под давлением (автоклавирование) Совместное действие высокой температуры и давления пара обеспечивает особую эффективность данного способа (табл. 1).
Таблица 1
Температура насыщенного пара при разных давлениях Давление Температура, нормальное, атм кПа °С 1,0 101,32 100 1,5 151,98 111 2,0 202,65 121 2,5 251,20 128 3,0 299,75 134 При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдержи6 вают и 5-минутную экспозицию в насыщенном паре при 121 °С.
Стерилизацию текучим паром под давлением осуществляют в автоклавах. Автоклав представляет собой металлический двустенный резервуар, способный выдерживать высокое давление, в который помещают стерилизуемый материал на специальную подставку. Предметы следует размещать не слишком плотно, так как пар должен проходить между ними, иначе они не нагреваются до нужной температуры и могут остаться нестерильными. По окончании времени стерилизации автоклав открывают, когда давление в нем сравняется с атмосферным. Преждевременное открывание крана автоклава недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает впоследствии стерильность материала. К работе с автоклавом допускаются только подготовленные лица! Подготовка сред к стерилизации.
При автоклавировании 3 — 5 % жидкости теряются в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5% дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях.
Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками с бумажными колпачками. Стеклянные, резиновые, корковые и другие пробки завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111-138 °С, т.е. от 0,5 до 2,5 атм. Температура ниже 111 °С не может считаться надежной; а выше 138 0С, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атм. Температура и длительность автоклавирования питательных сред определяются, прежде всего, их составом, термоустойчивостью или термолабильностью компонентов.
Стерилизация легко разрушающиеся субстраты при 0,5 атм в течение 15-30 мин / Sterilization of easily degraded substrates at 0.5 atm for 15-30 minutes
Внимание! Легко разрушающиеся субстраты, как молоко или желатиновые среды, а также субстраты, содержащие сахара, 7 витамины (пивное сусло, соки, дрожжевой автолизат и др.) обычно стерилизуют при 0,5 атм в течение 15-30 мин.
Мясопептонные среды можно стерилизовать при 1,0 атм 20 мин. С трудом поддаются стерилизации в автоклаве различные порошки (например тальк) и вязкие жидкости (глицерин, вазелиновое масло), поэтому их лучше стерилизовать в сушильных шкафах при 160 °С в течение 2 или 1 ч при 170 °С. В этом случае слой масла или порошка в сосуде не должен превышать 1,5 см. После автоклавирования среды для проверки стерильности выдерживают 2 — 3 сут в термостате при 30 0С. Если в средах обнаруживается рост микроорганизмов, их готовят заново.
Дробная стерилизация (тиндализация) и пастеризация Тиндализация, дробная стерилизация, была предложена в 1877 г. Тиндалем. Она применяется для сред, портящихся под действием температур выше 100 °С. Тиндализацию осуществляют текучим паром а автоклаве с незавинченной крышкой или в аппарате Коха. Среды прогревают несколько раз по 10 — 15 мин. Между прогреваниями среды ставят в термостат при температуре 3 0 0 С н а 8 — 1 2 ч для прорастания жизнеспособных спор. Среды, не выдерживающие нагревания при 100 °С, прогревают более осторожно при 60 — 80 °С через каждые 8 — 1 2 ч 4 — 5 дней подряд. Однократный прогрев материала при температуре ниже 100 0С известен под названием пастеризация. Этот метод, предложенный Пастером, предназначен для уничтожения только бесспоровых форм микроорганизмов. Следовательно, в подавляющем большинстве случаев он не обеспечивает стерильности.
Пастеризацию проводят при 60-80 0С 10 — 30 мин. Этот процесс используют в пищевой промышленности для обработки молока, фруктовых соков, вина, пива и др.
Стерилизация фильтрованием Фильтрованием стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты — витамины, аминокислоты (цистеин и цистин), белки, углеводы, антибиотики и др. Фильтрование жидкостей осуществляют через мелкопористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и др.
Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,20 мкм. Наиболее широкое распространение в микробиологической практике получили мембранные фильтры, которые в зависимости от величины пор применяют для фильтрования и стерилизации. Для стерилизации используют отечественные фильтры фирм «Владипор», «Владисарт» с диаметром пор 0,20 мкм. Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами.
Стерилизующими являются СФ-3 и СФ-4. Мембранные фильтры стерилизуют автоклавированием при 1 атм 15 мин или длительным кипячением. Стерилизация стеклянной посуды. Основным способом стерилизации стеклянной посуды является обработка ее сухим горячим воздухом при температуре не выше 180 ° в течение 1 — 3 ч (табл. 2). При этом погибают и вегетативные клетки, и споры микроорганизмов. Стерилизацию осуществляют в специальных суховоздушных (сухожаровых) стерилизаторах и сушильных шкафах, приспособленных для стерилизации и обеспечивающих автоматическое поддержание необходимой температуры.
Таблица 2 Время, необходимое для стерилизации стеклянной посуды сухим жаром Температура, °С Время, мин 140 180 150 150 160 120 170 60 Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. После этого еѐ загружают в стерилизатор (или в сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80 °С, так как при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться. Стерилизация инструментов и приборов.
Стерилизация прокаливанием в пламени перед использованием, металлические инструменты / Flame sterilization before use, metal tools
Внимание! Мелкие лабораторные металлические инструменты — петли, иглы, пинцеты, ножницы, шпатели — стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием.
На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при посевах культур и разливе сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов. Шприцы лучше всего стерилизовать сухим жаром при 160 0С либо в собранном, либо в разобранном виде. В первом случае длительность стерилизации 75, во втором — 60 мин. Собранные шприцы вместе с иглой стерилизуют в пробирке, закрытой ватной пробкой, разобранные заворачивают в бумагу или ткань.
Можно стерилизовать шприцы и в автоклаве при 1 атм в течение 15-20 мин. Автоклавируют их только в разобранном виде, иначе они повреждаются.
Стерилизация газообразными веществами / Sterilization with gaseous substances
Лабораторную аппаратуру, имеющую зеркальное, оптическое и радиоэлектронное оборудование, а также изделия из термолабильных пластмасс, например центрифужные пробирки, стерилизуют газовым методом. Для газовой стерилизации применяются только те соединения, которые обладают спороцидными свойствами. Это оксид этилена, метилбромид, оксид пропилена, формальдегид, глютаральдегид, бета-пропиолактон, озон и др. Газовую стерилизацию проводят в специальных герметически закрывающихся аппаратах.
Стерилизуемые объекты, помещаемые в камеру, упаковывают как при стерилизации в автоклаве или сушильном шкафу. При проведении газовой стерилизации строго соблюдают правила работы с ядовитыми газообразными веществами. Стерилизация облучением Для стерилизации помещений, оборудования, некоторых медицинских принадлежностей, пищевых продуктов используют различные виды излучений: инфракрасное, ультрафиолетовое, рентгеновские лучи, а-, Р- и у-лучи радиоактивных элементов. Чаще других в микробиологической практике используют ультрафиолетовое облучение. Мощность ультрафиолета измеряется в бактах. Доза УФ-излучения, губительная для различных видов микроорганизмов (кроме спор), составляет 5 мкб/см2
Текущая уборка в стационарах проводится (в соответствии с Сан.П и Н 2.1.3.2630-10)
-1 раз в сутки
+2 раза в сутки
-1 раз в 7 дней
-2 раза в 7 дней
Химические индикаторы используют для контроля
-режимов дезинфекции
+режимов стерилизации
-предстерилизационной очистки
-стерильности изделия
Воздушную стерилизацию можно проводить
-в стерилизационной коробке с фильтром
-в стерилизационной коробке без фильтра
-в бязевой упаковке
+в крафт-пакете, без упаковки
Основной путь передачи ВИЧ-инфекции в ЛПУ
-воздушно-капельный
-контактно-бытовой
+парентеральный
-пищевой
Физический метод дезинфекции – это
-стирка, мытье, проветривание
-протирание дезсредствами
+воздействие высокой температурой, паром под давлением, УФ излучением
-использование антибиотиков
Наибольшей устойчивостью во внешней среде обладают
-вирусы
-грибы
+споры
-бактерии
Отходы, не имеющие контакта с биологическими жидкостями пациентов, инфекционными больными, не токсичные отходы относятся к классу
+А
-Б
-В
-Г
Одноразовые изделия медицинского назначения перед утилизацией подвергают
-ополаскиванию проточной водой
-мойке
+дезинфекции
-стерилизации
Стерилизацию текстиля можно проводить методом
+паровым
-плазменным
-воздушным
-инфракрасным
К группе риска по ВБИ относится медицинский персонал отделений
-гастроэнторологических
-физиотерапевтических
-терапевтических
+ожоговых
ВБИ – это
-инфекционные заболевания медицинского персонала
-инфекционные заболевания взрослых — пациентов стационаров
-инфекционные заболевания детей — пациентов стационаров
+любые инфекционные заболевания, возникающие у пациентов в результате обращения в ЛПУ за медицинской помощью или у медицинских работников при выполнении профессиональных обязанностей
37.Эффективность стерилизации оценивается на основании результатов:
+бактериологических исследований
-химических индикаторов
-физических методов
-механических методов
Режим паровой стерилизации
+120о С, 45 минут
-140о С, 15 минут
-160о С, 150 минут
-180о С, 30 минут
При стерилизации погибают
+все микроорганизмы (в том числе споровые формы)
-вегетативные формы микроорганизмов
-только патогенные микроорганизмы
-вегетативные формы микроорганизмом и некоторые споры
К химическому методу дезинфекции относится
+обработка дезинфектантами
-использование УФО
-использование бактериальных фильтров
-использование пара под давлением
Основную долю возбудителей ВБИ составляют
+бактерии и вирусы
-простейшие
-грибы
-прионы
Радиоактивные отходы ЛПУ относятся к классу
-А
-Б
-В
+Д
Инструменты после инвазивных манипуляций в целях дезинфекции
-протирают дезраствором двукратно с промежутком в 15 минут
+погружают в дезраствор на время экспозиции
-ополаскиваются в растворе дезсредства
-орошаются дезсредством
Медицинский персонал проводит профилактическую дезинфекцию с целью
-обезвреживания источника инфекции
+разрыва путей передачи инфекции
-повышения невосприимчивости пациента к инфекции
-выявления источника инфекции
Генеральная уборка в кабинетах риска в стационарах различного профиля проводится
-1 раз в сутки
-2 раза в сутки
+1 раз в 7 дней
-2 раза в 7 дней
Вакцинация против гепатита В проводится
-однократно
+трехкратно по схеме 0,1,6 мес.
-четырехкратно по схеме 0,1,2,12 мес.
-двукратно по схеме 0,6 мес.
Для госпитальных штаммов возбудителей ВБИ характерна
-высокая чувствительность к антибактериальным средствам
+устойчивость к антибактериальным средствам
-чувствительность к ультрафиолетовому облучению
-устойчивость к инфракрасному излучению
Манипуляции, потенциально опасные для развития ВБИ у пациента
-физиотерапевтические
-измерение АД
-флюорография
+инвазивные
Уничтожение вероятно накопленных микроорганизмов при отсутствии видимого источника инфекции – это дезинфекция
+профилактическая
-очаговая
-текущая
-заключительная
Дезинфекционные мероприятия после удаления источника заболевания из очага – это дезинфекция
+заключительная очаговая
-текущая
-очаговая
-профилактическая
Срок сохранения стерильности изделий зависит от
-метода стерилизации
+упаковки
-вида изделия медицинского назначения
-характера манипуляции
Инкубационный период гепатита В
-20 дней
-30 дней
+180 дней
-1 год
Режим воздушной стерилизации
-120о С, 45 минут
-132о С, 20 минут
+160о С, 150 минут
-180о С, 30 минут
Антисептика – это мероприятия, направленные на
-предупреждение попадания микроорганизмов в рану
+уничтожение или уменьшение количества микроорганизмов в ране или организме в целом
-уничтожение патогенных и условно-патогенных микроорганизмов на эпидемиологически значимых объектах больничной среды:
-уничтожение всех микроорганизмов и их спор на изделиях медицинского назначения
На емкости с дезраствором не указывают
-концентрацию
-название раствора
-дату приготовления или начало использования
+объект дезинфекции
Основной целью проведения мероприятий по профилактической и очаговой дезинфекции является профилактика
+любых ВБИ
-гепатита
-заболеваний, передающихся через кровь
-ВИЧ-инфекции
Свойство препаратов, обладающих способностью убивать споры
-бактерицидное
+спороцидное
-вирулицидное
-фунгицидное
Сбор и утилизация медицинских отходов проводится с целью
-обезвреживания источника инфекции
+разрыва путей передачи инфекции
-повышения невосприимчивости персонала
-выявления источника инфекции
Для контроля предстерилизационной очистки изделий медицинского назначения
+проводят постановку азопирамовой и фенолфталеиновой проб
-используют термовременные индикаторы
-используют биотесты
-исследуют смывы с различных поверхностей
Аварийная аптечка индивидуальной защиты при работе с биологическим материалом не содержит
-70% спирт
+1% протаргол
-5% спиртовую настойку йода
-бактерицидный пластырь
После химической стерилизации изделий медицинского назначения проводится ополаскивание
-водопроводной водой
-дистиллированной водой
+стерильной водой
-антисептиком
Многоразовые изделия медицинского назначения после инвазивных манипуляций подвергаются
-только предстерилизационной очистке
-только дезинфекции
-только стерилизации
+дезинфекции, предстерилизационной очистке и стерилизации
Комплекс мероприятий, направленных на уничтожение членистоногих переносчиков возбудителей инфекционных заболеваний, называется
-дезинфекцией
+дезинсекцией
-дератизацией
-антисептикой
Для совмещения в один этап дезинфекции и предстерилизационной очистки можно использовать дезинфицирующие средства, обладающие
-дезинфицирующим действием
+дезинфицирующим и моющим действием
-дезинфицирующим и стерилизующим действием
-дезинфицирующим и дезодорирующим действием
Мероприятия, направленные на предупреждение попадания микроорганизмов в рану, называются
+асептикой
-антисептикой
-дезинфекцией
-стерилизацией
Для генеральной уборки предпочтительно использовать дезинфектанты, обладающие свойствами
-дезинфицирующими
+дезинфицирующими и моющими
-дезинфицирующими и дезодорирующими
-дезинфицирующими и спороцидными
К низкотемпературной стерилизации можно отнести
+плазменную
-паровую
-воздушную
-гласперленовую
Биологические среды ВИЧ-инфицированного пациента, содержащие наибольшее количество вирусов
-кровь, слюна
+кровь, сперма
-пот, слюна
-пот, сперма
Удаление с изделий медицинского назначения биологических жидкостей, лекарственных средств, жировых загрязнений это
-деконтаминация
-дезинфекция
+предстерилизационная очистка
-стерилизация
Дератизация-это комплекс мероприятий, направленных на уничтожение
-патогенных и условно-патогенных микроорганизмов
-членистоногих — переносчиков возбудителей инфекционных заболеваний
+грызунов- переносчиков возбудителей инфекционных заболеваний
-грибов
Дезинфицирующие средства, образующие защитную пленку на обработанной поверхности, нельзя использовать для дезинфекции
-стен, пола, потолка
-санитарно-технического оборудования
+медицинских инструментов
-манипуляционных столиков, кушеток
стерилизационных практик | Рекомендации по дезинфекции и стерилизации | Библиотека руководств | Инфекционный контроль
После очистки, сушки и проверки предметы, требующие стерилизации, должны быть завернуты или помещены в жесткие контейнеры и должны быть размещены в лотках / корзинах для инструментов в соответствии с инструкциями, предоставленными AAMI и другими профессиональными организациями 454, 811 -814, 819, 836, 962 . В этих рекомендациях говорится, что навесные инструменты следует открывать; элементы со съемными частями должны быть разобраны, если производитель устройства или исследователи не предоставят особые инструкции или данные испытаний об обратном 181 ; сложные инструменты должны быть подготовлены и стерилизованы в соответствии с инструкциями производителя устройств и данными испытаний; устройства с вогнутыми поверхностями следует располагать так, чтобы облегчить отвод воды; тяжелые предметы следует размещать так, чтобы не повредить хрупкие предметы; и вес набора инструментов должен основываться на конструкции и плотности инструментов и распределении массы металла 811, 962 .Хотя для хирургических наборов больше не существует установленного предела стерилизационного веса, масса тяжелых металлов является причиной влажных упаковок (т. Е. Влаги внутри ящика и лотка после завершения цикла стерилизации) 963 . Другие параметры, которые могут повлиять на сушку, — это плотность упаковки и конструкция набора 964 .
Существует несколько вариантов методов поддержания стерильности хирургических инструментов, включая жесткие контейнеры, открывающиеся пакеты (например, самозаклеивающиеся или термосвариваемые пластиковые и бумажные пакеты), рулоны или катушки (т.е. комбинации трубок из бумаги и пластика, предназначенные для того, чтобы позволить пользователю отрезать и запечатывать концы, чтобы сформировать пакет) 454 и стерилизационные обертки (тканые и нетканые). В медицинских учреждениях могут использоваться все эти варианты упаковки. Упаковочный материал должен обеспечивать проникновение стерилизующего вещества, обеспечивать защиту от контактного загрязнения во время работы, обеспечивать эффективный барьер для проникновения микробов и поддерживать стерильность обрабатываемого предмета после стерилизации 965 .Идеальная стерилизационная обертка будет успешно решать проблемы барьерной эффективности, проницаемости (т.е. позволяет стерилизующему проникать), аэрации (например, позволяет ETO рассеиваться), простоты использования, драпируемости, гибкости, устойчивости к проколам, прочности на разрыв, токсичности, запаха, удаления отходов , линтинг, стоимость, прозрачность 966 . Неприемлемая упаковка для использования с ETO (например, фольга, поливинилхлорид и поливинилиденхлор [прозрачная пленка кухонного типа]) 814 или газовая плазма с перекисью водорода (напр.g., белье и бумагу) не следует использовать для упаковки медицинских изделий.
При централизованной обработке двойная упаковка может выполняться последовательно или непоследовательно (т. Е. Одновременная упаковка). Обертывание должно производиться таким образом, чтобы не допускать скатывания и образования щелей. В последовательном обертывании используются два листа стандартной стерилизационной обертки, один за другим оборачиваемый. Эта процедура создает пакет внутри пакета. Непоследовательный процесс использует два листа, обернутых одновременно, поэтому обертывание необходимо выполнить только один раз.Этот последний метод обеспечивает многослойную защиту хирургических инструментов от загрязнения и экономит время, поскольку упаковка выполняется только один раз. Многослойность по-прежнему является обычной практикой из-за строгости обращения на предприятии, даже несмотря на то, что барьерная эффективность одного листа обертки за годы улучшилась 966 . Письменные и иллюстрированные процедуры подготовки предметов к упаковке должны быть легко доступны и использоваться персоналом при выполнении процедур упаковки 454 .
(PDF) Влияние различных методов стерилизации на поверхности из полиэстера
320 TEKSTİL ve KONFEKSİYON 23 (4), 2013
методы, используемые в больницах. Оксид этилена
может легко диффундировать в стерилизуемый материал
и эффективен при низких температурах. Однако
остается остатками этиленоксида и
нестабильным трехчленным кольцом
этиленоксид может реагировать с
различными функциональными группами, включая
сульфгидрильные, амино, карбоксильные и
гидроксильные группы белков и
. нуклеиновые кислоты (4).
Автоклавная стерилизация может быть использована как метод
как альтернатива стерилизации этиленом
оксидом. Это связано с высокой температурой
, паром и давлением в процессе
. Следовательно, недостатком способа
является гидролиз полимера
во время стерилизации
(4).
Альтернативой этим методам
, описанным ниже, может быть ультрафиолетовая стерилизация
, так как
не требует какой-либо термической или механической обработки, а
также является экологически чистым.
Полиэтилентерефталат (ПЭТ) представляет собой линейный полимер
и широко используется в медицине
, таких как хирургия
швы, медицинские халаты, больница
листов в виде пряжи и тканей
из-за его характеристик, включая
биостойкость, неаллергенность и отсутствие токсичности
(5).
С появлением новых применений нановолокон
нановолокна ПЭТ могут также использоваться в медицинских приложениях
, таких как каркасы
или системы доставки лекарств в виде матов из нановолокон
.Среди различных методов
электроспиннинг является одним из наиболее часто используемых методов
для производства нановолокон в последние годы
, поскольку он прост и позволяет электроформовать широкий спектр полимеров
. Метод
предполагает использование электрических зарядов
для производства нановолокон. В процессе электроспиннинга
к раствору полимера или расплаву
, удерживаемому на кончике капилляра, прикладывают высокое напряжение
.Когда напряжение
преодолевает поверхностное натяжение раствора полимера
, струя заряженного полимера
вылетает из наконечника
и движется к заряженному коллектору
. Во время движения струи
раствор испаряется и оставляет на поверхности коллектора (6-7) сухое волокно
.
Эти нетканые поверхности состоят из
нановолокон, которые находят множество применений в
медицине. Поскольку эти материалы должны быть стерилизованы перед применением
, необходимо выбрать наиболее подходящий метод
, чтобы не повредить свойства материала
.
Принимая во внимание эти условия, целью
данного исследования является изучение
эффектов различных методов стерилизации
на нановолокнах из электропряденого полиэфира
и полиэфирных тканях.
Так как поверхности из ПЭТ могут быть использованы в
в области медицины в качестве матов из нановолокна или тканых материалов
в зависимости от области применения
, влияния оксида этилена
(EO), автоклава (AU) и ультрафиолета
(УФ) методы стерилизации
были исследованы в обеих формах.С этой точки зрения, это исследование
состоит из двух частей. В первой части было исследовано влияние
различных методов стерилизации на
полиэтилентерефталатных (ПЭТ)
нановолокон, полученных методом электропрядения
с различными концентрациями
. Во второй части
было исследовано влияние различных методов стерилизации
на ПЭТ-ткани
.
2.МАТЕРИАЛЫ И МЕТОДЫ
2.1. Материалы
В этом исследовании использовались коммерчески доступные гранулы ПЭТ
и ткань полотняного переплетения 100%
полиэстер (ПЭТ). Растворы ПЭТ
с различной концентрацией
(10, 15 и 20 мас.%) Были приготовлены путем растворения гранул ПЭТ
в трифторуксусной кислоте (ТФУ)
(50 мас.%)
и дихлорметане (ДХМ) (50 мас.%)
растворителей. Все химические вещества
были коммерчески доступны от Sigma-
Aldrich и использовались в том виде, в котором они были получены, без какой-либо дополнительной очистки
.
2.2. Методы
Нановолокна ПЭТ были получены с помощью устройства электропрядения
(Inovenso
NanoSpinner24) в лабораториях
Университета Улудаг, кафедра текстильной инженерии
(Бурса, Турция).
Струя течет вверх от поверхности
висящей капли жидкости к вращающемуся барабану
(Рисунок 1). Таблица 1
показывает параметры прядения полученных нановолокон
.Все эксперименты
проводились на воздухе в комнатных условиях
.
Рисунок 1. Установка для электропрядения
Морфология поверхности тканей
и нановолокон, стерилизованных различными методами
, была оценена на
Carl Zeiss Evo 40 (Университет Улудаг,
Бурса, Турция) и на сканирующей электронной модели JEOL 840JXA
. микроскопы
(ТУБИТАК МАМ, Гебзе-ТУРЦИЯ).
Угол смачивания тканей и матов из электропряденого нановолокна
составил
, измеренный с использованием системы KSV-The Modular
CAM 200 для измерения угла смачивания
(Университет Улудаг, Бурса-
ТУРЦИЯ).Каплю дистиллированной воды
диспергировали на каждом образце с помощью микропипетки
; изображение каждой капли
было захвачено камерой
, соединенной с компьютерной системой захвата изображений
. Изображения
были захвачены как можно быстрее
после того, как капля воды была помещена на поверхность образца
, и сфотографированы в
менее чем за 1 с.
Таблица 1. Параметры электропрядения нановолокон
Концентрация
(мас.%)
Напряжение
(кВ)
Расстояние (мм) Расход (мл / ч) Скорость коллектора
(об / мин)
10 10 10 1250
15 10 10 1250
20 10 10 1 250
Что вы всегда хотели знать об упаковочных материалах
Что вы всегда хотели знать об упаковочных материалах
Джули Столлер, CRCST
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) классифицирует стерилизационные обертывания как медицинские устройства класса II, требующие следующие стандарты производительности: «Основное назначение и функция упаковочного материала (упаковка, стерилизационная обертка, пакет или аксессуары) — заключать медицинское устройство, которое должно быть стерилизовано медицинским учреждением.Он предназначен для стерилизации закрытого устройства, а также для поддержания стерильности устройства до его использования ».
Оберточные материалы подразделяются на две категории: тканые материалы многоразового использования и нетканые материалы, предназначенные для одноразового использования. В этой статье дается подробный обзор различные типы оберточных материалов и важность совместимости обертки с выбранным процессом стерилизации.Кроме того, будет обсуждена роль, которую технический специалист Центрального обслуживания играет в достижении желаемого результата правильно стерилизованных продуктов.
Есть три важных параметра, которые должны соблюдаться для любого типа используемой стерильной упаковки. Первый — обеспечить эффективный барьер между содержимым упаковки и микробиологическим загрязнением, второй — позволить проникнуть выбранному стерилизатору, а третий параметр состоит в том, что упаковка должна быть сконструирована таким образом, чтобы ее можно было открывать асептически.
Многоразовые или многоразовые ткани
Все обертки из тканого текстиля пригодны для повторной обработки, и между использованием их необходимо стирать.Тканые текстильные материалы, которые будут использоваться в качестве стерилизационных оберток, изготовлены из натуральных волокон хлопка, льна и / или смесей хлопка и синтетических материалов, таких как полиэстер (нейлон) и химически обработанные волокна (Quarpel), различное количество нитей (количество нитей на квадрат. дюйм) и веса нитей. Чем больше количество нитей, тем плотнее барьер.
Ранний тканый текстиль
Хлопковый муслин был одной из первых тканей, представленных в сфере здравоохранения в качестве универсальной обертки.Он имеет плотность 140 нитей на квадратный дюйм и состоит из 100% хлопка неплотного плетения. Для усиления барьерных свойств рекомендовалось двойное обертывание. Позже было обнаружено, что эффективность была снижена во время процесса стерилизации, когда он стал влажным, независимо от количества используемых слоев.
Хлопок пима или Т-280 — это более плотная хлопчатобумажная ткань с улучшенными барьерными свойствами и способностью выдерживать многократное использование и стирку. Эта ткань была первоначально разработана Институтом Ширли в Манчестере, Англия, во время Второй мировой войны и использовалась в летных костюмах.Пима Хлопок был заменен смесью полиэстера и хлопка.
Наиболее распространенными многоразовыми тканями, используемыми сегодня в медицинских учреждениях, являются смесовые или барьерные ткани. Этот тип тканой обертки изготавливается из комбинации двух или более типов волокон в одной пряжи с целью максимизации преимуществ их индивидуальных характеристик. Во многих учреждениях здравоохранения самой популярной смесью является перкаль из 50% полиэстера и 50% гребенного хлопка. Преимущества этого материала заключаются в том, что он не мнется, устойчив к истиранию и образованию пуха, а также очень прочен.Однако одним отрицательным аспектом этой ткани является ее низкая водонепроницаемость. Как упоминалось ранее, для повышения влагостойкости может применяться химическая обработка (Quarpel). Информацию по применению этого водоотталкивающего химического вещества следует получать у производителя. Медицинские учреждения, которые выбирают тканые ткани для своих стерильных оберток, должны иметь политику проверки ткани на наличие каких-либо дефектов.
Нетканые одноразовые (одноразовые)
Нетканые, одноразовые или плоские обертки изготавливаются другими методами, кроме ткачества, что позволяет использовать вымытую бумажную массу, волокна целлюлозы и синтетические волокна нейлона и / или других пластических полимеров. быть скрепленными под давлением, чтобы сформировать листы ткани.
Мятая бумажная масса, или ткани, уложенные мокрым способом, состоят из древесной массы и полиэстера. Смесь этих волокон суспендируется в воде с образованием суспензии — жидкой смеси воды и любого из нескольких мелких нерастворимых материалов — для обеспечения однородности. Затем вода сливается, в результате чего получается прочный материал, пригодный для многих применений.
Ткани спанлейс, например ткани мокрой укладки, состоят из древесной массы и полиэстера. Разница между ними заключается в процессе производства. Волокна тканей спанлейс подвергаются воздействию струй воды под высоким давлением, которые перемешивают или переплетают волокна, образуя мягкий драпируемый материал.
Полипропиленовая основа — это материал, изготовленный из гранул полипропилена, которые плавятся и затем экструдируются в одну непрерывную нить, а затем склеиваются вместе для образования прочной ткани. Другой нетканый материал на основе полипропилена, называемый спанбондом / выдуванием из расплава / спанбондом, происходит из непрерывных расплавленных нитей, которые формируются поточным прядением из расплава. Материалы, полученные выдуванием из расплава, похожи в том, что они образованы из полимера поточным формованием из расплава; однако волокна более тонкие и не непрерывные. Самый популярный из используемых нетканых материалов — это трехслойный полипропиленовый материал.Он поставляется в нескольких вариантах веса, каждый из которых предназначен для конкретного применения. Двухслойная ткань состоит из длинных непрерывных волокон, которые обеспечивают прочность ткани и ее устойчивость к истиранию. Центральный слой состоит из плотного мата из выдувных из расплава волокон, которые обеспечивают его эффективность в сопротивлении проникновению жидкостей и бактерий, одновременно обеспечивая проникновение пара для достижения стерилизации. Эти одноразовые плоские полимерные обертки с низким ворсом, мягкие на ощупь и драпируемые.
Материалы обертки
Материалы обертки должны соответствовать следующим требованиям:
- Обеспечивать адекватное удаление воздуха и проникновение пара в содержимое упаковки.
- Обеспечивает адекватный барьер для проникновения микроорганизмов.
- Обеспечьте адекватный барьер для жидкостей.
- Не допускайте разрывов и проколов.
- Подтвержденная целостность уплотнения.
- Обеспечить асептическую презентацию.
- Не содержать токсичных ингредиентов и непостоянных красителей.
- Анализ стоимости показал, что они рентабельны.
Было проведено множество исследований по поддержанию стерильности или сроку хранения стерильной упаковки, в большинстве из которых обсуждается, должны ли время или события быть основанием для определения. Несколько исследований подтвердили ценность политики, связанной с событиями. Такая практика снижает затраты на рабочую силу и поставки. При внедрении практик, связанных с событиями, следует учитывать важные факторы.Используемые типы обертки или упаковочных материалов должны быть достаточно стойкими, чтобы выдерживать неправильное вдыхание, и не допускать разрывов или проколов. Тип хранения (открытые или закрытые полки) и условия в зоне хранения необходимо контролировать, чтобы обеспечить стабильные условия окружающей среды, такие как температура и влажность. Наконец, персонал, работающий со стерилизованными предметами, должен быть обучен правильному порядку обращения с ними. Многие медицинские учреждения переходят на бесплодие, связанное с событиями, по сравнению с предыдущей практикой датирования истечения срока годности.При истечении срока годности на упаковку помещается наклейка с указанием даты стерилизации продукта и номера загрузки. Затем это используется в качестве инструмента для управления инвентарными запасами предприятия.
Что специалисты CS должны знать об упаковке
Специалисты CS должны понимать, как правильно выбирать и применять правильные упаковки для выбранного метода стерилизации. Изготовитель и дистрибьюторы должны иметь возможность предоставить подробные спецификации относительно свойств продукта, а также документацию о приемлемых результатах его прошлых характеристик.Неправильный выбор материалов и применение упаковки могут затруднить процесс стерилизации.
Технические специалисты также несут ответственность за вопросы обеспечения качества. Они должны собирать каждую упаковку с осторожностью, следя за тем, чтобы не порвать и не повредить упаковку. Каждая упаковка уникально организована в зависимости от содержимого, чтобы способствовать процессу стерилизации. Особое внимание необходимо также уделить способу загрузки стерилизатора.
В мире оберточных материалов произошло много улучшений, и, как всегда, в области централизованного обслуживания, вокруг нас происходят постоянные изменения.Новое стерилизационное оборудование приводит к появлению новых упаковочных материалов и усовершенствованных методов упаковки. Медицинские работники должны быть постоянно в курсе этих технологических усовершенствований. Всегда помните, что пациенты доверились нам.
Джули Столлер, CRCSD, работает техником в центральном технологическом отделении в больнице Innovative Health Hospital (Фарго, Северная Дакота).
Список ссылок можно найти на веб-сайте ICT.
Плазменная стерилизация: новая эпоха в медицинском текстиле
C.M. Пасторе, П. Хиенкенс, Характеристики поверхности волокон и текстиля (Марсель Деккер, Нью-Йорк, 2001), стр. 203
Google Scholar
E. Rodrigues, A.S. Левин, С.И. Синто, К.Ф. Мендес, Б. Барбоза, К.У. Грациано, Оценка использования и повторного использования хлопчатобумажных тканей в качестве медицинских и больничных покрытий. Braz. J. Microbiol. 37 , 113 (2006)
Артикул Google Scholar
Э. Абрутын, Д.А. Гольдман, У. Scheckler, Справочная служба по инфекционному контролю Saunders (WB Saunders Company, Филадельфия, 1998 г.), стр. 569
Google Scholar
Л. Титджен, В. Кронин, Н. Макинтош, Основы стерилизации. Руководство по профилактике инфекций, 11 , 13 (1992)
Всемирная организация здравоохранения (2008) Всемирный альянс за безопасность пациентов. Проверено 27 сентября 2008 г., www.who.орг
Американское общество специалистов централизованного обслуживания здравоохранения, Учебное пособие для техников централизованного обслуживания , 5-е изд. (Wiley, Hoboken, 2006), стр. 124
Google Scholar
J.D. Ninemeier, Техническое руководство по центральному обслуживанию. Int Assoc Healthc. Cent. Серв. Матер. Manag. 6 , 152 (2003)
Google Scholar
J.J. Перкинс, Принципы и методы стерилизации в медицинских науках , 2-е изд. (Charles C Thomas Pub. Ltd., Спрингфилд, 1983 г.)
Google Scholar
M. Reichert, J. Young, Технология стерилизации для медицинского учреждения (Aspen Publishing, Gaithersburg, 1993)
Google Scholar
G.R. Холиоак, С. Ван, Ю. Лю, Т.D. Банч, Токсическое действие остатков окиси этилена на эмбрионы крупного рогатого скота in vitro. Токсикология 108 , 33 (1996)
Статья Google Scholar
A.D. Lucas, K. Merritt, V.M. Хитчинс, Т. Вудс, С.Г. Н.К.Мами, Д. Лайл, С.А.Браун, Остаточный оксид этилена в медицинских устройствах и материалах устройств. J. Biomed. Матер. Res. 66 , 548 (2003)
Артикул Google Scholar
С. Аффатато, Г. Берсалья, И. Фолтран, П. Таддеи, Г. Фини, А. Тони, Характеристики гамма- и стерилизованных табличных чашек UHWMPE ace, испытанных в жестких условиях симулятора. Биоматериалы 23 , 4839 (2002)
Артикул Google Scholar
J. Lara, P.S. Фернандес, П. Периаго, А. Палоп, Облучение спор bacillus cereus и bacillus subtilis электронными лучами. Иннов. Food Sci. Emerg. Technol. 3 , 379 (2002)
Артикул Google Scholar
К. Уэмура, С. Исобе, Разработка нового аппарата для инактивации Escherichia coli в соленой воде с сильным электрическим полем. J. Food Eng. 53 , 203 (2002)
Артикул Google Scholar
Т. Осима, М. Сато, бактериальная стерилизация и высвобождение внутриклеточного белка импульсным электрическим полем. Adv. Biochem. Англ. Biotechnol. 90 , 113 (2004)
Google Scholar
К. Такешита, Дж. Шибато, Т. Самешима, С. Фукунага, С. Исобе, М. Арихара, М. Ито, Повреждение дрожжевых клеток, вызванное импульсным световым излучением. Int. J. Food Microbiol. 85 , 151 (2003)
Артикул Google Scholar
J.O. Нойс, Дж. Ф. Хьюз, Бактерицидные эффекты отрицательных и положительных ионов, генерируемых в азоте на Escherichia coli . J. Electrost. 54 , 179 (2002)
Артикул Google Scholar
Г. Тилтон, М. Кауфман (2004) Стерилизация и обзор основ управления инфекционным контролем, июнь
C.M. Чан, Модификация поверхности полимера и характеристика (Hanser Publications Inc, Нью-Йорк, 1994). п. 127
Google Scholar
J. Meichsner, Introduction to Plasma Physics (Европейская летняя школа — Физика плазмы в науке и технологиях, Университет Грайфсвальда — Институт физики, Прага, 2009)
С.М. Росснагель, Дж. Куомо, У.Д. Вествуд, Справочник по технологии плазменной обработки (Нойес Паблишинг, Нью-Йорк, 1990), стр. 253
Google Scholar
Силханкова Л., Микробиология для пищевой промышленности и биотехнологии (Victoria Publishing, Прага, 1995)
Google Scholar
P. Muranyi, J. Wunderlich, M. Heise, Эффективность стерилизации каскадного диэлектрического барьерного разряда.J. Appl. Microbiol. 103 , 1535 (2007)
Артикул Google Scholar
М. Хайзе, В. Нефф, О. Франкен, П. Мураньи, Дж. Вундерлих, Стерилизация полимерной фольги с помощью диэлектрических барьерных разрядов при атмосферном давлении. Plasmas Polym. 9 , 23 (2004)
Артикул Google Scholar
М. Ларусси, Ф. Лейпольд, Оценка роли активных форм, тепла и УФ-излучения в инактивации бактериальных клеток плазмой воздуха при атмосферном давлении.Int. J. Mass Spectrom. 233 , 81 (2004)
Артикул Google Scholar
J. Schneider, T.K.M. Баумгартнер, Дж. Файхтингер, Дж. Крюгер, П. Мураньи, А. Шульц, М. Уокер, Дж. Вундерлих, У. Шумахер, Исследование возможности использования микроволновой плазмы низкого давления при стерилизации пищевых упаковочных материалов на промышленном уровне . Серфинг. Пальто. Technol. 200 , 962 (2005)
Артикул Google Scholar
С. Дэн, Р. Руан, К. К. Мок, Г. Хуанг, X. Лин, П. Чен, Инактивация Escherichia coli на миндале с использованием нетепловой плазмы. J. Food Sci. 72 , M62 – M66 (2007)
Артикул Google Scholar
Дж. Эльбек, Р. Бранденбург, Т. Фон Вёдтке, У. Кроманн, М. Штибер, К. Вельтманн, ПЛАЗМОЗА — антимикробные эффекты модульных источников атмосферной плазмы. GMS Krankenhaushyg Interdiszip 3 (1), 1–12 (2008).DOC 14
Google Scholar
К.Д. Вельтманн, Э. Киндель, Р. Бранденбург, гл. Meyer, R. Bussiahn, Ch. Wilke, Th von Woedtke, Плазменная струя атмосферного давления для медицинской терапии: параметры плазмы и оценка риска. Contrib. Plasma Phys. 49 , 631 (2009)
Артикул Google Scholar
M. Moisan, J. Barbeau, M.-C. Кревье, Жак Пеллетье, Н.Филип, Б. Сауди, Методы и механизмы плазменной стерилизации. Pure Appl. Chem. 74 (3), 349 (2002)
Артикул Google Scholar
M. Laroussi, I. Alexe, W.L. Канг, Биологическая дезактивация нетепловой плазмой. IEEE Trans. Plasma Sci. 28 , 184 (2000)
Артикул Google Scholar
М. Ларусси, Нетермическое обеззараживание биологических сред плазмой атмосферного давления.IEEE Trans. Plasma Sci. 30 , 1409 (2002)
Артикул Google Scholar
М. Тиягараджан, И. Алексе, С. Парамесваран, С. Биби, Холодная плазма с барьером атмосферного давления для биологической дезактивации. IEEE Trans. Plasma Sci. 33 , 322 (2005)
Артикул Google Scholar
M. Laroussi, I. Alexe, J.P. Richardson, F.Дайер Ф. Резистивный барьерный разряд. IEEE Trans. Plasma Sci. 30 , 158 (2002)
Артикул Google Scholar
M. Heise, W. Ne, O. Franken, P. Muranyi, J. Wunderlich, Стерилизация полимерной фольги с помощью диэлектрических барьерных разрядов при атмосферном давлении. Plasmas Polym. 9 , 23 (2004)
Артикул Google Scholar
J.Г. Бирмингем, Механизмы дезактивации бактериальных спор с помощью нетепловых разрядов при атмосферном давлении. IEEE Trans. Plasma Sci. 32 , 1526 (2004)
Артикул Google Scholar
H.W. Херрманн, И. Хенинс, Дж. Парк, Г.С. Селвин, Обеззараживание боевых химических и биологических агентов с использованием плазменной струи атмосферного давления. Phys. Плазмы 6 , 2284 (1999)
Артикул Google Scholar
М. Ларусси, X. Лу, Плазменный шлейф при комнатной температуре и атмосферном давлении для биомедицинских приложений. Прил. Phys. Lett. 1 , 87 (2005)
Google Scholar
С. Моро, М. Мойзан, Т. Табризиан, Дж. Барбо, Дж. Пеллетье, Использование послесвечения плазмы для инактивации спор bacillus subtilis: влияние рабочих условий. J. Appl. Phys. 88 , 1166 (2000)
Артикул Google Scholar
М. Мойзан, Дж. Барбо, С. Моро, Дж. Пеллетье, М. Табризиан, Л. Х. Яхья, Низкотемпературная стерилизация с использованием газовой плазмы: обзор экспериментов и анализ механизмов инактивации. Int. J. Pharm. 226 , 21 (2001)
Артикул Google Scholar
Ф. Росси, Р. Де Митри, С. Бобин, Р. Элой, в Плазменные процессы и полимеры, изд. Авторы: Р д’Агостино, П. Фавиа, С. Эр, М. Р. Вертхаймер (Wiley, Weinheim, Германия, 2005), глава 24,
О. Килиан, М. Хасива, Ф. Росси, Влияние микроволновых разрядов низкого давления на биоактивность пирогенов. IEEE Trans. Plasma Sci. 34 , 2606 (2006)
Артикул Google Scholar
F.O. Росси, М. Хасива, Обеззараживание поверхностей плазменным разрядом низкого давления. Плазменный процесс. Polym. 3 , 431 (2006)
Артикул Google Scholar
J. Opretzka, J. Benedikt, P. Awakowicz, J. Wunderlich, A. Von Keudell, Роль химического распыления при плазменной стерилизации bacillus atrophaeus. J. Phys. D Прил. Phys. 40 , 2826 (2007)
Артикул Google Scholar
К. Ли, К. Пэк, В. Джу, Ю. Ли, Стерилизация бактерий, дрожжей и бактериальных эндоспор холодной плазмой атмосферного давления с использованием гелия и кислорода. J. Microbiol. 44 , 269 (2006)
Google Scholar
Дж. Х. Янг, в Новые технологии стерилизации. Технология стерилизации для медицинского учреждения , изд. М. Райхерт, Дж. Х. Янг (Aspen Publishers, Gaithersburg, 1997) ISBN 0-8342-0838-5, стр. 228
K. Kelly Wintenberg, T.C. Монти, К. Брикман, Дж. Р. Рот, А.К. Карр, К. Зорге, Л.С. Уодсворт, П. Цай, Стерилизация поверхностей и тканей при комнатной температуре плазмой тлеющего разряда однородной атмосферы. J. Ind. Microbiol. Biotechnol. 20 , 69 (1998)
Артикул Google Scholar
Дж. Р. Рот, П. П. Ку, Ю. Цай, Л. К. Уодсворт, К. Сан, Т. К. Монти, В. Келли, в Исследование стерилизации нетканых полотен с использованием плазмы тлеющего разряда с одной атмосферой. Труды конференции TAPPI , Северная Каролина, 1996, стр. 225, ISBN 0-89852-658-2
К. Келли Винтенберг, А. Ходж, T.C. Монти, Л. Делеану, Д. Шерман, Дж. Р. Рот, П. П. Цай, Л. Wadsworth, Использование однородной плазмы тлеющего разряда с одной атмосферой для уничтожения широкого спектра микроорганизмов.J. Vac. Sci. Technol. 17 , 87 (1999)
Артикул Google Scholar
Х. Войковска, Я. Сламова, З. Козакова, Ф. Крчма, Изучение стерилизующего действия диэлектрического барьерного разряда на эукариотические микроорганизмы. Astron. Обс. Белград. 89 , 331 (2010)
Google Scholar
Х. Халфманн, Н. Бибинов, Й. Вундерлих, П. Авакович, Двойная индуктивно связанная плазма для стерилизации медицинских изделий.J. Appl. Phys. 2 , 154 (2001)
Google Scholar
М.Дж. Киркпатрик, Б. Додет, Э. Одич, Влажная аргоновая плазма атмосферного давления для измерения стерилизации и моделирования образования водорода, кислорода и перекиси водорода. Int. J. Plasma Environ. Sci. Технол 1 , 96 (2007)
Google Scholar
M.J.Киркпатрик, Б. Локк, Образование водорода, кислорода и перекиси водорода в водной фазе импульсного коронного электрического разряда. Ind. Eng. Chem. Res. 44 , 4243 (2005)
Артикул Google Scholar
Я. Акишев, М. Грушин, В. Каральник, Н. Трушкин, В. Холоденко, В. Чугунов, Е. Кобзев, Н. Жиркова, И. Ирхина, Г. Киреев, Атмосферное давление. нетепловая плазменная стерилизация микроорганизмов в жидкостях и на поверхностях.Pure Appl. Chem. 80 (9), 1953 (2008)
Артикул Google Scholar
В. Шольц, Й. Юлак, В. Кржиха, Й. Мосингер, С. Копецка, Эффекты обеззараживания низкотемпературной плазмы, генерируемой коронным разрядом. Часть II: новые идеи. Prague Med. Реп. 108 , 128 (2007)
Google Scholar
Y.C. Tyan, J.D. Liao, S.P. Lin, C.C.Чен, Изучение стерилизующего эффекта гамма-облучения поверхностей нетканых материалов из полипропилена с иммобилизованным коллагеном. J. Biomed. Матер. Res. 67 , 1033 (2003). Wiley Periodicals, Inc.s
Статья Google Scholar
B.D. Ратнер, А. Чилкоти, Г. Лопес, Плазменное осаждение и обработка для применения биоматериалов, в Плазменное осаждение, обработка и травление полимеров , изд. Р. д’Агостино (Academic Press, Inc., Бостон, 1990), стр.416–464
Google Scholar
Сашка Димитриевска, Ален Пети, Чарльз Дж. Дуайон, Лаура Эпуре, Абделла Аджи, Л’Хосин Яхия, Мартин Бюро, Влияние стерилизации на нетканые структуры волокон из полиэтилентерефталата для сосудистых трансплантатов. Макромол. Biosci. 11 , 13 (2011)
Артикул Google Scholar
R. Roth, Industrial Plasma Engineering , vol.1 (Principles Institute of Physics Publisher, Бристоль, 1994), стр. 87
Google Scholar
P. Tasai, L. Wodsworth, P. Spence, J. Roth, in Модификации поверхности нетканых полотен с использованием плазмы тлеющего разряда с одной атмосферой для улучшения смачиваемости полотна и других свойств текстиля. 4-я ежегодная конференция TANDEC , Университет Теннесса, 1, 14, 1994
Дж. Рота Рис, Чжию Чен, Дэниел М.Шерман, Фуат Каракая, Увеличение поверхностной энергии и стерилизация нетканых материалов путем воздействия однородной плазмы тлеющего разряда в одну атмосферу. Int. Нетканые материалы J. 10 (3), 34 (2001)
Google Scholar
S. Müller, R.J. Зан, Т. Кобургер, К. Вельтманн, Уменьшение запаха и дезинфекция текстильных материалов с помощью диэлектрических барьерных разрядов. Nat. Sci. 2 (9), 1044 (2010)
Google Scholar
Стерилизация жидкостей, твердых веществ, отходов.Как правильно стерилизовать?
Процесс стерилизацииКак правильно стерилизовать?
Простая, безопасная, точная, воспроизводимая и проверяемая стерилизация.
Процесс стерилизации в автоклаве может быть довольно сложным. Например, при стерилизации жидкостей или твердых веществ (инструменты, стеклянная посуда, фильтры или текстильные изделия) для последующего использования в лаборатории процесс стерилизации должен обеспечивать получение стерильного продукта, воспроизводимого в любое время.Продукты, стерилизованные для использования в лабораториях, не могут быть проверены на стерильность, так как это может привести к их повторному загрязнению и, следовательно, их нельзя больше использовать в лаборатории. Валидация процессов паровой стерилизации становится все более важной проблемой для обеспечения воспроизводимых результатов, которые можно проверить. Кроме того, при автоклавировании, в частности, при стерилизации жидкостей, как правило, следует учитывать аспекты безопасности. Стерилизация обычно проводится при температуре 121 ° C. Это соответствует давлению пара прибл.2 бар. Такие высокие температуры и соответствующее давление могут представлять значительный риск для оператора, если процесс автоклавирования имеет конструктивные недостатки или не выполняется должным образом.
Стерилизация жидкостей и жидких отходов в бутылях
Стерилизация жидкостей — одна из самых сложных задач в лаборатории. Процессы стерилизации могут занимать очень много времени, бутылки должны быть открыты или, по крайней мере, вентилироваться, часть жидкости выкипит, жидкости могут вскипеть, а бутылки могут даже лопнуть.Другой вопрос, который необходимо решить, заключается в том, достигают ли жидкости внутри бутылок даже требуемой температуры стерилизации (например, 121 ° C) и когда их можно безопасно вынуть из автоклава после завершения процесса стерилизации.
Процесс стерилизации жидкостей делится на три этапа:
1. Фаза нагрева и время уравновешивания (H)
2. Фаза стерилизации, например 121⁰C в течение 20 минут (S)
3. Фаза охлаждения до безопасной температуры демонтажа (C)
Рисунок 1:
Синяя линия: Температура внутри камеры (резервуара высокого давления) автоклава
Красная линия: Температура, измеренная внутри жидкости
На рисунке 1 показаны отдельные фазы с помощью графического дисплея. Синяя линия представляет собой температуру внутри сосуда под давлением автоклава, красная линия — температура внутри жидкости. Хорошо видно, что температура внутри сосуда под давлением автоклава быстро достигает требуемой температуры 121 ° C, тогда как жидкостям внутри бутылок требуется гораздо больше времени для достижения температуры стерилизации. Во время нагрева тепловая энергия пара передается бутылкам за счет конденсации пара.Этот процесс конденсации и связанная с ним теплопередача требуют некоторого времени, что объясняет задержку во времени между простым нагревом сосуда высокого давления и нагревом самой жидкости. Время, необходимое для достижения одинаковых температур внутри сосуда высокого давления автоклава и внутри жидкостей, называется временем уравновешивания.
Многие автоклавы, используемые сегодня в лабораториях, до сих пор не оснащены устройством измерения температуры внутри эталонного сосуда. Таким образом, точная температура жидкости, подлежащей стерилизации, не измеряется и не может использоваться для регулирования процесса стерилизации.Эти автоклавы начинают фазу стерилизации после достижения необходимой температуры внутри сосуда высокого давления автоклава. Время уравновешивания, необходимое для того, чтобы жидкость также достигла требуемой температуры, не принимается во внимание. Таким образом, жидкости никогда не достигают температуры стерилизации, например 121 ° C и, следовательно, биологическая эффективность процесса стерилизации больше не гарантируется. В зависимости от устойчивости микроорганизмов, подлежащих деактивации, они деактивируются только частично или совсем не деактивируются.
Измерение температуры внутри эталонного сосуда
Измеряя температуру внутри эталонного сосуда с помощью датчика температуры, можно определить точную температуру стерилизуемой жидкости и затем использовать ее для регулирования процесса стерилизации. Время стерилизации начинается только после достижения необходимой температуры стерилизации внутри жидкости.
Эталонный сосуд заполняется водой. Очень важно, чтобы размер и уровень наполнения эталонного сосуда соответствовали самому большому сосуду, заполненному жидкостью, подлежащей стерилизации.
Рис. 2 — Измерение температуры Температура безопасного снятия
Датчик температуры для измерения внутри эталонного сосуда необходим для обеспечения достижения температуры стерилизации внутри жидкости. Также необходимо обеспечить безопасную температуру удаления после проведения стерилизации. Внутри автоклава жидкости нагреваются до температур, значительно превышающих обычную точку кипения (100 ° C). Тепловое тепло, передаваемое жидкости в связи с избыточным давлением, может представлять значительную опасность для оператора автоклава.Например, может произойти замедленное кипение, что означает, что жидкость самопроизвольно начнет кипеть при открытии автоклава. Это мгновенное закипание вызовет волну давления, состоящую из пара и горячей жидкости, извергающихся — подобно гейзеру — из сосудов. Из 1 литра воды будет производиться 1000 литров пара! Исходя из этого значительного потенциального риска, автоклавы, используемые для стерилизации жидкостей, подпадают под действие соответствующих правил. DIN EN 61010-2-040 предусматривает, что автоклавы, используемые для стерилизации жидкостей, должны быть оборудованы предохранительными устройствами, предотвращающими открытие автоклава до того, как жидкости не будут охлаждены до температуры удаления, безопасной для оператора.В стандарте определена безопасная температура удаления, которая должна быть на 20 К ниже точки кипения воды при атмосферном давлении окружающей среды. Это соответствует температуре безопасного удаления 80 ° C. Современные автоклавы оснащены дверным замком, зависящим от температуры и давления. Это предотвращает открытие автоклава, когда сосуд высокого давления находится под давлением и до тех пор, пока температура, измеренная внутри жидкости, превышает предусмотренные 80 ° C.
ll. 3 — Охлаждение с поддерживающим давлениемОхлаждение жидкости до безопасной температуры удаления может занять довольно много времени.Размер, часто используемый для автоклавов в лабораториях, — это автоклав с емкостью сосуда под давлением прибл. 150 л. Если такой автоклав заполнен бутылками, содержащими стерилизуемую жидкость, полный цикл стерилизации может занять до 10 часов. То есть в течение одного рабочего дня не может быть завершен даже один процесс стерилизации. Таким образом, рекомендуется оборудовать автоклав системой обратного охлаждения, что значительно сократит общее время, необходимое для стерилизации партии, и предотвратит дальнейшие опасности и недостатки при стерилизации жидкостей.
Быстрое обратное охлаждение — максимальная производительность и безопасность
Системы обратного охлаждения, доступные для автоклавов, в основном различают два типа систем охлаждения:
1. Охлаждение испарением — кипение жидкости во время фазы охлаждения
2. Охлаждение излучением — тепло, исходящее от жидкости, отсутствие кипения жидкости с этой системой охлаждения
Охлаждение испарением — наиболее часто используемый вид охлаждения внутри автоклава. Это может быть:
— Самоохлаждение за счет медленного выпуска пара
— Вентиляционное охлаждение — холодный окружающий воздух подается в сосуд высокого давления снаружи
— Водяное охлаждение без поддерживающего давления
Все указанные выше типы охлаждения имеют серьезные недостатки при стерилизации жидкостей и могут содержать значительную потенциальную опасность, если процесс стерилизации не выполняется должным образом, поскольку этот тип охлаждения требует охлаждения жидкости до кипения.
1. Когда жидкость закипает во время фазы охлаждения, часть жидкости теряется. Ожидаемая потеря жидкости обычно составляет от 3 до 10%, но может быть значительно выше — в зависимости от содержания жидкости. Особенно, если содержание белка в жидкости высокое, она имеет тенденцию к еще большему кипению, что снова увеличивает потери жидкости.
2. Поскольку жидкости должны закипеть, чтобы остыть, вероятность их выкипания высока. Поэтому бутылки наполняются только наполовину или даже только на треть, чтобы не допустить перекипания.С одной стороны, это значительная потеря производительности, поскольку теряется 50-70% доступной емкости (внутри бутылок). С другой стороны, надежно предотвратить выкипание невозможно. Если жидкости выкипят, автоклав необходимо очистить, и, например, жидкости на основе агара могут течь в систему труб (слив) автоклава и блокировать его, когда агар остывает и там затвердевает. Очистка системы трубопроводов часто требует больших затрат и возможна только для производителя автоклава.
3. Жидкости можно кипятить только из открытых бутылок. Поэтому бутылки должны быть открытыми или хотя бы вентилируемыми (крышка должна быть приоткрыта). Если вентиляция бутылок забыта или сделана неправильно, жидкость внутри не может закипеть во время фазы обратного охлаждения и, следовательно, не будет охлаждаться. После того, как эталонный сосуд достигнет температуры охлаждения 80 ° C и, таким образом, позволит открыть автоклав, герметично закрытые бутылки все еще будут находиться при температуре стерилизации с соответствующим давлением e.г. 121⁰C, 2 бар. Это представляет значительную опасность, так как эти бутылки могут взорваться при извлечении из автоклава, а содержащаяся в них жидкость может самопроизвольно испаряться — подобно замедленному кипячению. Из 1 литра воды получается 1000 литров пара!
Рис. 4 — UltracoolerПоэтому рекомендуется при покупке автоклава точно определить, для каких приложений он будет использоваться и как он должен быть оборудован с точки зрения производительности и безопасности.
Охлаждение излучением (быстрое охлаждение с опорным давлением)
Охлаждение излучением имеет значительные преимущества по сравнению с охлаждением испарением.Во время быстрого охлаждения с опорным давлением сосуд высокого давления охлаждается по всей его поверхности с помощью прикрепленных снаружи охлаждающих змеевиков, содержащих холодную воду. Перед включением охлаждения после фазы стерилизации пар внутри сосуда высокого давления заменяется стерильно отфильтрованным сжатым воздухом. Этот сжатый воздух надежно предотвращает закипание жидкости во время фазы охлаждения. Тепло передается от жидкости к холодным стенкам сосуда высокого давления посредством излучения, и жидкости, таким образом, охлаждаются.
Быстрое охлаждение с поддерживающим давлением позволяет значительно повысить производительность, поскольку время процесса по сравнению с самоохлаждением значительно сокращается. В то время как самоохлаждение требует до 10 часов для всего процесса автоклавирования, время повторного охлаждения за счет быстрого охлаждения с поддерживающим давлением может быть сокращено до 60% — в зависимости от количества обрабатываемых жидкостей.
Кроме того, все опасности и недостатки, описанные для охлаждения испарением (замедленное кипение, потеря жидкости, чрезмерное кипение, отсутствие охлаждения герметично закрытых бутылок), надежно устранены, поскольку жидкость больше не кипит.Этот тип охлаждения позволяет наполнять бутылки до максимального уровня (повышение производительности от 50 до 70%) — можно использовать даже герметично закрытые бутылки. Открытие или удаление воздуха из бутылок больше не требуется.
Дальнейшая оптимизация технологических циклов
Современные автоклавы позволяют дополнительно оптимизировать охлаждение жидкостей в модулях. Это дополнительно увеличивает производительность, но также влияет на качество стерилизуемых жидкостей. Многие жидкости содержат ингредиенты, которые не очень термостойкие.Жидкости необходимо стерилизовать, но время, в течение которого они будут подвергаться тепловому воздействию, должно быть как можно короче, чтобы термолабильные ингредиенты не подвергались отрицательному воздействию.
Модуль 1 — Радиальный вентилятор
Радиальный вентилятор генерирует воздушный поток внутри напорного резервуара автоклава во время фазы охлаждения. Этот воздушный поток направляет тепло от бутылок на стенки сосуда высокого давления, охлаждаемого быстрым охлаждением с поддерживающим давлением. Этот процесс сократит время охлаждения до 70% по сравнению с самоохлаждением.
Модуль 2 — Ультракулер
Ультракулер — это дополнительный теплообменник с водяным охлаждением, встроенный непосредственно в сосуд высокого давления автоклава. Это позволяет отводить тепло от бутылки именно там, где оно есть. Внутри сосуда высокого давления. За счет существенно улучшенной теплопередачи время охлаждения может быть сокращено до 90% по сравнению с самоохлаждением.
Примечание : Поскольку радиальный вентилятор и ультракулер устанавливаются внутри сосуда высокого давления, позаботьтесь о том, чтобы они не уменьшили полезное пространство, доступное внутри автоклава.
Стерилизация твердых частиц и отходов в мешках для уничтожения
При стерилизации твердых веществ (например, инструментов, пустой стеклянной посуды, наконечников пипеток в коробках, фильтров и текстильных изделий), а также при обеззараживании отходов в мешках для уничтожения необходимо обеспечить создание паровой атмосферы именно там, где это требуется. А именно на всех внутренних и внешних поверхностях стерилизуемого продукта. Многие автоклавы ненадежно удаляют воздух из автоклава и продукта. Если внутри автоклава и продукта остается воздух, стерилизующий эффект невозможен, поскольку только пар переносит тепловую энергию, необходимую для надежной дезактивации микроорганизмов.
Неэффективное удаление воздуха
На иллюстрациях 5 и 6 показано неэффективное удаление воздуха на примере коробки с наконечниками для пипеток, а также с мешками для уничтожения. Если автоклав просто нагревают, воздух вытесняется, и внутри сосуда под давлением автоклава образуется паровая атмосфера, но воздух остается внутри продукта, подлежащего стерилизации. Однако воздух, остающийся внутри продукта, препятствует проникновению пара туда, где его тепловая энергия необходима для достижения стерилизующего эффекта.
Рис. 5 — Неэффективное удаление воздухаПри той же температуре, что и пар (например, 121 ° C), воздух содержит только часть необходимой тепловой энергии. Для продуктов, которые нельзя стерилизовать в атмосфере пара, существуют стерилизаторы горячим воздухом, однако они стерилизуются при более высоких температурах (180–250 ° C), что требует гораздо большего времени (до нескольких часов стерилизации). Поэтому стерилизующий эффект воздуха при температуре 121 ° C — 134 ° C и времени стерилизации 3-20 минут, который обычно используется внутри парового стерилизатора, на практике не применяется.
Рис. 6 — Неэффективное удаление воздуха из мешков для уничтожения Эффективное удаление воздуха
Для полного и воспроизводимого удаления воздуха из автоклава и продукта, подлежащего стерилизации, необходимо использовать фракционированный предварительный вакуум. Поэтому автоклав оборудован вакуумной системой. Во время фазы нагрева выполняются циклы вакуумирования для эффективного удаления воздуха с последующим впрыском пара. Обычно применяется трехкратный фракционированный предварительный вакуум — однако в зависимости от продукта может потребоваться еще большее количество фракций.
Сушка твердых предметов — Superdry
Твердые предметы, такие как инструменты или пустая стеклянная посуда, обычно помещаются в сушильный шкаф после процесса стерилизации. Современные автоклавы позволяют сушить твердые частицы сразу после процесса стерилизации. Стерилизация и сушка в одном процессе. Дальнейшее обращение со стерилизуемым материалом, которое может вызвать повторное загрязнение, не требуется.
Стерилизация биологически опасных веществ
Стерилизация биологически опасных веществ представляет собой особую задачу. Во время фазы нагрева воздух внутри автоклава заменяется паром. Воздух вытесняется из автоклава и выпускается в помещение, где установлен автоклав. TRBA 100 — Технический регламент для биологических рабочих материалов. требует, чтобы в лабораториях с уровнем безопасности BSL2 технологический отработанный воздух из автоклава обрабатывался, поскольку отработанный воздух может быть загрязнен микроорганизмами из продукта, подлежащего стерилизации.Необходимо использовать соответствующий процесс. В случае автоклавов это обычно фильтрация. Поэтому автоклав может быть оборудован фильтром для выпуска воздуха. Весь воздух, вытесняемый из автоклава, проходит через фильтр с задерживаемыми в нем микроорганизмами. Фильтр стерилизуется «на линии» во время процесса стерилизации для дезактивации задержанных в нем микроорганизмов.
TRBA 100 работает только с отработанным воздухом, выходящим из автоклава, но не с собранным конденсатом. В процессе стерилизации пар конденсируется на продукте и, таким образом, снова превращается в воду (конденсат).Эта вода также может быть загрязнена микроорганизмами. Следовательно, конденсат должен оставаться внутри автоклава во время процесса стерилизации, а также его необходимо стерилизовать «на линии», прежде чем сливать после успешной стерилизации.
Квалификация и проверка
В ходе аттестации проверяется, подходит ли устройство для предполагаемого использования, и соответствует ли процесс — например, процесс стерилизации — может выполняться с учетом стерилизации продукта с постоянным (воспроизводимым) результатом, стерильным продуктом.Как правило, процесс квалификации делится на три основных части:
1. IQ — Квалификация установки
Проверка того, было ли устройство изготовлено и установлено в соответствии со спецификациями.
2. OQ — Operational Qualification
Проверка, работает ли устройство в целом в соответствии с заданными функциями.
3. PQ — Квалификация производительности
Проверка того, работает ли устройство с обрабатываемым продуктом в соответствии со спецификациями Цель квалификации и проверки, является документированным доказательством того, что устройство подходит для предполагаемого использования.
Target of Qualification and Validation — это задокументированное доказательство того, что устройство подходит для предполагаемого использования.
Стерилизующий эффект процесса автоклава подтверждается во время OQ (пустая камера) и PQ (с продуктом) с помощью внешних регистраторов данных температуры и давления, а также с использованием биоиндикаторов на основе Bacillus Stearothermophilus. В то время как внешние регистраторы данных для температуры и давления предоставляют доказательства того, что управление автоклавом отображает и документирует достоверные значения, а также выполняет процесс стерилизации в пределах определенных допусков, биоиндикаторы предоставляют доказательства биологической эффективности.Чтобы разместить биоиндикаторы, необходимо определить, на каких участках продукта, подлежащих стерилизации, сложнее всего достичь биологической эффективности. Точно в этих областях должны быть размещены биоиндикаторы, чтобы охватить «наихудший сценарий». Все этапы IQ, OQ и PQ должны быть подробно задокументированы. В каждом случае проведения IQ, OQ и PQ требуется тесное сотрудничество между пользователем и производителем.
Статья также опубликована в лабораторном журнале GIT Labor-Fachzeitschrift, 7/2016, стр. 14-18.
Дополнительная информация об автоклавах здесь:
ГИРБАУ
Прачечная на дому
Преимущества сохранения процессов стирки на месте:
- Предотвращает загрязнение тканей при транспортировке за пределы страны
- Защищает здоровье сотрудников
- Проверить соблюдение параметров дезинфекции
- Полный контроль над методами стирки и долговечностью текстильных изделий
- Полный контроль над процессами обработки, очистки и дезинфекции белья
- Использование биоразлагаемой химии и эффективных методов стирки
- Простое управление машиной даже для неспециалистов
- Устранение затрат на аутсорсинг
Оборудование должно включать в себя систему удаленной регистрации данных, например, которая отслеживает и проверяет соблюдение параметров дезинфекции для каждой обрабатываемой партии белья.
Каждая машина оснащена автоматическим впрыском химикатов, что избавляет от необходимости добавлять моющие средства вручную.
Размер прачечной подбирается в соответствии с вашими уникальными потребностями в производительности.
Шайба HS
Система Aqua Mixer : гарантирует поддержание заданной температуры в течение всего заданного времени.
Гарантия дезинфекции : Позволяет полностью контролировать температуру воды по градусам.
Программы стирки : Автоматически комбинирует мягкие для тканей моющие и дезинфицирующие средства, чтобы продлить срок службы униформы и СИЗ.
Влажная очистка : система сводит к минимуму просыпание микрочастиц полиэстера в сточную воду.
Control : простая в использовании система управления с 99 уникальными программами стирки. Просто загрузите, введите номер программы и нажмите старт. (В зависимости от модели).
Сушилка ED
Control : Высоко программируемое управление, предлагающее 10 предустановленных программ и 40 настраиваемых программ, что дает оператору полный контроль над параметрами сушки.
Программируемый датчик температуры на входе и выходе воздушного потока : непрерывно контролирует температуру и позволяет полностью контролировать скорость охлаждения.Предотвращает повреждение тканей от пересушивания.
Система контроля влажности : предотвращает пересушивание белья — исключает ошибки оператора, повышает производительность и предотвращает повреждение и усадку ткани.
Программы сушки : программы сушки, используемые для сушки влажных вещей, сочетают в себе низкие температуры и контроль движения барабана для превосходного ухода за тканями.
J-Pac Medical: Услуги по медицинскому текстилю
Дизайн / прототип
J-Pac Medical создает медицинские текстильные устройства нестандартной формы, отвечающие уникальным анатомическим и биологическим требованиям, а также позволяющие трансформировать форму на месте.Это сводит к минимуму время хирургической процедуры за счет уменьшения или исключения интраоперационных корректировок, а также может обеспечить хирургическое восстановление с уменьшением напряжения, присущего ненастроенным имплантатам.
Процессы плетения, вязания, ткачества и производства нетканого текстиля помогают значительно улучшить прочность, текстуру, гибкость и другие рабочие характеристики в соответствии с индивидуальными требованиями к устройствам. Возможности повышения механических характеристик и анатомической точности безграничны, что в конечном итоге приносит пользу пациенту.
Наши услуги по дизайну медицинского текстиля включают понимание требований к вашему устройству, выбор материалов и разработку методов сборки для правильной формы, формы и сборки готового устройства. Наш дизайн включает в себя прототипы и выпуски для стерилизации небольшими партиями.
Тестирование + проверка
Чтобы гарантировать, что механические свойства медицинских текстильных материалов не изменились, текстильные сборки тестируются после изготовления.Обычно это включает разрушающие испытания, проводимые в нашей лаборатории контроля качества. В большинстве случаев наши соединительные швы собранного текстиля прочнее, чем сам текстиль.
Наши процессы резки, формовки, формовки и сборки медицинского текстиля полностью сертифицированы на соответствие соответствующему индексу производственных возможностей. Утвержденные процессы повторно проверяются, если происходят производственные изменения. J-Pac Medical всегда оценивает критические параметры с учетом риска.
Разработка процессов
Одно из самых больших преимуществ медицинских текстильных устройств заключается в том, что они могут быть адаптированы под конкретного пациента и разрабатываться с учетом уникальных требований конечного пользователя.Устройства могут быть полностью изготовлены из рассасывающихся частей или из комбинации рассасывающихся и не рассасывающихся компонентов. Их можно использовать для контролируемой доставки лекарства или биологических агентов непосредственно в место имплантации.
J-Pac поможет вам выбрать правильные текстильные материалы, чтобы максимизировать производительность готового устройства по его прямому назначению.
Производство
Уникальные производственные технологии J-Pac, включая формовку и резку без воздействия на механические свойства ткани.Крой текстильных изделий включает гладкую кромку. Мы также разработали методы сборки, позволяющие комбинировать текстильные изделия без наложения швов.
Стерилизация
Услуги по стерилизации выполняются в тесном сотрудничестве с нашими надежными стратегическими партнерами для доставки клиентам продуктов, готовых к выпуску на рынок.Методы стерилизации включают EtO, гамма, VHP, автоклав и другие.
Упростите цепочку поставок
J-Pac Medical — ваш партнер в области подтвержденного соответствия Классу II / III и соблюдения строгих стандартов качества и валидации на каждом уровне цепочки поставок.


