|
⇐ ПредыдущаяСтр 17 из 26Следующая ⇒ Преимущество метода: — щадящий температурный режим; — возможность проводить стерилизацию децентрализовано (на рабочих местах). Основные недостатки: — длительная экспозиция (несколько часов): — необходимость отмыва стерильной водой от стерилянтов: — короткий срок хранения стерильных изделий; — трудности, связанные с контролем эффективности стерилизации. Этот метод проводится децентрализовано (в процедурных и перевязочных кабинетах). Выполняет стерилизацию специально обученный персонал. Все манипуляции проводят в асептических условиях, в стерильных перчатках. Стерилизуются медицинские изделия из термолабильных материалов, снабженных оптическими устройствами, из полимеров, резины, стекла, коррозионностойких металлов. После дезинфекции и предстерилизационной очистки изделия опускают в раствор стерилянта на время стерилизационной выдержки, после чего промывают стерильной водой (в 2-х водах). Простерилизованные и отмытые от стерилянта изделия высушивают стерильными салфетками и помещают в стерильную емкость, выложенную стерильной простыней. Препараты для стерилизации в растворах, режимы стерилизации и отмывки в стерильной воде, виды изделий и особенности проведения стерилизации в растворах указаны в таблице № 5. Используемое оборудование: пластмассовые, стеклянные, эмалированные емкости с плотно прилегающими крышками. После стерилизации химическим способом изделия ополаскивают в 2 – 3 порциях стерильной воды, в каждой по 5 минут.
Таблица 5 Стерилизация растворами химических средств
|
Химический метод стерилизации — Студопедия. Нет
Нет
1. Газовая стерилизация
2. Растворами химических веществ
3. Антисептики и консерванты
1.Газовая стерилизация основана на применении летучих дезинфицирующих веществ, легко удаляемых из среды путем слабого нагревания или вакуума. Используют соединения, обладающие спермицидными свойствами: окись этилена, смесь окиси этилена с бромистым метилом (1:2:5) смесь «ОБ»
Степень стерилизации зависит от:
1. вида микроорганизмов
2. температуры
3. влажности
4. концентрации газов
5. времени стерилизационной выдержки
Приборы:газовые стерилизаторы или микроанаэростаты
Режимы стерилизации:
Окись этилена доза 1200 мл/дм3; t° — 18 °C; влажность 80%; время стерилизации 16 часов
Смесь ОБ а) доза 2000 мл/дм3; t° — 18 °C; влажность 80%; время стерилизации 16 часов
б) доза 2000 мл/дм3; t° — 55 °C; влажность 80%; время стерилизации 4 часов
Допускают другие режимы, обеспечивающие стерильность и сохранность объекта, что должно быть оговорено в НТД.
Объекты:
Изделия из синтетических и полимерных материалов, резины, кожи, стекла и металла, в том числе одежды, обуви, предметов быта.
Но применение стерильных материалов возможно только после дегазации, т.е. выдержки в вентилируемом помещении до допустимых остаточных количеств дезинфицирующих газов, указанных в НТД.
2.Стерилизация растворами химических веществ.
Эффективность стерилизации зависит от:
1. концентрации активно действующих веществ
2. температуры раствора
3. времени стерилизационной выдержки
Режимы стерилизации:
6% раствор перекиси водорода:t° — 18 °C; время стерилизации6 часов
t° — 50 °C; время стерилизации 3 часа
1% раствор «Дезоксон-1» t° — 18 °C; время стерилизации 45 минут
(надуксусная кислота)
Объекты: изделия из полимерных материалов, резины, стекла и коррозийностойких металлов. Причем, при стерилизации объект полностью погружается в раствор, находящийся в закрытой емкости из стекла (Биксах), пластмассы или эмали. После стерилизации стерильный объект промывается в асептических условиях стерильной водой. Хранят стерильные объекты в стерильной емкости, выложенных стерильной простыней 3-е суток.
Причем, при стерилизации объект полностью погружается в раствор, находящийся в закрытой емкости из стекла (Биксах), пластмассы или эмали. После стерилизации стерильный объект промывается в асептических условиях стерильной водой. Хранят стерильные объекты в стерильной емкости, выложенных стерильной простыней 3-е суток.
Контроль параметров и эффективности химических методов стерилизации:
1. Определение содержания активно действующих веществ
2. Определение температуры рабочего раствора
Понятие о консервантах и антисептиках
Консерванты – это химические вещества, обладающие бактериостатическим действием, т.е., приостанавливают рост и развитие микробов. Например: спирт этиловый, глицерин, хлороформ, кислота салициловая, хлоргексидинабиглюконат и др.
Антисептики – это химические вещества, обладающие бактерицидным действием, т.е., убивающие микробов. Например: фенол в конц. 0,3%, Тринрезол 0,3%, формальдегид 0,2%, нипагин 0,25%, нипозол 0,07%.
Положительные стороны химического метода стерилизации:
1. Сохраняется стерильность раствора после вскрытия флакона
2. Процесс не трудоемкий
Недостатки:
1. Химические вещества – это токсические вещества не только для микробов, но и для организма человека
2. Антисептики консерванты понижают иммунитет
3. Микроорганизмы имеют свойство привыкать к определенным химическим веществам и перестают на него реагировать
Стерилизация фильтрованием
Стерилизация фильтрованием через мембранные и глубинные фильтры, задерживающие микроорганизмы и их споры, наряду со многими достоинствами присущи некоторые недостатки, которые ограничивают область его применения.
Положительные стороны:
1. Задерживают все части, размеры которых превышают размер пор
2. Мембранные и глубинные фильтры не выделяют в фильтрах волокна
3. Стабильны при нагревании до 130 °C
Стабильны при нагревании до 130 °C
4. Высокая производительность
5. Не поглощают фильтруемую жидкость
Недостатки:
1. Меньшая надежность стерилизации по сравнению с тепловой стерилизацией конечного готового продукта в герметической упаковки
2. Высокая стоимость процесса, требующего жестких условий по микробной чистоте помещений
3. Трудности технического порядка, малейшая трещина делает фильтр непригодным
4. Фильтрация может осуществляться под вакуумом или под давлением, т.е. необходимость фильтрующей установки
5. Через один фильтр можно профильтровать только раствор одного наименования
понятие, методы и режимы — Студопедия.Нет
Предстерилизационная очистка и стерилизация изделий медицинского назначения.
План.
1. Предстерилизационная очистка инструментария многоразового использования, аппаратуры в соответствии с нормативными документами.
2. Стерилизация: понятие, методы и режимы.
3. Устройство и функции ЦСО.
Предстерилизационная очистка инструментария многоразового использования, аппаратуры в соответствии с нормативными документами.
При проведении инвазивных ПМУ во всех отделениях и амбулаторно-поликлинических организациях используются стерильные изделия медицинского назначения, которые после обеззараживания при профилактической и очаговой дезинфекции подвергаются предстерилизационной очистке и стерилизации. Все мероприятия по стерилизации проводятся согласно документов:
1. Постановление Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58 «Об утверждении СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность».
2. «МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ДЕЗИНФЕКЦИИ, ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКЕ И СТЕРИЛИЗАЦИИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ. МУ-287-113» (УТВ. ДЕПАРТАМЕНТОМ ГОССАНЭПИДНАДЗОРА МИНЗДРАВА РФ ОТ 30. 12.1998).
12.1998).
3. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы».
Предстерилизационная очистка и стерилизация проводятся в централизованных стерилизационных отделениях (далее ЦСО), а при их отсутствии в отделениях МО систематически во всех случаях при подготовке изделий к предстоящим медицинским манипуляциям, при которых эти изделия будут соприкасаться с кровью, раневой поверхностью, инъекционными препаратами или при которых имеется риск повреждения слизистых оболочек.
Цель предстерилизационной очистки — удаление с изделий медицинского назначения белковых, жировых, лекарственных, механических загрязнений, в том числе невидимых (крови, слизи), дезинфицирующих средств, детергентов, что обеспечивает эффективность последующей стерилизации, безопасное использование простерилизованных изделий и снижающий риск пирогенных реакций. Предстерилизационная очистка осуществляется в качестве самостоятельного процесса после дезинфекции изделий или при совмещении с ней.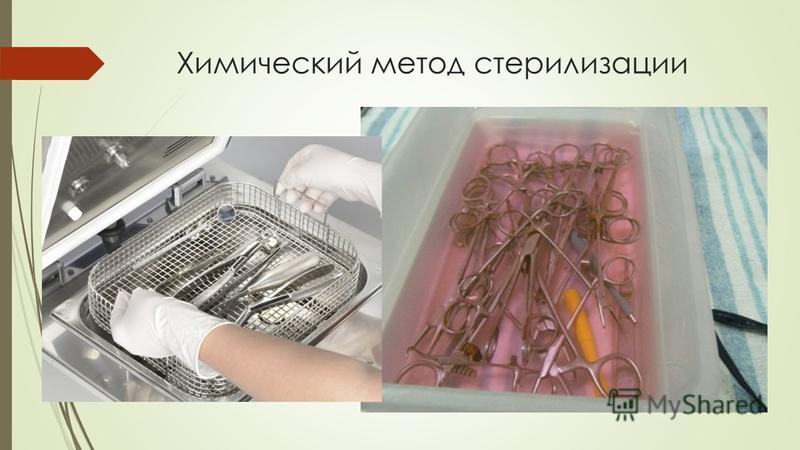
Предстерилизационную очистку проводят ручным и механизированным способами.
При ручной обработке замачивают, моют и ополаскивают изделия в ваннах, раковинах, бачках и других емкостях, которые должны иметь кран (шланг) для струйной подачи воды. Предстерилизационная очистка ручным способом должна осуществляться моющими растворами используя емкости из пластмасс, стекла или покрытых эмалью (без повреждений) в определенной последовательности.
Для механизированной предстерилизационной очистки используют специальные моечные и моечно-дезинфекционные (комбинированные) машины для мойки шприцев и игл, хирургических инструментов. Работа моечных машин основана на использовании одного из методов: струйного, ротационного, ершевания, ультразвукового с использованием поверхностно-активных веществ или других добавок. Методика проведения механизированной обработки зависит от типа используемого оборудования и должна соответствовать инструкции по эксплуатации.
Для предстерилизационной очистки, используются химические, физические средства, оборудование, аппаратура и материалы, разрешенные к применению в МО в установленном порядке в Российской Федерации, не оказывающие неблагоприятного воздействия на человека.
Разъемные изделия подвергают предстерилизационной очистке в разобранном виде.
После завершения ПСО проводится контроль качества предстерилизационной обработки — постановка контольных проб на наличие остаточных количеств щелочных компонентов моющего препарата, крови, жировых компонентов лекарственных средств.
Контролю подвергают 1% от одновременно обработанного инструментария одного наименования (но не менее 3-5 единиц). После завершения ПСО, при отрицательных контрольных пробах, изделия медицинского назначения подвергаются процессу стерилизации.
Стерилизация: понятие, методы и режимы.
Стерилизация обеспечивает полное высвобождение вещества или предмета от микроорганизмов.
Стерилизация — это процесс уничтожения всех видов микробной флоры (в том числе споровых микроорганизмов) и вирусов с помощью физических или химических воздействий.
Простейшим способом стерилизации является обжигание металлических и стеклянных предметов в пламени горелки. Выбор способа стерилизации зависит от целого ряда факторов, основным из которых является устойчивость предмета (изделия) к тому или иному воздействию.
Выбор способа стерилизации зависит от целого ряда факторов, основным из которых является устойчивость предмета (изделия) к тому или иному воздействию.
Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) и химическими (применение растворов химических средств, газовый) методами. Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий.
При стерилизации паровым, воздушным и газовым методами изделия, как правило, стерилизуют упакованными в стерилизационные упаковочные материалы; при паровом методе, кроме того, используют стерилизационные коробки без фильтров и с фильтрами.
Могут быть использованы только упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению (в случае импортных материалов — разрешенные к применению) в Российской Федерации.
При воздушном методе, а также в отдельных случаях при паровом и газовом методах, допускается стерилизация инструментов в неупакованном виде (в открытых лотках).
Методы стерилизации.
Воздушный метод. Воздушный метод стерилизации (в сухожаровом шкафу) рекомендуется применять для сухих изделий из металла, стекла . Стерилизацию проводят в упаковке из бумаги мешочной непропитанной, бумаги мешочной влагопрочной, бумаги для упаковывания продукции на автоматах марки Е и крафт-бумаге или без упаковки (в открытых емкостях).
В соответствии с ОСТ 42-21-2-85 выделяют два режима стерилизации:
-60 мин при 180°С;
-150 мин при 160°С.
При стерилизации в сухожаровом шкафу необходимо соблюдать несколько правил.
1. Изделия, подлежащие стерилизации, загружают в шкаф в количестве, допускающем свободную подачу горячего воздуха к стерилизуемому предмету.
2. Горячий воздух должен равномерно распределяться в стерилизационной камере.
3. Большие предметы следует класть на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха.
4. Стерилизуемые изделия необходимо укладывать горизонтально, поперек пазов кассет, полок, равномерно их распределяя.
Стерилизуемые изделия необходимо укладывать горизонтально, поперек пазов кассет, полок, равномерно их распределяя.
5. Недопустимо загружать стерилизатор навалом. Не допускается перекрывать продувочные окна и решетку вентилятора.
После стерилизации в открытой емкости медицинский инструментарий не хранится, а используется сразу.
Шприцы в разобранном виде и две иглы укладывают в крафт-пакеты из пергамента или влагопрочной бумаги. Свободный конец пакета дважды подворачивают и заклеивают. На пакете указывают вместимость шприца и дату стерилизации. Стерильность в крафт-пакетах сохраняется в течение 3 сут.
Паровой метод. При паровом методе (автоклавировании) стерилизация осуществляется увлажненным воздухом (паром) при повышенном давлении в специальных паровых стерилизаторах (автоклавах).
В соответствии с ОСТ 42-21-2-85 выделяют два режима стерилизации:
1) 2 атм — 132 °С — 20 мин — рекомендуется для изделий из коррозионно-стойкого металла, стекла, текстильных материалов;
2) 1,1 атм — 120°С — 45 мин — рекомендуется для изделий из резины (катетеры, зонды, перчатки), латекса и некоторых полимерных материалов (полиэтилен высокой плотности, поливинилхлорид).
Простерилизованные материалы хранят в крафт-пакетах, двухслойной бязевой упаковке или стерилизационных коробках с фильтром (биксах) не более 3 сут.
Стерилизации паром под давлением .нельзя подвергать режушие инструменты, приборы с оптической системой.
Химический метод (применение химических препаратов — дезинфектантов и антисептиков). Этот метод используют для изделий из полимерных материалов, резины, стекла, металлов. Стерилизация проводится в закрытых емкостях из стекла, пластмассы или покрытых эмалью (эмаль должна быть без повреждений) при полном погружении изделия в раствор. После этого изделие промывают стерильной водой. Простерилизованное изделие хранится в стерильной емкости (стерилизапионной коробке), выложенной стерильной простыней, в течение 3 сут. Для химической стерилизации в соответствии с ОСТ 42-21-2-85 применяют следующие режимы:
1) 6% раствор перекиси водорода:
• при 18 «С в течение 360 мин;
• 50 °С в течение 180 мин;
2) 1 % раствор дезоксона-1 при 18 °С в течение 45 мин.
Необходимо соблюдать правила химической стерилизации:
1. Температура растворов в процессе стерилизации не поддерживается.
2. Раствор перекиси водорода можно использовать в течение 7 сут со дня приготовления при условии хранения в закрытой емкости в темном месте. Далее раствор можно применять только при условии контроля содержания активно действующих веществ.
3. Раствор дезоксона-1 можно использовать в течение 1 сут.
4. Стерилизующие растворы применяют однократно.
В качестве модификации химического метода стерилизации применяются способы обработки изделий медицинского назначения газами или парами химических соединений.
Химическая стерилизация — Википедия
Материал из Википедии — свободной энциклопедии
Химические, низкотемпературные (при t<100оС) методы стерилизации (газовый, плазменный и с применением растворов средств), применяемые для стерилизации изделий из термолабильных материалов, требуют наличия соответствующих химических агентов.
Перечень химических средств, которые, согласно утвержденным официальным методическим указаниям, могут применяться для химической стерилизации, на сегодня значительно шире, по сравнению с перечнем, указанным в ОСТ 42-21-2-85. Однако с учетом современных представлений о биоцидных свойствах ряда активно действующих веществ, применяемых в средствах, а также использованных методик и тест-микроорганизмов для изучения стерилизующих свойств включение некоторых средств в число стерилянтов выглядит недостаточно обоснованным.
Например, это относится к средствам из группы четвертичных аммониевых соединений, полигуанидинов и третичных алкиламинов, а также их композиций (Пантелеева Л. Г.).
Стерилизация с применением растворов химических средств — вспомогательный метод
Необходимо также подчеркнуть, что стерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода или 0,9 % раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами.
Данный метод применяется для стерилизации изделий, в конструкции которых использованы термолабильные материалы и когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации. Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходимо обеспечить хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия. На данное время не существует международных стандартов на осуществление процедуры контроля качества стерилизации растворами химических средств.
Все изделия, простерилизованные в неупакованном виде, следует сразу использовать по назначению без переноса их из кабинета в кабинет.
Дезинфицирующее средство высокого уровня для химической стерилизации изделий медицинского назначения и аппаратуры
Для химической стерилизации изделий медицинского назначения и аппаратуры, изготовленных из термолабильных материалов, компания Интердез предлагает препарат «Солиокс» — дезинфицирующее средство высокого уровня.
Препаративная форма СОЛИОКСА
Препаративная форма средства — порошок. Активно действующим веществом в растворе средства является надуксусная кислота, относящаяся к окислителям и являющаяся одним из самых мощных биоцидов.
Самоактивация раствора происходит в течение 15 минут после растворения средства в воде. В течение этого времени в растворе синтезируется надуксусная кислота в количестве, необходимом для выполнения стерилизации и дезинфекции высокого уровня. Содержание надуксусной кислоты в растворе в концентрации 1,75 % по препарату (это концентрация, которая используется для стерилизации) — не меньше 0,3 %, а рН составляет 8,0±1,0 единиц рН, то есть реакция растворов находится в диапазоне от нейтральной до слабощелочной.
Средство содержит моющие, антикоррозионные и стабилизирующие содержание надуксусной кислоты компоненты.
Широкий спектр антимикробного действия Солиокса
- высокоэффективный бактерицид (в том числе против Pseudomonas aeruginosa)
- туберкулоцид (в том числе против Мycobacterium tuberculosis і Мycobacterium terrae)
- вирулицид (в том числе против возбудителей гепатитов А, В, С, ВИЧ, гриппа всех типов, парагриппа, птичьего гриппа, SARS, аденовирусной, энтеровирусной (в том числе полиомиелит), коронавирусной, респираторно-синтициальной, риновирусной, ротавирусной инфекции и др.
 )
) - фунгицид (в том числе против грибов рода Candida, вобудителей дерматомикозов, плесневых грибов A.niger)
- спороцид (в том числе против спор Bacillus subtilis, Bacillus сereus и Aspergillus niger)
- не формируются резистентные штаммы микрооорганизмов
Высокоэффективный стерилянт при экспозиции всего 15 минут
Растворы средства имеют моющее действие, умеренное коррозионное действие в отношении низкоуглеродистых сталей, в том числе с гальваническим покрытием, не повреждают нержавеющую сталь, медь и ее сплавы, алюминий и его сплавы, резину, пластмассы (полиэтилен, полипропилен, поливинилхлорид, органол и др.), стекло, фаянс, фарфор, керамику, древесину, лакокрасочные покрытия и т. д.; обладают отбеливающим действием на текстильные материалы без снижения их прочности, удаляют пятна. После высыхания растворы не оставляют на обработанных поверхностях пятен и потеков, легко смываются водой.
Назначение дезинфицирующего средства Солиокс
- стерилизация жестких и гибких эндоскопов и медицинских инструментов к ним, а также других изделий, которые подлежат стерилизации растворами стерилизующих средств;
- дезинфекция высокого уровня жестких и гибких эндоскопов и медицинских инструментов к ним, а также других изделий, подлежащих дезинфекции высокого уровня;
- обеззараживание ИМН, медицинской аппаратуры и оборудования, (в том числе аппаратов искусственной вентиляции легких, наркозно-дыхательной аппаратуры, кувезов, столовой и лабораторной посуды, поверхностей в помещениях и т.
 д.;
д.; - текущая, заключительная, профилактическая дезинфекция;
- профилактика появления и борьба с плесенью, в том числе в споровой форме.
Стерилизация (микробиология) — Википедия. Что такое Стерилизация (микробиология)
Стерилизация методом кипяченияСтерилиза́ция (иногда деконтаминация[1]) — освобождение какого-либо предмета или материала от всех видов микроорганизмов (включая бактерии и их споры, грибы, вирусы и прионы), либо их уничтожение. Осуществляется термическим, химическим, радиационным, фильтрационным методами.
Применение
Пищевые продукты
С давних времен частичная стерилизация пищи обеспечивалась за счет тщательной тепловой обработки во время приготовления. Нагревание пищи и воды позволяло снизить число случаев инфекционных заболеваний, увеличивая продолжительность жизни и трудоспособного возраста. Консервирование продуктов в герметичной упаковке стало логическим продолжением этого подхода к сохранению пищи.
Медицина
В медицине под стерилизацией понимается микробная деконтаминация неживых объектов. Принцип асептики предполагает исключение контакта пациента с поверхностями контаминированными условно-патогенной или даже патогенной микрофлорой. С этой целью стерилизовались скальпели, иглы и другой хирургический инструмент. Также стерилизация играет важную роль в производстве парентеральных препаратов.
Нагревание медицинских инструментов было известно ещё в Древнем Риме, но было забыто в Средние века, что привело к резкому росту числа осложнений и летальности после хирургических операций.
Методы стерилизации
- Термическая: паровая и воздушная (сухожаровая)
- Химическая: газовая или химическими растворами (стерилянтами)
- Плазменная (плазмой перекиси водорода)
- Радиационная стерилизация — применяется в промышленном варианте
- Метод мембранных фильтров — применяется для получения небольшого количества стерильных растворов, качество которых может резко ухудшиться при действии других методов стерилизации (бактериофаг, селективные питательные среды, антибиотики)[2]
Термические методы стерилизации
Преимущества термических методов стерилизации:
- Надёжность
- Отсутствие необходимости удаления стерилянтов с предметов медицинского назначения
- Удобство работы персонала
- Стерилизация проводится в упаковках, что позволяет сохранить стерильность некоторый период времени.

Паровая стерилизация
Осуществляется подачей насыщенного водяного пара под давлением в паровых стерилизаторах (автоклавах).
Паровая стерилизация под давлением считается наиболее эффективным методом, так как чем выше давление, тем выше температура пара, стерилизующего материал; бактерицидные свойства пара выше, чем воздуха, поэтому для стерилизации применяют пересыщенный пар.
Паровой стерилизации подвергают изделия из текстиля (бельё, вату, бинты, шовный материал), из резины, стекла, некоторых полимерных материалов, питательные среды, лекарственные препараты.
| Температура | Давление | Время | Описание |
|---|---|---|---|
| 132 °C | 2,1 атм | 3,5 мин | Основной режим. Стерилизуют все изделия (стекло, металл, текстиль, кроме резиновых) |
| 132 °C | 2,1 атм | 20 мин | режим «прионовой стерилизации» |
| 120 °C | 1,1 атм | 45 мин | щадящий режим (стекло, металл, резиновые изделия, полимерные изделия — согласно паспорту; текстиль) |
При паровой стерилизации используют следующие упаковочные материалы:
- Стерилизационная коробка (бикс) простая.
 Срок хранения 3 суток после стерилизации.
Срок хранения 3 суток после стерилизации. - Стерилизационная коробка (бикс) с фильтром. Срок хранения 20 суток после стерилизации.
- Крафт-пакеты со скрепками. Срок хранения — трое суток после стерилизации.
- Крафт-пакеты заклеивающиеся. Срок хранения — 50 суток после стерилизации.
- Ткань (бязь — КРОМЕ МАРЛИ). Срок хранения — трое суток после стерилизации.
- Комбинированные упаковки (прозрачная синтетическая плёнка + бумага). Срок хранения от 180 суток до 720 суток.
Тиндализация
Тиндализацию применяют для стерилизации растворов, неустойчивых к действию высокой температуры. Она состоит в неоднократном нагревании до температуры 70—100°С с промежутками в 24 ч.
Химические методы стерилизации
Используются при обработке приборов, аппаратов, сложных оптических систем, крупногабаритных изделий или изделий из титана, полимерных смол, резин.
Для газовой (холодной) стерилизации [3] используют окись этилена или герметичные контейнеры с парами окиси этилена, формальдегида или специализированными многокомпонентными системами.
Для химической стерилизации растворами применяются основных четыре группы веществ:
Концентрации и время стерилизации зависит от используемого антисептика или дезинфектанта.
Стерилизация ионизирующим излучением
- радиационный метод или лучевую стерилизацию γ-лучами применяют в специальных установках при промышленной стерилизации однократного применения — полимерных шприцев, систем переливания крови, чашек Петри, пипеток и других хрупких и термолабильных изделий.
- Ряд лет в фармтехнологии для стерилизации используется ультрафиолетовое (УФ) (длина волны 253,7 нм). Источники УФ-излучения — ртутные кварцевые лампы. Их мощное бактериостатическое действие основано на совпадении спектра испускания лампы и спектра поглощения ДНК микроорганизмов, что может являться причиной их гибели при длительной обработке излучением кварцевых ламп. При недостаточно мощном действии УФ в прокариотической клетке активизируются процессы световой и темновой репарации и клетка может восстановиться.
 Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.[4]
Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.[4]
См. также
Примечания
Стерилизация (микробиология) — Sterilization (microbiology)
Процесс, который устраняет или убивает все биологические агенты на объекте или в объеме
Стерилизация относится к любому процессу, который удаляет, убивает или дезактивирует все формы жизни (в частности, в отношении микроорганизмов, таких как грибы , бактерии , вирусы , споры , одноклеточные эукариотические организмы, такие как плазмодий и т. Д.) И других биологических агентов, таких как прионы, присутствующие в конкретная поверхность, объект или жидкость, например пищевая или биологическая питательная среда . Стерилизация может быть достигнута с помощью различных средств, включая нагревание , химикаты , облучение , высокое давление и фильтрацию . Стерилизация отличается от дезинфекции , санитарной обработки и пастеризации тем , что эти методы уменьшают, а не устраняют все существующие формы жизни и биологических агентов. После стерилизации объект считается стерильным или асептическим .
После стерилизации объект считается стерильным или асептическим .
Приложения
Еда
Один из первых шагов к модернизированной стерилизации был сделан Николасом Аппером, который обнаружил, что тщательное нагревание в течение подходящего периода замедляет разложение продуктов и различных жидкостей, сохраняя их для безопасного употребления в течение более длительного времени, чем обычно. Консервирование пищевых продуктов является продолжением того же принципа и помогает снизить количество пищевых заболеваний («пищевое отравление»). Другие методы стерилизации пищевых продуктов включают облучение пищевых продуктов и высокое давление ( паскализацию ). Одним из процессов стерилизации пищи является термическая обработка. Тепловая обработка прекращает активность бактерий и ферментов, что затем снижает вероятность получения продуктов низкого качества, сохраняя при этом срок службы нескоропортящихся продуктов. Одним из конкретных видов термической обработки является стерилизация при ультравысокой температуре. Этот тип термообработки ориентирован на стерилизацию более 100 градусов Цельсия. Два типа стерилизации UHT — стерилизация влажным и сухим жаром. При стерилизации влажным теплом используемые температуры варьируются от 110 до 130 градусов Цельсия. Стерилизация влажным теплом занимает от 20 до 40 минут, что обратно пропорционально температуре пищи. При стерилизации сухим теплом используется более длительное время восприимчивости, которое может длиться до 2 часов, и при этом используются гораздо более высокие температуры по сравнению со стерилизацией влажным теплом. Эти температуры могут колебаться от 160 до 180 градусов по Цельсию.
Этот тип термообработки ориентирован на стерилизацию более 100 градусов Цельсия. Два типа стерилизации UHT — стерилизация влажным и сухим жаром. При стерилизации влажным теплом используемые температуры варьируются от 110 до 130 градусов Цельсия. Стерилизация влажным теплом занимает от 20 до 40 минут, что обратно пропорционально температуре пищи. При стерилизации сухим теплом используется более длительное время восприимчивости, которое может длиться до 2 часов, и при этом используются гораздо более высокие температуры по сравнению со стерилизацией влажным теплом. Эти температуры могут колебаться от 160 до 180 градусов по Цельсию.
Медицина и хирургия
Аппарат для стерилизации хирургических инструментов, Verwaltungsgebäude der Schweiz. Kranken- und Hilfsanstalt, 1914-1918 гг.В общем, хирургические инструменты и лекарства, которые попадают в уже асептическую часть тела (например, в кровоток или проникают через кожу), должны быть стерильными. Примеры таких инструментов включают скальпели , иглы для подкожных инъекций и искусственные кардиостимуляторы . Это также важно при производстве парентеральных фармацевтических препаратов.
Это также важно при производстве парентеральных фармацевтических препаратов.
Приготовление инъекционных лекарств и растворов для внутривенного введения для заместительной жидкостной терапии требует не только стерильности, но и хорошо спроектированных контейнеров для предотвращения попадания посторонних агентов после первоначальной стерилизации продукта.
Большинство медицинских и хирургических устройств, используемых в медицинских учреждениях, изготовлены из материалов, которые можно стерилизовать паром . Однако с 1950 года увеличилось количество медицинских устройств и инструментов, изготовленных из материалов (например, пластмасс), требующих низкотемпературной стерилизации. Газообразный оксид этилена используется с 1950-х годов в медицинских устройствах, чувствительных к нагреванию и влаге. За последние 15 лет был разработан ряд новых низкотемпературных систем стерилизации (например, испарением перекиси водорода , иммерсией перуксусной кислоты , озоном ), которые используются для стерилизации медицинских устройств.
Паровая стерилизация является наиболее распространенной и надежной. Стерилизация паром нетоксична, недорога, обладает быстрым микробицидным и спороцидным действием, быстро нагревает и проникает в ткани.
Космический корабль
Существуют строгие международные правила защиты тел Солнечной системы от загрязнения биологическим материалом с Земли. Стандарты различаются в зависимости от типа миссии и ее назначения; чем более вероятно, что планета считается пригодной для жизни , тем строже требования.
Многие компоненты приборов, используемых на космических кораблях, не могут выдерживать очень высокие температуры, поэтому методы, не требующие чрезмерных температур, используются как допустимые, включая нагрев до по крайней мере 120 ° C (248 ° F), химическую стерилизацию, окисление, ультрафиолет и облучение.
Количественная оценка
Целью стерилизации является уменьшение количества изначально присутствующих микроорганизмов или других потенциальных патогенов. {\ left (- {\ frac {t} {D}} \ right)}}.
{\ left (- {\ frac {t} {D}} \ right)}}.
Значение D является функцией условий стерилизации и варьируется в зависимости от типа микроорганизма, температуры , активности воды , pH и т. Д. Для стерилизации паром (см. Ниже) обычно температура в градусах Цельсия указывается как индекс.
Теоретически вероятность выживания отдельного микроорганизма никогда не равна нулю. Чтобы компенсировать это, часто используется метод избыточного уничтожения. При использовании метода избыточного уничтожения стерилизация выполняется путем стерилизации дольше, чем требуется для уничтожения бионагрузки, присутствующей на стерилизуемом предмете или в нем. Это обеспечивает уровень гарантии стерильности (SAL), равный вероятности нестерильной единицы.
Для приложений с высоким риском, таких как медицинские устройства и инъекции, Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) требуется уровень гарантии стерильности не менее 10 −6 .
Высокая температура
Пар
Широко используемым методом тепловой стерилизации является автоклав , который иногда называют конвертерным или паровым стерилизатором. В автоклавах используется пар, нагретый до 121–134 ° C (250–273 ° F) под давлением . Для достижения стерильности изделие помещают в камеру и нагревают нагнетаемым паром до тех пор, пока изделие не достигнет заданной температуры и времени. Почти весь воздух удаляется из камеры, потому что воздух нежелателен в процессе стерилизации влажным теплом (это одна черта, которая отличается от типичной скороварки, используемой для приготовления пищи). Изделие выдерживают при заданном значении температуры в течение периода времени, который варьируется в зависимости от того, какая бионагрузка присутствует на стерилизуемом изделии и его устойчивости ( значение D ) к стерилизации паром. Общий цикл может составлять от 3 до 15 минут (в зависимости от выделяемого тепла) при 121 ° C (250 ° F) и давлении 100 кПа (15 фунтов на кв. Дюйм), что достаточно для обеспечения уровня гарантии стерильности 10 -4 для продукт с бионагрузкой 10 6 и значением D 2,0 минуты. После стерилизации жидкости в автоклаве под давлением необходимо медленно охладить, чтобы избежать выкипания при сбросе давления.
В автоклавах используется пар, нагретый до 121–134 ° C (250–273 ° F) под давлением . Для достижения стерильности изделие помещают в камеру и нагревают нагнетаемым паром до тех пор, пока изделие не достигнет заданной температуры и времени. Почти весь воздух удаляется из камеры, потому что воздух нежелателен в процессе стерилизации влажным теплом (это одна черта, которая отличается от типичной скороварки, используемой для приготовления пищи). Изделие выдерживают при заданном значении температуры в течение периода времени, который варьируется в зависимости от того, какая бионагрузка присутствует на стерилизуемом изделии и его устойчивости ( значение D ) к стерилизации паром. Общий цикл может составлять от 3 до 15 минут (в зависимости от выделяемого тепла) при 121 ° C (250 ° F) и давлении 100 кПа (15 фунтов на кв. Дюйм), что достаточно для обеспечения уровня гарантии стерильности 10 -4 для продукт с бионагрузкой 10 6 и значением D 2,0 минуты. После стерилизации жидкости в автоклаве под давлением необходимо медленно охладить, чтобы избежать выкипания при сбросе давления. Это может быть достигнуто путем постепенного сброса давления в стерилизационной камере и обеспечения возможности испарения жидкостей под отрицательным давлением при одновременном охлаждении содержимого.
Это может быть достигнуто путем постепенного сброса давления в стерилизационной камере и обеспечения возможности испарения жидкостей под отрицательным давлением при одновременном охлаждении содержимого.
Правильная обработка в автоклаве инактивирует все устойчивые бактериальные споры, а также грибы , бактерии и вирусы, но не ожидается, что устранят все прионы , которые различаются по своей устойчивости. В различных рекомендациях по устранению прионов указано 121–132 ° C (250–270 ° F) в течение 60 минут или 134 ° C (273 ° F) в течение как минимум 18 минут. 263K скрепи прион инактивируется относительно быстро с помощью таких процедур стерилизации; однако другие штаммы скрепи и штаммы болезни Крейтцфельда-Якоба (ХБП) и губчатой энцефалопатии крупного рогатого скота (ГЭКРС) более устойчивы. Один эксперимент с использованием мышей в качестве подопытных животных показал, что нагревание ткани головного мозга с положительной реакцией на BSE при 134–138 ° C (273–280 ° F) в течение 18 минут привело только к 2,5 log снижению инфекционности прионов.
В большинстве автоклавов есть измерители и диаграммы, которые записывают или отображают информацию, в частности температуру и давление, как функцию времени. Информация проверяется, чтобы убедиться, что условия, необходимые для стерилизации, были выполнены. Индикаторная лента часто размещается на упаковках продуктов перед автоклавированием, а некоторые упаковки включают индикаторы. Индикатор меняет цвет под воздействием пара, обеспечивая визуальное подтверждение.
Биоиндикаторы также могут использоваться для независимого подтверждения работы автоклава. Коммерчески доступны простые биоиндикаторы на основе спор микробов. Большинство из них содержат споры термостойкого микроба Geobacillus stearothermophilus (ранее Bacillus stearothermophilus ), который чрезвычайно устойчив к стерилизации паром. Биологические индикаторы могут иметь форму стеклянных пузырьков со спорами и жидкой средой или в виде спор на полосках бумаги внутри пергаминовых конвертов. Эти индикаторы размещаются в местах, куда пар трудно попасть, чтобы проверить, проникает ли туда пар.
Очистка в автоклаве имеет решающее значение. Посторонние биологические вещества или грязь могут защитить организмы от проникновения пара. Правильная очистка может быть достигнута с помощью физической очистки, обработки ультразвуком , ультразвука или пульсации воздуха.
Приготовление под давлением и консервирование аналогичны автоклавированию, и при правильном выполнении пища становится стерильной.
Влажное тепло вызывает разрушение микроорганизмов за счет денатурации макромолекул, в первую очередь белков. Этот метод является более быстрым процессом, чем стерилизация сухим жаром.
Сухое тепло
Стерилизатор сухого нагреваСухой жар был первым методом стерилизации и является более длительным процессом, чем стерилизация влажным теплом. Уничтожение микроорганизмов с помощью сухого тепла — явление постепенное. При более длительном воздействии смертельных температур количество убитых микроорганизмов увеличивается. Принудительная вентиляция горячим воздухом может использоваться для увеличения скорости передачи тепла организму и снижения температуры и количества времени, необходимого для достижения стерильности. При более высоких температурах требуется более короткое время воздействия для уничтожения организмов. Это может уменьшить повреждение пищевых продуктов тепловым воздействием.
При более высоких температурах требуется более короткое время воздействия для уничтожения организмов. Это может уменьшить повреждение пищевых продуктов тепловым воздействием.
Стандартная настройка духовки с горячим воздухом — не менее двух часов при 160 ° C (320 ° F). Быстрый метод нагревает воздух до 190 ° C (374 ° F) в течение 6 минут для неупакованных объектов и 12 минут для завернутых. Преимущество сухого тепла состоит в том, что его можно использовать для порошков и других термостойких предметов, на которые неблагоприятно влияет пар (например, он не вызывает ржавчины стальных предметов).
Пылающий
В микробиологических лабораториях пламенем подвергают инокуляционные петли и прямые провода на предмет образования штрихов . Если оставить петлю в пламени горелки Бунзена или спиртовой горелки, пока она не загорится красным, это гарантирует, что любой инфекционный агент будет инактивирован. Обычно это используется для небольших металлических или стеклянных предметов, но не для больших предметов (см.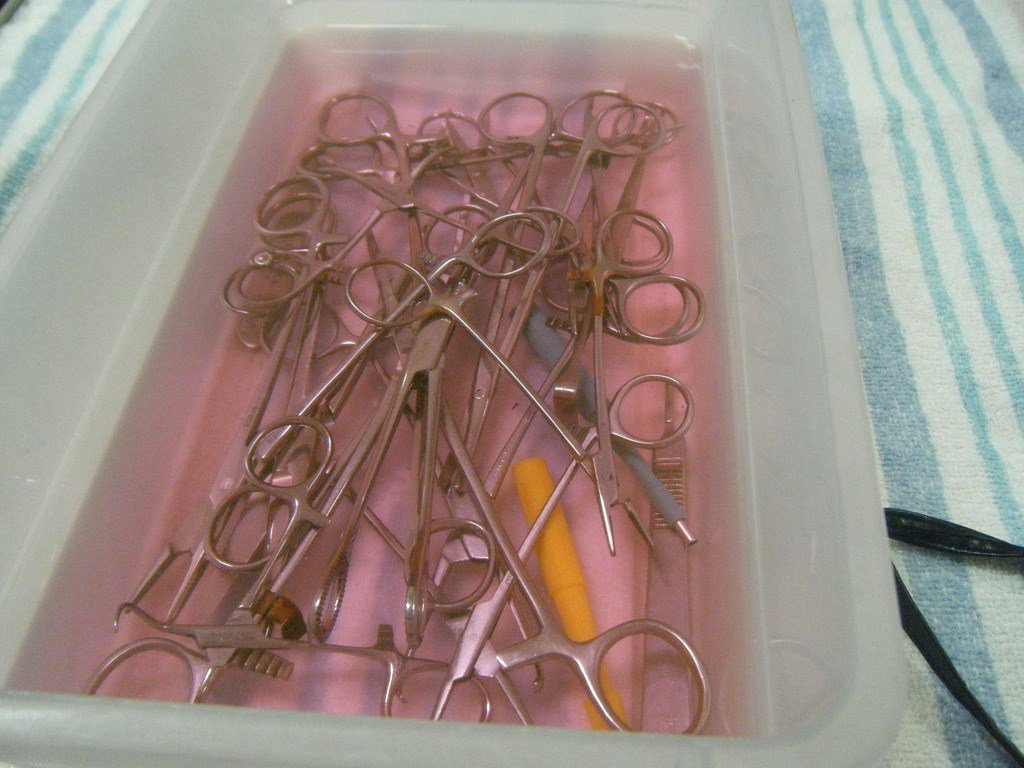 Сжигание ниже). Однако во время первоначального нагрева инфекционный материал может разбрызгиваться с поверхности проволоки до того, как он погибнет, загрязняя близлежащие поверхности и предметы. Поэтому были разработаны специальные нагреватели, которые окружают инокуляционный контур нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять зону. Другая проблема заключается в том, что газовое пламя может оставлять углерод или другие остатки на объекте, если объект недостаточно нагрет. Вариант поджигания — окунуть объект в 70% или более концентрированный раствор этанола , а затем ненадолго коснуться предмета пламени горелки Бунзена . Этанол воспламенится и быстро сгорит, оставляя меньше остатков, чем газовое пламя.
Сжигание ниже). Однако во время первоначального нагрева инфекционный материал может разбрызгиваться с поверхности проволоки до того, как он погибнет, загрязняя близлежащие поверхности и предметы. Поэтому были разработаны специальные нагреватели, которые окружают инокуляционный контур нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять зону. Другая проблема заключается в том, что газовое пламя может оставлять углерод или другие остатки на объекте, если объект недостаточно нагрет. Вариант поджигания — окунуть объект в 70% или более концентрированный раствор этанола , а затем ненадолго коснуться предмета пламени горелки Бунзена . Этанол воспламенится и быстро сгорит, оставляя меньше остатков, чем газовое пламя.
Сжигание
Сжигание — это процесс обработки отходов, который включает сжигание органических веществ, содержащихся в отходах. Этот метод также сжигает любой организм дотла. Он используется для стерилизации медицинских и других биологически опасных отходов перед их утилизацией вместе с неопасными отходами. Установки для сжигания бактерий — это мини-печи, которые сжигают и уничтожают любые микроорганизмы, которые могут находиться на петле или проводе посева.
Установки для сжигания бактерий — это мини-печи, которые сжигают и уничтожают любые микроорганизмы, которые могут находиться на петле или проводе посева.
Тиндаллизация
Названный в честь Джона Тиндалла , тиндаллизация — это устаревший и длительный процесс, предназначенный для снижения уровня активности спорообразующих бактерий, которые остаются после простого кипячения воды. Процесс включает кипячение в течение периода (обычно 20 минут) при атмосферном давлении, охлаждение, инкубацию в течение дня, а затем повторение процесса в общей сложности три-четыре раза. Инкубационные периоды должны дать возможность термостойким спорам, пережившим предыдущий период кипячения, прорасти, чтобы сформировать чувствительную к нагреванию вегетативную (растущую) стадию, которая может быть уничтожена на следующем этапе кипячения. Это эффективно, потому что тепловой шок стимулирует рост многих спор. Эта процедура работает только для сред, способных поддерживать рост бактерий, и не стерилизует непитательные субстраты, такие как вода. Тиндаллизация также неэффективна против прионов.
Тиндаллизация также неэффективна против прионов.
Стерилизаторы для стеклянных шариков
Стерилизаторы для стеклянных шариков работают за счет нагрева стеклянных шариков до 250 ° C (482 ° F). Затем инструменты быстро окунаются в эти стеклянные шарики, которые нагревают объект, физически соскребая загрязнения с их поверхности. Стерилизаторы со стеклянными шариками когда-то были обычным методом стерилизации, используемым в стоматологических кабинетах, а также в биологических лабораториях, но не одобрены Управлением по контролю за продуктами и лекарствами США (FDA) и Центрами по контролю и профилактике заболеваний (CDC) для использования в качестве стерилизаторов, поскольку 1997. Они по-прежнему популярны в европейских и израильских стоматологических клиниках, хотя в настоящее время нет основанных на доказательствах рекомендаций по использованию этого стерилизатора.
Химическая стерилизация
Химические вещества также используются для стерилизации. Нагревание обеспечивает надежный способ избавления объектов от всех передающихся агентов, но он не всегда подходит, если он может повредить термочувствительные материалы, такие как биологические материалы, волоконную оптику , электронику и многие пластмассы . В этих случаях химические вещества в газообразной или жидкой форме могут использоваться в качестве стерилизующих средств. Хотя использование газовых и жидких химических стерилизаторов позволяет избежать проблемы теплового повреждения, пользователи должны убедиться, что стерилизуемое изделие химически совместимо с используемым стерилизующим средством и что стерилизующее средство может достигать всех поверхностей, которые необходимо стерилизовать (обычно не могут проникнуть в упаковку). Кроме того, использование химических стерилизаторов создает новые проблемы для безопасности на рабочем месте , поскольку свойства, которые делают химические стерилизаторы эффективными, обычно делают их вредными для человека. Процедура удаления остатков стерилизующего средства из стерилизованных материалов зависит от используемого химического вещества и процесса.
В этих случаях химические вещества в газообразной или жидкой форме могут использоваться в качестве стерилизующих средств. Хотя использование газовых и жидких химических стерилизаторов позволяет избежать проблемы теплового повреждения, пользователи должны убедиться, что стерилизуемое изделие химически совместимо с используемым стерилизующим средством и что стерилизующее средство может достигать всех поверхностей, которые необходимо стерилизовать (обычно не могут проникнуть в упаковку). Кроме того, использование химических стерилизаторов создает новые проблемы для безопасности на рабочем месте , поскольку свойства, которые делают химические стерилизаторы эффективными, обычно делают их вредными для человека. Процедура удаления остатков стерилизующего средства из стерилизованных материалов зависит от используемого химического вещества и процесса.
Окись этилена
Обработка газа оксидом этилена (EO, EtO) — один из распространенных методов, используемых для стерилизации, пастеризации или дезинфекции предметов, из-за широкого диапазона совместимости материалов. Он также используется для обработки предметов, чувствительных к обработке другими методами, такими как излучение (гамма, электронный луч, рентгеновское излучение), тепло (влажное или сухое) или другие химические вещества. Обработка оксидом этилена — наиболее распространенный метод химической стерилизации, используемый примерно для 70% всех стерилизаций и более 50% всех одноразовых медицинских устройств.
Он также используется для обработки предметов, чувствительных к обработке другими методами, такими как излучение (гамма, электронный луч, рентгеновское излучение), тепло (влажное или сухое) или другие химические вещества. Обработка оксидом этилена — наиболее распространенный метод химической стерилизации, используемый примерно для 70% всех стерилизаций и более 50% всех одноразовых медицинских устройств.
Обработку оксидом этилена обычно проводят при температуре от 30 до 60 ° C (от 86 до 140 ° F), относительной влажности выше 30% и концентрации газа от 200 до 800 мг / л. Обычно процесс длится несколько часов. Оксид этилена очень эффективен, поскольку он проникает во все пористые материалы , а также может проникать через некоторые пластмассы и пленки. Оксид этилена убивает все известные микроорганизмы, такие как бактерии (включая споры), вирусы и грибки (включая дрожжи и плесень), и совместим почти со всеми материалами даже при многократном применении. Он легковоспламеняющийся, токсичный и канцерогенный ; однако, только с заявленным потенциалом некоторых неблагоприятных воздействий на здоровье, если не используется в соответствии с опубликованными требованиями. Стерилизаторы и процессы на основе оксида этилена требуют биологической валидации после установки стерилизатора, значительного ремонта или изменения процесса.
Стерилизаторы и процессы на основе оксида этилена требуют биологической валидации после установки стерилизатора, значительного ремонта или изменения процесса.
Традиционный процесс состоит из фазы предварительного кондиционирования (в отдельной комнате или камере), фазы обработки (чаще в вакуумной емкости, а иногда и в емкости с номинальным давлением) и фазы аэрации (в отдельной комнате или камере) для удаления Остатки ЭО и низшие побочные продукты, такие как этиленхлоргидрин (ЕС или ЭХГ) и, что менее важно, этиленгликоль (ЭГ). Для некоторых продуктов также существует альтернативный процесс, известный как комплексная обработка, при котором все три фазы выполняются в сосуде с вакуумным или номинальным давлением. Этот последний вариант может способствовать сокращению общего времени обработки и рассеиванию остатков.
Наиболее распространенным методом обработки ЭО является метод газовой камеры. Чтобы получить выгоду от экономии на масштабе , ЭО традиционно подавали путем заполнения большой камеры комбинацией газообразного ЭО либо в виде чистого ЭО, либо другими газами, используемыми в качестве разбавителей; разбавители включают хлорфторуглероды ( CFC ), гидрохлорфторуглероды (HCFC) и диоксид углерода .
Окись этилена по-прежнему широко используется производителями медицинского оборудования. Поскольку ЭО взрывоопасен при концентрациях выше 3%, ЭО традиционно поставлялся с инертным газом-носителем, таким как CFC или HCFC. Использование CFC или HCFC в качестве газа-носителя было запрещено из-за опасений истощения озонового слоя . Эти галогенированные углеводороды заменяются системами, в которых используется 100% ЭО, из-за нормативных требований и высокой стоимости смесей. В больницах в большинстве стерилизаторов ЭО используются одноразовые картриджи из-за удобства и простоты использования по сравнению с бывшими газовыми баллонами со смесями ЭО.
Важно придерживаться установленных правительством пределов ЭО для пациентов и медицинского персонала в отношении остатков ЭО в и / или на обработанных продуктах, воздействия на оператора после обработки, во время хранения и обращения с газовыми баллонами ЭО, а также выбросов в окружающую среду, возникающих при использовании ЭО.
Управление по безопасности и гигиене труда США (OSHA) установило допустимый предел воздействия (PEL) на уровне 1 ppm, рассчитанном как восьмичасовое средневзвешенное значение (TWA), и 5 ppm как 15-минутный предел экскурсии (EL). . Национальный институт по охране труда и здоровья «s (NIOSH) немедленно опасно для жизни и здоровья предела (IDLH) для ЕО 800 частей на миллион. Порог запаха составляет около 500 частей на миллион, так что ЭО незаметен до тех пор , пока концентрации значительно превышают OSHA PEL. Поэтому OSHA рекомендует использовать системы непрерывного контроля газов для защиты рабочих, использующих ЭО для обработки.
. Национальный институт по охране труда и здоровья «s (NIOSH) немедленно опасно для жизни и здоровья предела (IDLH) для ЕО 800 частей на миллион. Порог запаха составляет около 500 частей на миллион, так что ЭО незаметен до тех пор , пока концентрации значительно превышают OSHA PEL. Поэтому OSHA рекомендует использовать системы непрерывного контроля газов для защиты рабочих, использующих ЭО для обработки.
Диоксид азота
Газообразный диоксид азота (NO 2 ) является быстрым и эффективным стерилизующим средством для использования против широкого спектра микроорганизмов, включая обычные бактерии, вирусы и споры. Уникальные физические свойства газообразного NO 2 позволяют стерилизовать диспергирование в замкнутой среде при комнатной температуре и атмосферном давлении. Механизм летальности — это разрушение ДНК в ядре спор путем нитрования фосфатного остова, которое убивает подвергшийся воздействию организм, поскольку он поглощает NO 2 . Это разложение происходит даже при очень низких концентрациях газа. NO 2 имеет температуру кипения 21 ° C (70 ° F) на уровне моря, что приводит к относительно высокому давлению насыщенного пара при температуре окружающей среды. По этой причине жидкий NO 2 может использоваться в качестве удобного источника стерилизующего газа. Жидкий NO 2 часто называют его димером , тетроксидом диазота (N 2 O 4 ). Кроме того, требуемые низкие уровни концентрации в сочетании с высоким давлением пара гарантируют отсутствие конденсации на стерилизуемых устройствах. Это означает, что сразу после цикла стерилизации аэрация устройств не требуется. NO 2 также менее агрессивен, чем другие стерилизующие газы, и совместим с большинством медицинских материалов и адгезивов.
NO 2 имеет температуру кипения 21 ° C (70 ° F) на уровне моря, что приводит к относительно высокому давлению насыщенного пара при температуре окружающей среды. По этой причине жидкий NO 2 может использоваться в качестве удобного источника стерилизующего газа. Жидкий NO 2 часто называют его димером , тетроксидом диазота (N 2 O 4 ). Кроме того, требуемые низкие уровни концентрации в сочетании с высоким давлением пара гарантируют отсутствие конденсации на стерилизуемых устройствах. Это означает, что сразу после цикла стерилизации аэрация устройств не требуется. NO 2 также менее агрессивен, чем другие стерилизующие газы, и совместим с большинством медицинских материалов и адгезивов.
Наиболее устойчивым организмом (MRO) к стерилизации газом NO 2 является спора Geobacillus stearothermophilus , которая является одной и той же MRO для процессов стерилизации паром и перекисью водорода. Споровая форма G. stearothermophilus на протяжении многих лет хорошо характеризовалась как биологический индикатор при стерилизации. Микробная инактивация G. stearothermophilus газообразным NO 2 происходит быстро в лог-линейном режиме, что типично для других процессов стерилизации. Компания Noxilizer, Inc. коммерциализировала эту технологию, чтобы предложить услуги по стерилизации медицинских изделий по контракту на своем предприятии в Балтиморе, штат Мэриленд (США). Это было продемонстрировано в лаборатории Noxilizer в многочисленных исследованиях и подтверждается опубликованными отчетами других лабораторий. Эти же свойства также позволяют быстрее удалять стерилизующие и остаточные газы за счет аэрации замкнутой среды. Сочетание быстрой летальности и легкого удаления газа позволяет сократить общее время цикла во время процесса стерилизации (или обеззараживания) и снизить уровень остатков стерилизующего средства по сравнению с другими методами стерилизации.
stearothermophilus на протяжении многих лет хорошо характеризовалась как биологический индикатор при стерилизации. Микробная инактивация G. stearothermophilus газообразным NO 2 происходит быстро в лог-линейном режиме, что типично для других процессов стерилизации. Компания Noxilizer, Inc. коммерциализировала эту технологию, чтобы предложить услуги по стерилизации медицинских изделий по контракту на своем предприятии в Балтиморе, штат Мэриленд (США). Это было продемонстрировано в лаборатории Noxilizer в многочисленных исследованиях и подтверждается опубликованными отчетами других лабораторий. Эти же свойства также позволяют быстрее удалять стерилизующие и остаточные газы за счет аэрации замкнутой среды. Сочетание быстрой летальности и легкого удаления газа позволяет сократить общее время цикла во время процесса стерилизации (или обеззараживания) и снизить уровень остатков стерилизующего средства по сравнению с другими методами стерилизации.
Озон
Озон используется в промышленных условиях для стерилизации воды и воздуха, а также в качестве дезинфицирующего средства для поверхностей. Он способен окислять большую часть органических веществ. С другой стороны, это токсичный и нестабильный газ, который необходимо производить на месте, поэтому его нецелесообразно использовать во многих условиях.
Он способен окислять большую часть органических веществ. С другой стороны, это токсичный и нестабильный газ, который необходимо производить на месте, поэтому его нецелесообразно использовать во многих условиях.
Озон как стерилизующий газ имеет множество преимуществ; озон является очень эффективным стерилизующим средством из-за его сильных окислительных свойств ( E = 2,076 по сравнению с SHE ), способного уничтожать широкий спектр патогенов, включая прионы, без необходимости обращения с опасными химическими веществами, поскольку озон генерируется внутри стерилизатора из медицинских материалов. кислород . Высокая реакционная способность озона означает, что отработанный озон можно разрушить, пропустив простой катализатор, который превращает его в кислород и обеспечивает относительно короткое время цикла. Недостатком использования озона является то, что газ очень реактивен и очень опасен. Предел немедленной опасности для жизни и здоровья (IDLH) NIOSH для озона составляет 5 ppm, что в 160 раз меньше, чем IDLH 800 ppm для окиси этилена. NIOSH и OSHA установили PEL для озона на уровне 0,1 ppm , рассчитанном как восьмичасовое средневзвешенное значение. Производители стерилизующего газа включают в свою продукцию множество средств обеспечения безопасности, но разумная практика заключается в обеспечении непрерывного мониторинга воздействия озона, чтобы обеспечить быстрое предупреждение в случае утечки. В продаже имеются мониторы для определения воздействия озона на рабочем месте.
NIOSH и OSHA установили PEL для озона на уровне 0,1 ppm , рассчитанном как восьмичасовое средневзвешенное значение. Производители стерилизующего газа включают в свою продукцию множество средств обеспечения безопасности, но разумная практика заключается в обеспечении непрерывного мониторинга воздействия озона, чтобы обеспечить быстрое предупреждение в случае утечки. В продаже имеются мониторы для определения воздействия озона на рабочем месте.
Глутаральдегид и формальдегид
Растворы глутаральдегида и формальдегида (также используемые в качестве фиксаторов ) являются приемлемыми жидкими стерилизующими агентами при условии, что время погружения достаточно длительное. Для уничтожения всех спор в прозрачной жидкости может потребоваться до 22 часов с глутаровым альдегидом и даже больше с формальдегидом. Наличие твердых частиц может продлить необходимый период или сделать лечение неэффективным. Стерилизация блоков ткани может занять намного больше времени из-за времени, необходимого для проникновения фиксатора. Глутаральдегид и формальдегид летучие и токсичные при контакте с кожей и при вдыхании. Глутаральдегид имеет короткий срок хранения (<2 недель) и стоит дорого. Формальдегид дешевле и имеет гораздо более длительный срок хранения, если добавить немного метанола для ингибирования полимеризации до параформальдегида , но он гораздо более летуч. Формальдегид также используется как газообразный стерилизующий агент; в этом случае его получают на месте путем деполимеризации твердого параформальдегида. Многие вакцины, такие как оригинальная вакцина от полиомиелита Солка , стерилизованы формальдегидом.
Глутаральдегид и формальдегид летучие и токсичные при контакте с кожей и при вдыхании. Глутаральдегид имеет короткий срок хранения (<2 недель) и стоит дорого. Формальдегид дешевле и имеет гораздо более длительный срок хранения, если добавить немного метанола для ингибирования полимеризации до параформальдегида , но он гораздо более летуч. Формальдегид также используется как газообразный стерилизующий агент; в этом случае его получают на месте путем деполимеризации твердого параформальдегида. Многие вакцины, такие как оригинальная вакцина от полиомиелита Солка , стерилизованы формальдегидом.
Пероксид водорода
Перекись водорода , как в жидкости, так и в виде перекиси водорода в парообразном состоянии (VHP), является еще одним химическим стерилизующим агентом. Перекись водорода — сильный окислитель , который позволяет уничтожать широкий спектр болезнетворных микроорганизмов. Перекись водорода используется для стерилизации изделий, чувствительных к нагреванию или температуре, таких как жесткие эндоскопы . При медицинской стерилизации перекись водорода используется в более высоких концентрациях, от 35 до 90%. Самым большим преимуществом перекиси водорода в качестве стерилизатора является короткое время цикла. В то время как время цикла для этиленоксида может составлять от 10 до 15 часов, некоторые современные стерилизаторы с перекисью водорода имеют время цикла всего 28 минут.
При медицинской стерилизации перекись водорода используется в более высоких концентрациях, от 35 до 90%. Самым большим преимуществом перекиси водорода в качестве стерилизатора является короткое время цикла. В то время как время цикла для этиленоксида может составлять от 10 до 15 часов, некоторые современные стерилизаторы с перекисью водорода имеют время цикла всего 28 минут.
Недостатки перекиси водорода включают совместимость материалов, меньшую проницаемость и риски для здоровья оператора. Продукты, содержащие целлюлозу, например бумагу, нельзя стерилизовать с помощью VHP, а продукты, содержащие нейлон, могут стать хрупкими. Проникающая способность перекиси водорода не так хороша, как у окиси этилена, поэтому существуют ограничения на длину и диаметр просвета объектов, которые можно эффективно стерилизовать. Пероксид водорода является основным раздражителем, и контакт жидкого раствора с кожей вызовет обесцвечивание или изъязвление в зависимости от концентрации и времени контакта. Он относительно нетоксичен при разбавлении до низких концентраций, но является опасным окислителем при высоких концентрациях (> 10% мас. / Мас.). Пар также опасен, в первую очередь поражая глаза и дыхательную систему. Даже кратковременное воздействие может быть опасным, и NIOSH установил IDLH на уровне 75 ppm, что составляет менее одной десятой IDLH для оксида этилена (800 ppm). Продолжительное воздействие более низких концентраций может вызвать необратимое повреждение легких, и, следовательно, OSHA установило допустимый предел воздействия на уровне 1,0 ppm, рассчитанный как восьмичасовое средневзвешенное значение. Производители стерилизаторов делают все возможное, чтобы сделать свою продукцию безопасной за счет тщательного проектирования и включения многих функций безопасности, хотя все еще существуют случаи воздействия перекиси водорода на рабочем месте из газовых стерилизаторов, задокументированные в базе данных FDA MAUDE. При использовании газового стерилизатора любого типа разумные методы работы должны включать в себя хорошую вентиляцию, постоянный газоанализатор для перекиси водорода, а также надлежащие методы работы и обучение.
Он относительно нетоксичен при разбавлении до низких концентраций, но является опасным окислителем при высоких концентрациях (> 10% мас. / Мас.). Пар также опасен, в первую очередь поражая глаза и дыхательную систему. Даже кратковременное воздействие может быть опасным, и NIOSH установил IDLH на уровне 75 ppm, что составляет менее одной десятой IDLH для оксида этилена (800 ppm). Продолжительное воздействие более низких концентраций может вызвать необратимое повреждение легких, и, следовательно, OSHA установило допустимый предел воздействия на уровне 1,0 ppm, рассчитанный как восьмичасовое средневзвешенное значение. Производители стерилизаторов делают все возможное, чтобы сделать свою продукцию безопасной за счет тщательного проектирования и включения многих функций безопасности, хотя все еще существуют случаи воздействия перекиси водорода на рабочем месте из газовых стерилизаторов, задокументированные в базе данных FDA MAUDE. При использовании газового стерилизатора любого типа разумные методы работы должны включать в себя хорошую вентиляцию, постоянный газоанализатор для перекиси водорода, а также надлежащие методы работы и обучение.
Испаренная перекись водорода (VHP) используется для стерилизации больших закрытых и герметичных помещений, например целых комнат и салонов самолетов.
Несмотря на свою токсичность, VHP за короткое время распадается на воду и кислород.
Надуксусная кислота
Перуксусная кислота (0,2%) является признанным FDA стерилизующим средством для использования при стерилизации медицинских устройств, таких как эндоскопы .
Возможность химической стерилизации прионов
Прионы обладают высокой устойчивостью к химической стерилизации. Фактически было показано, что обработка альдегидами , такими как формальдегид, увеличивает устойчивость к прионам. Было показано, что перекись водорода (3%) в течение одного часа неэффективна, обеспечивая снижение загрязнения менее чем на 3 log (10 -3 ). Йод , формальдегид, глутаральдегид и перуксусная кислота также не прошли этот тест (лечение в течение одного часа). Только хлор , фенольные соединения , тиоцианат гуанидиния и гидроксид натрия снижают уровни прионов более чем на 4 log; хлор (слишком едкий для использования на определенных объектах) и гидроксид натрия являются наиболее стойкими. Многие исследования показали эффективность гидроксида натрия.
Многие исследования показали эффективность гидроксида натрия.
Радиационная стерилизация
Стерилизация может быть достигнута с помощью электромагнитного излучения , такого как ультрафиолетовый свет , рентгеновские лучи и гамма-лучи , или облучения субатомными частицами, такими как электронные лучи . Электромагнитное излучение или излучение твердых частиц может быть достаточно мощным для ионизации атомов или молекул ( ионизирующее излучение ) или менее энергичным ( неионизирующее излучение ).
Стерилизация неионизирующим излучением
Облучение ультрафиолетовым светом (УФ, от бактерицидной лампы ) полезно для стерилизации поверхностей и некоторых прозрачных предметов. Многие объекты, прозрачные для видимого света, поглощают УФ. Ультрафиолетовое облучение обычно используется для стерилизации внутренней части боксов биологической безопасности между применениями, но оно неэффективно в затененных областях, включая участки под грязью (которая может полимеризоваться после длительного облучения, так что ее очень трудно удалить). Он также повреждает некоторые пластмассы, такие как пенополистирол, если подвергаться длительному воздействию.
Он также повреждает некоторые пластмассы, такие как пенополистирол, если подвергаться длительному воздействию.
Стерилизация ионизирующим излучением
Иллюстрация эффективности различных радиационных технологий (электронный луч, рентгеновские лучи, гамма-лучи)Безопасность облучательных установок регулируется Международным агентством по атомной энергии Организации Объединенных Наций и контролируется различными национальными комиссиями по ядерному регулированию (NRC). Аварии с радиационным облучением, которые произошли в прошлом, документируются агентством и тщательно анализируются для определения причины и потенциала улучшения. Затем такие улучшения необходимы для модернизации существующих объектов и будущей конструкции.
Гамма-излучение очень проникающее и обычно используется для стерилизации одноразового медицинского оборудования, такого как шприцы, иглы, канюли и наборы для внутривенных вливаний, а также продуктов питания. Он испускается радиоизотопом , обычно кобальтом-60 ( 60 Co) или цезием-137 ( 137 Cs), которые имеют энергию фотонов до 1,3 и 0,66 МэВ соответственно.
Использование радиоизотопа требует экранирования для безопасности операторов при использовании и хранении. В большинстве конструкций радиоизотоп опускается в резервуар для хранения источника, заполненный водой, который поглощает излучение и позволяет обслуживающему персоналу входить в радиационную защиту. В одном варианте радиоизотоп постоянно находится под водой, а продукт, подлежащий облучению, опускается в воду в герметично закрытых колпаках; для таких конструкций дополнительное экранирование не требуется. В других редко используемых конструкциях используется сухое хранилище, обеспечивающее подвижные экраны, снижающие уровни излучения в областях камеры облучения. Инцидент в Декейтере, штат Джорджия , США, где водорастворимый цезий-137 просочился в бассейн для хранения источника, что потребовало вмешательства NRC, привело к тому, что использование этого радиоизотопа было почти полностью прекращено в пользу более дорогостоящего нерастворимого в воде кобальта. -60. Гамма- фотоны кобальта-60 имеют примерно вдвое большую энергию и, следовательно, большую дальность проникновения, чем излучение, производимое цезием-137.
Электронно-лучевая обработка также обычно используется для стерилизации. Электронные лучи используют технологию включения-выключения и обеспечивают гораздо более высокую скорость дозирования, чем гамма- или рентгеновские лучи. Из-за более высокой мощности дозы требуется меньшее время воздействия и, таким образом, снижается любое возможное разложение до полимеров. Поскольку электроны несут заряд, электронные лучи менее проникают, чем гамма- и рентгеновские лучи. Для защиты рабочих и окружающей среды от радиационного воздействия на предприятиях используются прочные бетонные экраны.
Рентгеновские лучи высокой энергии (производимые тормозным излучением ) позволяют облучать большие упаковки и поддоны с медицинскими приборами. Они обладают достаточной проникающей способностью, чтобы обрабатывать несколько поддонов с упаковками низкой плотности с очень хорошими коэффициентами однородности дозы. Для стерилизации рентгеновскими лучами не требуются химические или радиоактивные материалы: рентгеновские лучи высокой энергии генерируются с высокой интенсивностью с помощью генератора рентгеновских лучей , который не требует защиты, когда он не используется. Рентгеновские лучи генерируются путем бомбардировки плотного материала (мишени), такого как тантал или вольфрам, высокоэнергетическими электронами в процессе, известном как преобразование тормозного излучения. Эти системы энергоэффективны и требуют гораздо больше электроэнергии, чем другие системы для того же результата.
Рентгеновские лучи генерируются путем бомбардировки плотного материала (мишени), такого как тантал или вольфрам, высокоэнергетическими электронами в процессе, известном как преобразование тормозного излучения. Эти системы энергоэффективны и требуют гораздо больше электроэнергии, чем другие системы для того же результата.
Облучение рентгеновскими лучами, гамма-лучами или электронами не делает материалы радиоактивными , потому что используемая энергия слишком мала. Обычно для индукции радиоактивности в материале требуется энергия не менее 10 МэВ . Нейтроны и частицы очень высоких энергий могут сделать материалы радиоактивными, но имеют хорошее проникновение, тогда как частицы с более низкой энергией (кроме нейтронов) не могут сделать материалы радиоактивными, но имеют худшее проникновение.
Однако стерилизация облучением гамма-лучами может повлиять на свойства материала.
Облучение используется Почтовой службой США для стерилизации почты в Вашингтоне, округ Колумбия . Некоторые продукты (например, специи и мясной фарш) стерилизуют облучением .
Некоторые продукты (например, специи и мясной фарш) стерилизуют облучением .
Субатомные частицы могут быть более или менее проникающими и могут генерироваться радиоизотопом или устройством, в зависимости от типа частицы.
Стерильная фильтрация
Жидкости, которые могут быть повреждены теплом, облучением или химической стерилизацией, например, лекарственный раствор , можно стерилизовать микрофильтрацией с использованием мембранных фильтров . Этот метод обычно используется для термолабильных фармацевтических препаратов и белковых растворов при производстве лекарственных препаратов. Микрофильтр с размером пор обычно 0,22 мкм эффективно удаляет микроорганизмы . Однако было показано, что некоторые виды стафилококков обладают достаточной гибкостью, чтобы проходить через фильтры 0,22 мкм. При обработке биопрепаратов , вирусы должны быть удалены или инактивированы, что требует использования нанофильтров с меньшим размером пор (20-50 нм ). Поры меньшего размера снижают скорость потока, поэтому для достижения более высокой общей пропускной способности или во избежание преждевременного засорения можно использовать предварительные фильтры для защиты мембранных фильтров с небольшими порами. Системы тангенциальной фильтрации (TFF) и попеременного тангенциального потока (ATF) также уменьшают накопление твердых частиц и их засорение.
Системы тангенциальной фильтрации (TFF) и попеременного тангенциального потока (ATF) также уменьшают накопление твердых частиц и их засорение.
Мембранные фильтры, используемые в производственных процессах, обычно изготавливаются из таких материалов, как смешанный эфир целлюлозы или полиэфирсульфон (PES). Оборудование для фильтрации и сами фильтры могут быть приобретены в виде предварительно стерилизованных одноразовых единиц
Стерилизация оксидом этилена для медицинских устройств
Обновление пилотной программы мастер-файлов стерилизации оксидом этилена
20 марта 2020 г., в рамках наших постоянных усилий по ускорению утверждения определенных изменений в процессах и средствах стерилизации оксидом этилена, FDA объявило о своем первом принятии мастер-файла в пилотную программу FDA по стерилизации с помощью оксида этилена. Узнайте больше о пилотной программе стерилизации мастер-файлов оксидом этилена.
Узнайте больше о пилотной программе стерилизации мастер-файлов оксидом этилена.
Это признание происходит в особенно критический момент для FDA, чтобы продолжить нашу важную работу по сокращению нехватки устройств, стерилизованных оксидом этилена.
FDA считает, что пилотная программа стерилизации эталонного файла оксидом этилена должна привести к тому, что в стерилизационных помещениях будет использоваться значительно меньшее количество оксида этилена, но при этом обеспечивается надежная защита пациентов.
FDA продолжит свои усилия по снижению чрезмерной зависимости от этиленоксида при стерилизации медицинских изделий и предоставит обновленную информацию о будущих приемах мастер-файлов.
На этой странице:
Связанные страницы:
Почему оксид этилена используется для стерилизации медицинских изделий?
Медицинские изделия стерилизуют различными способами, включая использование влажного тепла (пара), сухого тепла, излучения, газообразного этиленоксида, испаренного пероксида водорода и других методов стерилизации (например, газообразным диоксидом хлора, испаренной надуксусной кислотой и диоксидом азота. ). Стерилизация оксидом этилена — важный метод стерилизации, который производители широко используют для обеспечения безопасности медицинских устройств.Дополнительные сведения о методах стерилизации см. В разделе «Подача и проверка информации о стерильности в предпродажном уведомлении» (510 (k)) для устройств, помеченных как руководство по стерилизации (PDF — 386 КБ).
). Стерилизация оксидом этилена — важный метод стерилизации, который производители широко используют для обеспечения безопасности медицинских устройств.Дополнительные сведения о методах стерилизации см. В разделе «Подача и проверка информации о стерильности в предпродажном уведомлении» (510 (k)) для устройств, помеченных как руководство по стерилизации (PDF — 386 КБ).
Для многих медицинских устройств стерилизация оксидом этилена может быть единственным методом, который эффективно стерилизует и не повреждает устройство во время процесса стерилизации. Медицинские устройства, изготовленные из определенных полимеров (пластмассы или смолы), металлов или стекла, или имеющие несколько слоев упаковки или труднодоступные места (например, катетеры), вероятно, будут стерилизованы оксидом этилена.
Какие устройства стерилизуются оксидом этилена?
Литература показывает, что около пятидесяти процентов 1,2,3 всех стерильных медицинских устройств в США стерилизованы оксидом этилена. Типы устройств, которые стерилизуются оксидом этилена, варьируются от устройств, используемых в общей медицинской практике (например, перевязки ран), до более специализированных устройств, используемых для лечения определенных участков тела (например, стентов).
Типы устройств, которые стерилизуются оксидом этилена, варьируются от устройств, используемых в общей медицинской практике (например, перевязки ран), до более специализированных устройств, используемых для лечения определенных участков тела (например, стентов).
Как FDA помогает гарантировать безопасность медицинских изделий, стерилизованных оксидом этилена?
Перед тем, как большинство стерильных медицинских изделий появятся на рынке, FDA рассматривает предмаркетинговые заявки, чтобы определить, есть ли информация о стерильности (например, метод, который производитель выбирает для стерилизации своего изделия, и действия по валидации, используемые для демонстрации того, что изделие может быть эффективно стерилизовано) соответствует международно согласованным добровольным консенсусным стандартам, признанным FDA.Важным элементом нашей нормативной базы является надежная программа стандартов. FDA поощряет спонсоров медицинских устройств использовать признанные FDA добровольные консенсусные стандарты в своих представлениях, поскольку соответствие соответствующим стандартам упрощает нормативный контроль и способствует повышению качества. Узнайте больше о программе признанных стандартов FDA.
Узнайте больше о программе признанных стандартов FDA.
Для стерилизации оксидом этилена два добровольных согласованных стандарта (ANSI AAMI ISO 11135: 2014 и ANSI AAMI ISO 10993-7: 2008 (R) 2012) описывают, как разрабатывать, проверять и контролировать процессы стерилизации оксидом этилена для медицинских изделий, а также приемлемые уровни остаточного этиленоксида и этиленхлоргидрина, оставшегося на устройстве после того, как оно прошло стерилизацию этиленоксидом.Эти стандарты помогают гарантировать, что уровни оксида этилена на медицинских устройствах находятся в безопасных пределах, поскольку длительное и профессиональное воздействие оксида этилена связано с раком. Узнайте больше о рисках, связанных с оксидом этилена, на веб-странице Национального института здравоохранения, посвященной оксиду этилена.
Если производитель медицинского изделия изменяет метод, процесс или средство, указанные в его первоначальном представлении PMA для стерилизации своих изделий, производитель обычно должен подать приложение PMA, чтобы агентство могло рассмотреть эти изменения и определить, соответствуют ли они также на международном уровне. согласованные добровольные стандарты, признанные FDA.Для производителей, которые являются держателями 510 (k), метод стерилизации, модификации процесса или места могут быть оценены с помощью руководящего документа FDA: «Решение, когда подавать 510 (k) на изменение существующего устройства» для определения того, была ли стерилизация изменения вызовут необходимость повторной подачи.
согласованные добровольные стандарты, признанные FDA.Для производителей, которые являются держателями 510 (k), метод стерилизации, модификации процесса или места могут быть оценены с помощью руководящего документа FDA: «Решение, когда подавать 510 (k) на изменение существующего устройства» для определения того, была ли стерилизация изменения вызовут необходимость повторной подачи.
FDA также проверяет промышленные предприятия, которые стерилизуют медицинские изделия, и предприятия по производству медицинских изделий, чтобы убедиться, что они прошли валидацию процессов стерилизации, соответствующих признанным стандартам FDA.
Государственные департаменты здравоохранения проверяют медицинские учреждения, которые используют оксид этилена для стерилизации медицинских изделий. Узнайте больше о правилах стерилизации в медицинских учреждениях на веб-странице Центров по контролю и профилактике заболеваний.
Роль EPA в стерилизации оксидом этилена
Агентство по охране окружающей среды США (EPA) проверяет и обеспечивает выполнение положений Закона о чистом воздухе для стерилизационных помещений, выделяющих оксид этилена, чтобы гарантировать, что они защищают население от значительного риска. Узнайте больше о правилах EPA для оксида этилена на веб-сайте EPA.
Узнайте больше о правилах EPA для оксида этилена на веб-сайте EPA.
Действия FDA по продвижению стерилизации медицинских изделий
FDA активно работает с экспертами по стерилизации, производителями медицинского оборудования и другими государственными учреждениями, чтобы продвигать инновационные способы стерилизации медицинских устройств с более низким уровнем используемых в настоящее время агентов и использовать новые агенты или альтернативы, сохраняя при этом безопасность и эффективность устройства.
Заседания Консультативного комитета по практике инфекционного контроля (HICPAC)
В мае и ноябре 2019 года FDA привлекло сообщество по контролю за инфекциями на заседании Консультативного комитета по практике инфекционного контроля в здравоохранении (HICPAC), чтобы проинформировать общественность о работе FDA и взаимодействии с промышленностью по методам стерилизации устройств, которые обычно стерилизуются с использованием оксида этилена. .
Вызовы инноваций FDA
15 июля 2019 г.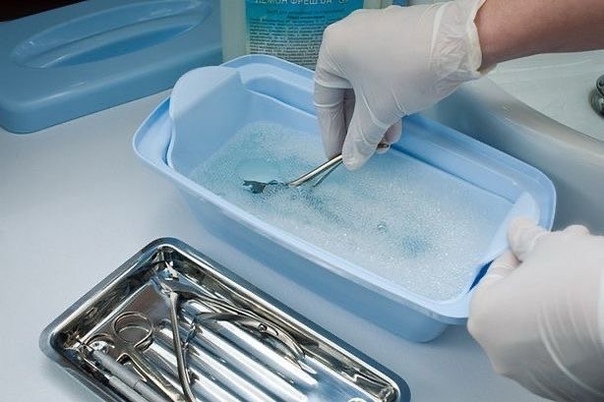 FDA объявило о двух государственных инновационных задачах, направленных на поощрение разработки новых методов стерилизации, которые могут включать новые устройства или новые методы, безопасные и эффективные для стерилизации медицинских устройств:
FDA объявило о двух государственных инновационных задачах, направленных на поощрение разработки новых методов стерилизации, которые могут включать новые устройства или новые методы, безопасные и эффективные для стерилизации медицинских устройств:
25 ноября 2019 года FDA объявило, что было получено 46 заявок и отобрано 12 участников для испытаний. Подробную информацию о выбранных участниках и дальнейших действиях см. На странице каждой задачи.
Больница общего профиля и приборы для личного пользования Консультативного комитета по медицинскому оборудованию
6-7 ноября 2019 г. FDA провело заседание Группы по больницам и устройствам для личного пользования Консультативного комитета по медицинским устройствам, чтобы обсудить, как лучше всего продвигать инновации в стерилизации медицинских устройств. Материалы встречи доступны на странице объявлений о заседании Консультативного комитета.
Одна из рекомендаций совещания консультативного комитета — производителям устройств как можно скорее начать сокращать количество бумаги (например, для этикеток и инструкций по использованию), которые включаются в упаковку стерильного устройства. Медицинское изделие, стерилизованное оксидом этилена, должно быть запечатано в тщательно разработанную газопроницаемую упаковку, которая позволяет проникать газу оксида этилена. Когда стерилизационная загрузка (включающая все материалы, вставленные в камеру стерилизатора с устройством) включает в себя большое количество бумаги с устройством, это препятствует попаданию оксида этилена в устройство и, как правило, означает, что требуется больше оксида этилена. Из-за этого FDA поощряет производителей устройств переходить на электронные материалы, где это возможно и безопасно для пользователей устройств.Мы стремимся работать с отраслью, чтобы внести это изменение.
Медицинское изделие, стерилизованное оксидом этилена, должно быть запечатано в тщательно разработанную газопроницаемую упаковку, которая позволяет проникать газу оксида этилена. Когда стерилизационная загрузка (включающая все материалы, вставленные в камеру стерилизатора с устройством) включает в себя большое количество бумаги с устройством, это препятствует попаданию оксида этилена в устройство и, как правило, означает, что требуется больше оксида этилена. Из-за этого FDA поощряет производителей устройств переходить на электронные материалы, где это возможно и безопасно для пользователей устройств.Мы стремимся работать с отраслью, чтобы внести это изменение.
Пилотная программа мастер-файла стерилизации оксидом этилена
25 ноября 2019 года FDA объявило о своей пилотной программе стерилизации мастер-файлов оксидом этилена (EtO Pilot Program). Эта добровольная программа предназначена для того, чтобы позволить компаниям (поставщикам стерилизации), которые стерилизуют одноразовые медицинские устройства с использованием оксида этилена с фиксированной камерой (EtO), предоставить мастер-файл при внесении определенных изменений между участками стерилизации или при внесении определенных изменений в процессы стерилизации, которые используют сокращенные Концентрации EtO.
В рамках этой добровольной программы производители (держатели PMA) устройств класса III, подлежащих предварительному одобрению, которые затронуты такими изменениями, могут ссылаться на мастер-файл, представленный их поставщиком стерилизации, в отчете после утверждения вместо представления приложения PMA.
Эта пилотная программа направлена на обеспечение доступа пациентов к безопасным медицинским устройствам, одновременно поощряя новые инновационные способы стерилизации медицинских устройств, которые уменьшают потенциальное воздействие EtO на окружающую среду и здоровье населения.
Пилотная программа EtO Master File началась 25 ноября 2019 года. На сегодняшний день FDA приняло мастер-файлы от участников, перечисленных ниже:
| Компания | Дата приемки |
|---|---|
| Boston Scientific | 18 марта 2020 |
| Becton, Dickinson & Company (BD) | 11 сентября 2020 |
Сообщить об изменениях в месте стерилизации в FDA
Если остановка операций в стерилизационном центре повлияла на вашу продукцию, и вы планируете использовать альтернативную установку для стерилизации своих продуктов:
Сообщить о проблеме или нехватке медицинских изделий
Проблемы с поставками могут привести к нехватке медицинских устройств и могут представлять угрозу для здоровья населения из-за задержки или прерывания оказания неотложной помощи пациентам. FDA уделяет большое внимание устранению проблем с поставками продукции и предотвращению причинения вреда пациентам из-за нехватки устройств.
FDA уделяет большое внимание устранению проблем с поставками продукции и предотвращению причинения вреда пациентам из-за нехватки устройств.
Планирование и предотвращение нехватки оборудования — важная обязанность. FDA может помочь предвидеть, предотвратить или смягчить будущий дефицит, работая с производителями устройств, которые добровольно предоставляют нам информацию о потенциальных проблемах с поставками продукции. Узнайте больше о том, как сообщить о нехватке медицинских изделий или проблемах с поставками.
Свяжитесь с нами
Чтобы сообщить о нехватке медицинских устройств или проблемах с поставками, напишите на Deviceshortages @ fda.hhs.gov или по телефону 1-800-638-2041 или 301-796-7100.
1 (31 августа 2017 г.). Сравнение технологий гамма-, электронно-лучевого, рентгеновского и этиленоксида для промышленной стерилизации медицинских устройств и товаров медицинского назначения. Получено 13 марта 2019 г. с http://iiaglobal. com/wp-content/uploads/2018/01/White-Paper-Comparison-Gamma-Eb-Xray-and-EO-for-Sterilisation.pdf
com/wp-content/uploads/2018/01/White-Paper-Comparison-Gamma-Eb-Xray-and-EO-for-Sterilisation.pdf
2 Бласс, К. (2001). Роль поли (винилхлорида) в здравоохранении .Шобери, Великобритания: Rapra Technology Limited. Извлечь из оксида https://books.google.com/books?id=vNp3bFNOU_AC&pg=PA47&lpg=PA47&dq=Ethylene стерилизации, медицинские приборы, долю рынка и источник = бл & отс = oQzply-FBQ & сиг = ACfU3U0bKGYVubW_3UEj0Kq7G3CpF6SbuQ & гл = еп & са = Х & вед =
2ahUKEwiKso3BnuzgAhWFk1kKHeiIC8Q4KBDoATAHegQIARAB # v = OnePage & д = Стерилизация оксидом этилена,
медицинских изделий, доля рынка & f = false
3 Нормативный обзор стандарта этиленоксида Управления по охране труда, 29 C.F.R § (2005) 1910.1047 https://www.osha.gov/dea/lookback/ethylene_oxide_lookback.pdf.
Химическая стерилизация Юридическое определение химической стерилизации
Стерилизация
Медицинская процедура, при которой репродуктивные органы удаляются или становятся неэффективными.
Установленная законом стерилизация преступников или других членов общества, считающихся «социально нежелательными», в течение некоторого времени считалась пятном в истории У.С. закон. Эта практика, также известная как евгеника, возникла в начале двадцатого века. В 1914 году Гарри Лафлин опубликовал Типовой закон евгенической стерилизации в Офисе евгенических записей. Лафлин предложил стерилизацию «социально неадекватных» людей, что переводится как «кто-либо полностью или частично содержится за счет государственных средств». Сюда входят «слабоумные, безумные, слепые, глухие, сироты и бездомные». На момент публикации модельного закона законы о стерилизации были приняты в 12 штатах.Считалось, что такие законы приносят пользу обществу, поскольку они, по-видимому, снижали нагрузку на налогоплательщиков по содержанию государственных объектов. В конце концов, эти законы были оспорены в суде.
In Buck v. Bell, 274 U.S. 200 (1927), Оливер Венделл Холмс мл. написал печально известное мнение, подтверждающее конституционность закона о стерилизации Вирджинии, что послужило стимулом для последующих законодательных усилий по принятию дополнительных законов о стерилизации. К 1930 году 30 штатов и Пуэрто-Рико приняли законы, требующие стерилизации за многие уголовные или моральные преступления.Практически все государства с такими законами ввели обязательную стерилизацию умственно отсталых граждан. В девятнадцати штатах требовалась стерилизация родителей детей, которые могут страдать от различных заболеваний. Шесть штатов поощряли стерилизацию лиц, чьи дети могли быть «социально неполноценными».
К 1930 году 30 штатов и Пуэрто-Рико приняли законы, требующие стерилизации за многие уголовные или моральные преступления.Практически все государства с такими законами ввели обязательную стерилизацию умственно отсталых граждан. В девятнадцати штатах требовалась стерилизация родителей детей, которые могут страдать от различных заболеваний. Шесть штатов поощряли стерилизацию лиц, чьи дети могли быть «социально неполноценными».
Наконец, Верховный суд отменил закон Оклахомы о принудительной стерилизации рецидивистов в деле Skinner v. Oklahoma , 316 U.S. 535, 62 S. Ct. 1110, 86 л.Эд. 1655 (1942). Джастис уильям о. Мнение Дугласа широко определяет право на неприкосновенность частной жизни, включая право на деторождение, и приходит к выводу, что власть государства по стерилизации нарушает основные свободы человека.
К середине века отношение к законам изменилось, и многие государственные законы о стерилизации были признаны неконституционными в соответствии с Восьмой поправкой, запрещающей жестокие и необычные наказания.
Дополнительная литература
Карлсон, Элоф Аксель. 2001. Неподходящий: История плохой идеи. Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор Пресс.
Кевлес, Дэниел Дж. 1985. Во имя евгеники. Нью-Йорк: Кнопф.
Смит, Дж. Дэвид и К. Рэй Нельсон. 1999. Стерилизация Кэрри Бак. Фар-Хиллз, Нью-Джерси: New Horizon Press.
Энциклопедия американского права Веста, издание 2. © Gale Group, Inc., 2008 г. Все права защищены.
Химические методы стерилизации и дезинфекции
Окись этилена .Этот высокореактивный газ (C2h5O) легковоспламеняющийся, токсичный и сильный раздражитель слизистой оболочки. Окись этилена может использоваться для стерилизации при низких температурах (20–60 8C). Газ
обладает высокой проникающей способностью и может проникать даже через пластиковую пленку. Одним из недостатков является то, что этот газ не может
убить высушенные микроорганизмы и требует уровня относительной влажности 40–
90% в стерилизационной камере. Оксид этилена переходит в раствор в пластмассах, каучуке
Оксид этилена переходит в раствор в пластмассах, каучуке
и подобных материалах, поэтому стерилизованным предметам необходимо дать постоять
в течение более длительного периода, чтобы обеспечить полную десорбцию.
Альдегиды . Формальдегид (HCHO) — самый важный альдегид. Его можно
использовать в специальном аппарате для газовой стерилизации. Однако его основное применение — дезинфекция
. Формальдегид — водорастворимый газ. Формалин представляет собой 35% раствор
этого газа в воде. Формальдегид раздражает слизистую оболочку; контакт с кожей может вызвать
воспалений или аллергических экзем. Формальдегид представляет собой мицид широкого спектра действия против бактерий, грибов и вирусов.При более высоких концентрациях также уничтожаются споры
. Вещество применяется для дезинфекции поверхностей и предметов
в 0,5–5% растворах. В прошлом он обычно использовался в газообразной форме для дезинфекции воздуха в помещениях (5 г / м3). Механизм действия формальдегида-
Механизм действия формальдегида-
основан на денатурации белка.
Другой альдегид, используемый для дезинфекции, — это глутаральдегид.
Спирты . Для дезинфекции используются следующие виды спирта: этанол (80%), пропанол
(60%) и изопропанол (70%).Спирты достаточно эффективны против бактерий и грибов, но не против вирусов. Они не убивают споры бактерий. Благодаря быстрому действию
и хорошему проникновению через кожу, основными областями применения кохолов al-
являются хирургическая и гигиеническая дезинфекция кожи и рук. Одним из недостатков является то, что их эффект не является длительным (нет эффекта депо). Спирты
денатурируют белки.
Фенолы . Листер был первым, кто применил фенол (карболовую кислоту) в медицинских целях.Сегодня широко используются производные фенола, замещенные органическими группами и / или галоген-
генами (алкилированные, арилированные и галогенированные фенолы). Общей чертой
Общей чертой
фенольных веществ является их слабая эффективность против
спор и вирусов. Фенолы денатурируют белки. Они связываются с органическими материалами
только в умеренной степени, что делает их пригодными для дезинфекции материалов
из организма.
Галогены . Хлор, йод и производные этих галогенов
подходят для использования в качестве дезинфицирующих средств.Хлор и йод проявляют общий микробицидный эффект, а также убивают споры.
Хлор денатурирует белки путем связывания со свободными аминогруппами; гипохлористоводородная кислота (HOCl), с другой стороны, образуется в водных растворах, тогда
распадается на HCl и 1/2 O2 и, таким образом, действует как мощный окислитель. Хлор
используется для дезинфекции питьевой воды и воды в плавательных бассейнах (до 0,5 мг / л).
Гипохлорит кальция (хлорированная известь) может быть использован для неспецифической дезинфекции выделений. Хлорамины — это органические соединения хлора, которые в водных растворах отщепляют
Хлорамины — это органические соединения хлора, которые в водных растворах отщепляют
хлора. Они используются для очистки и промывки воздуховодов и для дезинфекции экскрементов.
Йод имеет свойства, аналогичные свойствам хлора. Важнейшими препаратами йода-
являются растворы йода и йода калия в спирте (йод-
олово), используемые для дезинфекции кожи и небольших ран. Йодофоры представляют собой
комплексы йода и поверхностно-активных веществ (например, поливинилпирролидона). Хотя йод-
форы менее раздражают кожу, чем чистый йод, они также менее эффективны в качестве гермицидов
.
Окислители . Эта группа включает озон, перекись водорода, ганат перманент-
калия и перуксусную кислоту. Их соответствующая химическая активность основана на расщеплении кислорода
. Большинство из них используются в качестве мягких антисептиков для дезинфекции слизистой оболочки,
кожи или ран.
ПАВ . Эти вещества (также известные как поверхностно-активные вещества, тензиды,
Эти вещества (также известные как поверхностно-активные вещества, тензиды,
или детергенты) включают анионные, катионные, амфотерные и неионогенные детергентные соединения
, из которых катионный и амфотерный типы являются наиболее эффективными (рис.1.8).
Бактерицидное действие этих веществ умеренное. Они не имеют эффекта
вообще на туберкулезные бактерии (за исключением амфотензидов), споры
или неинкапсулированные вирусы. Их эффективность хороша против грамположительных бактерий, но в меньшей степени против грамотрицательных палочек. Их преимущества в
включают низкий уровень токсичности, отсутствие запаха, хорошую переносимость кожей и очищающий эффект.
Нравится:
Нравится Загрузка …
Связанные
Рубрики: Микробиология | Tagged: Микробиология, Стерилизация |
СТЕРИЛИЗАЦИЯ… от А до Я | Инфекционный контроль сегодня
БЫЛО НАПИСАНО МНОГИЕ СТАТЬИ, ОПИСЫВАЮЩИЕ множество глубинных процессов стерилизации. Эта статья предназначена для предоставления широкого обзора распространенных технологий стерилизации и основных элементов обеспечения стерильности, а также рекомендаций по выбору процесса стерилизации. Краткая история микробиологии предназначена для напоминания читателям о том, как недавно было обнаружено, что бесплодие является критическим фактором в медицинских процедурах.
Эта статья предназначена для предоставления широкого обзора распространенных технологий стерилизации и основных элементов обеспечения стерильности, а также рекомендаций по выбору процесса стерилизации. Краткая история микробиологии предназначена для напоминания читателям о том, как недавно было обнаружено, что бесплодие является критическим фактором в медицинских процедурах.
Ранние открытия в микробиологии
До изобретения составного микроскопа, в котором вторая линза дополнительно увеличивает изображение с первой линзы, отдельные микроорганизмы не наблюдались. Простые линзы не были достаточно мощными, чтобы обеспечить необходимое увеличение. Размер типичных микроорганизмов колеблется от половины до нескольких микрон. Микрон — это одна тысячная миллиметра. Человеческий глаз может обнаруживать объекты размером до одной десятой миллиметра.Голландский исследователь Антон фон Левенгук (1632-1723), специалист в области выдувания стекла и тонкой обработки металлов, был первым, кто идентифицировал мир микроорганизмов с помощью построенного им сложного микроскопа. В последующие годы многие исследователи пытались определить, возникла ли жизнь из неживой материи и воздуха (спонтанное зарождение или абиогенез), или живые организмы были перенесены в пыль и другие материалы. Таким образом, связь этой формы жизни с болезнью человека не проводилась еще много лет.Луи Пастер (1822-1895), исследуя ферментацию вина и пива, в значительной степени опроверг теорию абиогенеза. Он использовал колбы с длинными изогнутыми горлышками, чтобы продемонстрировать, что бульон, сваренный в такой колбе, не испортится даже на воздухе, пока колба не опрокинется, заставляя бульон соприкасаться с пылью, скопившейся в горлышке колбы. Во время таких ранних исследований тепло было средством предотвращения развития роста. Недостаточный нагрев или зависимость от кипячения часто приводили к запутанным результатам из-за неизвестного существования термостойких спор.Джон Тиндалл (1820—1893) опроверг абиогенез в 1876 году, продемонстрировав существование термостойкой формы жизни. Он вскипятил бульон, дал ему развиться, затем снова вскипятил и продемонстрировал, что никакого дальнейшего роста не произойдет. В этом процессе, который стал известен как тиндаллизация, термостойкие споры получили возможность прорасти, а затем растущие микроорганизмы кипятили, прежде чем они снова смогли образовать споры. Роберт Кох (1843-1910) известен разработкой методов выделения и чистых культур, а также демонстрацией связи между конкретными микроорганизмами и болезнями человека (постулаты Коха).Доказательство связи между микроорганизмами и болезнью или инфекцией привело к развитию асептической хирургии Джозефом Листером (1827-1912). Разбавленные растворы карболовой кислоты (фенола) использовались для очистки ран и хирургических участков, и была осознана важность стерилизации хирургических инструментов.
Мытье рук и предоперационная хирургическая очистка стали частью системы асептической хирургии, введенной в 1882 году Тренделенбургом, фон Бергманном и Шиммельбушем в Германии и Хальстадом в США, когда было продемонстрировано, что бактерии, присутствующие на коже, могут вызывать инфекцию раны.До этого не было ничего необычного в том, что пациент выжил после операции и вскоре после этого скончался от инфекции. Еще недавно, во время Гражданской войны в США (1861-1865), в вооруженных силах было больше смертей из-за инфекции, чем из-за самих ран. Как всегда, беспокоит стерильность медицинских изделий, чтобы снизить риск инфицирования пациента. Таким образом, основной причиной стерилизации медицинских изделий является устранение патогенов человека — организмов, которые, как известно, вызывают заболевания человека.Поскольку пациенты часто ослаблены или имеют ослабленную или подавленную иммунную систему из-за болезни или лекарственной терапии, также важно устранить организмы, которые обычно не считаются патогенами. Сочетание стерильных устройств, асептических хирургических процедур (попытка исключить микроорганизмы) и антибиотиков сделало возможным широкий спектр инвазивных медицинских процедур, используемых сегодня.
Определения
Стерилизация означает освобождение объекта или вещества от всех форм жизни.Стерилизацию следует отличать от дезинфекции , что означает уничтожение или удаление организмов, способных вызвать инфекцию, которая не обязательно может привести к стерилизации. Обычные дезинфицирующие средства включают фенол, формальдегид, хлор и йод. Санитарная обработка — это форма дезинфекции, обычно применяемая к неодушевленным предметам. Антисептики похожи на дезинфицирующие средства, но обычно считаются веществами, которые убивают или подавляют микроорганизмы при контакте с телом, не причиняя при этом значительного повреждения плоти. Asepsis или асептический метод означает исключение микроорганизмов из окружающей среды или процедуры.
Измерение стерильности
Несмотря на то, что существует множество вариантов процедур стерильности и микробного подсчета, здесь кратко описаны два наиболее распространенных метода. Живые организмы на устройстве чаще всего обнаруживаются, помещая устройство в питательный раствор или промывая его питательным раствором, инкубируя раствор в течение определенного периода времени при определенной температуре, а затем ища рост организмов по образованию мутности. .Это называется тестом на стерильность . Тест на стерильность просто демонстрирует наличие или отсутствие микроорганизмов. В качестве альтернативы промывочный раствор можно отфильтровать через субмикронный фильтр перед инкубацией с последующим помещением фильтра на питательный агар (гель) или питательную подушку и инкубирование в течение определенного периода времени при определенной температуре. Каждый организм, задержанный на фильтре, дает начало колонии, и количество колоний можно подсчитать. Это обычно называется тестом на бионагрузку , который демонстрирует общее количество или нагрузку микроорганизмов на устройстве.Точность подсчета микроорганизмов таким способом зависит от того, насколько эффективно процедура полоскания удаляет микроорганизмы с устройства.
На надежность методов подсчета и стерильности также влияют используемые условия роста, поскольку некоторые организмы растут только в очень специфических условиях. Некоторые из наиболее распространенных вариаций в условиях роста — это тип питательного вещества, время инкубации, температура инкубации и наличие или отсутствие кислорода. Очевидно, было бы очень легко не обнаруживать организмы, если какое-либо из этих условий не соответствует росту организмов, присутствующих на устройстве.Хотя это ограничение следует признать, в большинстве случаев используется только одно или небольшое количество условий, которые позволят выявить большинство типов вызывающих озабоченность микроорганизмов.
Предполагается, что присутствие большого количества микроорганизмов, которые не могут расти в этих общих условиях, крайне маловероятно.
Однако были некоторые примечательные исключения, и справедливость этого предположения всегда следует учитывать при работе с новыми или необычными материалами устройства.Для повторно обработанных устройств необходимо учитывать окружающую среду и условия, в которых они находились, при выборе условий роста для тестирования стерильности.
Как обеспечивается стерильность
Есть несколько факторов, которые влияют на обеспечение стерильности медицинского изделия. К ним относятся: количество организмов на устройстве до стерилизации, устойчивость этих организмов к процессу стерилизации, характеристики процесса стерилизации и продолжительность воздействия условий стерилизации.
Стерильность, особенно при работе с большим количеством устройств, трудно доказать по трем причинам. Во-первых, можно ввести жизнеспособные организмы в процессе тестирования на их наличие. Даже в хорошо контролируемых условиях уровень загрязнения 0,1% — это лучший показатель, которого можно ожидать без особых усилий. Во-вторых, проверка на стерильность, как правило, деструктивна, поскольку все отдельное устройство можно протестировать только в одном наборе условий роста.Наконец, абсолютное бесплодие не может быть доказано, оно выражается математической вероятностью выживания.
Например, популяция жизнеспособных организмов постепенно сокращается в численности с течением времени при заданном наборе условий стерилизации до тех пор, пока вероятность выживания не станет меньше одного. Существует логарифмическая зависимость между количеством жизнеспособных микроорганизмов в популяции и временем при заданном наборе условий стерилизации. Другими словами, количество жизнеспособных организмов сокращается на 90% за определенный период времени.Воздействие на другой равный период времени снова снижает популяцию на 90% и так далее. Обычно это выражается в D-значении. Например, для организма с D-значением четыре минуты популяция будет уменьшена на 90% за четыре минуты при заданном наборе условий стерилизации. Для большинства типов устройств производители должны снизить вероятность выживания микроорганизмов до менее одного на миллион. Обычно это выражается как уровень гарантии стерильности (SAL) 10 -6 .Уровень SAL в размере 10 -6 означает, что по статистике менее одного из миллиона устройств являются носителями жизнеспособных организмов. Важность этого можно оценить, когда в год производятся десятки тысяч медицинских устройств данного типа. Очевидно, что нецелесообразно тестировать достаточное количество устройств, чтобы продемонстрировать этот уровень гарантии только путем тестирования на стерильность, а возможность контаминации во время тестирования на стерильность несет в себе риск ошибочного заключения о том, что стерильный продукт не является стерильным.Кроме того, хотя можно определить среднее количество микроорганизмов на устройстве данного типа, любой продукт несет неизвестный уровень загрязнения, и устойчивость этих организмов к процессу стерилизации определить трудно. Поэтому простой тест на стерильность естественно загрязненного продукта не может быть использован для установления требуемого уровня SAL.
Для решения этих проблем используется известное количество стандартных организмов с известным уровнем устойчивости к процессу стерилизации для заражения продукта.Выбранный организм имеет высокую устойчивость к оцениваемому процессу стерилизации. Путем демонстрации стерильности продукта, зараженного 10 6 этих организмов и затем подвергнутого стерилизации, демонстрируется снижение на 10 6 (шесть логарифмов). Удвоив время выдержки в условиях стерилизации, можно достичь SAL 10 -6 (в данном случае 12 log уменьшения).
Другой компонент обеспечения стерильности связан с популяцией жизнеспособных организмов, присутствующих на изделии до стерилизации.Например, если бионагрузка обычно контролируется до менее 1000, время воздействия может быть сокращено, чтобы обеспечить сокращение на девять логарифмов и при этом достичь SAL 10 -6 (10 3 — 10 9 = 10 -6 ).
Методы стерилизации медицинских изделий
Общие методы стерилизации включают физические и химические методы. Физические методы включают сухое тепло, пар, излучение и плазму. Излучение включает в себя множество типов, включая гамма-излучение, электронный луч, рентгеновские лучи, ультрафиолетовое, микроволновое и белый (широкий спектр) свет.Химические методы включают, например, оксид этилена, оксид пропилена, диоксид хлора, газообразный озон и различные химические вещества в жидкой и парообразной форме, такие как глутаральдегид, пероксид водорода и надуксусная кислота.
Повторная обработка медицинских изделий
В последние годы в системе здравоохранения несколько тем, которые вызвали больше споров, чем переработка медицинских изделий. Очистка — один из наиболее важных аспектов обработки, поскольку биологические вещества, такие как ткани и кровь, могут значительно защитить микроорганизмы от воздействия стерилизующих агентов.Очистка обычно включает механическое и химическое удаление мусора, а также химическую дезинфекцию. Исторически медицинские устройства часто делались из металла, и повторная обработка была практичной и ожидаемой частью использования этих устройств. Простые устройства было относительно легко чистить, и их можно было легко стерилизовать без потери функциональности.
Обработка становилась все труднее по мере усложнения устройств. Демонтаж и повторная сборка устройства часто становились необходимыми для обеспечения чистоты.Достижения в области технологий привели к появлению более мелких и сложных устройств с полостями, которые было трудно чистить. Стали доступны материалы с превосходными эксплуатационными характеристиками, такие как полимеры, клеи и покрытия. Многие из этих материалов не выдерживают некоторых стандартных процессов очистки и стерилизации или многократного воздействия этих процессов. Давление на систему здравоохранения заставило производителей медицинского оборудования разрабатывать устройства для повторной обработки. В зависимости от устройства и желаемых рабочих характеристик это не всегда возможно.Соответствующий баланс между производительностью и переработкой продолжает вызывать споры. Нельзя ставить под угрозу безопасность пациента.
Выбор процесса стерилизации
Процессы стерилизации, наиболее часто используемые производителями медицинского оборудования, — это оксид этилена и радиация. Steam также продолжает играть значительную роль. Частично это связано с наличием оборудования для крупномасштабной обработки и гибкостью применения этих процессов для широкого спектра продуктов и упаковки.Альтернативные методы более распространены в больницах, поскольку они могут быть экономически эффективными в меньшем масштабе и, как правило, вызывают меньше проблем с эксплуатационной безопасностью. Такие альтернативы также изучаются для использования в конце производственных линий, а не в центральной среде пакетной обработки.
При выборе процесса стерилизации необходимо учитывать его влияние на функции продукта и целостность упаковки, а также его эффективность для каждого конкретного продукта. В первую очередь следует учитывать характеристики стерилизуемого устройства.Основные характеристики устройства — это материалы, конструкция и габариты. Эти характеристики будут определять термическую стабильность (размягчение, плавление, коробление, усадку, принятие заданной формы и т. Д.), Поглощение влаги (набухание, липкость и т. Д.), Радиационную стойкость (пожелтение, растрескивание, растрескивание, охрупчивание и т. Д.) ), реакция с химическими стерилизаторами, способность выдерживать давление и вакуум, а также способность проникновения стерилизующего вещества (проницаемость, плотность, длинные узкие просветы, маленькие полости и т. д.). Также необходимо учитывать упаковку, особенно термостабильность, проницаемость и прочность уплотнения; однако упаковка часто может быть адаптирована к потребностям процесса стерилизации.
Другие факторы, которые следует учитывать при выборе процесса стерилизации:
- Объем обрабатываемого продукта
- Капитальные затраты на оборудование
- Затраты на оборудование и требования
- Безопасность / токсичность / экологические проблемы
- Простота эксплуатации и калибровки
Кроме этого, трудно сделать общие выводы о различных методах стерилизации, поскольку эти факторы могут сильно различаться в зависимости от размера и расположения стерилизатора, а также от методы, используемые для выпуска продукта.Например, необходимое время воздействия гамма-излучения может составлять всего несколько часов. Однако время воздействия и доза контролируются скоростью носителя продукта на движущейся дорожке, которая несколько раз проходит мимо гамма-источника. Продукты обычно группируются по их минимальным и максимальным допустимым дозам, поэтому фактическая переработка продукта на большом предприятии может занять несколько дней. Точно так же цикл этиленоксида в стерилизаторе может занимать менее 12 часов, но поддоны с продуктом часто необходимо предварительно кондиционировать (позволять нагреваться и увлажнять), а затем аэрировать их для удаления остатков этиленоксида, в результате чего общее время обработки составляет от двух до четыре дня.Использование биологических индикаторов для выпуска может добавить к процессу еще от двух до семи дней. Все эти проблемы повлияют на выбор процесса стерилизации и эффективность его работы.
Дуг Харбрехт — старший научный сотрудник по системам стерилизации в Boston Scientific Corporation. Он получил степени бакалавра и магистра микробиологии в Университете Висконсина в Мэдисоне, активно работает в AAMI и ASTM и имеет 20-летний опыт стерилизации и исследований в медицинской промышленности и биофармацевтической промышленности.
Для получения полного списка ссылок и таблиц посетите сайт www.infectioncontroltoday.com
Чтобы просмотреть полный список ссылок, щелкните здесь
Стерилизация (микробиология) — Infogalactic: ядро планетарных знаний
Стерилизация (или стерилизация ) — термин, относящийся к любому процессу, который устраняет (удаляет) или убивает (дезактивирует) все формы жизни и другие биологические агенты (такие как прионы, а также вирусы, которые некоторые не считают живыми, но тем не менее являются биологическими патогенами) , включая возбудителей инфекции (таких как грибы, бактерии, вирусы, прионы, формы спор, одноклеточные эукариотические организмы, такие как Plasmodium и т. д.) присутствуют в определенной области, такой как поверхность, объем жидкости, лекарство или в соединении, таком как биологические питательные среды. [1] [2] Стерилизация может быть достигнута одним или несколькими из следующих способов: нагревание, химикаты, облучение, высокое давление и фильтрация. Стерилизация отличается от дезинфекции, санитарной обработки и пастеризации тем, что стерилизация убивает, деактивирует или устраняет все формы жизни и другие биологические агенты.
Приложения
Продукты питания
Один из первых шагов к стерилизации был сделан Николасом Аппером, который обнаружил, что тщательное нагревание в течение подходящего периода замедляет разложение продуктов и различных жидкостей, сохраняя их для безопасного употребления в течение более длительного времени, чем обычно.Консервирование пищевых продуктов является продолжением того же принципа и помогает уменьшить пищевые заболевания («пищевое отравление»). Другие методы стерилизации пищевых продуктов включают облучение пищевых продуктов [3] и высокое давление (паскализацию). [4]
Медицина и хирургия
Аппарат для стерилизации хирургических инструментов, Verwaltungsgebäude der Schweiz. Kranken- und Hilfsanstalt, 1914-1918 гг.В общем, хирургические инструменты и лекарства, которые попадают в уже асептическую часть тела (например, в кровоток или проникают через кожу), должны быть стерильными.Примеры таких инструментов включают скальпели, иглы для подкожных инъекций и искусственные кардиостимуляторы. Это также важно при производстве парентеральных фармацевтических препаратов.
Приготовление инъекционных препаратов и растворов для внутривенного введения для заместительной жидкостной терапии требует не только стерильности, но и хорошо сконструированных контейнеров для предотвращения попадания посторонних агентов после первоначальной стерилизации продукта.
Большинство медицинских и хирургических устройств, используемых в медицинских учреждениях, изготовлены из материалов, которые можно стерилизовать паром.Однако с 1950 года увеличилось количество медицинских устройств и инструментов, изготовленных из материалов (например, пластмасс), требующих низкотемпературной стерилизации. Газообразный оксид этилена используется с 1950-х годов в медицинских устройствах, чувствительных к нагреванию и влаге. За последние 15 лет был разработан ряд новых низкотемпературных систем стерилизации (например, газовая плазма перекиси водорода, иммерсионная надуксусная кислота, озон), которые используются для стерилизации медицинских изделий.] [5] Стерилизация паром является наиболее широко используемым и надежным.Стерилизация паром нетоксична, недорога, обладает быстрым микробицидным и спороцидным действием, быстро нагревает и проникает в ткани. [6]
Космический корабль
Существуют строгие международные правила защиты тел Солнечной системы от загрязнения биологическим материалом с Земли. Стандарты различаются в зависимости от типа миссии и ее назначения; чем больше вероятность того, что на планете есть жизнь, тем строже требования.
Многие компоненты приборов, используемых на космических кораблях, не могут выдерживать очень высокие температуры, поэтому методы, не требующие чрезмерных температур, используются как допустимые, включая нагрев до по крайней мере 120 ° C, химическую стерилизацию, окисление, ультрафиолетовое излучение и облучение. [7]
Количественное определение
Целью стерилизации является уменьшение количества изначально присутствующих микроорганизмов или других потенциальных патогенов. Степень стерилизации обычно выражается кратным десятичному значению времени восстановления или D-значению, обозначающему время, необходимое для уменьшения первоначального числа до одной десятой () от его исходного значения. [8] Тогда количество микроорганизмов по истечении времени стерилизации определяется по формуле:
- .
Значение D зависит от условий стерилизации и меняется в зависимости от типа микроорганизма, температуры, активности воды, pH и т. Д.. Для паровой стерилизации (см. Ниже) температура (в ° C) обычно указывается как индекс.
Теоретически вероятность выживания отдельного микроорганизма никогда не равна нулю. Чтобы компенсировать это, часто используется метод избыточного уничтожения. Используя метод избыточного уничтожения, стерилизация выполняется путем стерилизации дольше, чем требуется для уничтожения бионагрузки, присутствующей на стерилизуемом предмете или в нем. Это обеспечивает уровень гарантии стерильности (SAL), равный вероятности нестерильной единицы.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США требует уровня гарантии стерильности не менее 10 −6 для приложений с высоким риском, таких как медицинские устройства и инъекции. [9]
Тепло
Пар
Широко используемым методом тепловой стерилизации является автоклав, который иногда называют преобразователем или паровым стерилизатором. В автоклавах используется пар, нагретый до 121–134 ° C под давлением. Для достижения стерильности изделие нагревают в камере нагнетаемым паром до тех пор, пока изделие не достигнет заданного значения времени и температуры.Затем изделие выдерживают при этом заданном значении в течение периода времени, который изменяется в зависимости от бионагрузки, присутствующей на стерилизуемом изделии, и его устойчивости (D-значение) к стерилизации паром. Общий цикл может составлять от 3 до 15 минут (в зависимости от выделяемого тепла) [10] при 121 ° C и 100 кПа, что достаточно для обеспечения уровня гарантии стерильности 10 –4 для продукта. с бионагрузкой 10 6 и значением D 2,0 минуты. [11] После стерилизации жидкости в автоклаве под давлением необходимо медленно охладить, чтобы избежать выкипания при сбросе давления.Это может быть достигнуто путем постепенного сброса давления в стерилизационной камере и обеспечения возможности испарения жидкостей под отрицательным давлением при одновременном охлаждении содержимого.
Правильная обработка в автоклаве деактивирует все устойчивые бактериальные споры, а также грибы, бактерии и вирусы, но не ожидается, что устранит все прионы, которые различаются по своей устойчивости. Для удаления прионов различные рекомендации гласят 121–132 ° C в течение 60 минут или 134 ° C в течение как минимум 18 минут. [ необходимая ссылка ] Прион скрепи 263K относительно быстро инактивируется такими процедурами стерилизации; однако другие штаммы скрепи и штаммы CJD и BSE более устойчивы.Один эксперимент с использованием мышей в качестве подопытных животных показал, что нагревание ткани головного мозга с положительной реакцией на BSE при 134–138 ° C в течение 18 минут привело только к 2,5 log снижению инфекционности прионов. [ требуется ссылка ]
В большинстве автоклавов есть измерители и диаграммы, которые записывают или отображают информацию, особенно температуру и давление, как функцию времени. Информация проверяется, чтобы убедиться, что условия, необходимые для стерилизации, были выполнены. Индикаторная лента часто помещается на упаковки продуктов перед автоклавированием, а некоторые упаковки включают индикаторы.Индикатор меняет цвет под воздействием пара, обеспечивая визуальное подтверждение.
Биологические индикаторы также можно использовать для независимого подтверждения работы автоклава. Коммерчески доступны простые биоиндикаторы на основе спор микробов. Большинство из них содержат споры термостойкого микроба Geobacillus stearothermophilus (ранее Bacillus stearothermophilus ), который чрезвычайно устойчив к стерилизации паром. Биологические индикаторы могут иметь форму стеклянных пузырьков со спорами и жидкой средой или в виде спор на полосах бумаги внутри пергаминовых конвертов.Эти индикаторы размещаются в местах, куда пар трудно попасть, чтобы проверить, проникает ли туда пар.
Очистка в автоклаве имеет решающее значение. Посторонние биологические вещества или грязь могут защитить организмы от проникновения пара. Правильная очистка может быть достигнута с помощью физической очистки, обработки ультразвуком, ультразвука или пульсации воздуха. [12] Приготовление под давлением и консервирование аналогичны автоклавированию, и при правильном выполнении продукты становятся стерильными.
Влажное тепло вызывает разрушение микроорганизмов путем денатурации макромолекул, в первую очередь белков.Этот метод является более быстрым процессом, чем стерилизация сухим жаром.
Сухой жар
Сухой жар был первым методом стерилизации, и он является более длительным процессом, чем стерилизация влажным теплом. Уничтожение микроорганизмов с помощью сухого тепла — явление постепенное. При более длительном воздействии смертельных температур количество убитых микроорганизмов увеличивается. Принудительная вентиляция горячим воздухом может использоваться для увеличения скорости передачи тепла организму и снижения температуры и количества времени, необходимого для достижения стерильности.При более высоких температурах требуется более короткое время воздействия для уничтожения организмов. Это может уменьшить повреждение пищевых продуктов тепловым воздействием. [13]
Стандартная настройка духовки с горячим воздухом составляет не менее двух часов при 160 ° C. При быстром методе воздух нагревается до 190 ° C в течение 6 минут для неупакованных предметов и 12 минут для завернутых. [14] [15] Сухой жар имеет то преимущество, что его можно использовать для порошков и других термостойких предметов, на которые отрицательно влияет пар (например.грамм. не вызывает коррозии стальных предметов).
Пылающий
Flaming применяется для петель и прямых проводов в микробиологических лабораториях. Если оставить петлю в пламени горелки Бунзена или спиртовой лампы, пока она не загорится красным, то любой инфекционный агент будет инактивирован. Обычно это используется для небольших металлических или стеклянных предметов, но не для больших предметов (см. Сжигание ниже). Однако во время первоначального нагрева инфекционный материал может «разбрызгиваться» с поверхности провода до того, как он погибнет, загрязняя близлежащие поверхности и предметы.Поэтому были разработаны специальные нагреватели, которые окружают инокуляционный контур нагретой клеткой, гарантируя, что такой распыляемый материал не будет дополнительно загрязнять зону. Другая проблема заключается в том, что газовое пламя может оставлять углерод или другие остатки на объекте, если объект недостаточно нагрет. Вариант пламени — окунуть объект в этанол 70% или выше, а затем на короткое время прикоснуться к нему пламенем горелки Бунзена. Этанол воспламеняется и быстро сгорает, оставляя меньше остатков, чем газовое пламя.
Сжигание
Сжигание — это процесс обработки отходов, который включает сжигание органических веществ, содержащихся в отходах. Этот метод также сжигает любой организм дотла. Он используется для стерилизации медицинских и других биологически опасных отходов перед их утилизацией вместе с неопасными отходами. Установки для сжигания бактерий — это мини-печи, используемые для сжигания и уничтожения любых микроорганизмов, которые могут находиться на петле или проводе посева. [16]
Тиндаллизация
Названный в честь Джона Тиндаля, Tyndallization [17] — это устаревший и длительный процесс, разработанный для снижения уровня активности спорообразующих бактерий, которые остаются после простого кипячения воды.Процесс включает кипячение в течение определенного периода (обычно 20 минут) при атмосферном давлении, охлаждение, инкубацию в течение дня, а затем повторение процесса в общей сложности три-четыре раза. Инкубационные периоды должны дать возможность термостойким спорам, пережившим предыдущий период кипячения, прорасти, чтобы сформировать чувствительную к нагреванию вегетативную (растущую) стадию, которая может быть уничтожена на следующем этапе кипячения. Это эффективно, потому что тепловой шок стимулирует рост многих спор. Эта процедура работает только для сред, способных поддерживать рост бактерий, и не стерилизует непитательные субстраты, такие как вода.Тиндаллизация также неэффективна против прионов.
Стерилизаторы для стеклянных шариков
Стерилизаторы для стеклянных шариков работают за счет нагрева стеклянных шариков до 250 ° C. Затем инструменты быстро окунаются в эти стеклянные шарики, которые нагревают объект, физически соскребая загрязнения с их поверхности. Стерилизаторы со стеклянными шариками когда-то были обычным методом стерилизации, используемым в стоматологических кабинетах, а также в биологических лабораториях, [18] , но не одобрены Управлением по контролю за продуктами и лекарствами США (FDA) и Центрами по контролю и профилактике заболеваний (CDC), чтобы быть Используется как стерилизатор с 1997 года. [19] Они по-прежнему популярны в европейских и израильских стоматологических клиниках, хотя в настоящее время нет основанных на фактических данных руководств по использованию этого стерилизатора. [18]
Химическая стерилизация
Химические вещества также используются для стерилизации. Нагрев является надежным способом избавления объектов от всех передающихся агентов, но он не всегда подходит, если он может повредить термочувствительные материалы, такие как биологические материалы, волоконную оптику, электронику и многие пластмассы.В этих ситуациях химические вещества в виде газов или жидкости могут использоваться в качестве стерилизующих средств. Хотя использование газовых и жидких химических стерилизаторов позволяет избежать проблемы теплового повреждения, пользователи должны гарантировать, что стерилизуемый предмет химически совместим с используемым стерилизующим средством. Кроме того, использование химических стерилизаторов создает новые проблемы для безопасности на рабочем месте, поскольку свойства, которые делают химические стерилизаторы эффективными, обычно делают их вредными для человека.
Оксид этилена
Обработка газа оксидом этилена (EO, EtO) — один из распространенных методов, используемых для стерилизации, пастеризации или дезинфекции предметов из-за его совместимости с широким диапазоном материалов.Он также используется для обработки предметов, чувствительных к обработке другими методами, такими как излучение (гамма, электронный луч, рентгеновское излучение), тепло (влажное или сухое) или другие химические вещества. Обработка оксидом этилена является наиболее распространенным методом стерилизации, который используется примерно для 70% всех стерилизаций и более чем для 50% всех одноразовых медицинских устройств. [20]
Обработка оксидом этилена обычно проводится при температуре от 30 ° C до 60 ° C, относительной влажности выше 30% и концентрации газа от 200 до 800 мг / л. [21] Обычно процесс длится несколько часов. Оксид этилена очень эффективен, поскольку он проникает во все пористые материалы, а также может проникать через некоторые пластмассы и пленки. Оксид этилена убивает все известные микроорганизмы, такие как бактерии (включая споры), вирусы и грибки (включая дрожжи и плесень), и совместим почти со всеми материалами даже при многократном применении. Он легковоспламеняющийся, токсичный и канцерогенный, однако, по имеющимся сведениям, может вызывать некоторые неблагоприятные последствия для здоровья при несоблюдении опубликованных требований.Стерилизаторы и процессы на основе оксида этилена требуют биологической валидации после установки стерилизатора, значительного ремонта или изменения процесса.
Традиционный процесс состоит из фазы предварительного кондиционирования (в отдельной комнате или камере), фазы обработки (чаще в вакуумном сосуде, а иногда и в сосуде с номинальным давлением) и фазы аэрации (в отдельной комнате или камере) для удалить остатки этиленоксида и побочные продукты более низкого уровня, такие как этиленхлоргидрин (EC или ECH) и, что менее важно, этиленгликоль (EG).Для некоторых продуктов также существует альтернативный процесс, известный как комплексная обработка, при котором все три фазы выполняются в сосуде с вакуумным или номинальным давлением. Этот последний вариант может способствовать сокращению общего времени обработки и рассеиванию остатков.
Наиболее распространенным методом обработки оксида этилена является метод газовой камеры. Чтобы получить выгоду от эффекта масштаба, оксид этилена традиционно доставлялся путем заполнения большой камеры комбинацией газообразного оксида этилена либо в виде чистого оксида этилена, либо с другими газами, используемыми в качестве разбавителей (хлорфторуглероды (CFC), гидрохлорфторуглероды (HCFC) или углекислый газ).
Окись этилена по-прежнему широко используется производителями медицинского оборудования. Поскольку оксид этилена взрывоопасен при концентрациях выше 3%, оксид этилена [22] традиционно поставлялся с инертным газом-носителем, таким как CFC или HCFC. Использование CFC или HCFC в качестве газа-носителя было запрещено из-за опасений истощения озонового слоя. [23] Эти галогенированные углеводороды заменяются системами, в которых используется 100% оксид этилена из-за нормативных требований и высокой стоимости смесей.В больницах в большинстве стерилизаторов оксида этилена используются одноразовые картриджи из-за удобства и простоты использования по сравнению с бывшими газовыми баллонами со смесями оксида этилена.
Важно соблюдать установленные государством ограничения для пациентов и медицинского персонала в отношении остатков этиленоксида в продуктах и / или на них, воздействия на оператора после обработки, во время хранения и обращения с газовыми баллонами с этиленоксидом, а также выбросов в окружающую среду при использовании этиленоксида.
Управление по безопасности и гигиене труда США (OSHA) установило допустимый предел воздействия (PEL) на уровне 1 ppm, рассчитанном как восьмичасовое средневзвешенное значение (TWA) [29 CFR 1910.1047], и 5 ppm как 15-минутный предел отклонения. (EL). Национальный институт профессиональной безопасности и здоровья (NIOSH), предел, непосредственно опасный для жизни и здоровья (IDLH) для оксида этилена, составляет 800 частей на миллион. [24] Порог запаха составляет около 500 ppm, [25] , поэтому оксид этилена неощутим до тех пор, пока его концентрация не будет значительно выше OSHA PEL.Поэтому OSHA рекомендует использовать системы непрерывного контроля газов для защиты рабочих, использующих окись этилена для обработки. [26] Медицинские карты сотрудников должны храниться в течение 30 лет во время работы и после увольнения.
Двуокись азота
Двуокись азота (NO 2 ) — это быстрое и эффективное средство для стерилизации широкого спектра микроорганизмов, включая обычные бактерии, вирусы и споры. Уникальные физические свойства газа NO 2 позволяют диспергировать стерилизующее средство в замкнутой среде при комнатной температуре и атмосферном давлении.Механизм летальности — это разрушение ДНК в ядре спор путем нитрования фосфатного остова, которое убивает подвергшийся воздействию организм, поскольку он поглощает NO 2 . Это разложение происходит даже при очень низких концентрациях газа. [27] NO 2 имеет точку кипения 21 ° C на уровне моря, что приводит к относительно высокому давлению насыщенного пара при температуре окружающей среды. По этой причине жидкий NO 2 может использоваться в качестве удобного источника стерилизующего газа.Жидкий NO 2 часто называют его димером, тетроксидом диазота (N 2 O 4 ). Кроме того, требуемые низкие уровни концентрации в сочетании с высоким давлением пара гарантируют отсутствие конденсации на стерилизуемых устройствах. Это означает, что сразу после цикла стерилизации вентиляция устройств не требуется. [28] NO 2 также менее агрессивен, чем другие стерилизующие газы, и совместим с большинством медицинских материалов и адгезивов. [28]
Наиболее устойчивым организмом (MRO) к стерилизации газом NO 2 является спора Geobacillus stearothermophilus, которая является одной и той же MRO для процессов стерилизации паром и перекисью водорода. Споровая форма G. stearothermophilus на протяжении многих лет хорошо характеризовалась как биологический индикатор при стерилизации. Микробная инактивация G. stearothermophilus газом NO 2 протекает быстро лог-линейно, как это типично для других процессов стерилизации.Noxilizer, Inc. коммерциализировала эту технологию, чтобы предложить контрактные услуги по стерилизации медицинских устройств на своем предприятии в Балтиморе, штат Мэриленд. [29] Это было продемонстрировано в лаборатории Noxilizer во многих исследованиях и подтверждается опубликованными отчетами других лабораторий. Эти же свойства также позволяют быстрее удалить стерилизующее средство и остатки за счет аэрации замкнутой среды. Сочетание быстрой летальности и легкого удаления газа позволяет сократить общее время цикла во время процесса стерилизации (или обеззараживания) и снизить уровень остатков стерилизующего средства по сравнению с другими методами стерилизации. [28]
Озон
Озон используется в промышленных условиях для стерилизации воды и воздуха, а также в качестве дезинфицирующего средства для поверхностей. Он способен окислять большую часть органических веществ. С другой стороны, это токсичный и нестабильный газ, который необходимо производить на месте, поэтому во многих случаях его использование непрактично.
Озон как стерилизующий газ имеет множество преимуществ; озон является очень эффективным стерилизующим средством из-за его сильных окислительных свойств (E = 2.076 против SHE [30] ), способных уничтожать широкий спектр патогенов, включая прионы, без необходимости обращения с опасными химическими веществами, поскольку озон генерируется внутри стерилизатора из кислорода медицинского класса. Высокая реакционная способность озона означает, что отработанный озон можно разрушить, пропустив простой катализатор, который превращает его в кислород и обеспечивает относительно короткое время цикла. Недостатком использования озона является то, что газ очень реактивен и очень опасен. Предел NIOSH, непосредственно опасный для жизни и здоровья, для озона составляет 5 ppm, что в 160 раз меньше, чем IDLH 800 ppm для окиси этилена.Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH): Перечень химических веществ NIOSH и документация пересмотренных значений IDLH (по состоянию на 3/1/95) [31] и OSHA установили PEL для озона на уровне 0,1 ppm, рассчитанном как 8-часовое средневзвешенное значение (29 CFR 1910.1000, таблица Z-1). Канадский центр профессиональной гигиены и безопасности предоставляет превосходный обзор последствий воздействия озона на здоровье. Производители стерилизующего газа включают в свою продукцию множество функций безопасности, но разумной практикой является обеспечение непрерывного мониторинга ниже требований OSHA PEL, чтобы обеспечить быстрое предупреждение в случае утечки.В продаже имеются мониторы для определения воздействия озона на рабочем месте.
Глутаральдегид и формальдегид
Растворы глутаральдегида и формальдегида (также используемые в качестве фиксаторов) являются приемлемыми жидкими стерилизующими средствами при условии, что время погружения достаточно велико. Для уничтожения всех спор в прозрачной жидкости может потребоваться до 22 часов с глутаровым альдегидом и даже больше с формальдегидом. Наличие твердых частиц может продлить необходимый период или сделать лечение неэффективным.Стерилизация блоков ткани может занять намного больше времени из-за времени, необходимого для проникновения фиксатора. Глутаральдегид и формальдегид летучие и токсичные при контакте с кожей и при вдыхании. Глутаральдегид имеет короткий срок хранения (<2 недель) и стоит дорого. Формальдегид дешевле и имеет гораздо более длительный срок хранения, если добавить немного метанола, чтобы ингибировать полимеризацию до параформальдегида, но он гораздо более летуч. Формальдегид также используется как газообразный стерилизующий агент; в этом случае его получают на месте путем деполимеризации твердого параформальдегида.Многие вакцины, такие как оригинальная вакцина от полиомиелита Солка, стерилизованы формальдегидом.
Перекись водорода
Перекись водорода в жидком виде и в виде перекиси водорода в парообразном состоянии (VHP) является еще одним химическим стерилизующим агентом. Перекись водорода — сильный окислитель, который позволяет уничтожать широкий спектр болезнетворных микроорганизмов. Перекись водорода используется для стерилизации изделий, чувствительных к нагреванию или температуре, таких как жесткие эндоскопы. При медицинской стерилизации перекись водорода используется в более высоких концентрациях, от 35 до 90%.Самым большим преимуществом перекиси водорода в качестве стерилизатора является короткое время цикла. В то время как время цикла для этиленоксида может составлять от 10 до 15 часов, некоторые современные стерилизаторы с перекисью водорода имеют время цикла всего 28 минут. [32]
Недостатки перекиси водорода включают совместимость материалов, меньшую проницаемость и риски для здоровья оператора. Продукты, содержащие целлюлозу, например бумагу, нельзя стерилизовать с помощью VHP, а продукты, содержащие нейлон, могут стать хрупкими. [33] Проникающая способность пероксида водорода не так хороша, как у этиленоксида. [ цитата необходима ] , поэтому существуют ограничения на длину и диаметр просветов, которые можно эффективно стерилизовать, и инструкции можно получить в стерилизаторе. производители. Пероксид водорода является основным раздражителем, и контакт жидкого раствора с кожей вызовет обесцвечивание или образование язв, в зависимости от концентрации и времени контакта. Он относительно нетоксичен при разбавлении до низких концентраций, но является опасным окислителем при высоких концентрациях (> 10% мас. / Мас.).Пар также опасен, в первую очередь поражая глаза и дыхательную систему. Даже кратковременное воздействие может быть опасным, и NIOSH установил уровень немедленной опасности для жизни и здоровья (IDLH) на уровне 75 ppm, [24] менее одной десятой IDLH для окиси этилена (800 ppm). Продолжительное воздействие более низких концентраций может вызвать необратимое повреждение легких, поэтому OSHA установило допустимый предел воздействия на уровне 1,0 ppm, рассчитанный как 8-часовое средневзвешенное значение. [34] Производители стерилизаторов делают все возможное, чтобы сделать свои продукты безопасными за счет тщательного проектирования и включения многих функций безопасности, хотя воздействие перекиси водорода на рабочем месте из газовых стерилизаторов все еще зарегистрировано в базе данных FDA MAUDE. [35] При использовании любого типа газового стерилизатора разумные методы работы будут включать в себя хорошую вентиляцию, непрерывный газоанализатор для перекиси водорода, а также надлежащие методы работы и обучение. [36] [37]
Испаренная перекись водорода (VHP) используется для стерилизации больших закрытых и герметичных помещений, таких как целые комнаты и салоны самолетов.
Перуксусная кислота
Перуксусная кислота (0,2%) является признанным стерилизующим средством FDA [38] для использования при стерилизации медицинских устройств, таких как эндоскопы.
Возможность химической стерилизации прионов
Прионы обладают высокой устойчивостью к химической стерилизации. Фактически было показано, что обработка альдегидами, такими как формальдегид, увеличивает устойчивость к прионам. Было показано, что перекись водорода (3%) в течение одного часа неэффективна, обеспечивая снижение загрязнения менее чем на 3 log (10 −3 ). Йод, формальдегид, глутаральдегид и перуксусная кислота также не прошли этот тест (лечение в течение одного часа). Только хлор, фенольные соединения, тиоцианат гуанидиния и гидроксид натрия (NaOH) снижают уровни прионов более чем на 4 log; хлор (слишком агрессивный для использования на определенных объектах) и NaOH являются наиболее стойкими.Многие исследования показали эффективность гидроксида натрия. [39]
Радиационная стерилизация
Стерилизация может быть достигнута с помощью электромагнитного излучения, такого как электронные лучи, рентгеновские лучи, гамма-лучи или облучение субатомными частицами. [40] Электромагнитное излучение или излучение твердых частиц может быть достаточно сильным для ионизации атомов или молекул (ионизирующее излучение) или менее энергичным (неионизирующее излучение).
Стерилизация неионизирующим излучением
Облучение ультрафиолетовым светом (УФ, от бактерицидной лампы) полезно для стерилизации поверхностей и некоторых прозрачных предметов.Многие объекты, прозрачные для видимого света, поглощают УФ. Ультрафиолетовое облучение обычно используется для стерилизации внутренней части боксов биологической безопасности между применениями, но оно неэффективно в затененных областях, включая участки под грязью (которая может полимеризоваться после длительного облучения, так что ее очень трудно удалить). Он также повреждает некоторые пластмассы, такие как пенополистирол, если подвергаться длительному воздействию.
Стерилизация ионизирующим излучением
Иллюстрация эффективности различных радиационных технологий (электронный луч, рентгеновские лучи, гамма-лучи)Безопасность облучательных установок регулируется Международным агентством по атомной энергии Организации Объединенных Наций и контролируется различными национальными комиссиями по ядерному регулированию.Инциденты, которые произошли в прошлом, документируются агентством и тщательно анализируются для определения основной причины и потенциала улучшения. Затем такие улучшения необходимы для модернизации существующих объектов и будущей конструкции.
Гамма-излучение очень проникающее и обычно используется для стерилизации одноразового медицинского оборудования, такого как шприцы, иглы, канюли и наборы для внутривенных вливаний, а также продуктов питания. Он испускается радиоизотопом, обычно кобальтом-60 ( 60 Co) или цезием-137 ( 137 Cs).
Использование радиоизотопа требует экранирования для безопасности операторов во время использования и хранения. В большинстве конструкций радиоизотоп опускается в резервуар для хранения источника, заполненный водой, который поглощает радиацию и позволяет обслуживающему персоналу входить в радиационную защиту. В одном варианте радиоизотоп постоянно находится под водой, а продукт, подлежащий облучению, опускается в воду по направлению к источнику в герметичных колпаках; для таких конструкций дополнительное экранирование не требуется. В других редко используемых конструкциях используется сухое хранилище, обеспечивающее подвижные экраны, снижающие уровни излучения в областях камеры облучения.Инцидент в Декейтере, штат Джорджия, США, где водорастворимый цезий-137 просочился в бассейн для хранения источника, что потребовало вмешательства NRC [41] , привело к тому, что использование этого радиоизотопа было почти полностью прекращено в пользу более дорогостоящих, не содержащих водорастворимый кобальт-60. Гамма-фотоны кобальта-60 имеют примерно вдвое большую энергию и, следовательно, большую дальность проникновения, чем излучение цезия-137.
Обработка электронным лучом также широко используется для стерилизации. Электронные лучи используют технологию включения-выключения и обеспечивают гораздо более высокую скорость дозирования, чем гамма- или рентгеновские лучи.Из-за более высокой мощности дозы требуется меньшее время воздействия и, таким образом, снижается любое возможное разложение до полимеров. Ограничением является то, что электронные лучи менее проникают, чем гамма- или рентгеновские лучи. Для защиты рабочих и окружающей среды от радиационного воздействия на предприятиях используются прочные бетонные экраны.
Рентгеновское излучение: высокоэнергетическое рентгеновское излучение (вызванное тормозным излучением) позволяет облучать большие упаковки и поддоны с медицинскими приборами. Они обладают достаточной проникающей способностью, чтобы обрабатывать несколько поддонов с упаковками низкой плотности с очень хорошими коэффициентами однородности дозы.Для стерилизации рентгеновскими лучами не требуются химические или радиоактивные материалы: рентгеновские лучи высокой энергии генерируются с высокой интенсивностью с помощью генератора рентгеновских лучей, который не требует защиты, когда он не используется. Рентгеновские лучи генерируются путем бомбардировки плотного материала (мишени), такого как тантал или вольфрам, высокоэнергетическими электронами в процессе, известном как преобразование тормозного излучения. Эти системы энергоэффективны и требуют гораздо больше электроэнергии, чем другие системы для того же результата.
Облучение рентгеновскими или гамма-лучами, электромагнитным излучением, а не частицами, не делает материалы радиоактивными.Облучение частицами может сделать материалы радиоактивными в зависимости от типа частиц и их энергии, а также от типа материала мишени: нейтроны и частицы очень высоких энергий могут сделать материалы радиоактивными, но имеют хорошее проникновение, тогда как частицы с более низкой энергией (кроме нейтронов ) не может сделать материалы радиоактивными, но имеет меньшую проницаемость.
Однако стерилизация облучением гамма-лучами может в некоторых случаях влиять на свойства материала. [42]
Облучение используется Почтовой службой США для стерилизации почты в Вашингтоне, округ Колумбия.C. площадь. Некоторые продукты (например, специи, мясной фарш) стерилизуют облучением.
Субатомные частицы могут быть более или менее проникающими и могут генерироваться радиоизотопом или устройством, в зависимости от типа частицы.
Стерильная фильтрация
Жидкости, которые могут быть повреждены нагреванием, облучением или химической стерилизацией, например лекарственные препараты, можно стерилизовать микрофильтрацией с использованием мембранных фильтров. Этот метод обычно используется для термолабильных фармацевтических препаратов и белковых растворов при производстве лекарственных препаратов.Микрофильтр с размером пор 0,2 мкм обычно эффективно удаляет микроорганизмы. [43] При обработке биопрепаратов вирусы должны быть удалены или инактивированы, что требует использования нанофильтров с меньшим размером пор (20-50 нм). Поры меньшего размера снижают скорость потока, поэтому для достижения более высокой общей пропускной способности или во избежание преждевременного засорения можно использовать предварительные фильтры для защиты мембранных фильтров с небольшими порами.
Мембранные фильтры, используемые в производственных процессах, обычно изготавливаются из таких материалов, как смешанный эфир целлюлозы или полиэфирсульфон (PES).Фильтровальное оборудование и сами фильтры могут быть приобретены в виде предварительно стерилизованных одноразовых единиц в запечатанной упаковке или должны стерилизоваться пользователем, как правило, путем автоклавирования при температуре, которая не повреждает хрупкие мембраны фильтра. Чтобы гарантировать надлежащее функционирование фильтра, мембранные фильтры проверяются на целостность после использования, а иногда и перед использованием. Неразрушающий контроль целостности гарантирует, что фильтр не поврежден, и является нормативным требованием. [44] Как правило, окончательная стерильная фильтрация фармацевтических препаратов выполняется в чистом помещении для предотвращения загрязнения.
Сохранение стерильности
Инструменты, прошедшие стерилизацию, можно поддерживать в таком состоянии, помещая в герметичную упаковку до использования.
Асептическая техника — это акт поддержания стерильности во время процедур.
См. Также
Список литературы
- ↑ Глоссарий ВОЗ
- ↑ Эпидемиология UCLA: Определения
- ↑ Молинс, Рикардо А. (2001). Облучение пищевых продуктов: принципы и применение .Wiley-IEEE. п. 23. ISBN 978-0-471-35634-9 .
- ↑ Браун, Эми Кристиан (2007). Понимание пищи: принципы и приготовление (3-е изд.). Cengage Learning. п. 546. ISBN 978-0-495-10745-3 .
- ↑ [1] Эта статья включает текст из этого источника, который находится в общественном достоянии.
- ↑ [2] Эта статья включает текст из этого источника, который находится в общественном достоянии.
- ↑ «Никаких ошибок, пожалуйста, это чистая планета!». Европейское космическое агентство. 30 июля 2002 г. Дата обращения 7 августа 2014 г.
- ↑ «Руководство для промышленности: биологические индикаторы». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 4 октября 2007 г.
- ↑ «Руководство для промышленности: стерильные лекарственные препараты, произведенные путем асептической обработки» (PDF). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Сентябрь 2004 г.
- ↑ [3]
- ↑ «Принципы паровой стерилизации». STERIS Life Sciences. Ноябрь 2013 г.
- ↑ «Обеззараживание и стерилизация». НИЗ .
- ↑ Казолари А. «СТЕРИЛИЗАЦИЯ ПИЩЕВЫХ ПРОДУКТОВ ТЕПЛОМ». Причина знания свободы .
- ↑ «- Здоровье и благополучие Альберты» (PDF). Health.gov.ab.ca. Проверено 25 июня 2010.
- ↑ Dental Volume 1 — Учебное пособие для военных стоматологов
- ↑ Сжигание
- ↑ Тиль, Тереза (1999).«Стерилизация бульонных сред методом тиндаллизации» (PDF). Наука в реальном мире. Проверено 6 марта 2007.
- ↑ 18,0 18,1 Задик Ю., Перец А. (апрель 2008 г.). «Эффективность стерилизатора стеклянных шариков в стоматологической практике». Дж. Иср Дент Асс . 25 (2): 36–9. PMID 18780544.
- ↑ http: // www.CDC.gov/OralHealth/InfectionControl/faq/bead.htm 2008-09-11
- ↑ «Окись этилена» (PDF). Управление охраны труда . OSHA. Проверено 17 мая 2016.
- ↑ «Стерилизация | НАСП». Североамериканская стерилизация и упаковка . Проверено 17 мая 2016.
- ↑ «ATSDR — Руководство по медицинскому менеджменту (MMG): оксид этилена». www.atsdr.cdc.gov . Проверено 17 мая 2016.
- ↑ «Замещающие стерилизаторы согласно протоколу SNAP от 28 сентября 2006 г.» (PDF). Проверено 25 июня 2010.
- ↑ 24,0 24,1 «NIOSH: Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH) / Перечень химикатов NIOSH и документация пересмотренных значений IDLH (по состоянию на 3/1/95) — intridl4».Cdc.gov. Проверено 25 июня 2010.
- ↑ «ATSDR — MMG: Оксид этилена». Atsdr.cdc.gov. 2007-09-24. Проверено 25 июня 2010.
- ↑ «Электронный инструмент больницы: центральный модуль снабжения». Osha.gov. Проверено 25 июня 2010.
- ↑ Görsdorf S, Appel KE, Engeholm C, Обе Г.; Диоксид азота вызывает разрывы однонитевой ДНК в культивируемых клетках китайского хомячка: канцерогенез. 1990.
- ↑ 28,0 28,1 28,2 «Обзор механизма, июнь 2012 г.» (PDF). noxilizer.com . Noxilizer, Inc. Получено 2 июля 2013 г.
- ↑ «Контрактные услуги по стерилизации Noxilizer». noxilizer.com . Noxilizer, Inc. Проверено 2 июля 2013 г.
- ↑ Справочник CRC по химии и физике, 76-е изд. . 1995.
- ↑ http://www.cdc.gov/niosh/idlh/intridl4.html
- ↑ «Sterrad NX». Проверено 25 марта 2015 г.
- ↑ «Рекомендации по дезинфекции» (PDF).Центры по контролю и профилактике заболеваний США. 2008.
- ↑ «29 CFR 1910.1000, таблица Z-1». Управление по охране труда. Проверено 25 марта 2015 г.
- ↑ «MAUDE — Производитель и пользовательский интерфейс устройства». Accessdata.fda.gov. Проверено 25 июня 2010.
- ↑ «Руководство по безопасности и гигиене труда для перекиси водорода». Osha.gov. Проверено 25 июня 2010.
- ↑ «ATSDR — MMG: Перекись водорода». Atsdr.cdc.gov. 2007-09-24. Проверено 25 июня 2010.
- ↑ «Утвержденные стерилизаторы и дезинфицирующие средства высокого уровня с общими требованиями для обработки многоразовых медицинских и стоматологических устройств».Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Март 2015 г.
- ↑ Бауман, Пенсильвания; Лоуренс Л.А.; Biesert L; Dichtelmüller H; Fabbrizzi F; Gajardo R; Gröner A; Хоркера Джи; Kempf C; Kreil TR; фон Хёген I; Pifat DY; Петтуэй С.Р. Младший; MCai K (июль 2006 г.). «Критические факторы, влияющие на инактивацию прионов гидроксидом натрия». Вокс Пел . 91 (1): 34–40. DOI: 10.1111 / j.1423-0410.2006.00790.x. PMID 16756599.
- ↑ Тенденции радиационной стерилизации медицинских изделий, МАГАТЭ, Вена, 24 сентября 2008 г.
- ↑ Информационное сообщение № 89-82: ПОСЛЕДНИЕ ИНЦИДЕНТЫ, СВЯЗАННЫЕ С БЕЗОПАСНОСТЬЮ НА БОЛЬШИХ ОБЛУЧАТЕЛЯХ
- ↑ Бхарати, S; Soundrapandian C; Basu D; Датта S (2009). «Исследования нового биоактивного стекла и композиционного покрытия с гидроксиапатитом на сплавах на основе титана: влияние γ-стерилизации на покрытие». J Eur. Ceram. Soc . 29 (12): 2527–35. DOI: 10.1016 / j.jeurceramsoc.2009.02.013.
- ↑ «Руководство для промышленности, стерильные лекарственные препараты, произведенные путем асептической обработки — Текущая надлежащая производственная практика» (PDF). Министерство здравоохранения и социальных служб США. 2004
- ↑ «Руководство для промышленности: стерильные лекарственные препараты, произведенные путем асептической обработки» (PDF).Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Сентябрь 2004 г.
Прочие ссылки
- ВОЗ — Руководство по инфекционному контролю при трансмиссивных губчатых энцефалопатиях. Проверено 10 июля 2010 г., .
- Ninemeier J. Техническое руководство по центральному обслуживанию (6-е изд.). Международная ассоциация управления материальными ресурсами центральной службы здравоохранения.
- Борьба с микробами
- Раджу Г.К., Куни К.Л. (1993). «Среда и стерилизация воздуха». В Stephanopoulos G (ред.). Биотехнология, 2E, Vol. 3, Биотехнология . Вайнхайм: Wiley-VCH. С. 157–84. ISBN 3-527-28313-7 .
- Инновационные технологии биофункциональности и конечной стерилизации медицинских изделий
- Фармацевтическая фильтрация — Управление удалением организмов, Meltzer TH, Jornitz MW, PDA / DHI 1998
- «Ассоциация по развитию медицинского оборудования ANSI / AAMI ST41-Стерилизация оксидом этилена в медицинских учреждениях: безопасность и эффективность.»Арлингтон, Вирджиния: Ассоциация развития медицинского оборудования; 2000. «ISBN 1-57020-420-9
- «Министерство труда, безопасности и гигиены труда США. 29 CFR 1910.1020. Доступ к медицинской документации сотрудников «. 26 октября 2007 г.
- Периоперационные стандарты и рекомендуемые методы, AORN 2013, ISBN 978-1-888460-77-3
Разработка стерилизации — Большая химическая энциклопедия
Последние разработки стерилизаторов привели к использованию туннелей для стерилизации сухим жаром, в которых передача тепла достигается за счет инфракрасного излучения или принудительной конвекции в туннелях с ламинарным потоком фильтрованного воздуха.Предметы, подлежащие стерилизации, помещаются на конвейерную ленту и проходят через зону высоких температур (250 — 300 + ° C) в течение нескольких минут. [Pg.398]Porteus Процесс кондиционирования осадка сточных вод путем нагревания под давлением до 180–220 ° C в течение приблизительно одного часа. Твердый продукт легко обезвоживается и является стерильным. Разработан и использовался в Германии в 1980-х годах. [Pg.214]
Перевод на полномасштабные стерильные партии развития … [Pg.132]
Поддержание условий, в том числе в культуральной среде, которые сводят стресс к минимуму, является одним из лучших методов лечения болезней мочеиспускания.Vacciaes заболели пчелами из-за нескольких болезней, и еще больше находятся в стадии разработки. Селективное разведение животных с устойчивостью к болезням имело лишь ограниченный успех. Хорошая санитария и дезинфекция загрязненных помещений являются важной мерой предотвращения и контроля. Некоторые дезинфицирующие средства являются Hsted ia Таблица 6. Почвы Poad можно стерилизовать негашеной известью (CaO), гашеной известью [Ca (OH) 2] или соединениями хлора (12). [Стр.22]
Открытие в 1900 году существования групп крови вместе с улучшенным пониманием важности стерильных условий проложило путь к современной терапии переливания крови.В 1915 году была продемонстрирована возможность хранения цельной крови. Во время Первой мировой войны была определена оптимальная концентрация цитрата для использования в качестве антикоагулянта. Этот антикоагулянт использовался до 1942 года, когда был разработан раствор кислота-цитрат-декстроза (ACD). [Pg.519]
Молоко было источником пищи для людей с незапамятных времен. Хотя потребление свежего молока увеличилось с развитием экономики, большая часть потребления происходит после того, как молоко было нагрето, переработано или превращено в масло.Молочная промышленность превратилась в коммерческое предприятие, когда были внедрены методы консервирования жидкого молока. Успешная эволюция молочной промышленности от небольших производственных единиц к крупным, т. Е. От фермы до молочного завода, зависела от санитарных условий животных, продуктов и оборудования, охлаждающих установки, стандартов здоровья для животных и рабочих, транспортных систем, строительства материалов для технологического оборудования и оборудования. контейнеры для продуктов методы пастеризации и стерилизации контейнеры для распределения и охлаждения продуктов в магазинах и дома.[Pg.350]
Термическая обработка продуктов. Эквивалентную термическую обработку для уничтожения микроорганизмов или инактивации ферментов можно представить, построив логарифм времени в зависимости от температуры. Эти отношения были первоначально разработаны для стерилизации пищевых продуктов при 121,1 ° C, поэтому время уничтожения микроорганизмов определяется значением V при 121,1 ° C (250 ° F). Наклон кривой равен, а диапазон температур составляет один логарифмический цикл. Термическая обработка при 131 ° C в течение одной минуты эквивалентна 121.1 ° C в течение 10 минут (рис. 10). [Pg.359]
Упаковка. Асептическая упаковка была разработана в сочетании с высокотемпературной обработкой и способствовала превращению стерилизованного молока и молочных продуктов в коммерческую реальность. [Pg.363]
Медицинские и медицинские приложения потребляют около 21 000 т поликарбоната. Поликарбонат популярен благодаря своей прозрачности, ударной вязкости и низкому уровню извлекаемых примесей. Были разработаны специальные марки для сохранения прозрачности и устойчивости к воздействию процессов стерилизации гамма-излучением (qv).Приложения для досуга и безопасности многочисленны и разнообразны, на их долю приходится около 22 000 т потребления. Циклы промышленной стерилизации … [Pg.285]
, как правило, значительно различаются не только от производителя к производителю, но часто от типа продукта к типу продукта, в зависимости от бионагрузки, присутствующей на данной загрузке. Исторически химические индикаторы использовались только для различения стерилизованной и нестерилизованной упаковки. Недавние разработки привели к появлению химических дозиметров с достаточной точностью, чтобы их можно было использовать либо в качестве общих мониторов, либо в качестве критических детекторов определенных параметров.[Pg.407]
Выбор соответствующего цикла паровой стерилизации должен быть сделан после тщательного изучения природы стерилизуемых предметов, типа и количества присутствующих организмов, типа и размера каждой упаковки и типа. использованного упаковочного материала. Исследования развития цикла могут проводиться с использованием автоклавных нагрузок fiiU. [Pg.408]
Другие стерилизующие средства. Методы стерилизации, разработанные в ответ на требования к низкой температуре, некоррозионным свойствам и быстрому производственному циклу, требуемому большинством больниц, включают использование паров перекиси водорода, плазмы перекиси водорода и пероксиуксусной кислоты.На момент написания этой статьи (около 1996 г.) применение этих методов не было всеобщим. [Pg.410]
Гипохлорит, образующийся при электролизе, может использоваться для окислительного уничтожения цианидов (qv) или стерилизации бытовых отходов. Было разработано несколько локальных систем для стерилизации плавательных бассейнов и очистки городских отходов. Одна из этих систем описана в ссылке 124. Производство хлора на месте и немедленное использование хлора считается более безопасным, чем транспортировка хлора.[Стр.81]
Первые две категории, осветляющие фильтры и фильтры с поперечным потоком, были очень хорошо разработаны и оптимизированы для использования в биотехнологиях и стандартных системах очистки сточных вод. Для этих целей легко доступно оборудование, будь то небольшой стерилизующий фильтр 0,2 микрона, используемый для окончательной стерилизации 100 мл раствора продукта, или небольшой поперечный фильтр на 500 мл, используемый для концентрирования небольшого количества раствора антител. Многие поставщики этого оборудования для очистки сточных вод берут свое начало в CPI (Chemical Process Industries) и внедрили многие свойства масштабирования и оптимизации, разработанные в гораздо более крупных установках, используемых в крупномасштабном химическом производстве.В результате эти две операции фильтрации являются одними из наиболее оптимизированных и эффективных, используемых при очистке сточных вод. [Pg.185]
Как описано в патенте США 2 929 763, метандростенолон может быть получен путем ферментации. 2 г нитрата натрия, 1 г первичного ортофосфата калия, 0,5 г гептагидрата сульфата магния, 0,5 г хлорида калия, 50 г глюкозы и 1 г дрожжевого экстракта Difco растворяют в одном литре водопроводной воды с доведением pH до 5.

 Выдержки, мин
Выдержки, мин
 Капроновые, крученые, шнуры хир.полиэфир-ные)
Капроновые, крученые, шнуры хир.полиэфир-ные)
 Изделия из полимерных материалов (резины, пластм.), стекла, металлов, в том числе эндоскопы и инструменты к ним
Изделия из полимерных материалов (резины, пластм.), стекла, металлов, в том числе эндоскопы и инструменты к ним
 Нет
Нет )
) д.;
д.;
 Срок хранения 3 суток после стерилизации.
Срок хранения 3 суток после стерилизации. Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.[4]
Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.[4]