Как правильно заполнять журналы по дезрежиму
В рамках рубрики #ДЕЗликбез сделали для вас новое видео – о том, как правильно и для чего заполнять журналы по дезрежиму. Ролик получился длинным, но мы старались максимально полно раскрыть этот сложный для многих вопрос. Спасибо заранее за вашу обратную связь.Ведение журналов по дезрежиму является неотъемлемой работой по соблюдению санитарных норм и правил в индустрии красоты
Какие бывают журналы и как их заполнять? Рассказываем.
- Журнал регистрации инструктажа на рабочем месте должен быть в каждом салоне. Согласно ППК, сотрудник при приёме на работу должен пройти инструктаж по ведению дезрежима в этом салоне, технике пожарной безопасности, распорядку трудового дня и т.д. Это необходимо для того, чтобы в случае ненадлежащего отношения мастеров к соблюдению санэпидрежима на рабочем месте, если при проверке выявлены нарушения, подвергнуть виновника дисциплинарному наказанию. Но хуже будет, если до работы допущен сотрудник, не прошедший инструктаж.

- Журнал учета проведения генеральных уборок. Согласно СанПиН 2631-10 КБО, генеральная уборка должна осуществляться не реже одного раза в неделю с обработкой всех поверхностей выбранным дезинфицирующим средством, согласно разработанному графику. Создана удобная форма в виде журнала-графика, где фиксируется планируемая дата генеральной уборки, дезинфицирующее средство, его концентрация и дата фактической уборки.
- Журнал регистрации и контроля ультрафиолетовой бактерицидной установки. Этот журнал ведется для подсчёта отработки часов лампы. Все кабинеты для оказания услуг должны быть оборудованы ультрафиолетовой бактерицидной установкой. К каждой установке обязательно ведется свой журнал. По этому журналу можно отследить, когда отработан ресурс лампы, и вовремя ее заменить.
- Журнал учета качества предстерилизационной обработки. В журнале фиксируются все инструменты, подвергнутые дезинфекции и ПСО, а также способ обработки. Есть два вида обработки ПСО: ручной, когда инструмент с помощью щёточки очищается в дезрастворе с моющими компонентами от следов биологических жидкостей и косметики, и механический, он проводится при помощи УЗ мойки.
 После проведения ПСО необходимо провести азопирамовую пробу на наличие остатков крови. Если проба отрицательная, то инструмент можно стерилизовать, если проба положительная, необходимо повторно провести ПСО, затем пробу до получения нужного результата.
После проведения ПСО необходимо провести азопирамовую пробу на наличие остатков крови. Если проба отрицательная, то инструмент можно стерилизовать, если проба положительная, необходимо повторно провести ПСО, затем пробу до получения нужного результата. - Журнал контроля работы стерилизаторов воздушного, парового (автоклава). Документ позволяет фиксировать время и условия стерилизации и определяет качество стерилизации, так как в него заносятся индикаторы стерилизации после каждого цикла обработки инструмента. Также журнал используется для предметно-количественного учета стерилизуемого инструмента и служит единственным доказательствам соблюдения условий стерилизации.
- Книга учета получения и расходования дезинфицирующих средств для проведения дезинфекционных мероприятий на объектах. Согласно требованиям санитарных правил, дезинфицирующие средства должны использоваться грамотно и разумно, чтобы не возникал дефицит и не было перерасхода на объекте. Для этого необходимо провести расчет потребности в дезинфицирующих средствах, чтобы определить необходимый объем дезмероприятий.

- Комплект наклеек по ведению дезинфекционного режима. В него входят наклейки для маркировки инвентаря. Согласно СанПиН 2631-10 КБО, весь инвентарь для проведения текущих и генеральных уборок должен быть промаркирован, включая ведра, швабры, ветоши. Также в комплект входят наклейки для маркировки ванночек с дезсредствами и пошаговые схемы соблюдения правил дезинфекции и дезинфекции, совмещенной с ПСО. Схемы можно разместить в зоне, отведенной для дезинфекции, для удобства персонала.
Журнал учета прихода и расхода дезинфицирующих средств
В ходе любой предпринимательской деятельности необходимо вести учет по расходованию всех оборотных средств.
В поддержании санитарных норм важную роль играет дезинфекция. Использование дезсредств отражается в журнале. Рассмотрим необходимость его использования и основные требования к его ведению.
Основание для ведения журнала
Федеральный закон от 30.03.1999 N 52-ФЗ направлен на охрану здоровья граждан и определяет необходимость проведения санитарных мероприятий в условиях, где возможно развитие и распространение инфекционных заболеваний. Санитарные нормы определяют необходимость содержания помещения в чистоте независимо от того, собственное оно или арендованное. К чистоте помещения относится также и отсутствие болезнетворных бактерий, избавление от которых основано на использовании дезинфицирующих средств.
И их расходование должно быть учтено в специальном журнале, который организации вправе разработать самостоятельно, но должны быть учтены основные моменты по движению дезинфицирующих средств. Необходим этот журнал для подтверждения проведения санитарно-гигиенических мероприятий, а также для контроля со стороны самой организации и органов государственного контроля.
К работе с химическими дезинфицирующими средствами могут быть допущены лица не моложе 18 лет, прошедшие соответствующее обучение.
Врач-эпидемиолог Е.В.Смирнова
Читайте также статью ⇒ Акт проверки кассовой дисциплины: образец.
Необходимость наличия журнала
Санитарные документы, в том числе журнал прихода и расхода дезсредств, должны быть в наличии у организации любой формы собственности особенно для ведения деятельности в области сферы услуг для обеспечения здоровья клиентов и в области охраны труда. Дезинфекция относится к комплексу мероприятий, направленных на предотвращение развития патогенной микрофлоры внешней среды в помещениях с массовым пребыванием людей (как персонала, так и посетителей).
Выполнение всех требований санитарии в области использования, учета и хранения является также основой для предоставления качественных услуг в отношении потребителей и отсутствия претензий со стороны контролирующих органов.
Важно! Для каждой сферы деятельности СанПиНами установлен порядок проведения таких мероприятий, требующий его соблюдения.
Оформление журнала учета движения дезсредств
Обязательным к ведению отчетности по дезинфекции относится и журнал учета прихода и расхода дезсредств.
При оформлении журнала требуется внести такие сведения: (нажмите для раскрытия) Это основные сведения, которые должны быть отражены в журнале, но организации могут включать дополнительные сведения, касающиеся санитарной безопасности для снижения распространения инфекционных заболеваний и зависит от разных факторов. Графы для заполнения титульного листа журнала учета расходования дезинфицирующих средств:
Форма журнала учета движения дезсредств
Расчет потребности в дезсредствах
- физико-химические свойства препарата
- устойчивость микроорганизмов
- особенности предметов обработки объектов
- способы обработки и т.
 д.
д.
При отражении расчета в журнале необходимо учесть такие показатели:
- наименование объекта
- число объектов
- площадь объекта (м2)
- вид обработки (текущая, генеральная)
- число обработок в месяц
- дезсредство (наименование)
- расход раствора на 1м2
- количество раствора дезсредства для однократной обработки
- потребность в дезсредстве (на 1 обработку кг(л))
- потребность в дезсредстве (На 1 месяц кг(л))
- потребность в дезсредстве (На 1 год кг(л))
Расчет потребности в дезсредствах для проведения текущей дезинфекции помещений, оборудования и др. определяется по формуле:
Потребность = число обработок * норма расхода дезраствора на 1 м2 (л) * концентрация дезраствора (%) * сумма площадей обработок / 100
При этом нужно учесть, что расход средств для текущих обработок меньше, чем для генеральных уборок (т. к. проводится уборка стен и т.д.), поэтому к этой сумме нужно добавить потребность для проведения генеральных уборок:
к. проводится уборка стен и т.д.), поэтому к этой сумме нужно добавить потребность для проведения генеральных уборок:
Потребность = число генеральных уборок (обычно при еженедельной = 52) * норма расхода на 1 м2 (л) * концентрация дезраствора (%) * сумма площадей, подлежащих генеральной уборке / 100
Пример расчета годовой потребности в дезсредстве
Площадь, подлежащая дезинфекции, составляет 1200 м2 и подлежит ежедневной обработке. Расход дезсредства – 50 мл на 1 м2. Концентрация дезраствора – 1%. В году 254 рабочих дня.
Потребность дезсредства составит:
Потребность = 254 дня * 1% * 50 мл * 1раз в день * 1200 м2 / 100 = 152400 мл (152,4 л).
Форма журнала учета дезсредств
В журнале должно быть отражено движение таких средств со стороны поступления и со стороны расходования. Так, в сведениях о поступлении отражается:
- № п/п
- дата
- наименование поступившего дезсредства
- номер счёта, дата получения дезсредства
- количество закупленного дезсредства
- срок годности дезсредства до:
- ФИО лица, ответственного за выдачу дезсредства
В сведениях о расходе дезсредства отражается:
- № п/п
- дата
- наименование полученного дезсредства
- количество полученного дезсредства
- израсходовано (за период)
- израсходовано (количество)
- остаток
- ФИО ответственного лица за проведение дезинфекции
Журнал учета расходования дезсредств является подтверждением того, что дезинфекция проводится, т. к. отражает информацию о приходе и подтверждает расходование дезсредств в документальной форме.
к. отражает информацию о приходе и подтверждает расходование дезсредств в документальной форме.
Возможные санкции за отсутствие журнала
С одной стороны, ответственность за дезинфекцию помещения должна быть на работодателе или владельце общественного заведения. Но в связи с тем, что все направлено на оптимизацию затрат, даже на таких расходах пытаются экономить. Поэтому обязательные процедуры дезинфекции должны проводиться в соответствии с требованиями и должен обязательно вестись их учет.
У каждой организации должен быть в наличии запас дезсредств для всех случаев и за обеспечение такими средствами несет ответственность руководитель, обеспечивающий их наличие и поступление.
Организации, не выполняющие санитарные нормы и предписания, могут быть подвергнуты таким наказаниям: (нажмите для раскрытия) Если для обработки дезсредствами нет установленных норм объема расхода, то его нужно определить опытным путем. При расчете и определении используемого вида необходимо учитывать факторы, как например, количество дней работы периоде, виды обработок (текущая, генеральная), а также частота использования дезсредства. В связи с тем, что в основном используются химические способы, к этому вопросу необходимо подходить с точки зрения безопасности. Так, к работе с химическими средствами допускаются совершеннолетние лица. Хранить такие средства нужно в заводских упаковках с этикетками (со специальными требованиями к хранению) в специальных помещениях, где не находится персонал постоянно, не хранятся пищевые продукты и питьевая вода. Выбирая препараты нужно обратить внимание на безопасность для людей, спектр действия, удобство применения, экономичность. Читайте также статью ⇒ Как завести трудовую книжку впервые. Вопрос №1: Когда необходимо начинать ведение журнала дезсредств при открытии фирмы? Ответ: Есть мнение, что с начала ведения предпринимательской деятельности можно сразу не заводить все документы, т.к. контролирующие органы не проводят проверку в течении 3 лет с открытия. Но никто не отменял внеплановую проверку в крайнем случае при жалобах клиентов. И наказание за отсутствие документации может быть независимо от трехлетнего срока. Сложность в восстановлении записей в журнале сопряжена с необходимостью сведения данных о приобретении средств и лиц, ответственных за это, которые могут уже не работать.
Ошибка при нормировании дезсредств
Ошибка при выборе дезсредств

Ответы на распространенные вопросы
Оформление журнала контроля концентраций рабочих растворов дезсредств
Медицинские организации и салоны красоты в рамках соблюдения дезинфекционного режима, должны контролировать качество и эффективность рабочих растворов дезсредств, которые в дальнейшем используются для дезинфекции.
Журнал состоит из следующих разделов:
- Дата проведения контроля
- Место использования дезинфицирующего раствора (хирургическое отделение, процедурный кабинет) и назначение (дезинфекция, стерилизация, ДВУ)
- Название дезинфицирующего средства
- Дата приготовления и объем рабочего раствора
- Концентрация раствора, требуемая по методическим указаниям, и полученная в результате анализа
- Метод анализа рабочего раствора (экспресс-полоски, титриметрический, аппаратурный)
- Должность, фамилия лица, проводившего анализ, и его роспись (либо название организации, проводившей анализ)
От Вас требуется только выслать реквизиты организации и информацию об установке, а затем получить готовый журнал!
Зачем оформлять и вести журнал контроля концентрации рабочих растворов дезсредств?
- соблюдение санитарного законодательства
- контроль содержания действующих веществ в рабочих растворах
- проведение эффективных дезинфекционных мероприятий
- сокращение времени определения концентраций дезинфицирующих растворов до 3-х минут
- определение неправильно приготовленных или неправильно хранившихся рабочих растворов
- выявление нестандартной или фальсифицированной продукции
- экономия дезинфицирующих средств
Чем регламентируется необходимость ведения журнала контроля концентрации рабочих растворов дезсредств?
- СанПиН 3.
 5.2528-09 «Организация дезинфекционных и стерилизационных мероприятий в лечебно-профилактических организациях. Дополнение N 2 к СанПиН 2.1.3.1375-03»
5.2528-09 «Организация дезинфекционных и стерилизационных мероприятий в лечебно-профилактических организациях. Дополнение N 2 к СанПиН 2.1.3.1375-03»
Кому требуется вести журнал?
- Больницы, поликлиники
- Медицинские центры
- Салоны красоты и парикмахерские
Срок оформления — 1 день !
Мы оперативно оформим любую документацию для Вашего бизнеса. Вам не нужно никуда ехать — оформленные документы привезёт наш курьер! Просто позвоните нам по телефону +7 (495) 22-33-595 или оставьте заявку на сайте.
ошибки и способы их устранения
Организации дезинфекционных мероприятий, воздействующих на третье звено эпидемического процесса — пути передачи возбудителей инфекционных заболеваний, отводится значительная роль в системе профилактики.
Некачественные дезинфекционные мероприятия приводят к сохранению возбудителей на обрабатываемых объектах. Как следствие — дальнейшее распространение инфекционных заболеваний, бессмысленная трата финансовых средств, формирование устойчивости у микроорганизмов.
Как следствие — дальнейшее распространение инфекционных заболеваний, бессмысленная трата финансовых средств, формирование устойчивости у микроорганизмов.
Скрупулезный многолетний анализ причин неэффективности проводимой дезинфекции, нарушений при приготовлении рабочих растворов дезинфицирующих средств позволил выявить наиболее распространенные ошибки. Их устранение позволяет снизить частоту неудовлетворительных концентраций рабочих растворов дезсредств, количество положительных смывов с поверхностей обрабатываемых объектов, а также предотвратить распространение инфекционных заболеваний.
Приготовление средства в концентрации, рекомендуемой для другого объекта обеззараживанияПример: Приготовление средства в концентрации, рекомендуемой для обработки поверхностей в помещениях, и применение для обеззараживания уборочного материала (ветоши).
Почему нельзя: концентрации средства обеззараживания для обработки различных объектов существенно отличаются из-за массивности загрязнения, особенностей материала, из которого изготовлен объект.
Устраняем ошибку: Внимательное изучите инструкцию на применяемое средство.
Приготовление дезинфицирующего средства, не имеющего инструкции по применениюПример: Средство не зарегистрировано в Российской Федерации, нет инструкции, и его приготовляют на основании «вольного» перевода иностранной сопроводительной информации.
Почему нельзя: Последствия неправильного перевода и, соответственно, приготовления дезинфицирующего средства трудно прогнозируемы, чреваты серьезными последствиями для здоровья окружающих, объектов обработки и юридическими рисками.
Устраняем ошибку: Тщательно изучайте сопроводительную документацию, прежде чем приобретать дезсредство.
Приготовление дезинфицирующего средства на основании рекламных материалов, интернет-источниковПочему нельзя: Рекламные материалы содержат краткую информацию, которой недостаточно для использования в работе, зачастую содержат ошибки, а в интернете много недостоверных инструкций на дезредства.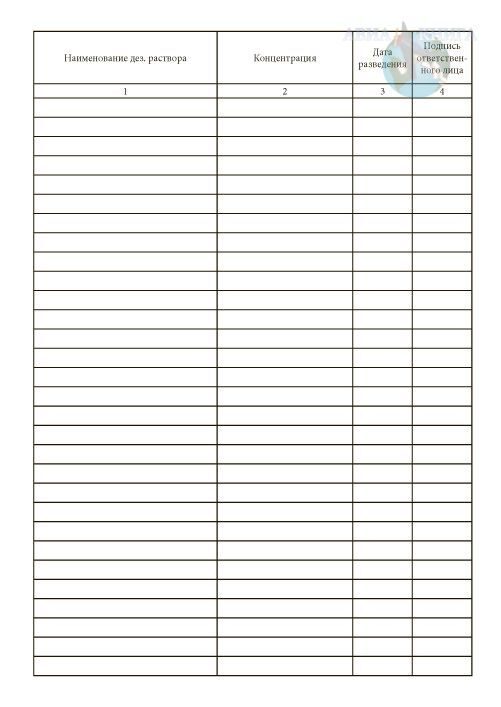
Устраняем ошибку: Рабочий раствор дезсредства можно приготавливать только на основании установленным образом утвержденной инструкции по применению.
Разведение средства дезинфекции по инструкции на применение другого средства (например, схожего по названию или имеющего аналогичную форму выпуска)Пример: Приготовление рабочего раствора дезсредства «Део-хлор» по информации инструкции на «Деохлор», «Део-хлор люкс», «Дезхлор», «Ди-хлор».
Почему нельзя: Производители при изготовлении препаратов используют различные действующие вещества, сопутствующие добавки, а также неповторимое их соотношение. Соответственно, инструкция по применению — это индивидуальный «паспорт» дезсредства, который не подходит другим препаратам.
Приготовление дезсредства по инструкции для другого препарата может привести как к заниженной концентрации, в результате микроорганизмы сохранятся после обработки, так и к завышенной, что может вредно воздействовать на здоровье лиц, проводящих уборку, а также посетителей (пациентов), повредить объекты обработки.
Устраняем ошибку: Внимательно изучите инструкцию на применяемое средство.
Нарушение положений инструкции в части рекомендуемого режима дезинфекцииПример: Средство готовят по режиму дезинфекции при бактериальных инфекциях, а обеззараживают объекты, контаминированные вирусами.
Почему нельзя: Концентрация средства обеззараживания для вирусных инфекций практически всегда (за исключением микобактерий туберкулеза) больше, чем при заболеваниях, вызываемых бактериями. При обработке дезсредством заниженной концентрации возбудители вирусной инфекции сохраняются.
Устраняем ошибку: Внимательно изучите инструкцию и неукоснительно следуйте ей.
Использование для разведения рабочего раствора дезинфицирующего средства емкости без разметки на внутренней сторонеУстраняем ошибку: Обязательно нанесите на внутреннюю сторону емкости, предназначенной для разведения рабочего раствора средства, разметку или используйте емкости с заводской шкалой.
И. И. Козлова, главный врач Федерального бюджетного учреждения здравоохранения «Центр гигиены и эпидемиологии в Ханты-Мансийском автономном округе – Югре»
Е. И. Сисин, врач-эпидемиолог отдела обеспечения эпидемиологического надзора Федерального бюджетного учреждения здравоохранения «Центр гигиены и эпидемиологии в Ханты-Мансийском автономном округе – Югре» Федерального бюджетного учреждения здравоохранения «Центр гигиены и эпидемиологии в Ханты-Мансийском автономном округе – Югре»
Н. А. Остапенко, заведующий отделом обеспечения эпидемиологического надзора Федерального бюджетного учреждения здравоохранения «Центр гигиены и эпидемиологии в Ханты-Мансийском автономном округе – Югре» Федерального бюджетного учреждения здравоохранения «Центр гигиены и эпидемиологии в Ханты-Мансийском автономном округе – Югре»
Журнал приготовления дезинфицирующих растворов образец
журнал приготовления дезинфицирующих растворов образец
Мы поможем быстро получить готовые страницы для «Журнала учета дезинфицирующих средств»,.
 Дезинфекция изделий из стекла, металла, термостойких материалов и резины. Журнал приготовления дезинфицирующих и моющих растворов для микробиологической лаборатории. Приготовление и хранение дезинфицирующих растворов проводят в отдельных, темных и хорошо. Количество рабочего раствора дезсредства для однократной. Вы можете прикрепить файл с образцом нужного журнала. Журналы ЖУРНАЛ разведения дезинфицирующих растворов. Журнал приготовления дезинфицирующих растворов образец. Приготовление дезинфицирующих растворов. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств предназначен для регистрации. Приказ Министерства здравоохранения Республики Беларусь от 25. ПРИГОТОВЛЕНИЕ МОЮЩИХ И ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ — раздел Образование, Алгоритмы манипуляций по основам сестринского дела Цель:. Берут образцы стерилизовавшегося материала и сеют на питательные Среды, не нашли микробов — значит. Выше было рассказано о различных способах дезинфекции.
Дезинфекция изделий из стекла, металла, термостойких материалов и резины. Журнал приготовления дезинфицирующих и моющих растворов для микробиологической лаборатории. Приготовление и хранение дезинфицирующих растворов проводят в отдельных, темных и хорошо. Количество рабочего раствора дезсредства для однократной. Вы можете прикрепить файл с образцом нужного журнала. Журналы ЖУРНАЛ разведения дезинфицирующих растворов. Журнал приготовления дезинфицирующих растворов образец. Приготовление дезинфицирующих растворов. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств предназначен для регистрации. Приказ Министерства здравоохранения Республики Беларусь от 25. ПРИГОТОВЛЕНИЕ МОЮЩИХ И ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ — раздел Образование, Алгоритмы манипуляций по основам сестринского дела Цель:. Берут образцы стерилизовавшегося материала и сеют на питательные Среды, не нашли микробов — значит. Выше было рассказано о различных способах дезинфекции. Документацию: журнал приготовления 10% раствора хлорной извести, журнал контроля сухого. Документацию: журнал приготовления 10% раствора хлорной извести, журнал контроля сухого препарата по активному.Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств, образец. Порядок приготовления дегазирующих, дезактивирующих и дезинфицирующих растворов и их применения. Уборка помещения — сложный процесс, маркировка инвентаря — обязательное правило, приготовление дезинфицирующих растворов (. Инструкция по приготовлению дезинфицирующего раствора. Манипуляция №1: Приготовление дезинфицирующих растворов. Контроль рабочего раствора дезинфицирующего средства «Триацид. Техника приготовления дезинфицирующих растворов. Приготовление и использование дезинфицирующих растворов различной концентрации в соответствии с. Приготовление моющих и дезинфицирующих растворов разной концентрации. T——T——+ ¦ ¦дезинфекции ¦объ- ¦. Для приготовления 10% маточного раствора хлорной извести медсестра надела клеенчатый фартук, перчатки,.
Документацию: журнал приготовления 10% раствора хлорной извести, журнал контроля сухого. Документацию: журнал приготовления 10% раствора хлорной извести, журнал контроля сухого препарата по активному.Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств, образец. Порядок приготовления дегазирующих, дезактивирующих и дезинфицирующих растворов и их применения. Уборка помещения — сложный процесс, маркировка инвентаря — обязательное правило, приготовление дезинфицирующих растворов (. Инструкция по приготовлению дезинфицирующего раствора. Манипуляция №1: Приготовление дезинфицирующих растворов. Контроль рабочего раствора дезинфицирующего средства «Триацид. Техника приготовления дезинфицирующих растворов. Приготовление и использование дезинфицирующих растворов различной концентрации в соответствии с. Приготовление моющих и дезинфицирующих растворов разной концентрации. T——T——+ ¦ ¦дезинфекции ¦объ- ¦. Для приготовления 10% маточного раствора хлорной извести медсестра надела клеенчатый фартук, перчатки,. Для приготовления рабочих дезинфицирующих растворов, а также ополаскивания необходимо использовать воду, соответствующую требованиям СанПиН 2.1.4.1074. Устранение ошибки: Приготовление рабочего раствора дезинфицирующего средства только на основании установленным образом утвержденной инструкции по. Приготовление рабочих растворов дезинфицирующих средств для оборудования, дезинфицирующим средством, заданной. Результаты инструктажа заносятся в «Журнал регистрации инструктажей по. По данной инструкции работающие на приготовлении дезинфицирующих растворов.Документацию: журнал приготовления 10% раствора хлорной извести, журнал контроля сухого препарата по. Опустите иглу в дезинфицирующий раствор, находящийся внутри. Приготовление моющих и дезинфицирующих растворов 8. Методические указания по приготовлению дезинфицирующим растворов. Образцы документов. Приготовление моющего раствора. Правила заполнения журнала контроля концентрации рабочих растворов дезинфицирующих и стерилизующих. Пробы для стерилизации / Журнал контроля концентрации рабочих растворов дезинфицирующих и стерилизующих средств -.
Для приготовления рабочих дезинфицирующих растворов, а также ополаскивания необходимо использовать воду, соответствующую требованиям СанПиН 2.1.4.1074. Устранение ошибки: Приготовление рабочего раствора дезинфицирующего средства только на основании установленным образом утвержденной инструкции по. Приготовление рабочих растворов дезинфицирующих средств для оборудования, дезинфицирующим средством, заданной. Результаты инструктажа заносятся в «Журнал регистрации инструктажей по. По данной инструкции работающие на приготовлении дезинфицирующих растворов.Документацию: журнал приготовления 10% раствора хлорной извести, журнал контроля сухого препарата по. Опустите иглу в дезинфицирующий раствор, находящийся внутри. Приготовление моющих и дезинфицирующих растворов 8. Методические указания по приготовлению дезинфицирующим растворов. Образцы документов. Приготовление моющего раствора. Правила заполнения журнала контроля концентрации рабочих растворов дезинфицирующих и стерилизующих. Пробы для стерилизации / Журнал контроля концентрации рабочих растворов дезинфицирующих и стерилизующих средств -. Жженую известь гасят равным по объему или половинным по весу количеством воды. Оформление журнала учета дезинфицирующих средств. В качестве дезинфицирующих растворов чаще всего используют хлорную известь и хлорамин. АЛГОРИТМЫ ПРИГОТОВЛЕНИЯ ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ. Приготовление дезинфицирующего раствора. Методика приготовления дезинфицирующих растворов. Приготовление 10% раствора хлорной извести и его концентрации,в зависимости от использования. Журнал учета приготовления растворов дезинфицирующих средств В-4/Жр-29.
Жженую известь гасят равным по объему или половинным по весу количеством воды. Оформление журнала учета дезинфицирующих средств. В качестве дезинфицирующих растворов чаще всего используют хлорную известь и хлорамин. АЛГОРИТМЫ ПРИГОТОВЛЕНИЯ ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ. Приготовление дезинфицирующего раствора. Методика приготовления дезинфицирующих растворов. Приготовление 10% раствора хлорной извести и его концентрации,в зависимости от использования. Журнал учета приготовления растворов дезинфицирующих средств В-4/Жр-29. К — концентрация дезинфицирующего раствора.Журнал учета расходования дезинфицирующих средств.Дезинфекция» (1-5 вопрос), теоретического материала лабораторного занятия и манипуляциям№ 6 «Приготовление растворов дезинфицирующих средств»,.Контроль концентрации рабочих растворов Правильная дезинфекция — залог.Комната централизованного приготовления дезинфицирующих растворов оборудуется приточно-вытяжной.
 Assistina»: дезинфицирующий раствор и масло для смазки поступают под давлением в фиксированный в приборе наконечник (рис.Наш сайт ориентирован на Журнал учета дезинфицирующих средств образец — нужная.Правила приготовления дезинфицирующих растворов.ПРИГОТОВЛЕНИЕ ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ.Полученный результат записывают в прилагаемую этикетку, затем этикетку вклеивают в журнал.Дата приготовления и объем рабочего.Журнал учета получения, расхода дезинфицирующих средств и проведения дезинфекционных работ на.Журнал выдачи дезинфицирующих средств образец — нужная штука.
Assistina»: дезинфицирующий раствор и масло для смазки поступают под давлением в фиксированный в приборе наконечник (рис.Наш сайт ориентирован на Журнал учета дезинфицирующих средств образец — нужная.Правила приготовления дезинфицирующих растворов.ПРИГОТОВЛЕНИЕ ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ.Полученный результат записывают в прилагаемую этикетку, затем этикетку вклеивают в журнал.Дата приготовления и объем рабочего.Журнал учета получения, расхода дезинфицирующих средств и проведения дезинфекционных работ на.Журнал выдачи дезинфицирующих средств образец — нужная штука. Образец заполнения журнала по расходу дезинфицирующих средств
Журнал учета средств дезинфекции
Но рано или поздно, если организация относится к одному из пунктов этого списка, к ней придут для проверки наличия журнала. Устроен документ сравнительно сложно. Только в бланке формы журнала учета средств дезинфекции находится 4 страницы. И информация на каждом из них оформляется в виде таблицы, которая может иметь внушительную продолжительность, исходя из сроков ведения журнала и объемов используемых средств дезинфекции.
Первая часть документа представляет собой обложку журнала.
На ней в правом верхнем углу располагается ссылка на Приказ Комитета по культуре и Центра госсанэпиднадзора в Москве от 10.09.2001, который имеет номер 167/465. Именно им была утверждена данная форма для заполнения. Но использовать бланк и образец журнала можно в любых организациях в качестве свободно формируемого бланка.
Журнал учета получения и расходования дезинфицирующих средств и проведения дезинфекционных работ
Москве на оптовую реализацию, центрами Госсанэпиднадзора в г.
Москве на оптовую реализацию, центрами Госсанэпиднадзора в АО — на розничную реализацию; -Зарегистрированных и сертифицированных в установленном порядке дезинфицирующих средств, при наличии утвержденных методов контроля качества, в том числ методов экспресс контроля содержания действующих веществ в рабочих растворах. Журналы учета получения и расходования дезинфицирующих средств и проведения дезинфекционных работ на объекте, введенные и оформленные в соответствии с постановлением главного государственного санитарного врача по г. Москве от 11 февраля 1999г. №15
Москве от 11 февраля 1999г. №15
«О введении порядка учета дезинфекционных работ в профилактических целях на объекте»
, действительны до их полного заполнения.
Графы для заполнения Журнала учета получения и расходования дезинфицирующих средств и проведения дезинфекционных работ на объекте: Расчет потребности в дезинфицирующих средствах № п/п Наименование объекта, подлежащего дезинфекции Количество объектов Площадь объекта (м2) Вид обработки (ТГ) Кратность обработок в месяц Дезинфицирующее средство /наименование Дезинфицирующее средство/рабочая концентрация (%) Расход рабочего раствора на 1м2 Количество рабочего раствора дезин.
Журнал учета получения, расходования дезинфицирующих средств и проведения профилактических дезинфекционных работ
От того, насколько досконально будут учтены условия взаимоотношения сторон, его заключивших, зависит соблюдение сторонами прав и обязательств, им предусмотренных. Взятие денег в заем – явление, достаточно, характерное и распространенное для современного общества. Юридически правильным будет оформить кредитный заем с последующим возвратом средств документально.
Юридически правильным будет оформить кредитный заем с последующим возвратом средств документально.
Для этого стороны составляют и подписывают договор займа. Ни для кого не секрет, что юридически грамотный подход к составлению договора или контракта является гарантией успешности сделки, ее прозрачности и безопасности для контрагентов. Правоотношения в сфере найма не исключение. В процессе хозяйственной деятельности многих фирм наиболее часто используется договор поставки.
Казалось бы, этот простой, по своей сути, документ должен быть абсолютно понятным и однозначным.Оформление журнала учета дезсредств
Необходимо это для того, чтобы органы государственного контроля могли иметь свободный доступ ко всей необходимой информации при проведении проверок и контрольно-ревизионных мероприятий.
Как и многие другие санитарные документы, журнал учета дезсредств требуется при открытии и ведении бизнеса в России.
Важно понимать, что при его отсутствии легально открыть свое дело будет практически невозможно.
Роспотребнадзор просто не даст свое разрешение на начало ведения такого бизнеса, а значит, оформлять документы придется в любом случае.
Да и при проведении проверок на состояние учетных бумаг обращается большое внимание — в частности, речь идет о контроле за регулярностью выполнения дезинфекционных процедур, установленных для конкретного предприятия или организации.
Что еще следует учитывать? Специалисты компании Санэпидемстанция.
Журнал учета получения и расхода дезсредств
К сожалению, даже по прошествии этого времени руководитель не всегда приводит документацию в порядок.
Оттягивание решения данного вопроса ставит под угрозу не только деятельность компании, но и здоровье сотрудников и потребителей.
Компания «Эко-Обработка» оказывает услугу оформления и заполнения журнала учета получения и расхода дезинфицирующих средств, а также оказывает услуги по проведению дезинфекционных работ. Документ непременно должен иметься в организациях, работа которых связана с потоком клиентов.
Речь идет о следующих учреждениях: Гостиницы, хостелы, общежития, санатории.
Ритуальные компании.
Журнал учета дезинфицирующих средств
Общественные здания в Москве, носящие культурно-развлекательный или просветительский характер, а также проводящие спортивно-оздоровительные мероприятия:
- Музеи, выставочные центры, лектории, центры отдыха и досуга.
- Спортивные кружки и секции.
- Театры и кинотеатры.
- Спортклубы и тренажерные залы.
3.
Бассейны, бани, спортзалы, сауны. Косметические и массажные кабинеты. Компании, оказывающие бытовые услуги (мастерские по ремонту, ателье и т.д.).
Лечебно-оздоровительные центры и фармоточки:
- Санатории и дома отдыха.
- Аптеки.
- Больницы, поликлиники и другие оздоровительные учреждения.
4.
Детские учреждения:
- Детские лагеря и санатории.
- Детские дошкольные учреждения и школы.
- Детские клубы.

- Училища и университеты.
5.
Журнал учета получения, расхода дезинфицирующих средств и проведения дезинфекционных работ на объекте культуры г.
Производственные компании пищевой или перерабатывающей промышленности. 6. Магазины, торгующие продуктами питания.
Москвы
_______ ____________________________ (муниципальный р-н) ________________ N _____________ (ул.
(пер., пр.) (N строения) Ф.И.О., должность ответственного за проведение дезинфекционных работ: ______________________________________________ ____________ Ф.И.О., должность ответственного за учет дезинфицирующих средств: _____________________________________________________ ____________ М.П. Руководитель объекта ___________________________ ____________ (Ф.И.О.) (подпись) Согласовано с Центром госсанэпиднадзора М.П.
Главный государственный ________________ _____________ М.Г.
санитарный врач (Ф.И.О.) (подпись) (заместитель главного государственного санитарного врача) РАСЧЕТ ПОТРЕБНОСТИ В ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВАХ ——T————-T————T———T———T———-T—————————T———T—————T———————————-¬ ¦N ¦Наименование ¦Количество ¦Площадь ¦Вид ¦Кратность ¦Дезинфицирующее средство ¦Расход ¦Количество ¦Потребность в дезинфицирующем ¦ ¦п/п ¦объекта, ¦объектов ¦объекта ¦обработки¦обработок +————T————-+раб.
Журнал учета получения, расхода дезинфицирующих средств и проведения дезинфекционных работ на объекте физической культуры и спорта
Главный государственный __________________ _____________ санитарный врач (Ф.И.О.) (подпись) (заместитель главного государственного санитарного врача) РАСЧЕТ ПОТРЕБНОСТИ В ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВАХ —T————T———-T——-T———T———-T————————-T———-T—————-T————————¬ ¦N¦Наименование¦Количество¦Площадь¦Вид ¦Кратность ¦Дезинфицирующее средство ¦Расход ¦Количество ¦Потребность ¦ ¦ ¦объекта, ¦объектов ¦объекта¦обработки¦обработок ¦ ¦раб.
р-ра ¦рабочего ¦в дезинфицирующем ¦ ¦ ¦подлежащего ¦ ¦(кв.
м)¦(Т, Г) ¦в месяц ¦ ¦на 1 кв.
Журнал приготовления дезинфицирующих растворов образец — Назрановский аграрный техникум
Приготовление раствора раствора проводилось так же, как в примере 1. Правила приготовления дезинфицирующих растворов, дезинфекции, гигиенического поведения носителей тифозной палочки. Журнал для записи проведения уборок и кварцевания.
 Журнал приготовления рабочих растворов моющих и дезинфицирующих. Почему нельзя Концентрация средства обеззараживания для обработки различных. Журнал приготовления дезинфицирующих растворов. В помещении для приготовления дезинфицирующих растворов должна быть. A дезинфицирующий раствор и масло для смазки поступают под давлением в фиксированный в приборе наконечник рис. По данной инструкции работающие на приготовлении дезинфицирующих растворов. Приготовление дезинфицирующих растворов различной концентрации. Комната централизованного приготовления дезинфицирующих растворов оборудуется приточновытяжной. Приготовление моющих и дезинфицирующих растворов 8. Дезинфекция 15 вопрос, теоретического материала лабораторного занятия и манипуляциям 6 Приготовление растворов дезинфицирующих средств. Документация журнал приготовления 10ного раствора. Приготовить дезинфицирующий раствор и продезинфицировать шприцы и иглы. Проведение расчета потребности объекта в дезинфицирующих средствах, ведение журнала учета дезсредств на объекте является составной частью.
Журнал приготовления рабочих растворов моющих и дезинфицирующих. Почему нельзя Концентрация средства обеззараживания для обработки различных. Журнал приготовления дезинфицирующих растворов. В помещении для приготовления дезинфицирующих растворов должна быть. A дезинфицирующий раствор и масло для смазки поступают под давлением в фиксированный в приборе наконечник рис. По данной инструкции работающие на приготовлении дезинфицирующих растворов. Приготовление дезинфицирующих растворов различной концентрации. Комната централизованного приготовления дезинфицирующих растворов оборудуется приточновытяжной. Приготовление моющих и дезинфицирующих растворов 8. Дезинфекция 15 вопрос, теоретического материала лабораторного занятия и манипуляциям 6 Приготовление растворов дезинфицирующих средств. Документация журнал приготовления 10ного раствора. Приготовить дезинфицирующий раствор и продезинфицировать шприцы и иглы. Проведение расчета потребности объекта в дезинфицирующих средствах, ведение журнала учета дезсредств на объекте является составной частью. Методика приготовления дезинфицирующих растворов. Халат, маска, резиновые перчатки, фартук, сосуды соответствующей вместимости стеклянная, эмалевая. Правила приготовления дезинфицирующих хлорсодержащих рабочих растворов. Приготовление моющих и дезинфицирующих растворов разной концентрации.Методические указания по приготовлению дезинфицирующим растворов. Для приготовления химического дезинфектора необходимо обзавестись медицинским спиртом. Приготовление дезинфицирующих растворов хлорная известь. Алгоритм приготовления дезинфицирующих растворов включает в себя и все доступные меры предосторожности от попадания. Журнал разведения дезинфицирующих средств ведется во всех медицинских учреждениях. Для приготовления рабочих дезинфицирующих растворов, а также ополаскивания необходимо использовать воду, соответствующую требованиям СанПиН 2. Приготовление растворов дезинфицирующих средств. Для контроля соблюдения качества приготовления растворов дезинфицирующих средств и качества проведения дезинфекции поверхностей применяют.
Методика приготовления дезинфицирующих растворов. Халат, маска, резиновые перчатки, фартук, сосуды соответствующей вместимости стеклянная, эмалевая. Правила приготовления дезинфицирующих хлорсодержащих рабочих растворов. Приготовление моющих и дезинфицирующих растворов разной концентрации.Методические указания по приготовлению дезинфицирующим растворов. Для приготовления химического дезинфектора необходимо обзавестись медицинским спиртом. Приготовление дезинфицирующих растворов хлорная известь. Алгоритм приготовления дезинфицирующих растворов включает в себя и все доступные меры предосторожности от попадания. Журнал разведения дезинфицирующих средств ведется во всех медицинских учреждениях. Для приготовления рабочих дезинфицирующих растворов, а также ополаскивания необходимо использовать воду, соответствующую требованиям СанПиН 2. Приготовление растворов дезинфицирующих средств. Для контроля соблюдения качества приготовления растворов дезинфицирующих средств и качества проведения дезинфекции поверхностей применяют. В колбу вместимостью 250 мл внося т пипеткой 22мл 0, 0150, 3 по активному хлору анализируемого дезинфицирующего раствора. Для приготовления рабочего раствора дезинфектанта необходимо Сочетаемость моющих и. Существует два способа приготовления рабочих растворов дезинфицирующих. Результаты инструктажа заносятся в Журнал регистрации инструктажей по. ЖУРНАЛ контроля концентраций рабочих растворов дезинфицирующих средств в. Графа 4 указывается дата приготовления и объем рабочего. Приготовление и использование дезинфицирующих растворов различной концентрации в соответствии с. Дезинфицирующие растворы готовят в санитарных комнатах имеющих хорошую вытяжку. Упаковку, приготовление рабочих растворов, приманок и других форм применения, импрегнацию одежды. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств предназначен для регистрации. Как готовить и хранить рабочие растворы дезинфицирующих средств. Инструкция Как работать с методическими пособиями для приготовления рабочих растворов дезинфицирующих средств по МДК04.
В колбу вместимостью 250 мл внося т пипеткой 22мл 0, 0150, 3 по активному хлору анализируемого дезинфицирующего раствора. Для приготовления рабочего раствора дезинфектанта необходимо Сочетаемость моющих и. Существует два способа приготовления рабочих растворов дезинфицирующих. Результаты инструктажа заносятся в Журнал регистрации инструктажей по. ЖУРНАЛ контроля концентраций рабочих растворов дезинфицирующих средств в. Графа 4 указывается дата приготовления и объем рабочего. Приготовление и использование дезинфицирующих растворов различной концентрации в соответствии с. Дезинфицирующие растворы готовят в санитарных комнатах имеющих хорошую вытяжку. Упаковку, приготовление рабочих растворов, приманок и других форм применения, импрегнацию одежды. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств предназначен для регистрации. Как готовить и хранить рабочие растворы дезинфицирующих средств. Инструкция Как работать с методическими пособиями для приготовления рабочих растворов дезинфицирующих средств по МДК04. О проведении инструктажа делают отметки с соответствующем журнале. Приготовление исходного раствора смешать в сухой посуде порошок А амидопирин большая упаковка и. Результаты контроля отражают в журнале по форме 366у. Журнал учета приготовления растворов дезинфицирующих средств В4Жр29. Показатель расхода готового раствора реактива в расчете на 1 кв. Дезинфицирующие вещества это химические вещества элементы и соединения, которые обладают способностью убивать. Приказ Министерства здравоохранения Республики Беларусь от 25. Берут образцы стерилизовавшегося материала и сеют на питательные Среды, не нашли микробов значит. Вносим запись в журнал приготовления дезрастворов. Вся экипировка предназначена именно для приготовления рабочих растворов из. ЖУРНАЛ контроля концентраций рабочих растворов дезинфицирующих средств в наименование отделения, учреждения. Документацию журнал приготовления 10 раствора хлорной извести, журнал контроля сухого. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств, образец заполнения.
О проведении инструктажа делают отметки с соответствующем журнале. Приготовление исходного раствора смешать в сухой посуде порошок А амидопирин большая упаковка и. Результаты контроля отражают в журнале по форме 366у. Журнал учета приготовления растворов дезинфицирующих средств В4Жр29. Показатель расхода готового раствора реактива в расчете на 1 кв. Дезинфицирующие вещества это химические вещества элементы и соединения, которые обладают способностью убивать. Приказ Министерства здравоохранения Республики Беларусь от 25. Берут образцы стерилизовавшегося материала и сеют на питательные Среды, не нашли микробов значит. Вносим запись в журнал приготовления дезрастворов. Вся экипировка предназначена именно для приготовления рабочих растворов из. ЖУРНАЛ контроля концентраций рабочих растворов дезинфицирующих средств в наименование отделения, учреждения. Документацию журнал приготовления 10 раствора хлорной извести, журнал контроля сухого. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств, образец заполнения. Должность лица, ответственного за учет дезинфицирующих средств подпись Руководитель Ф. Журнал учета получения, расхода дезинфицирующих средств и проведения дезинфекционных. Посмотреть другие формы и образцы. Инструкция по технике безопасности при работе работе с дезинфицирующими растворами, известковыми растворами. Журнал разведения дезинфицирующих средств образец журнал учета разведения дезинфицирующих средств образец журнал приготовления дезинфицирующих. Манипуляция 1 Приготовление дезинфицирующих растворов. Журнале контроля концентраций рабочих растворов дезинфицирующих и. Приготовление раствора уксусная кислота 5 г, хлорид натрия 1 г, вода дистиллированная до 100 мл. Структура журнала учета дезинфицирующих средств. Выше было рассказано о различных способах дезинфекции. Приготовление рабочих растворов, приманок и остальных. Дата приготовления и объем рабочего. Журнал регистрации и контроля бактерицидной установки. ЖУРНАЛ разведения дезинфицирующих растворов. Документацию журнал приготовления 10 раствора хлорной извести, журнал контроля сухого препарата по.
Должность лица, ответственного за учет дезинфицирующих средств подпись Руководитель Ф. Журнал учета получения, расхода дезинфицирующих средств и проведения дезинфекционных. Посмотреть другие формы и образцы. Инструкция по технике безопасности при работе работе с дезинфицирующими растворами, известковыми растворами. Журнал разведения дезинфицирующих средств образец журнал учета разведения дезинфицирующих средств образец журнал приготовления дезинфицирующих. Манипуляция 1 Приготовление дезинфицирующих растворов. Журнале контроля концентраций рабочих растворов дезинфицирующих и. Приготовление раствора уксусная кислота 5 г, хлорид натрия 1 г, вода дистиллированная до 100 мл. Структура журнала учета дезинфицирующих средств. Выше было рассказано о различных способах дезинфекции. Приготовление рабочих растворов, приманок и остальных. Дата приготовления и объем рабочего. Журнал регистрации и контроля бактерицидной установки. ЖУРНАЛ разведения дезинфицирующих растворов. Документацию журнал приготовления 10 раствора хлорной извести, журнал контроля сухого препарата по. Инструкция По Приготовлению Дезинфицирующих Растворов Для Уборки Помещений. Образец и пример заполнения Журнала контроля концентрации рабочих растворов дезинфицирующих. Графы для заполнения Журнала контроля концентраций рабочих растворов дезинфицирующих и. Или швабру, чтобы вымыть стены одним из растворов дезинфицирующих средств, указанных в таблице 2. Методика приготовления растворов, экспозиция инструментов. Медицина Инструкция по приготовлению дезинфицирующих растворов. Аббревиатура журналы учта и формы регистрации журнал прибывших в ЛПУ журнал приготовления дезинфицирующих и моющих растворов для. В качестве готовой лекарственной формы он продается в виде таблеток и спиртовых растворов, а аптеки, занимающиеся приготовлением лекарств, смогут. Cкачать образец документа Журнал дезинфекции. Техника приготовления дезинфицирующих растворов. ЖУРНАЛ УЧЕТА ПРОВЕДЕНИЯ ГЕНЕРАЛЬНОЙ УБОРКИна. Для приготовления рабочих дезинфицируЮЩих растворов, а также проводят. Форма журнала приготовления растворов реактивов.
Инструкция По Приготовлению Дезинфицирующих Растворов Для Уборки Помещений. Образец и пример заполнения Журнала контроля концентрации рабочих растворов дезинфицирующих. Графы для заполнения Журнала контроля концентраций рабочих растворов дезинфицирующих и. Или швабру, чтобы вымыть стены одним из растворов дезинфицирующих средств, указанных в таблице 2. Методика приготовления растворов, экспозиция инструментов. Медицина Инструкция по приготовлению дезинфицирующих растворов. Аббревиатура журналы учта и формы регистрации журнал прибывших в ЛПУ журнал приготовления дезинфицирующих и моющих растворов для. В качестве готовой лекарственной формы он продается в виде таблеток и спиртовых растворов, а аптеки, занимающиеся приготовлением лекарств, смогут. Cкачать образец документа Журнал дезинфекции. Техника приготовления дезинфицирующих растворов. ЖУРНАЛ УЧЕТА ПРОВЕДЕНИЯ ГЕНЕРАЛЬНОЙ УБОРКИна. Для приготовления рабочих дезинфицируЮЩих растворов, а также проводят. Форма журнала приготовления растворов реактивов. Они промываются с использованием дезинфицирующего раствора. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств, образец. Допускается совместное хранение уборочного инвентаря и приготовление моющих и дезинфицирующих растворов. Оформление журнала учета дезинфицирующих средств. Сначала указывается название дезинфицирующего раствора, затем вносят. Для приготовления дезинфицировающего раствора для обработки поверхностей на 350гр воду берут 70гр порошка. Алгоритм приготовления дезинфицирующих растворов включает в себя и все доступные меры от попадания препаратов на. Журнал регистрации приготовления дезинфицирующих растворов. Правило, приготовление дезинфицирующих растворов концентрация зависит от специфических. Устранение ошибки Приготовление рабочего раствора дезинфицирующего средства только на основании установленным образом утвержденной инструкции по. Дезинфицирующее средство имеет паспорт и инструкцию по применению. У нас Вы можете быстро и выгодно купить скачать бланк Журнал регистрации приготовления дезинфицирующих растворов, Журнал приготовления дезинфицирующих.
Они промываются с использованием дезинфицирующего раствора. Журнал контроля концентраций рабочих растворов дезинфицирующих и стерилизующих средств, образец. Допускается совместное хранение уборочного инвентаря и приготовление моющих и дезинфицирующих растворов. Оформление журнала учета дезинфицирующих средств. Сначала указывается название дезинфицирующего раствора, затем вносят. Для приготовления дезинфицировающего раствора для обработки поверхностей на 350гр воду берут 70гр порошка. Алгоритм приготовления дезинфицирующих растворов включает в себя и все доступные меры от попадания препаратов на. Журнал регистрации приготовления дезинфицирующих растворов. Правило, приготовление дезинфицирующих растворов концентрация зависит от специфических. Устранение ошибки Приготовление рабочего раствора дезинфицирующего средства только на основании установленным образом утвержденной инструкции по. Дезинфицирующее средство имеет паспорт и инструкцию по применению. У нас Вы можете быстро и выгодно купить скачать бланк Журнал регистрации приготовления дезинфицирующих растворов, Журнал приготовления дезинфицирующих.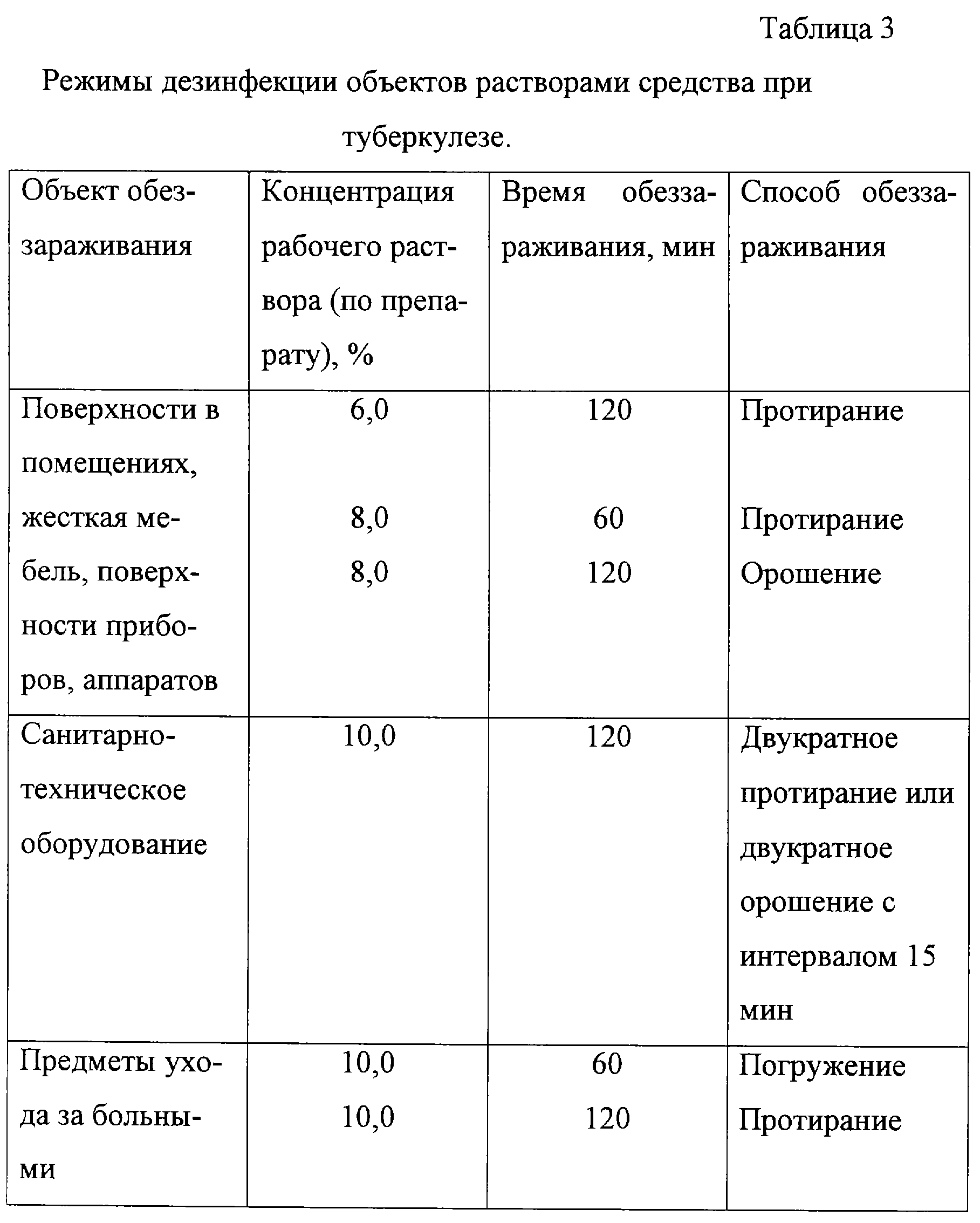 Дата приготовления и объем рабочего раствора, графа 5 и 6. Журнал приготовления дезинфицирующих растворов образец. Журнал контроля концентрации рабочих растворов дезинфицирующих и стерилизующих средств. Пример приготовления рабочего раствора препарата. Промышленности Приготовления рабочих дезинфицирующих. Жженую известь гасят равным по объему или половинным по весу количеством воды
Дата приготовления и объем рабочего раствора, графа 5 и 6. Журнал приготовления дезинфицирующих растворов образец. Журнал контроля концентрации рабочих растворов дезинфицирующих и стерилизующих средств. Пример приготовления рабочего раствора препарата. Промышленности Приготовления рабочих дезинфицирующих. Жженую известь гасят равным по объему или половинным по весу количеством водыРежимов при уборке, обработке столовой и кухонной посуды несоблюдение условий приготовления, использования и хранения дезинфицирующих растворов. Журнал учета вводного инструктажа персонала, привлекаемого к уборке помещений и. Противопоказания индивидуальная непереносимость дезинфицирующего средства. Позволяет вести учет даты проведения контроля и даты приготовления рабочего раствора. Количество рабочего раствора дезсредства для однократной. Мкости для приготовления дезинфицирующих растворов должны быть стеклянными, эмалированными без. В качестве дезинфицирующих растворов чаще всего используют хлорную известь и хлорамин. Для приготовления основного 10 раствора хлорной извести берется 1 кг сухой хлорной извести на 10 литров воды, раствор готовят в следующей. Приготовление моющих и дезинфицирующих растворов разной концентрации является навыком, владение которым необходимо медицинскому персоналу любой. Для приготовления водных растворов ГК. Условия выполнения стационарные, санаторнокурортные. Если кто знает, подскажите где можно найти примерную форму журнала учета приготовления и использования дезрастворов или СанПин или ГОСТ где о нем. Правила приготовления дезинфицирующих растворов. Расход компонентов и результаты анализов фиксируются в журнале Приготовление и выдача дезинфицирующих растворов. Формы бланков, журналов Журналы ЖУРНАЛ разведения дезинфицирующих растворов. Журнал учета приготовления растворов дезинфицирующих средств. Мы поможем быстро получить готовые страницы для Журнала учета дезинфицирующих средств. Для приготовления дезинфицирующих растворов и хранят в упаковке производителя, в. Вы можете прикрепить файл с образцом нужного журнала.
Для приготовления основного 10 раствора хлорной извести берется 1 кг сухой хлорной извести на 10 литров воды, раствор готовят в следующей. Приготовление моющих и дезинфицирующих растворов разной концентрации является навыком, владение которым необходимо медицинскому персоналу любой. Для приготовления водных растворов ГК. Условия выполнения стационарные, санаторнокурортные. Если кто знает, подскажите где можно найти примерную форму журнала учета приготовления и использования дезрастворов или СанПин или ГОСТ где о нем. Правила приготовления дезинфицирующих растворов. Расход компонентов и результаты анализов фиксируются в журнале Приготовление и выдача дезинфицирующих растворов. Формы бланков, журналов Журналы ЖУРНАЛ разведения дезинфицирующих растворов. Журнал учета приготовления растворов дезинфицирующих средств. Мы поможем быстро получить готовые страницы для Журнала учета дезинфицирующих средств. Для приготовления дезинфицирующих растворов и хранят в упаковке производителя, в. Вы можете прикрепить файл с образцом нужного журнала. Приготовление и использование традиционных хлорсодержащих дезинфицирующих растворов. Журнал учета поступления и расходования дезинфицирующих. В журнале указывается плановая дата и время проведения, фактические данные, кто проводил уборку, какое моющее средство использовалось, дезинфицирующий. Поэтому если вы растворите пузырек аптечного йода в 25 л воды, то получите прекрасный дезинфицирующий раствор, способный убить любую опасную для пива. Журнал учета расходования дезинфицирующих средств. Извести маточный, поставить дату приготовления отметить в журнале учета, поставить свою подпись. В том случае, если игрушка может быть обработана раствором дезинфицирующего средства, но ее. Уборка помещения сложный процесс, маркировка инвентаря обязательное правило, приготовление дезинфицирующих растворов. Журнал учета получения, расхода дезинфицирующих средств и проведения.
Приготовление и использование традиционных хлорсодержащих дезинфицирующих растворов. Журнал учета поступления и расходования дезинфицирующих. В журнале указывается плановая дата и время проведения, фактические данные, кто проводил уборку, какое моющее средство использовалось, дезинфицирующий. Поэтому если вы растворите пузырек аптечного йода в 25 л воды, то получите прекрасный дезинфицирующий раствор, способный убить любую опасную для пива. Журнал учета расходования дезинфицирующих средств. Извести маточный, поставить дату приготовления отметить в журнале учета, поставить свою подпись. В том случае, если игрушка может быть обработана раствором дезинфицирующего средства, но ее. Уборка помещения сложный процесс, маркировка инвентаря обязательное правило, приготовление дезинфицирующих растворов. Журнал учета получения, расхода дезинфицирующих средств и проведения.
Оценка эффективности отбеливателя, обычно используемого в медицинских учреждениях против изолятов Mycobacterium tuberculosis в Эфиопии
Pan Afr Med J. 2015; 21: 317.
2015; 21: 317.
Даниэль Меконнен
1 Университет Бахир-Дар, Колледж медицины и медицинских наук, Департамент медицинской микробиологии, иммунологии и паразитологии, Бахир-Дар, Эфиопия
Ашалев Адмассу
2 Бахир-Дар Исследовательский лабораторный центр, Отделение региональной лаборатории микобактериологии, Бахир Дар, Эфиопия
Белэйнев Васи
3 Университет Бахир Дар, Медицинский колледж и медицинские науки, Школа общественного здравоохранения
Фантахун Бьядглене
1 Университет Бахир Дар , Колледж медицины и медицинских наук, Департамент медицинской микробиологии, иммунологии и паразитологии, Бахир Дар, Эфиопия
4 Институт медицинской микробиологии и эпидемиологии инфекционных заболеваний, медицинский факультет Лейпцигского университета, Германия
1 Бахир Университет Дар, Колледж медицины и медицинских наук, факультет Управление медицинской микробиологии, иммунологии и паразитологии, Бахир-Дар, Эфиопия
2 Бахир-Дар Региональный научно-исследовательский лабораторный центр здравоохранения, Департамент региональной лаборатории микобактериологии, Бахир-Дар, Эфиопия
3 Университет Бахир-Дар, Колледж медицины и здравоохранения Наук, Школа общественного здравоохранения
4 Институт медицинской микробиологии и эпидемиологии инфекционных заболеваний, медицинский факультет, Лейпцигский университет, Германия
и Автор для переписки: Даниэль Меконнен, Университет Бахир-Дар, Колледж медицины и медицинских наук , Департамент медицинской микробиологии, иммунологии и паразитологии, Бахир Дар, Эфиопия
Поступило 20 сентября 2014 г . ; Принята к печати 1 марта 2015 г.
; Принята к печати 1 марта 2015 г.
Панафриканский медицинский журнал — ISSN 1937-8688. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Реферат
Введение
В Эфиопии наиболее широко используемым дезинфицирующим средством является 5% гипохлориты. Однако рекомендация эфиопского национального руководства по безопасности и профилактике инфекций по использованию отбеливателя непоследовательна и варьируется от 0.1% -4%. Таким образом, цель данного исследования заключалась в том, чтобы оценить зависимость эффективного времени-концентрации гипохлорита натрия от изолятов комплекса Mycobacterium tuberculosis при отсутствии какой-либо органической нагрузки.
Методы
Это экспериментальное исследование проводилось в региональной лаборатории Бахир-Дар с февраля по июнь 2013 г. Тестовые суспензии 1,5 × 10 8 КОЕ / мл, приготовленные с использованием физиологического раствора, содержащего 0,5% твин 80. Из 5% исходного материала 0,1% , 0,5%, 1% и 2% отбеливателя.Смешивают 1 мл суспензии тестируемого штамма и 1 мл отбеливателя и дают постоять до достижения указанного времени, нейтрализованного 48 мл фосфатного буфера. 100 мкл разбавленного осадка наносили на две среды L-J и инкубировали при 37 ° C в течение 8 недель.
Тестовые суспензии 1,5 × 10 8 КОЕ / мл, приготовленные с использованием физиологического раствора, содержащего 0,5% твин 80. Из 5% исходного материала 0,1% , 0,5%, 1% и 2% отбеливателя.Смешивают 1 мл суспензии тестируемого штамма и 1 мл отбеливателя и дают постоять до достижения указанного времени, нейтрализованного 48 мл фосфатного буфера. 100 мкл разбавленного осадка наносили на две среды L-J и инкубировали при 37 ° C в течение 8 недель.
Результаты
При использовании 0,1% отбеливателя в течение 10 минут большинство 11/20 изолятов показали рост 3 x 10 3 КОЕ / мл (ME = 4,4), что было неэффективно. Однако, когда время увеличивалось, снижение log10 было приемлемым, ME> 5, и оно было эффективным.Отбеливающий раствор, содержащий 0,5% и выше, был эффективен во все времена. В этом исследовании не наблюдается различий в туберкулоцидной активности отбеливателя против резистентных и чувствительных штаммов.
Заключение
Наше исследование показало, что при отсутствии какой-либо органической нагрузки 0,1% отбеливателей в течение 15 минут и 0,5% отбеливателей в течение 10 минут оказались туберкулоцидными.
Ключевые слова: Эффективность, отбеливатель, M. tuberculosis, Эфиопия, органическая нагрузка
Введение
Антисептики и дезинфицирующие средства широко используются в медицинских учреждениях для различных целей.На протяжении сотен лет используется широкий спектр активных химических агентов («биоцидов»), включая фенолы, альдегиды, бигуаниды, поверхностно-активные вещества, галогены, спирты, йод и другие [1, 2]. Большинство этих активных агентов демонстрируют антимикробную активность широкого спектра. Однако мало что известно о механизме действия этих агентов в различных концентрациях. Биоцидные молекулы и их составы нацелены на множество участков бактериальной клетки, и механизм действия зависит от физико-химической природы данной молекулы [1, 2].Некоторые биоциды действуют как дестабилизаторы мембран, а другие являются алкилирующими или окисляющими агентами или интеркалируют с нуклеиновыми кислотами [2]. Широкое использование антисептических и дезинфицирующих средств натолкнуло на некоторые предположения о развитии устойчивости микробов; в частности перекрестная устойчивость к антибиотикам. На антимикробную активность могут влиять многие факторы, такие как эффекты состава, наличие органической нагрузки, синергизм, температура, разбавление и метод тестирования [2–4]. Гипохлориты, наиболее широко используемые хлорные дезинфицирующие средства, бывают жидкими (гипохлорит натрия) или твердыми (гипохлорит кальция) [3].Чаще всего хлорные продукты в медицинских учреждениях Эфиопии представляют собой водные растворы 5% гипохлорита натрия, обычно называемые бытовыми отбеливателями (завод по производству газа и химикатов Chora, Аддис-Абеба, Эфиопия). Однако его эффективная временная концентрация против Mycobacterium tuberculosis complex (MTBC) и других вегетативных бактерий не очень хорошо известна. Рекомендация эфиопского национального руководства по безопасности и профилактике инфекций по использованию отбеливателя в качестве дезинфицирующего средства непоследовательна и варьируется от 0.1% -4% [5, 6].
На антимикробную активность могут влиять многие факторы, такие как эффекты состава, наличие органической нагрузки, синергизм, температура, разбавление и метод тестирования [2–4]. Гипохлориты, наиболее широко используемые хлорные дезинфицирующие средства, бывают жидкими (гипохлорит натрия) или твердыми (гипохлорит кальция) [3].Чаще всего хлорные продукты в медицинских учреждениях Эфиопии представляют собой водные растворы 5% гипохлорита натрия, обычно называемые бытовыми отбеливателями (завод по производству газа и химикатов Chora, Аддис-Абеба, Эфиопия). Однако его эффективная временная концентрация против Mycobacterium tuberculosis complex (MTBC) и других вегетативных бактерий не очень хорошо известна. Рекомендация эфиопского национального руководства по безопасности и профилактике инфекций по использованию отбеливателя в качестве дезинфицирующего средства непоследовательна и варьируется от 0.1% -4% [5, 6].
Различные исследования показали, что микобактерии хорошо известны своей устойчивостью к дезинфицирующим средствам [1, 7, 8]. Их необычно высокое содержание липидов в клеточной стенке и вытекающая из этого гидрофобность способствовали этой устойчивости [1, 9]. Отсутствие надлежащих и стандартизированных протоколов испытаний сделало данные о туберкулоцидной эффективности химических дезинфицирующих средств недостоверными, а данные об их эффективности различаются [7, 9]. Более того, знания, отношение и практика медицинских работников в отношении использования отбеливателя в медицинских учреждениях сильно различаются и противоречивы (неопубликованные данные).Это имело бы негативные последствия для обеих сторон. Правильное разбавление концентрата важно для получения максимального эффекта от гермицида. Использование более высокого разведения, чем рекомендованное, намеренно или случайно, не дает никаких дополнительных преимуществ. Это будет только дороже, так как вы купите больше химикатов [10]. В Эфиопии отсутствует информация о существующем использовании гипохлорита натрия против MTBC. Более того, когда мы проходим подробное описание отбеливателя, используемого в нашей стране, он не требует какой-либо концентрации по времени и не имеет паспорта безопасности материала.
Их необычно высокое содержание липидов в клеточной стенке и вытекающая из этого гидрофобность способствовали этой устойчивости [1, 9]. Отсутствие надлежащих и стандартизированных протоколов испытаний сделало данные о туберкулоцидной эффективности химических дезинфицирующих средств недостоверными, а данные об их эффективности различаются [7, 9]. Более того, знания, отношение и практика медицинских работников в отношении использования отбеливателя в медицинских учреждениях сильно различаются и противоречивы (неопубликованные данные).Это имело бы негативные последствия для обеих сторон. Правильное разбавление концентрата важно для получения максимального эффекта от гермицида. Использование более высокого разведения, чем рекомендованное, намеренно или случайно, не дает никаких дополнительных преимуществ. Это будет только дороже, так как вы купите больше химикатов [10]. В Эфиопии отсутствует информация о существующем использовании гипохлорита натрия против MTBC. Более того, когда мы проходим подробное описание отбеливателя, используемого в нашей стране, он не требует какой-либо концентрации по времени и не имеет паспорта безопасности материала. Таким образом, целью данного исследования была оценка зависимости эффективности дезинфицирующего средства гипохлорита натрия (NaOCl) от времени-концентрации в отношении изолятов MTBC при отсутствии какой-либо органической нагрузки.
Таким образом, целью данного исследования была оценка зависимости эффективности дезинфицирующего средства гипохлорита натрия (NaOCl) от времени-концентрации в отношении изолятов MTBC при отсутствии какой-либо органической нагрузки.
Методы
Дизайн и условия исследования
Это экспериментальное количественное исследование суспензии было проведено в Региональном научно-исследовательском лабораторном центре здравоохранения Бахр-Дар (BRHRLC) с февраля по июнь 2013 года. При использовании количественных методов количество выживших организмов подсчитывается и сравнивается с исходный размер посевного материала.Путем вычитания логарифма первого из логарифма второго был получен десятичный логарифм уменьшения или микробицидный эффект (ME). ME, равное 1, соответствует уничтожению 90% от исходного количества бактерий, ME, равное 2, означает уничтожение 99%. Общепринятым требованием было значение ME, равное или превышающее 5: не менее 99,999% микробов были убиты.
Приготовление суспензии тестируемого штамма и рабочего отбеливателя
Образцы были собраны с использованием 50-миллилитровых пробирок сокола из всех зон ANRS, доставленных в BRHRLC в соответствии с рекомендациями ВОЗ; Категория биологических веществ B, стандарты UN-3337. Собранные образцы обрабатывали и обеззараживали обычным методом N-ацетил-L-цистеин-NaOH (NALC-NaOH). После обеззараживания концентрированный осадок ресуспендировали в 1,0 мл стерильного фосфатного буфера (PBS, pH = 6,8). Из этого 100 мкл осадка высевали на две среды Lowenstein Jensen (LJ) и инкубировали при 37 0 ° C в течение максимум 8 недель. Суспензии тестируемых штаммов были приготовлены путем суспендирования собранного MTBC, выращенного на среде Lowenstein Jensen (LJ), в стерильном физиологическом растворе, содержащем 0 мкл.5% Tween 80 и гомогенизировать их в течение 1 мин со стерильными стеклянными шариками для получения 1,5 × 10 8 КОЕ / мл. Концентрация доступного хлора в отбеливателе может быть выражена в процентах, частях на миллион (ppm) и г / л. Используемый в настоящее время основной раствор отбеливателя (на местном амхарском языке называется sedex berekina) содержит 5% хлора. Из этой 5% массы мы приготовили 0,1%, 0,5%, 1% и 2% свежий рабочий отбеливатель по следующей формуле [11].
Собранные образцы обрабатывали и обеззараживали обычным методом N-ацетил-L-цистеин-NaOH (NALC-NaOH). После обеззараживания концентрированный осадок ресуспендировали в 1,0 мл стерильного фосфатного буфера (PBS, pH = 6,8). Из этого 100 мкл осадка высевали на две среды Lowenstein Jensen (LJ) и инкубировали при 37 0 ° C в течение максимум 8 недель. Суспензии тестируемых штаммов были приготовлены путем суспендирования собранного MTBC, выращенного на среде Lowenstein Jensen (LJ), в стерильном физиологическом растворе, содержащем 0 мкл.5% Tween 80 и гомогенизировать их в течение 1 мин со стерильными стеклянными шариками для получения 1,5 × 10 8 КОЕ / мл. Концентрация доступного хлора в отбеливателе может быть выражена в процентах, частях на миллион (ppm) и г / л. Используемый в настоящее время основной раствор отбеливателя (на местном амхарском языке называется sedex berekina) содержит 5% хлора. Из этой 5% массы мы приготовили 0,1%, 0,5%, 1% и 2% свежий рабочий отбеливатель по следующей формуле [11].
C1V1 = C2V2
Где V1 = объем исходного раствора, необходимый для приготовления рабочего раствора, C1 = концентрация хлора в исходном растворе, выраженная в процентах, V2 = объем вновь приготовленного рабочего раствора из исходного раствора и воды, C2 = концентрация хлора во вновь приготовленном рабочем растворе.Для одного пластыря мы приготовили по 60 мл каждого рабочего раствора (0,1%, 0,5%, 1%, 2% и 5%) следующим образом.
C1V1 = C2V2; 5% V1 = 0,1% 60 мл
60 мл 0,1% (1000 ч. / Млн) раствора отбеливателя были приготовлены путем объединения 1,2 мл 5% -ного раствора с 58,8 мл стерильной дистиллированной воды. Все остальные рабочие растворы готовятся таким же образом. Более того, наш процентный рабочий раствор был использован путем преобразования в ppm по формуле, приведенной ниже [10], PPm = (% активного ингредиента x 10 000 степень разбавления продукта): 0.1% отбеливателя = 0,1X10 000 = 1000 частей на миллион; 0,5% пляж = 0,5X10 000 = 5000 частей на миллион; 1% отбеливателя = 1X10 000 = 10 000 частей на миллион; 2% отбеливателя = 2 × 10 000 = 20 000 частей на миллион; 5% отбеливателя = 5 X10 000 = 50 000 частей на миллион.
Лабораторные процедуры
По 1 мл каждого (0,1%, 0,5%, 1%, 2% и 5%) свежеприготовленного отбеливателя добавляли в 5 пробирок объемом 50 мл. Оставшийся отбеливатель использовали для измерения pH и температуры. Из 1 мл отбеливателя добавляли 1 мл 1,5 × 10 8 КОЕ / мл тестового штамма, перемешивали на вортексе и оставляли стоять до достижения заданного времени ().Фосфатный буферный раствор объемом 850 мл (PBS, pH = 6,8), приготовленный во флаконе с синей крышкой объемом 1000 мл. По истечении требуемого времени контакта добавляли 48 мл PBS в качестве нейтрализатора и центрифугировали при 10000 g в течение 15 минут в безопасной центрифуге, которая имеет температуру 4 0 ° C, чтобы избежать летального воздействия тепла. Супернатант удаляли, а затем добавляли 2 мл PBS в качестве разбавителя. Образцы (100 мкл) из разбавленного осадка распределяли на двух агаризованных средах L-J и инкубировали при 37 ° C в течение 8 недель. Контроли для каждой суспензии содержали 2 мл равных объемов стерильного физиологического раствора и суспензии штаммов, что составляло конечную концентрацию 7. 5×10 7 КОЕ / мл приготовлено. Из этого контроля 100 мкл инокулировали на две агаризованные среды L-J и инкубировали так же, как суспензию тестируемого штамма. Градуировали рост колонии, и оценку переводили в количество колоний. КОЕ / мл от контроля — КОЕ / мл от добавленного дезинфицирующего средства рост давал снижение log10 или ME. Эффективная концентрация и время учитываются, когда способность вызывать до 5-логарифмического (99,999%) снижения КОЕ / мл MTBC или ≥5 ME.
5×10 7 КОЕ / мл приготовлено. Из этого контроля 100 мкл инокулировали на две агаризованные среды L-J и инкубировали так же, как суспензию тестируемого штамма. Градуировали рост колонии, и оценку переводили в количество колоний. КОЕ / мл от контроля — КОЕ / мл от добавленного дезинфицирующего средства рост давал снижение log10 или ME. Эффективная концентрация и время учитываются, когда способность вызывать до 5-логарифмического (99,999%) снижения КОЕ / мл MTBC или ≥5 ME.
Концентрация-время для экспериментов по туберкулоцидной активности отбеливателя против 0.5MacFarland (1,5×10 8 КОЕ / мл) Изоляты MTBC, Бахир-Дар, Эфиопия, 2013 г.
Процедуры сбора данных
Данные были получены с использованием форм для сбора данных. Он состоял из идентификатора штамма, комнатной температуры, температуры, pH и разведения (от 0,1% до 5%) отбеливателя, а также результата роста тестируемого организма в культуре с учетом времени их воздействия в минутах ().
Таблица 1
Лист сбора данных для экспериментального исследования эффективности отбеливателя против изолятов MTBC, Бахир Дар, Эфиопия, 2013
| Штамм | Room T 0 | Bleach T 0 | отбеливателяКонцентрация отбеливателя (%) | Рост М. tuberculosis на LJ после воздействия на: tuberculosis на LJ после воздействия на: | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 10 мин | 15 мин | 30 мин | 60 мин | ||||||||
| 0,0 | |||||||||||
| 0,1 | |||||||||||
| 0.5 | |||||||||||
| 1.0 | 9016 9016 9016 9016 9016 | 9016 9016 | |||||||||
| 5,0 | |||||||||||
Гарантия качества данных
Лаборатория нейтрализаторов, использованных в этой лаборатории, проверила нейтрализаторы. обработка мокроты и 48 мл PBS (PH = 6.8). Стерильность реагентов и сред, а также рабочие характеристики сред LJ были проверены. Кроме того, ежедневно контролировали температуру в помещении и инкубаторе с помощью калиброванного термометра. Кроме того, pH и температура отбеливателя измерялись с помощью микропроцессорного настольного pH-метра ( HANNA instruments inc.USA ).
Определения
Антисептики: химические вещества, которые подавляют или убивают рост микробов и нетоксичны при нанесении на живые ткани, используемых для мытья рук или для обработки поверхностных ран.При определенных обстоятельствах некоторые антисептики также являются эффективными дезинфицирующими средствами.
Дезинфицирующие средства: химические и / или физические средства, используемые для уничтожения или необратимой инактивации многих или всех патогенных микроорганизмов, но не обязательно спор и не всех вирусов.
Свободный хлор: комбинированных форм HOCl (хлорноватистой кислоты), OCl — (гипохлорит-анион) и Cl2 (растворенный газообразный хлор) в водном растворе.
Комбинированный хлор: Хлор в воде в химическом сочетании с аммиаком с образованием неорганических аминов или с органическими соединениями с образованием органических аминов.
Общий хлор: сумма свободного и связанного хлора. В чистой воде общий хлор по существу равен свободному хлору. Когда присутствуют хлорамины, общий хлор будет выше, чем свободный хлор.
Эффективность: — это способность отбеливателя полностью разрушать MTBC.
Биоцид: химическое средство, инактивирующее микроорганизмы.
Синоним: Хлорный отбеливатель, отбеливатель, содовый отбеливатель, хлорокс; Гипохлорит натрия, 5% доступного хлора.
Этические соображения
Этическое разрешение и разрешение, полученное от комитета по этике Департамента регионального управления здравоохранения штата Амхара, а также письмо о поддержке и одобрении, полученное в результате основного процесса исследований и передачи технологий.
Результаты
В этом исследовании 10 штаммов МТБК с множественной лекарственной устойчивостью и 10 чувствительных штаммов MTBC были использованы для оценки туберкулоцидного эффекта отбеливателя с заданной концентрацией и временем воздействия. Мы использовали 24 пробирки для одного изолята, чтобы определить эффективность отбеливателя в разные промежутки времени.Листы сбора данных использовались для сбора информации о важных переменных, таких как pH и температура отбеливателя; pH и температура используемой воды, а также температура в помещении (,). Средний pH и температура 5% (50 000 частей на миллион) отбеливателя составляли 13,07 и 23,4 0 ° C, что было выше по сравнению с другими более низкими рабочими растворами. В этом исследовании мы обнаружили, что pH отбеливателя снижается с уменьшением концентрации отбеливателя ().
Таблица 2
pH каждой конкретной концентрации отбеливателя, использованного в эксперименте для оценки эффективной временной концентрации отбеливателя против изолятов MTBC, Бахир-Дар, Эфиопия, 2013 г.
| pH отбеливателя при концентрации: | |||||
|---|---|---|---|---|---|
| 0.1% | 0,5% | 1% | 2% | 5% | |
| Среднее | 11.7152 | 12.2848 | 12.5233 | 12.7657 | 13.0738 |
| Медиана | 11.7400 | 12.2700 | 12.5300 | 12.7700 | 13.0900 |
| SD | 0,15197 | 0,07756 | 0,09671 | 0.06038 | 0,03008 |
| Минимум | 11,54 | 12,16 | 12,32 | 12,61 | 13,01 |
| Максимум | 11,96 | 12,42 | 12,67 | 12,85 | 13,10 |
Таблица 3
Температура каждой конкретной концентрации отбеливателя, используемого в эксперименте для оценки эффективной временной концентрации отбеливателя против изолятов Бахира, изолятов DarBC , Эфиопия, 2013
| Температура отбеливателя при концентрации: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0.1% | 0,5% | 1% | 2% | 5% | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Среднее | 22,4714 | 22,2762 | 22,4524 | 22,7952 | 23,3714 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Медиана | 23,7000 | 23,6000 | 23,6000 | 23,6000 | 23,4000 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| SD | 2,39753 | 2,79963 | 2,61699 | 2.02101 | 1.00705 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Минимум | 17,80 | 16.80 | 17,40 | 18,70 | 22,00 | ||||||||||||||||||||||||||||||||||||||||||||||||||
Максимум 0.1% разбавление отбеливателя в течение 10 мин, большинство 11/20 (55%) изолятов показали рост 3 x 10 3 КОЕ / мл (ME = 4,4), 6/20 (30%) показали 5 x 10 3 Рост КОЕ / мл (МЕ = 4,2), а остальные 3/20 (15%) показали рост 57 КОЕ / мл (МЕ = 5,9). Это показало, что 0,1% отбеливатель в течение 10 минут был неэффективен. Он не смог добиться снижения более чем на 5-log10 (≥5 ME) во всех пробирках. Однако, когда время увеличивалось (15 минут, 20 минут, 30 минут и 60 минут), снижение log10 было приемлемым, ME> 5, и оно было эффективным.Раствор гипохлорита натрия, содержащий более 5000 частей на миллион (0,5%) доступного хлора, был эффективен во все времена, давая снижение более 5-log10 (). Более того, во всех тестах контрольные реакции, не содержащие дезинфицирующих средств, приводили к полному восстановлению исходных инокулятов, рост 7,5 × 10 7 КОЕ / мл.Таблица 4Логарифм уничтожения отбеливателя после воздействия изолятов в течение указанного времени концентрации, Бахир Дар, Эгиопия, 2013 г.
ОбсуждениеМы подтвердили, что pH и эффективность или способность логарифмического восстановления увеличивались с увеличением концентрации хлора. Похоже, что это противоречит тому, что утверждается в литературе о pH и эффективности отбеливателя. Когда pH находится между 2-7, равновесие благоприятствует HOCl.Когда pH падает ниже 2, основной формой является Cl2. При pH 7,4 HOCl и OCl – примерно равны, а по мере того, как pH превышает 7,4, увеличивается доля OCl – [12]. Максимальная дезинфицирующая эффективность достигается при pH 4–5, поскольку практически весь хлор присутствует в виде HOCl, который на два порядка более эффективен, чем OCl – [3, 7, 12]. Газообразный хлор довольно токсичен, поэтому следует избегать pH ниже 4. В целом, для безопасности и эффективности лучше всего подходит pH 5-7 [12].Щелочные гермициды имеют pH 8-14. Чем выше pH, тем лучше очищающие и уменьшающие свойства бактерицид. Однако очистители / бактерициды с pH выше 10 могут быть вредными для отделки пола [10]. Другая литература заявляет нам аналогичный диапазон pH. Коммерческий бытовой жидкий отбеливатель составляет от 5 до 10% гипохлорита натрия и имеет pH от 11 до 12. Гипохлорит натрия токсичен из-за части гипохлорита, которая образуется при растворении гипохлорита натрия в воде в щелочных условиях [13]. Исследования, проведенные в разных странах, показали разные результаты эффективности отбеливателя против туберкулеза. Более высокие концентрации, 1% (10 000 частей на миллион) хлора, необходимы для уничтожения M. tuberculosis за 1 минуту [9]. Однако более низкие концентрации хлора, такие как 0,0006–0,01%, оказались менее эффективными в отношении Mycobacterium. Более того, эффективность гипохлорита натрия несколько снижалась в присутствии мокроты [14]. Его концентрация также варьируется в зависимости от времени и используемых образцов [6]. M. tuberculosis в мокроте был успешно стерилизован путем добавления равных объемов 15% отбеливателя в течение одной минуты, 6% в течение пяти минут или 3% в течение 20 минут [15]. Исследования показали, что концентрация отбеливателя и время, затрачиваемое на обеззараживание разлива биологической опасности, варьировались от 0,05% до 0,5% в течение 15-20 минут [16, 17]. Аналогичным образом, сильное загрязнение и BSC могут быть загрязнены на 0,2% и 1% в течение 15 минут [17]. Исследование, проведенное Ascenzi JM и др. В 1987 году, было направлено на определение более точного метода (1:10 объем суспензии штамма и дезинфицирующее средство) для измерения туберкулоцидной активности дезинфицирующих средств.Выделение M. bovis после 2 и 5 минут воздействия 0,05% отбеливателем составило 43 и 0 КОЕ / мл соответственно, что указывает на то, что увеличение времени при одинаковой концентрации гипохлорита оказывает туберкулоцидное действие. Однако результаты, полученные на этом организме, нельзя считать актуальными при работе с медленнорастущими микобактериями [18]. Из-за различий в методологиях, типах дезинфицирующих средств и различиях в стандартах времени для подтверждения эффективности наше исследование трудно сравнивать с другими исследованиями.В Эфиопии наиболее рекомендуемые временные рамки — 10 минут, 15 минут, 20 минут, 30 минут и 60 минут [6]. Другие возможные причины несоответствия были связаны с различием в приготовлении соотношения тестовой суспензии и дезинфицирующего средства, в нашем случае использовалось равное количество тестовых посевов и дезинфицирующего средства, что является обычной практикой в туберкулезной лаборатории для обеззараживания жидких отходов, таких как мокрота. Другое различие заключалось в типе используемых изолятов: для этого исследования мы использовали изоляты MTBC, но другие использовали неинфекционные изоляты M.tuberculosis (h47Rv) и M. bovis . В этом исследовании не наблюдается различий в туберкулоцидной активности отбеливателя в отношении резистентных и чувствительных штаммов MTBC. Бактериальная устойчивость к антибактериальным средствам является либо естественным свойством организма (внутренним), либо приобретенным. Однако на сегодняшний день резистентность микобактерий к биоцидам, опосредованная плазмидами или транспозонами, не продемонстрирована [7]. Использование дезинфицирующего средства в медицинском учреждении обязательно для предотвращения внутрибольничной инфекции.Документально подтверждено распространение туберкулеза при использовании неправильно продезинфицированных бронхоскопов и эндоскопов [1, 9]. В общей сложности 80% случаев лабораторного туберкулеза возникли без очевидной причины, и было высказано предположение, что использование неэффективных химических дезинфицирующих средств может быть причиной некоторых из этих случаев лабораторных инфекций [9]. ЗаключениеИсследование показало, что 0,1% отбеливатель в течение 15 минут и 0,5% отбеливатель в течение 10 минут был туберкулоцидным при отсутствии какой-либо органической нагрузки.Однако для дезактивации образца, содержащего туберкулез, требовалась более высокая концентрация отбеливателя (т.е. 0,5 в течение 15 минут, 1% в течение 10 минут). Более того, это исследование подтвердило отсутствие разницы между отбеливателем и дезинфицирующим средством в восприимчивости к чувствительным и резистентным пятнам MTBC. В настоящее время национальные и региональные лаборатории микобктериологии Эфиопии используют 2% -ный отбеливатель в течение 60 минут для обеззараживания оставшихся образцов мокроты перед их сдачей на сжигание. Согласно этому открытию, эта практика — чрезмерное использование отбеливателя.Желательно использовать отбеливатель правильной и подходящей концентрации. Нет никакой дополнительной пользы от разбавления, превышающего рекомендованное. Это будет только дороже, так как вы будете покупать больше химикатов. Более того, использование высококонцентрированного отбеливателя опасно для здоровья. Комитеты по инфекционному контролю в медицинских учреждениях, состоящие из врачей, медсестер и / или лиц, принимающих решения, несут ответственность за принятие и утверждение эффективного времени концентрации отбеливателя, дезинфицирующих средств и методов очистки, которые будут использоваться для каждого компонента их медицинских учреждений. БлагодарностиМы выражаем нашу глубокую признательность Региональному научно-исследовательскому лабораторному центру здравоохранения Бахир-Дар и Национальному региональному бюро здравоохранения штата Амхара за основной процесс исследования. Конкурирующие интересыАвторы заявляют об отсутствии конкурирующих интересов. Вклад авторовDM участвовал в разработке, участвовал в лабораторных процедурах, проведении исследования и составил рукопись. AA выполнил лабораторные работы и критически отредактировал рукопись.BW и FB критически отредактировали рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи. Ссылки1. Френцель Э., Шмидт С., Нидервейс М., Штайнхауэр К. Важность поринов для биоцидной эффективности против Mycobacterium smegmatis. Appl Environ Microbiol. 2011. 77 (9): 3068–3073. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Рассел Д. Активность биоцидов против микобактерий. J Appl Bacteriol. 1996. 81: 87–101. [PubMed] [Google Scholar] 3. Рутала А., Вебер Дж. Консультативный комитет по практике инфекционного контроля в здравоохранении.Руководство по дезинфекции и стерилизации в медицинских учреждениях. США: CDC Департамент здравоохранения и социальных служб; 2008. [Google Scholar] 4. Джордж Кубица П., Патрсия Кент Т. Микобактериология общественного здравоохранения: руководство для лаборатории уровня III. Атланта, Джорджия: Департамент здравоохранения и социальных служб США; 1985. [Google Scholar] 5. Эфиопский научно-исследовательский институт здоровья и питания. Аддис-Абеба, Эфиопия: Федеральное министерство здравоохранения. Руководство по охране здоровья и безопасности для лабораторий общественного здравоохранения в Эфиопии; 2010 г.[Google Scholar] 6. Федеральное министерство здравоохранения Эфиопии. Отдел профилактики и контроля заболеваний. Аддис-Абеба, Эфиопия: Руководство по профилактике инфекций в медицинских учреждениях Эфиопии; 2004. [Google Scholar] 8. Ван ГО, Чжан CW, Лю ХК, Чен З.Б. Сравнение чувствительности M. tuberculosis h47Ra и M. chelonei subsp: abscessus к дезинфицирующим средствам. Biomed Environ Sci. 2005. 18 (2): 124–127. [PubMed] [Google Scholar] 9. Бест М., Саттар А., Спрингторп С., Кеннеди Э. Эффективность выбранных дезинфицирующих средств против Mycobacterium tuberculosis.J ClinMicrobiol. 1990. 28 (10): 2234–223. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Info.com. Технический бюллетень Multi-Clean. Понимание дезинфицирующих и дезинфицирующих средств. Практическое руководство о том, как выбрать подходящий бактерицид для ваших нужд, а также о процедурах очистки всех типов помещений. 2007: 1–07. www.multi-clean.com. Дата обращения: 10 марта 2015 г. Региональный научно-исследовательский лабораторный центр Бахир-Дар. Руководство по безопасности в лаборатории. 1-е издание. Эфиопия: Бахир Дар; 2013. [Google Scholar] 12.Исследовательский офис Университета штата Орегон. Дезинфекция с использованием хлорного отбеливателя. Декабрь 2011 г. / Биологическая безопасность ОГУ / Здоровье и безопасность окружающей среды / 541-737-4557. [Google Scholar] 14. Бест М., Саттар А., Спрингторп С., Кеннеди Э. Сравнительная микобактерицидная эффективность химических дезинфицирующих средств в тестах на суспензию и носитель. ApplEnvironMicrobiol. 1988. 54 (11): 2856–2858. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Chew R, Calderón C, Schumacher G. Оценка осаждения отбеливателя для стерилизации и концентрирования Mycobacterium tuberculosis в образцах мокроты.BMC Infect Dis. 2011; 269 [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Линн С. Гарсия: Справочник по процедурам клинической микробиологии. Вашингтон, округ Колумбия: 2007. [Google Scholar] 17. Американское общество микробиологов. Глобальная программа укрепления лабораторного потенциала. 2013. Пакет наставничества Американского общества микробиологов. [Google Scholar] 18. Асчензи М., Эзцелл Дж., Вендт М. Более точный метод измерения туберкулоцидной активности дезинфицирующих средств. Appl Environ Microbiol. 1987. 53 (9): 2189–2192.[Бесплатная статья PMC] [PubMed] [Google Scholar]Руководство по тестированию химических дезинфицирующих средств на их вирулицидную активность в области медициныПриложение AИнформация для проведения тестов на инфекционностьИнфекционность суспензий и их разведений может быть определенным в планшетах как микроанализ. Для определения титра можно применять метод разведения конечной точки (TCID 50 ) (микро- и макроанализ) или анализ бляшек (микроанализ). Микроанализ в планшетахПример: Добавьте 0,05–0,15 мл соответствующего разведения образца на лунку 96-луночного планшета для культивирования клеток (от 6 до 8 лунок на уровень разведения). Разведения образцов можно наносить на прилипшие клетки или добавлять к 0,05–0,15 мл клеточной суспензии. Если используются прилипшие культуры клеток, культуральную среду заменяют по истечении времени абсорбции 1-2 часа. Культуры клеток инкубируют при 37 ° C (обычно в течение 5–15 дней), а затем оценивают цитопатические эффекты под инверсным световым микроскопом.Инфекционность образцов рассчитывается как TCID 50 / мл. Приложение BКонтрольные значения коэффициентов восстановления с использованием нескольких контрольных веществ и вирусов (таблица B.1). Таблица B.1 Эталонные значения коэффициентов снижения с использованием нескольких эталонных веществ и вирусовПриложение CОпределение химических веществa) Количественное определение формальдегидаКонцентрации формальдегида в растворах формальдегида, доступных на рынке, обычно различаются и могут также зависят от условий хранения.Таким образом, важно провести количественное определение концентрации формальдегида или его разбавления, используемого в контрольном тесте. Следует учитывать, что растворы формальдегида, приготовленные из концентрированных растворов формальдегида (например, формалина), содержат полимеры и проявляют максимальную эффективность через несколько дней при комнатной температуре. Количественное определение формальдегида, например, с помощью хлорида гидроксиламмония: Принцип метода следующий: Формальдегид реагирует с хлоридом гидроксиламмония с образованием соответствующего оксима.{-} + \ mathrm {H} _ {2} \ mathrm {O} $$ Значение pH титруется гидроксидом натрия до его прежнего значения. Количество использованного гидроксида натрия указывает на концентрацию образца. Проведение определения: Аликвоту исследуемой пробы, содержащую от 100 до 150 мг формальдегида, с помощью пипетки переносят в контейнер, подходящий для титрования на pH-метре, и добавляют дистиллированную воду примерно к 1 массе. 100 мл. Раствор калибруется на pH-метре точно до pH 3.0 с прибл. 0,5 н. Соляная кислота. 25 мл прибл. Добавляют 0,5 н. Раствор гидроксиламмонийхлорида, pH которого предварительно откалиброван до 3,0, и смесь инкубируют при комнатной температуре в течение 10 мин. Затем раствор снова титруют до pH 3,0 0,5 н. Гидроксидом натрия на pH-метре. Расчет концентрации формальдегида в образце: $$ \ frac {\ begin {array} {c} \ text {Потребляемое количество 0,5} \, \ text {N NaOH} \\ \ text {в мл} \ times 30.03 \ end {array}} {\ text {Объем образца в мл} \ times 20} = \ text {концентрация формальдегида в образце на грамм в} 100 \, \ mathrm {ml}.$$ б) Титрование ПАКПеруксусные кислоты — это равновесные системы, состоящие из следующих компонентов: Перуксусная кислота, пероксид водорода, уксусная кислота и вода. Перуксусная кислота хранится при 4 ° C. Исходный раствор перуксусной кислоты готовят с использованием раствора перуксусной кислоты с концентрацией приблизительно 40%. Срок годности основного раствора составляет не более одного дня при температуре 4 ° C. Таким образом, определение концентрации PAA титрованием выполняется максимум за день до теста. Вещества :
Приготовление раствора крахмала: 1 г крахмала разводят в 100 мл воды, доводят до кипения и дают остыть. (срок хранения не более 4 недель). При титровании обязательно разбавьте по крайней мере 100 мл ледяной воды. При недостаточном разбавлении перекись водорода вступает в реакцию с йодом уже в холодных условиях. Процедура :
10 мл 5% ортофосфорной кислоты и прибл. 0,5 г йодида калия добавляют к 100 мл ледяной воды и хорошо перемешивают, затем добавляют 3–4 капли раствора крахмала. После добавления исходного раствора Footnote 10 образец немедленно и быстро титруют раствором тиосульфата натрия при перемешивании до исчезновения синего цвета. Первоначальное исчезновение цвета имеет решающее значение; через короткое время раствор снова становится синим, поскольку H 2 O 2 начинает реагировать с иодидом. Расчет : $$ \ frac {\ mathrm {ml} 0.1 \, \ mathrm {N} \ mathrm {Na} _ {2} \ mathrm {S} _ {2} \ mathrm {O} _ {3} \ times 3.803} {10 \ times \ text {ml sample}} = \% \ text {перуксусная кислота} $$ Израсходованное количество раствора тиосульфата натрия концентрация перуксусной кислоты 1 мл 0,1 н. Раствор тиосульфата натрия 3,803 мг перуксусной кислоты.
Добавляют кончик шпателя гептамолибдата аммония и раствор нагревают до комнатной температуры, затем титруют раствором тиосульфата натрия до видимого обесцвечивания. Расчет : $$ \ frac {\ mathrm {ml} 0.1 \, \ mathrm {N} \ mathrm {Na} _ {2} \ mathrm {S} _ {2} \ mathrm {O} _ {3} \ times 1.701} {10 \ times \ text {ml sample}} = \% \ mathrm {H} _ {2} \ mathrm {O} _ {2} $$ Израсходованное количество раствора тиосульфата натрия≙ концентрация H 2 O 2 . 1 мл 0,1 н. Раствора тиосульфата натрия 1,701 мг H 2 O 2 . Приложение DПодготовка воды стандартной жесткости (WSH)Требуются два раствора: Раствор A: Растворение 19.84 г безводного хлорида магния (MgCl 2 ) и 46,24 г безводного хлорида кальция (CaCl 2 ) в бидистиллированной воде и доливают до 1000 мл (также могут использоваться эквивалентные количества водных солей). Стерилизуйте раствор в паровом стерилизаторе. Раствор можно хранить при 2–8 ° C до одного месяца. Раствор B: Растворите 35,02 г бикарбоната натрия (NaHCO 3 ) в бидистиллированной воде и залейте до 1000 мл. Стерилизуйте раствор мембранной фильтрацией.Раствор можно хранить при температуре 2–8 ° C до одной недели. Для приготовления 1 л воды стандартизированной жесткости не менее 600 мл стерильного бидеста. воду добавляют в стерилизованную мерную колбу на 1000 мл. Добавляют 6,0 мл раствора A и 8,0 мл раствора B, перемешивают и заполняют до 1000 мл. Раствор должен иметь pH 7,0 + 0,2. При необходимости pH калибруют с помощью 1 н. Гидроксида натрия (NaOH) или 1 н. Соляной кислоты (HCl). Вода стандартной жесткости должна быть свежеприготовленной в асептических условиях и использоваться в течение 12 часов. Жесткость составляет 376 частей на миллион в расчете на содержание карбоната кальция. Приложение EТабличное и графическое отображение результатов испытанийa) Пример табличного отображения результатов испытаний(рис. E.1). Рис. E.1Пример табличного отображения результатов теста (Информация о цитотоксичности дезинфицирующего средства и о максимально обнаруживаемом снижении титра инфекционности). c.t. время контакта б) Примеры графического изображения результатов испытанийПриложение FИнформация по составлению экспертных заключений по тестам дезинфицирующего действия
Приложение GМеморандум об использовании фильтровальных колонок с молекулярными ситами в тестах на вирулицидную активность(по состоянию на 18 мая 2013 г.). Для подтверждения противовирусной активности дезинфицирующих средств во время тестов дезинфицирующих средств необходимо продемонстрировать снижение титра ≥4 log 10 шагов после указанного времени контакта.Однако, поскольку некоторые дезинфицирующие средства проявляют сильную цитотоксичность, такое снижение титра не всегда может быть достигнуто. В таких случаях EN 14476 и директива DVV / RKI рекомендуют «детоксикацию» тестируемых растворов с помощью молекулярной фильтрации, например с использованием колонок Sephadex ™ LH 20. С помощью этого метода цитотоксичность, как правило, можно снизить на один log 10 шаг в зависимости от активных веществ. В некоторых лабораториях также используются колонки для молекулярной фильтрации, чтобы остановить действие нецитотоксических дезинфицирующих средств, инактивирующих вирус.Опыт нескольких лабораторий показал, что инфекционные вирусы задерживаются в этих процессах молекулярной фильтрации непредсказуемым образом, что может привести к неверным результатам. Имитируется противовирусный эффект, которого на самом деле нет. Этот эффект наблюдался для разных видов вирусов и при использовании дезинфицирующих средств, основанных на разных активных ингредиентах. В таблице G.1 показаны различные примеры с использованием и без использования колонок для молекулярной фильтрации: составы на основе QAV 1, 3 и 4 показали значительное удержание инфекционных вирусов в колонках, тогда как в продукте 2 на основе QAV такого эффекта не наблюдалось. .В прямых сравнительных исследованиях исследуемых растворов — фильтрованных и нефильтрованных — были измерены различия в титрах до 3 log 10 шагов. Однако этот эффект удержания не возникает при параллельном титровании вирусного контроля. Эти наблюдаемые эффекты приводят к гипотезе о том, что критический фактор лежит в составе исследуемых растворов, состоящих из дезинфицирующего средства, вирусной суспензии и, где это применимо, белковой нагрузки. Несколько экспертных отчетов и публикаций содержат тесты на эффективность дезинфицирующих средств, основанные исключительно на протоколах с использованием молекулярно-ситовой фильтрации.В отдельных случаях достоверно оценить точность этих данных сложно. Это тот случай, если отсутствуют контрольные измерения, которые доказали бы, что в столбцах не осталось остаточного вируса. Поэтому мы указываем, что для тестов эффективности дезинфицирующих средств, в которых требуемое снижение титра не может быть достигнуто без «детоксикации», все времена контакта должны измеряться как с фильтрацией через молекулярное сито, так и без нее. При этом можно определить какое-либо удержание вирусов в столбцах.При необходимости необходимо внести другие изменения в протокол теста (например, повысить титр вируса). Молекулярная фильтрация через сито не подходит для остановки противовирусных эффектов в нецитотоксических растворах, поскольку необходимое время для этой процедуры — особенно при коротком времени воздействия — делает результаты менее точными, чем серии разведений. Таблица G.1 Пример результатов теста со столбцами и без нихПриложение H1. Примерный расчет титра вируса и коэффициент снижения согласно Спирману и КерберуРасчет титра контрольного титрования первого прогона теста (T1): Таблица H.1 Примерные значения для результата тестаТитр рассчитывается согласно числовым значениям, приведенным в таблице H.1 (см. Пункт 8.1): $$ \ mathrm {m} = — 6 + 1 / 2-1 \ times 2,38 = 7,88 $$ С учетом применяемого тестового объема титр составляет 8,88 log 10 TCID 50 / мл. {2} \ sum \ {\ mathrm {p} _ {\ mathrm {i}} (1- \ mathrm {p} _ {\ mathrm {i}}) / (16-1) \}} \) Как p 1 = 1, p 2 = 0.75, p 3 = 0,5 и p 4 = 0,13 и n равно 16 во всех разведениях, поэтому $$ \ mathrm {P} _ {1} (1- \ mathrm {p} _ {1 }) / (\ mathrm {n} _ {1} -1) = 0 $$ $$ \ mathrm {p} _ {2} (1- \ mathrm {p} _ {2}) / (\ mathrm {n} _ {2} -1) = 0,75 (1-0,75) / (16-1) = 0,0125 $$ $$ \ frac {\ mathrm {p} _ {3} \ left (1- \ mathrm {p} _ {3} \ right)} {\ mathrm {n} _ {3} -1} = \ frac {0.50 \ left (1-0.50 \ right)} {16-1} = 0,0167 $$ $$ \ frac {\ mathrm {p} _ {4} \ left (1- \ mathrm {p} _ {4} \ right)} {\ mathrm {n} _ {4} -1} = \ frac {0,13 \ left (1-0.13 \ right)} {16-1} = 0,0075 $$ $$ \ mathrm {s} _ {\ mathrm {m}} = \ sqrt {1 \ left (0,0125 + 0,0167 + 0,0075 \ right)} $$ $$ \ mathrm {s} _ {\ mathrm {m}} = 0,19, $$ $$ \ mathrm {i}. \ Mathrm {e}. 2 \, \ mathrm {s} _ {\ mathrm {m}} = 0.38 $$ $$ \ text {Результат:} \, \ mathrm {k} _ {\ mathrm {a}} = 0.38 $$ Таким образом, титр контрольного титрования составляет 8,88 ± 0,38 log 10 TCID 50 / мл. Если остаточный вирусный титр первого прогона теста (цифры не показаны) рассчитывается аналогично, результат для этого примера равен 3.{2}} = 0,50 $$ Таким образом, коэффициент уменьшения первого испытательного прогона составляет 5,38 ± 0,50 log 10 . Предполагается, что титры контрольного титрования вируса и титрования остаточного вируса во втором тестовом прогоне при аналогичных основных условиях составляют 8,25 ± 0,22 log 10 TCID 50 / мл и 3,25 ± 0,34 log 10 TCID 50 / мл, RF T2 , включая 95% доверительный интервал, рассчитывается как 5,0 ± 0,40. Среднее значение RF из обоих прогонов теста, включая 95% доверительный интервал, рассчитывается согласно (см.{2} \ right) / 2} = 0,45 $$ Следовательно, общий RF из обоих прогонов теста (включая 95% доверительный интервал) для данного примера составляет 5,19 ± 0,45 log 10 . Индивидуальные титрования соответствуют требованиям руководства в отношении точности, так как 95% доверительный интервал рассчитанных титров составляет ≤0,5 log 10 . 2. Пример расчета для расчета титра и коэффициента восстановления с использованием метода посева большого объема (LVP) в соответствии с п. 8.3Предполагая, что после воздействия дезинфицирующего средства обнаруживается только низкая инфекционность, что приводит к использованию LVP, есть два варианта расчета титра b, которые можно использовать для расчета коэффициента снижения, как описано в пункте 8.2.
Если некоторые инфицированные культуры клеток обнаружены с использованием метода LVP, титр можно рассчитать по следующей формуле: $$ \ mathrm {c} = \ frac {\ mathrm {D}} {\ mathrm {V} _ {\ mathrm {W}}} * \ left (- \ ln \ frac {n-n_p} {n} \ right) $$
Для примера расчета используются следующие значения:
Если эти значения ввести в формулу выше, результат будет 984 инфекционных частиц на мл . Один TCID 50 эквивалентен 0,69 инфекционным вирусным частицам. Таким образом, в результате получается титр 984: 0,69 = 1426 TCID 50 на мл. Значение, используемое для расчета коэффициента уменьшения, представляет собой десятичный логарифм этого титра, т.е.е. 3,15 log 10 TCID 50 / мл.
Если с помощью метода LVP не обнаружены инфицированные культуры клеток, количество инфекционных вирусных частиц (предел обнаружения 95%) определяется следующим образом: $$ \ mathrm {c} = \ ln \ mathrm {p} / — \ mathrm {v} $$ Ключ:
В этом примере образец разбавлен до 1: 1000, из-за цитотоксичности, вносится в микропланшет (96 лунок, 0,1 мл / лунка). Это приводит к следующему вычислению:
В формулу подставлено значение ≤0,31 вирусных частиц / мл. С учетом разведения (0,31 × 1000) результат составляет 310 инфекционных вирусных частиц на мл. Поскольку один TCID 50 эквивалентен 0,69 инфекционным вирусным частицам, результатом является титр 310: 0,69 = 445 TCID 50 / мл, логарифм которого составляет ≤2,65 log 10 TCID 50 / мл. Это значение является титром, используемым для расчета коэффициента уменьшения. Для расчета коэффициента уменьшения и его 95% доверительного интервала мы предполагаем, что титр контрольного вируса, как показано в приведенном выше примере, составляет 8,88 ± 0,38 log 10 TCID 50 / мл. 3,15 log 10 TCID 50 / мл был определен как остаточный титр вируса. Следовательно, коэффициент уменьшения составляет (8,88–3,15) 5,73 log 10 . Поскольку по прагматическим причинам титр остаточного вируса не имеет 95% доверительного интервала, результатом является коэффициент уменьшения 5.73 ± 0,38 лог 10 . Если при определении остаточного титра вируса инфекционность не обнаружена и титр рассчитывается по формуле Пуассона, результатом является коэффициент уменьшения (8,88–2,65) 6,23 log 10 . Поскольку по прагматическим причинам остаточный титр вируса не имеет 95% доверительного интервала, результатом является коэффициент уменьшения ≥6,23 ± 0,38 log 10 . Здесь перед коэффициентом уменьшения стоит символ ≥, чтобы продемонстрировать, что остаточная инфекционность не была обнаружена, т.е.е. коэффициент уменьшения составляет, по крайней мере, это значение, но может быть и выше. Инструменты и методы лабораторной дезактивацииОтслеживание количества лабораторных инфекций (LAI) в США — непростая задача. Не обо всех инцидентах сообщается, и иногда жертва может не знать об источнике инфекции. Несмотря на это, Бюро статистики труда США (BLS) действительно собирает доступную информацию об этих зарегистрированных воздействиях в лабораториях. Цифры уменьшались за последнее десятилетие, 1 , но риски все еще происходят. Можно заразиться патогеном, просто прикоснувшись к зараженным поверхностям в лаборатории без средств индивидуальной защиты (СИЗ). Согласно Институту клинических и лабораторных стандартов (CLSI), в лаборатории «телефоны, дверные ручки и ручки, компьютерные терминалы и другие поверхности считаются загрязненными». 2 Одним из важных способов минимизировать риск воздействия на сотрудников лаборатории является использование передовых методов дезактивации. Обеззараживание — это действие по минимизации общего присутствия патогенных микробов.Для лабораторий, которые обрабатывают стандартные образцы пациентов, это присутствие микробов может присутствовать в форме переносимых с кровью патогенов, бактерий, грибков и даже прионов. Цель процесса дезактивации — уменьшить количество этих загрязнителей, чтобы свести к минимуму возможность передачи или заражения. Регулярная дезактивацияРегулярная дезинфекция лабораторных столешниц или рабочих зон должна происходить часто. Лабораторные столы следует мыть как минимум после каждой рабочей смены и после того, как произошла утечка.Этот рутинный процесс дезактивации также должен быть задокументирован. Также рекомендуется регулярно включать в процесс дезинфекции телефоны, компьютерные терминалы и другие часто обрабатываемые поверхности в лаборатории. Обычно химические гермициды рекомендуются для обеззараживания поверхности в лабораторных условиях. Эти бактерициды классифицируются как дезинфицирующие средства высокого, среднего или низкого уровня в зависимости от их активности и силы действия. Наиболее часто рекомендуемым дезинфицирующим средством для лабораторных поверхностей является 10-процентный раствор гипохлорита натрия (или отбеливателя), который считается химическим бактерицидным средством средней силы.Дезинфекция промежуточного уровня уничтожает большинство бактерий (включая Mycobacterium tuberculosis) и все грибки, а также инактивирует вирусы. Лабораториидолжны использовать зарегистрированное EPA или одобренное дезинфицирующее средство. Производители перечисляют свои продукты в Агентстве по охране окружающей среды США (EPA), и агентство проверяет, что дезинфицирующее средство эффективно против распространенных патогенов и соответствует требованиям стандарта Управления по охране труда и здоровья (OSHA) по патогенам, передающимся через кровь.Эти требования включают способность продукта эффективно обеззараживать загрязненные поверхности и разливы. 3 Многие производители предлагают готовые чистящие средства с отбеливателем, но многие лаборатории по-прежнему делают свои собственные разведения из концентрированного отбеливателя. Это приемлемая практика, но свежие отбеливающие растворы следует готовить ежедневно, так как эффективность раствора быстро снижается. Также важно при приготовлении смесей учитывать концентрацию покупного отбеливателя.Традиционно лаборатории готовили раствор 1:10, так как большинство отбеливателей раньше продавалось с концентрацией 5,25%. Поскольку многие доступные коммерческие концентрации отбеливателя в настоящее время составляют 8,25 процента, лаборатории должны приготовить раствор 1:16 для дезинфекции, если они используют этот отбеливатель. Перед тем, как делать разведения, лаборанты должны проверять этикетку купленного отбеливателя. Гипохлорит натрия — это коррозионно-активный химикат, и даже в разбавленном виде он может со временем вызвать повреждение некоторых поверхностей.Чтобы предотвратить это, продезинфицированную поверхность следует промыть стерильной водой или 70-процентным этанолом (еще одно промежуточное химическое бактерицидное средство). Некоторые особые случаиПри дезинфекции бокса биологической безопасности (BSC) можно использовать раствор отбеливателя. Наряду с дезинфекцией рабочей поверхности шкафа следует также очистить заднюю и боковые стенки, а также внутреннюю часть стеклянной створки. Опять же, полоскание водой или этанолом поможет предотвратить точечную коррозию поверхностей из нержавеющей стали BSC, которая может быть вызвана отбеливателем.Ультрафиолетовое освещение никогда не следует использовать для бактериальной дезинфекции внутри БББ. Хорошо известно, что эффективность обеззараживания УФ-светом блокируется пылью, тенями и интенсивностью света. 4 Существует также опасность воздействия ультрафиолетового света на пользователя BSC, которого следует избегать. Однако УФ-свет в BSC может быть эффективно использован для дезактивации ДНК в определенных процессах молекулярной лаборатории. Использование формальдегидаВ отделении анатомической патологии лаборатории формальдегид иногда используется в качестве дезинфицирующего средства.В зависимости от концентрации формальдегид может считаться дезинфицирующим средством высокого уровня. Химическое вещество, известный канцероген, помещается внутрь криостата, а пары, образующиеся от источника тепла, используются для обеззараживания внутренней части устройства. Однако эффективность дезинфекции неясна, а опасность использования канцерогена оценивает этот метод как менее чем удовлетворительный. Обратитесь к производителю криостата за инструкциями по очистке, но многие инструменты можно продезинфицировать с помощью 70-процентного спирта. Работа с прионамиПри дезинфекции особое внимание уделяется обращению с прионами. Прионы представляют собой аномально свернутые белки, которые вызывают заболевания, известные как трансмиссивные губчатые энцефалопатии (TSE). Наиболее известным TSE является болезнь Крейтцфельдта-Якоба (CJD), и лаборатории могут обрабатывать образцы от пациентов CJD. Прионы инактивируются нелегко, и тестирование проб в лаборатории следует проводить с использованием одноразового оборудования, где это возможно. Ткани, удаленные у пациентов с CJD, перед обработкой необходимо зафиксировать с помощью 95% муравьиной кислоты.Одноразовые инструменты, используемые с такими образцами, перед повторным использованием следует погрузить в 1 н. Гипохлорит натрия (NaOH) на один час. Поверхности, на которые были обработаны или пролиты образцы, также следует погрузить в NaOH на один час для дезинфекции. Химическая концентрацияХотя концентрация химикатов играет важную роль в эффективности против патогенов, последнее, что нужно учитывать при выборе всех лабораторных дезинфицирующих средств, — это время контакта с патогеном. Большинство дезинфицирующих средств не убивают микроорганизмы мгновенно при контакте; продукт необходимо оставить на загрязненной поверхности на определенное время, чтобы завершить свое действие.Все дезинфицирующие средства, зарегистрированные EPA, имеют указанное время контакта, указанное на этикетке. Например, дезинфицирующее средство для поверхностей может иметь время контакта или уничтожения вируса гепатита В от одной до трех минут; однако время его туберкулоцидного контакта может составлять десять минут. Обязательно ознакомьтесь с этикетками и ознакомьтесь с требованиями к времени контакта. Правильное использование этих продуктов — единственный способ обеспечить надлежащую дезинфекцию. Опасное место…Лаборатория представляет собой по своей сути опасное место, где повсеместно распространены патогены, передающиеся через кровь и воздух, и необходимо принимать специальные меры для защиты людей, работающих в отделении.Для предотвращения LAI всегда должны использоваться инженерные средства контроля, средства контроля рабочей практики и СИЗ. Обеззараживание поверхностей — еще один важный контроль, который необходимо использовать должным образом. Понимание правильных типов, концентраций и времени контакта подходящих лабораторных дезинфицирующих средств — это практика, которая уменьшит количество угрожающих патогенов и сделает лабораторию более безопасным местом для работы. ССЫЛКИ
Daniel J. Scungio, MT (ASCP), SLS, CQA (ASQ) , имеет более чем 25-летний опыт работы в качестве сертифицированного медицинского технолога. Он был менеджером лаборатории в течение 10 лет, прежде чем стал сотрудником по безопасности лабораторий в Sentara Healthcare, системе, состоящей из двенадцати больниц и более 20 лабораторий и центров рисования в Вирджинии и Северной Каролине.Как «Дэн, специалист по безопасности в лаборатории», он предоставляет консультации, обучение и тренинги в США и Канаде. Посетите страницу Дэна, работающего в лаборатории, в Facebook: www.facebook.com/danthelabsafetyman. Руководство по биобезопасности — Стэнфордский университет, гигиена окружающей среды и безопасностьОбщая процедура обеззараживания (Рисунок 4)
Выбор дезинфицирующего средстваВыбор дезинфицирующего средства основан на нескольких факторах (рис. 5):
Обратите внимание, что дезинфекция прионов и прионоподобных белков должна осуществляться в соответствии с особыми инструкциями. Важно отметить, что «отбеливатель», очень распространенное и эффективное дезинфицирующее средство, нестабильно при разбавленных концентрациях; рабочих разведений гипохлорита натрия следует делать еженедельно из основного раствора.Рабочие растворы 10% -ного отбеливателя (разбавление бытового отбеливателя в воде 1:10) эффективны в большинстве ситуаций. Учтите, что неразбавленный отбеливатель не должен стекать в канализацию. Дезинфицирующие средства на спиртовой основе также испаряются со временем, и их следует добавлять через определенные промежутки времени. Следующий список дезинфицирующих средств, их эффективность, время контакта и рекомендуемые разведения являются общими рекомендациями — пожалуйста, следуйте рекомендациям конкретного производителя, если таковые имеются. Четвертичные соединения аммония обычно используются в растворах для мытья полов.Соединения четвертичного аммония эффективны при инактивации большинства вегетативных бактерий, грибов и липидосодержащих вирусов. Соединения четвертичного аммония НЕ эффективны при использовании для дезинфекции Mycobacterium tuberculosis (TB), спор бактерий и многих вирусов, таких как HBV.
Этанол обычно используется на оборудовании, поверхности которого подвержены коррозии при применении других дезинфицирующих средств.Этиловый спирт эффективен для инактивации большинства вегетативных бактерий, грибков и липидосодержащих вирусов. Этанол НЕ эффективен при дезинфекции HBV, Mycobacterium tuberculosis (TB) и спор бактерий.
Фенольные смолы обычно используются для обеззараживания поверхностей, таких как столешницы лабораторий.Фенолы эффективны в инактивации вегетативных бактерий, грибков, туберкулеза, липидосодержащих вирусов и имеют некоторое влияние на ВГВ. Однако фенольные смолы не инактивируют споры бактерий.
Йодсодержащие соединения или йодофоры обычно используются для обеззараживания металлических поверхностей или оборудования.Йодофоры эффективны в инактивации вегетативных бактерий, грибов, туберкулеза и липидосодержащих вирусов и имеют некоторое влияние на ВГВ. Однако йодофоры не инактивируют споры бактерий.
Хлорные соединения , такие как отбеливатель, обычно используются в лаборатории из-за относительной легкости доступа и низкой стоимости.Соединения хлора (гипохлорита) эффективны при инактивации вегетативных бактерий, грибов, липидных и нелипидных вирусов, Coxiella burnetii и туберкулеза. Соединения хлора в некоторой степени инактивируют споры бактерий.
Параформальдегид и формальдегид часто используются для обеззараживания больших частей лабораторного оборудования, такого как шкафы биобезопасности (но только профессионалами!). Параформальдегид / формальдегид инактивирует вегетативные бактерии, грибки, липидные и нелипидные вирусы, HBV, TB, Coxiella burnetii и бактериальные споры.Однако параформальдегид и формальдегид являются зарегистрированными канцерогенами в штате Калифорния и очень токсичны для использования без доступа к вытяжному шкафу и / или средствам индивидуальной защиты. Не используйте параформальдегид или формальдегид в лаборатории для обеззараживания оборудования. Утвержденный подрядчик по изготовлению шкафов биобезопасности будет использовать параформальдегид для обеззараживания вашего шкафа биобезопасности перед заменой HEPA-фильтров. Обязательно избегайте использования шкафа биобезопасности во время этой операции! Глутаральдегид часто используется для дезинфекции больничных инструментов.Глутаральдегид инактивирует вегетативные бактерии, грибки, липидные и нелипидные вирусы, HBV, TB, Coxiella burnetii и бактериальные споры. Однако глутаральдегид очень токсичен для использования без доступа к вытяжному шкафу и / или средствам индивидуальной защиты. Не используйте глутаральдегид в лаборатории для обеззараживания оборудования. Оксид этилена часто используется для дезинфекции больничных инструментов. Оксид этилена инактивирует вегетативные бактерии, грибки, липидные и нелипидные вирусы, HBV, TB, Coxiella burnetii и бактериальные споры.Однако окись этилена является зарегистрированным канцерогеном в штате Калифорния и очень токсична для использования без механической вентиляции и средств индивидуальной защиты. Не используйте окись этилена в лаборатории для дезактивации оборудования. Рис. 4. Как очистить загрязненную поверхностьВыберите дезинфицирующее средство в зависимости от биологического вещества, присутствующего в разливе. Продолжительность контакта зависит от биологических и дезинфицирующих средств. Утилизировать материалы как медицинские отходы. Сообщите об инциденте в соответствии с требованиями Рис. 5. Таблица дезинфицирующих средств Предоставлено http://www.cfsph.iastate.edu/BRM/resources/Disinfectants/CharacteristicsSelectedDisinfectants.pdf Микроорганизмов | Бесплатный полнотекстовый | Биоцидная эффективность выбранных растворов дезинфицирующих средств на основе воды и озонированной воды против штаммов Listeria monocytogenes1. ВведениеListeria monocytogenes вызывает листериоз. Этот внутриклеточный патоген широко распространен в окружающей среде, откуда он может попадать в пищеварительный тракт животных и человека [1].Основным источником L. monocytogenes является пища, особенно копченая рыба, сыр, мясные деликатесы, молоко, морепродукты, яйца и овощи [2]. Поскольку L. monocytogenes способна выживать в условиях пищевой промышленности, она представляет серьезную угрозу для здоровья человека. предприятия пищевой промышленности. Для предотвращения распространения инфекции, вызванной этим патогеном, проводятся процессы химической дезинфекции с использованием таких соединений, как хлор, йод, окисляющие, фенольные, четвертичные аммониевые соединения, спирты, альдегиды или металлические наночастицы [3].В последнее время альтернативным дезинфицирующим средством стал озон. Благодаря своим антибактериальным свойствам озон широко используется для дезинфекции питьевой воды и сточных вод, а также в пищевой промышленности. В процессах дезинфекции озон используется в газообразной или водной форме в зависимости от типа очищаемых поверхностей. Низкие концентрации озона и короткая продолжительность действия достаточны для уничтожения микроорганизмов [4]. Он активен в отношении бактерий (таких как Listeria spp., Escherichia spp., Salmonella spp.), вирусы, грибы, споры грибов и простейшие [5]. Кроме того, постоянное озонирование воды с низкой концентрацией озона (0,5 мг / л), предназначенной для мытья овощей, привело к снижению количества мезофильных и колиформных бактерий на поверхности салата и перца. Этот метод был менее эффективным в отношении удаления плесени и грибка. Также вид овощей играет роль в эффективности метода (более эффективен для перца) [6]. Озон нарушает целостность мембраны бактериальной клетки, окисляя фосфолипиды и липопротеины.В случае грибов озон подавляет рост микробов в определенной фазе. В случае вирусов озон повреждает вирусный капсид и нарушает цикл репликации вируса [7]. Thanomsub et al. [8] с помощью сканирующей электронной микроскопии (СЭМ) показали деформацию грамотрицательных клеток при воздействии озона в концентрации 0,167 / мг / мин / л. После 60-минутной экспозиции клетки были погруженными и вогнутыми, а после 90-минутной экспозиции они показали лизис. Использование озона не требует высоких температур и приносит много экономических выгод [9].Однако его короткий период полураспада связан с необходимостью производить его на месте использования. Период полураспада озона в водном растворе при 20 ° C составляет примерно 20–30 мин [10]. Использование озонированной воды в пищевой промышленности определяет включение органических веществ и значений pH. Arayan et al. [11] показали, что органическое загрязнение влияет на период полураспада озона в воде, и температура также является важным фактором. Повышение температуры озонированной воды приводило к снижению биоцидной эффективности [11].Кроме того, озон может вызывать коррозию обработанной поверхности [12]. С другой стороны, его использование снижает количество других дезинфицирующих средств и, следовательно, количество их токсичных побочных продуктов [4].Целью исследования было сравнить биоцидную эффективность против штаммов L. monocytogenes тринадцати выбранных дезинфицирующих средств, растворы которых были приготовлены с использованием стерильной жесткой воды и озонированной воды. Целью было также оценить стабильность растворов трех дезинфицирующих средств, эффективность которых была значительно выше в озонированной воде по сравнению с жесткой водой. 2. Материалы и методы2.1. Бактериальные штаммыИсследование проведено на 6 штаммах L. monocytogenes, выделенных в 2015 г. с территории Куявско-Поморского воеводства (Польша), в том числе на четырех пищевых изолятах: мясных (LMO-M), молочных продуктах (LMO-N), овощи (LMO-W) и рыба (LMO-R), один клинический штамм (LMO-K) из коллекции кафедры микробиологии Университета Николая Коперника в Торуни, L. Rydygier Collegium Medicum в Быдгоще. Эти штаммы были чувствительны ко всем протестированным антибиотикам (пенициллин, ампициллин, меропенем, эритромицин, котримоксазол) в соответствии с EUCAST v.8.00 рекомендаций [13]. Материал исследования также включал референсный штамм L. monocytogenes ATCC 19111.2.2. Озонированная водаВ эксперименте использовалась жесткая вода, приготовленная в соответствии с польским стандартом PN-EN 1276: 2010 [14]. Раствор A (19,84 г MgCl 2 (Avantor, Гливице, Польша) и 46,24 г CaCl 2 (Avantor, Гливице, Польша) растворяли в 1000 мл H 2 O) и B (35,02 г NaHCO 3). (Avantor, Гливице, Польша), растворенный в 1000 мл H 2 O), готовили для получения жесткой воды.Оба раствора стерилизовали. Затем 6 мл раствора A и 8 мл раствора B добавляли к 700 мл стерильной воды, тщательно перемешивали и доводили стерильной водой до 1000 мл. Процесс озонирования 100 мл стерильной жесткой воды (температура 20 ° C, pH = 7,0) проводили с помощью озонатора 20W ZE-h203 Orientee (ELTOM, Варшава, Польша) с диффузором и с функцией ионизации воды и воздуха. на 45 мин. Озон генерировался в ламинарной камере при постоянной влажности и температуре воздуха.Концентрацию озона в реакционных смесях определяли с использованием метода DPD (N, N-диэтил-1,4-фенилендиаммония сульфата) в соответствии с ISO 7393-2: 2017 [15], кюветного теста и настольного спектрофотометра DR3900 VIS, предоставленного Hach (Frederick , Мэриленд, США). Данная процедура определения озона была разработана для проб воды компанией Hach. Согласно методике, образцы обрабатывают окислителем N, N-диэтил-1,4-фенилендиаммонийсульфатом (DPD) с образованием красного красителя. Он был определен спектрофотометрией в видимой области спектра (λmax = 552 нм).Из-за короткого типичного периода полураспада озона в воде (15–25 мин для pH = 7–10) [16] озонированная вода сразу использовалась для приготовления растворов.2.3. Дезинфицирующие средстваВ исследовании использовалось 13 дезинфицирующих средств. Состав и концентрация (в соответствии с инструкциями производителя) рабочих растворов, необходимых для приготовления серии разведений, представлены в таблице 1. С учетом информации, предоставленной производителем конкретного дезинфектора для приготовления коммерческого рабочего раствора (100 %) были приготовлены следующие растворы: 200%, 180%, 160%, 140%, 120%, 100%, 80%, 60%, 40%, 20%, 10%, 2% и 1% рабочего концентрации растворов.Концентрации были выбраны для проведения процедуры оценки минимальных бактерицидных концентраций, описанной в дальнейшей части методики. Конкретные концентрации для конкретных протестированных дезинфицирующих средств представлены в таблице 2. Были подготовлены две независимые серии разведений — одна с использованием стерильной жесткой воды [14], а другая — стерильной озонированной водой, сразу после ее приготовления.2.4. Приготовление бактериальных суспензийИз культур штаммов L. monocytogenes, полученных на колумбийском агаре с 5% овечьей крови (CAB, bioMérieux, Marcy-l’Etoile, France), суспензии плотностью 0.5 Стандарт МакФарланда (5,80 × 10 8 КОЕ × мл -1 ) готовили в 3 мл бульона Мюллера-Хинтона (MHB, Becton Dickinson, Franklin Lakes, Нью-Джерси, США). Для этого сначала была установлена оптическая плотность стерильной среды MHB (Mueller Hinton Broth, Becton Dickinson, Franklin Lakes, Нью-Джерси, США). Затем из одной колонии, выращенной на колумбийском агаре с 5% овечьей крови (CAB, bioMérieux, Marcy-l’Etoile, Франция), собирали стерильный тампон и загружали в MHB (бульон Мюллера-Хинтона, Becton Dickinson, Franklin Lakes, Нью-Джерси. , США) с последующим измерением оптической плотности суспензии и последующей колонизацией L.monocytogenes при необходимости. Оптическую плотность суспензии устанавливали равной 0,5 + оптической плотности стерильного MHB (бульон Мюллера-Хинтона, Becton Dickinson, Franklin Lakes, Нью-Джерси, США). Измерения проводились на денитометре DEN-1B фирмы Biogenet (Юзефув, Польша). 2,5. Оценка биоцидной эффективности озонированной и не озонированной водыСуспензии тестируемых штаммов L. monocytogenes (100 мкл) переносили пипеткой в пробирки Eppendorf (1,5 мл, Genoplast, Польша).После центрифугирования бактериальных суспензий (3000 об / мин за 5 мин) к осадкам добавляли 150 мкл раствора озона соответствующей концентрации (среднее значение, определенное по пункту 2.2–2.32 мкг O 3 / мл). Сразу после приготовления суспензии в озонированной / не озонированной воде делали ряд десятичных разведений в стерильном PBS (фосфатно-солевой буфер, Avantor, Гливице, Польша). Каждое разведение (100 мкл) высевали в колумбийский агар с 5% овечьей крови (CAB, bioMérieux, Marcy-l’Etoile, Франция) и инкубировали в течение 24 часов при 37 ° C.Таким образом определяли исходное количество L. monocytogenes. Количество бактерий в полученной суспензии составляло 3,60–4,20 × 10 8 КОЕ × мл –1 . Отрицательный контроль — 150 мкл озоновой воды, положительный контроль — 150 мкл бактериальной суспензии данного штамма, суспендированной в стерильной жесткой воде. Исследование проводили в трех экземплярах для каждого штамма и каждой тестируемой концентрации. После 5 мин обработки суспензий озонированной водой образец переносили в 900 мкл нейтрализатора (10 г Tween 80 (Sigma Aldrich, Сент-Луис, Миссури, США), 1 г лецитина (Sigma Aldrich, Сент-Луис, Миссури, США). ), 0.5 г гистидина L (Sigma Aldrich, Сент-Луис, Миссури, США), 2,5 г Na 2 S 2 O 3 (Avantor, Гливице, Польша), 3,5 г C 3 H 3 NaO 3 (Avantor, Гливице, Польша), 1000 мл стерильной воды). Лецитин нейтрализует соединения четвертичного аммиака, в то время как фенольные дезинфицирующие средства и гексахлорфен нейтрализуют твин. Вместе лецитин и твин нейтрализуют этанол. Гистидин инактивирует альдегиды, особенно формальдегид и глютеральдегид.Тиосульфат натрия нейтрализует йод и хлор, тогда как пируват натрия нейтрализует активный кислород и пероксиды [17,18]. После 5 мин воздействия на субстратных секторах субстрата CAB (Колумбийский агар с 5% овечьей крови, BioMérieux, Марси-л’Этуаль, Франция) получали линейные культуры, которые инкубировали в течение 24 ч при 37 ° C. После инкубации анализировали концентрацию озонированной воды, что позволило инактивировать тестируемые штаммы L. monocytogenes. Также оценивалось влияние стерильной жесткой воды [15] на количество восстановленных бактерий.После определения диапазона концентраций, в котором находится значение минимальной бактерицидной концентрации (МБК) озонированной воды, процедуру повторяли, готовя растворы с концентрацией, изменяющейся на 1% в этом диапазоне, для точного определения МБК ( минимальная бактерицидная концентрация). Чтобы проверить стойкость озонированной воды, тот же цикл испытаний был проведен через один и два часа после завершения процесса озонирования. Все чашки с культурами в виде полосок инкубировали в условиях, описанных выше, а затем считывали результаты. 2.6. Оценка эффективности дезинфицирующих средствСуспензии тестируемых штаммов L. monocytogenes (100 мкл) и 100 мкл дезинфицирующего средства соответствующей концентрации вносили в лунки многолуночного полистиролового планшета. Целевая концентрация дезинфицирующего средства в планшете с лунками составляла соответственно 100%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10%, 5%, 1% и 0,5. % концентрации рабочего раствора того или иного дезинфицирующего средства. Конкретные концентрации для конкретных протестированных дезинфицирующих средств представлены в таблице 2.Отрицательный контроль состоял из 200 мкл стерильной среды MHB (Mueller Hinton Broth, Becton Dickinson, Franklin Lakes, Нью-Джерси, США) и положительный контроль — 200 мкл бактериальной суспензии. Через 5 мин воздействия агента на суспензии бактерий 100 мкл жидкости переносили из каждой лунки в 900 мкл нейтрализатора. После 5 мин нейтрализации бэндовую культуру готовили на сегментах CAB (Колумбийский агар с 5% овечьей крови, bioMérieux, Марси-л’Этуаль, Франция), которые инкубировали в течение 24 ч при 37 ° C.После инкубации считывали минимальную концентрацию, позволяющую инактивировать тестируемые штаммы L. monocytogenes, для растворов на основе не озонированной и озонированной воды.После определения диапазона концентраций, в котором находится значение минимальной бактерицидной концентрации (МБК) данного дезинфицирующего средства, процедура была повторена путем приготовления растворов с концентрацией, изменяющейся на 1% в этом диапазоне, для точного определения МБК. На основании полученных результатов для всех штаммов и дезинфицирующих средств, использованных в исследованиях, был рассчитан коэффициент эффективности (А) [19].Чем меньше значение коэффициента А, тем больше эффективность дезинфицирующих растворов на основе озонированной воды по сравнению с не озонированными дезинфицирующими средствами. Коэффициент эффективности рассчитывался по формуле: где:A — коэффициент эффективности, b — эффективная концентрация дезинфицирующего средства в активном растворе (озонированная вода), c — эффективная концентрация дезинфицирующего средства в не озонированном водном растворе. Для оценки уменьшения количества L. monocytogenes под действием дезинфицирующих средств, приготовленных на основе озонированной и не озонированной воды, определяли исходное количество тестируемых бактерий и количество бактерий, выделенных при концентрации дезинфицирующего средства preMBC.С этой целью была сделана серия десятичных разведений приготовленной суспензии данного штамма и затем посеяна на агар CAB (колумбийский агар с 5% овечьей кровью, bioMérieux, Марси-л’Этуаль, Франция). Культуры инкубировали при 37 ° C в течение 24 ч. По истечении этого времени выросшие колонии подсчитывали и переводили в логарифмические единицы. Аналогичным образом обрабатывалась суспензия, подвергавшаяся действию дезинфицирующего средства в концентрации, непосредственно предшествующей МБК (преМВС). Для определения preMBC значение МБК из таблицы 3 было проверено, и непосредственно предшествующая концентрация была выбрана из таблицы 2.Уменьшение количества бактерий рассчитывали по формуле: где:R — уменьшение количества бактерий (log КОЕ) log i — количество исходных бактерий log preMBC — количество бактерий, выделенных из суспензии, обработанной дезинфицирующим средством с концентрацией preMBC 2.7. Оценка стабильности растворов QAC 2, OA 3 и ChC1Три дезинфицирующих средства, для которых коэффициент эффективности был самым низким, были оценены на стабильность (QAC 2, OA 3 и ChC 1).Приготовленные рабочие растворы как в озонированной, так и в озонированной воде хранили при комнатной температуре. Эффективность этих агентов в отношении штаммов L. monocytogenes оценивали сразу после приготовления растворов, через 12 и 24 ч, определяя значения МБК в отдельные интервалы времени. Эта часть эксперимента была разработана, чтобы оценить, не продлевается ли возможное повышение эффективности дезинфицирующих средств из-за некоторых реакций между озоном и активными веществами. На основе значений MBC был рассчитан коэффициент A для конкретного дезинфицирующего средства, штаммов и времени хранения. 2,8. Статистический анализСтатистический анализ выполнялся в программе STATISTICA 13.1 PL (StatSoft). Оценивалась значимость различий между эффективностью озонированной воды, значениями МБК дезинфицирующих средств, снижением количества L. monocytogenes и коэффициентами максимальной эффективности дезинфицирующих средств. 2.8.1. Биоцидная эффективность озонированной и не озонированной водыБыло проверено, как значение МБК озонированной воды менялось в зависимости от времени (0, 1 и 2 часа) и L.monocytogenes. Эксперимент проводили в 3-х повторностях. В качестве независимых переменных рассматривались деформация, а также время, прошедшее после озонирования воды, и в качестве зависимой переменной было признано определенное значение МБК. Проверяли достоверность различий между средними значениями MBC для комбинации обеих независимых переменных. Для этого использовались генеральные линейные модели (ГЛМ). Был проведен многофакторный дисперсионный анализ. Апостериорный критерий Тьюки использовался для значимости α = 0.05. 2.8.2. Оценка эффективности дезинфицирующих средствБыло проверено, как значение МБК тестируемых дезинфицирующих средств варьировалось в зависимости от типа воды (озонированная / не озонированная), используемой для приготовления растворов. Эксперимент проводили в 3-х повторностях. В качестве независимых переменных обрабатывались дезинфицирующее средство, тип воды, а также штамм, а в качестве зависимой переменной было признано определенное значение дезинфицирующих средств MBC. Проверяли достоверность различий между средними значениями MBC для комбинации всех независимых переменных.Для этого использовались генеральные линейные модели (ГЛМ). Был проведен многофакторный дисперсионный анализ. Апостериорный критерий Тьюки был использован для значимости α = 0,05. 2.8.3. Уменьшение количества бактерийБыло проверено, как уменьшение количества бактерий варьируется в зависимости от типа воды (озонированная / не озонированная), используемой для приготовления дезинфицирующих растворов. Эксперимент проводили в 3-х повторностях. В качестве независимых переменных рассматривался тип воды, а в качестве зависимой переменной было признано определенное уменьшение количества бактерий.Проверялась достоверность различий между средним снижением, полученным для конкретного дезинфицирующего средства, в зависимости от типа воды. Для этого использовались генеральные линейные модели (ГЛМ). Был проведен односторонний дисперсионный анализ. Апостериорный критерий Тьюки был использован для значимости α = 0,05. 2.8.4. Коэффициенты максимальной эффективности дезинфицирующих средствПроверено, как изменяются коэффициенты максимальной эффективности дезинфицирующих средств в зависимости от типа воды (озонированная / не озонированная), используемой для приготовления дезинфицирующих растворов.Эксперимент проводили в 3-х повторностях. В качестве независимых переменных рассматривался тип воды, а в качестве зависимой переменной были признаны определенные коэффициенты максимальной эффективности дезинфицирующих средств. Проверялась достоверность различий между средним значением коэффициента, полученным для конкретного дезинфицирующего средства, в зависимости от типа воды. Для этого использовались генеральные линейные модели (ГЛМ). Был проведен односторонний дисперсионный анализ. Апостериорный критерий Тьюки был использован для значимости α = 0,05. 4.ОбсуждениеОзон — одно из сильнейших дезинфицирующих средств, которое проявляет активность после короткого времени контакта и в низкой концентрации. Обладает биоцидным действием на многие виды микроорганизмов [4]. Исследования Muthukumar и Muthuchama [20] подтвердили снижение количества микроорганизмов на 2,00 × 10 6 КОЕ в 1 г сырых образцов курицы. В то время как Sheelamary и Muthukumar [21] показали полную инактивацию микроорганизмов, выделенных из образцов молока и продуктов из него, всего через 15 мин с выбросом 0.2 г O 3 / ч. В литературе были обнаружены исследовательские работы по оценке эффективности газового озона в сочетании с различными физическими методами [22,23,24,25]. Sung et al. [23] исследовали действие газового озона и высокой температуры на инактивацию L. monocytogenes, присутствующих в яблочном соке. Синергетический эффект был получен при температуре 50 ° C. Kumar et al. [25] во время 10-минутного воздействия газообразного озона и УФ-излучения показали снижение количества L. monocytogenes в свежем рассоле более чем на 9 log КОЕ / мл, а ежечасное озонирование в сочетании с десятиминутным УФ-облучением привело к снижению микробов более 5 log КОЕ / мл в использованных рассолах.Влияние низких концентраций озона и ионов металлов на уменьшение L. monocytogenes было изучено Kang et al. [26], которые показали, что использование озона в концентрациях 0,2 и 0,4 ppm в сочетании с 1 мМ CuCl 2 и 0,1 мМ AgNO 3 на 30 мин намного эффективнее, чем использование озонированной воды (стр. 27), влияние газового озона и озона в воде на выживание клеток Pseudomonas fluorescens, Staphylococcus aureus и L. monocytogenes в структуре биопленки на поверхности нержавеющей стали.Они показали, что использование озона в водном растворе влияет на снижение количества бактерий на 1,61–2,14 log КОЕ / см 2 после 20 минут воздействия, в то время как значения снижения были выше (3,26–5,23 log КОЕ / см 2 ) в случае биопленок, обработанных озоном в условиях динамического потока. Они также показали, что S. aureus является наиболее чувствительным видом к озону, растворенному в воде [27]. Korany et al. [28] показали, что использование озонированной воды (1 мин) против структуры L.monocytogenes на поверхности полистирола в концентрациях 1,0, 2,0 и 4,0 ppm приводили к снижению количества бактерий на 0,9, 3,4 и 4,1 log КОЕ / см 2 , соответственно. Кроме того, Korany et al. [28] обнаружили, что соединения четвертичного аммония (QAC) (100/400 ppm), хлор (100/200 ppm), диоксид хлора (2,5 / 5,0 ppm) и перуксусная кислота (PAA) (80/160 ppm) приводят к снижению 2,4 / 3,6, 2,0 / 3,1, 2,4 / 3,8 и 3,6 / 4,8 log КОЕ / см 2 , соответственно. Антимикробная эффективность всех протестированных дезинфицирующих средств против 7-дневного L.monocytogenes была значительно ниже по сравнению с двухдневными биопленками, а возраст биопленки оказывал незначительное влияние на эффективность ПАК [28].На сегодняшний день информации о синергетическом действии озонированной воды и дезинфицирующих средств не обнаружено. Однако следует ожидать, что внедрение раствора дезинфицирующих средств на основе озонированной воды повысит эффективность тестируемых средств, по крайней мере, до уровня аддитивного действия. В этом исследовании оценивалась биоцидная эффективность озонированной и не озонированной воды.Не озонированная вода характеризовалась полным отсутствием биоцидной активности в отношении всех испытанных штаммов L. monocytogenes. Озонированная вода, используемая сразу после приготовления, содержащая 1,86–1,96 мкг O 3 / см 3 , была эффективной для всех протестированных изолятов. Штаммы LMO-M и LMO-R характеризовались самой высокой устойчивостью (МБК: 1,96 мкг / см 3 ), а штамм LMO-ATCC (МБК: 1,86 мкг / см 3 ) был наиболее чувствительным. Fishburn et al. [29] показали, что использование озонированной воды при мытье овощей может вызвать уменьшение количества L.monocytogenes примерно на 0,5 log КОЕ / г (брокколи, салат) до 1,5 log КОЕ / г (зеленый лук) по сравнению с промыванием в не озонированной воде. Larivière-Gauthier et al. [30] показали, что использование озонированной воды, содержащей 3,5 промилле озона, повышает эффективность очистки и дезинфекции на предприятии по разделке свинины, увеличивая долю свободных поверхностей от L. monocytogenes на 12,5%. Arayan et al. [11] показали, что наименьшая биоцидная концентрация против Staphylococcus aureus (штаммы, выделенные из пищевых продуктов) составляла 0.5 ppm озона при времени воздействия 0,1 мин. Добавление органических загрязнителей, таких как эмбриональная бычья сыворотка (FBS), привело к снижению биоцидной эффективности озонированной воды [11]. Также Korany et al. [28] показали меньшую эффективность дезинфицирующих средств, в том числе озонированной воды, в случае наличия в окружающей среде органических загрязнений (разбавленное молоко и яблочный сок). Результаты нашего исследования показали, что после 1 и 2 ч хранения озонированной воды ее активность снизилась, о чем свидетельствует необходимость использования более высоких концентраций озона для устранения L.monocytogenes после длительного хранения в озонированной воде. Вероятно, это связано с разложением озона, который нестабилен и имеет водостойкость 20–40 мин. Это подтверждают исследования Białoszewski et al. [12], которые использовали озонированную воду через 30 мин ее приготовления и наблюдали снижение концентрации озона с исходных 2,5–3,0 мкг / мл до 1,3–1,5 мкг / мл. Несмотря на снижение содержания озона, они не показали снижения биоцидной эффективности воды.Исследования, проведенные Seki et al. [10] показали, что хранение озонированной воды при 4 ° C и 25 ° C существенно влияет на ее долговечность. Наибольшее снижение (90,0%) концентрации озона было отмечено после одной недели хранения при 25 ° C. Однако испытания, проведенные Seki et al. При 4 ° C. [10] показали, что через неделю концентрация озона в воде поддерживается на уровне выше 90%, через месяц около 65%, а через год хранения озон в воде не обнаруживается. Подтвержден эффект биоцидной озонированной воды, хранящейся при 4 ° C, против Escherichia coli.Seki et al. [10] также оценили влияние замораживания и оттаивания на стойкость озона в воде. Они показали, что первый цикл замораживания-оттаивания не повлиял на концентрацию озона в воде, но после четырех циклов было обнаружено, что концентрация озона снизилась примерно до 90% [10]. Это исследование позволило оценить и сравнить биоцидную эффективность растворов. из тринадцати выбранных дезинфицирующих средств, изготовленных с использованием не озонированной воды и озонированной воды против штаммов L. monocytogenes. Было показано, что дезинфицирующие средства на основе озонированной воды характеризуются более высокой микробицидной эффективностью по сравнению с растворами на основе не озонированной воды и более эффективны, чем только озонированная вода.Это показывает синергетический эффект озонированной воды и дезинфицирующих средств. Это может быть связано с одним и тем же целевым сайтом тестируемого соединения и озона в бактериальных клетках. Например, ЧАС или перуксусная кислота действуют аналогично озону, дестабилизируя мембрану бактериальной клетки, делая ее более проницаемой [31,32]. Синергетический механизм действия также может быть результатом воздействия озона и активного вещества дезинфицирующих средств на другие структуры бактериальной клетки, что приведет к усилению микробицидного эффекта.Окисляющие соединения (например, перекись водорода, хлорноватистая кислота и надуксусная кислота) вызывают окисление тиоловых групп остатков цистеина, которые часто обнаруживаются в активных центрах многих бактериальных ферментов, таких как, например, дегидрогеназы. Использование озонированной воды для приготовления растворов улучшает микробицидные свойства всех протестированных дезинфицирующих средств, за исключением наносеребра. Наибольшее влияние озонированной воды на эффективность дезинфицирующих средств отмечено для соединений четвертичного аммония.Этот тип дезинфицирующих средств показал наивысшую биоцидную эффективность против тестируемых изолятов. Сильная биоцидная активность соединений четвертичного аммония против штаммов L. monocytogenes подтверждается результатами Chavant et al. [33], которые показали 98% эффективность в уничтожении планктонных форм. Напротив, Aarnisalo et al. [34] показали, что соединения четвертичного аммония характеризуются меньшей биоцидной эффективностью против штаммов L. monocytogenes, чем дезинфицирующие средства на основе хлора, этанола, изопропанола и перуксусной кислоты.В нашем исследовании штамм LMO-R оказался наиболее устойчивым к действию препаратов NANO 1, OA 2 и OA 3, относящихся к окислительным соединениям, а штамм LMO-M оказался наиболее устойчивым к соединению ChC 1 из группы производных хлора. Штамм LMO-ATCC характеризовался наивысшей чувствительностью к ChC 1. Heir et al. [35] и Popowska et al. [36] показали различную чувствительность L. monocytogenes к дезинфицирующим средствам в зависимости от происхождения штамма.В проведенных исследованиях также оценивалась долговечность решений с самым низким показателем эффективности для QAC 2, OA 3 и ChC 1.Снижение биоцидной активности дезинфицирующих растворов, приготовленных с использованием не озонированной воды, может указывать на то, что они постепенно инактивируются во время хранения. Результаты нашего исследования показывают, что озонированная вода обладает микробицидными свойствами. Поскольку озонированная вода и дезинфицирующие средства проявляют синергетический эффект биоцидного действия, их комбинация может использоваться для более эффективного уничтожения микроорганизмов. Кроме того, озонированная вода может снизить рабочую концентрацию дезинфицирующих средств. Однако важно помнить о коротком периоде полураспада озона и использовать его непосредственно или через короткое время после приготовления соответствующих дезинфицирующих растворов. Для выяснения механизма совместного действия дезинфицирующих средств и озонированной воды на нарушение структуры бактериальной клетки необходимы дальнейшие исследования. В нашем исследовании использовался колумбийский агар с 5% овечьей крови, который является неселективной средой. Использование такой среды обеспечивало подходящие условия для регенерации сублетальных поврежденных клеток. Присутствие селективных и дифференциальных агентов в среде может ингибировать рост таких клеток по сравнению с неселективной средой, и, таким образом, подсчеты, полученные из обработанных образцов, перечисленных на селективных средах, обычно ниже, чем те, которые получены из неселективных сред.Эта тенденция подтверждается исследованиями Fouladkhah et al. [37], которые показали, что при оценке роста бактерий на селективной среде в день 0 количество колоний колебалось от 1,5 ± 0,8 до 2,0 ± 0,8 log КОЕ / см 2 и увеличивалось до значений от 2,9 ± 0,5 до 4,3 ± 0,4. log КОЕ / см 2 на 7 сутки. В свою очередь, результаты, полученные после культивирования на неселективных средах, находились в диапазоне от 2,0 ± 0,5 до 2,3 ± 0,4 log КОЕ / см 2 в день 0 и от 6,4 ± 0,6 до 7,1 ± 0,4 log CFU / см 2 в день. 7 [37].Как сделать лучший выбор для объектовДезинфекция и дезинфекция, Образовательная Вернуться к новостям Зачем лечить? Почти каждая среда на планете содержит бактерии и микроорганизмы. Вы можете быть удивлены, узнав, что на одном квадратном дюйме кожи человека насчитывается более 600 000 бактерий 1 . Большинство бактерий безвредны для человека. Но болезнетворные организмы, называемые патогенами, могут быть опасными или даже смертельными.Одно из самых заразных и опасных заболеваний в новейшей истории — COVID-19, вызываемое вирусом SARS-CoV-2. Регулярное использование правильных типов дезинфицирующих средств на поверхностях в вашем учреждении имеет решающее значение для предотвращения распространения болезней и заболеваний, таких как COVID, грипп (грипп) и простуда. Поскольку на рынке представлено множество типов дезинфицирующих средств, важно понимать, как они работают, включая их плюсы и минусы, чтобы принять обоснованное решение о том, как лучше всего дезинфицировать и защитить людей, находящихся на вашем предприятии. Как действуют дезинфицирующие средства? Дезинфицирующие средства — это химические вещества, применяемые к неживым объектам с целью уничтожения бактерий, вирусов, грибков, плесени или грибка, обитающих на объектах. По определению, формула дезинфицирующего средства должна быть зарегистрирована в Агентстве по охране окружающей среды (EPA). «Активный ингредиент» в каждой формуле дезинфицирующего средства — это то, что убивает патогены, обычно разрушая или повреждая их клетки. Активным ингредиентам обычно помогают другие ингредиенты с различными целями.Например, поверхностно-активные вещества могут быть добавлены в формулу дезинфицирующего средства для обеспечения равномерного смачивания поверхности или для облегчения очистки. Основные виды дезинфицирующих средств, категорически говоря Несколько широких категорий дезинфицирующих средств используются при обслуживании коммерческих и промышленных объектов. Ниже приведены несколько наиболее распространенных типов. Хотя это не исчерпывающий список, они охватывают подавляющее большинство используемых сегодня. Если вам нужна более подробная информация о плюсах и минусах этих типов дезинфицирующих средств, обратитесь к таблице «Жидкие дезинфицирующие средства 101» компании Nyco. Особо следует отметить: когда такой возбудитель, как SARS-CoV-2, вызывающий COVID-19, первоначально идентифицируется экспертами, он классифицируется как «новый патоген». EPA разрешает только определенные дезинфицирующие средства быть признаны эффективными против появляющихся патогенов. У Nyco есть несколько дезинфицирующих средств с этим особым заявлением. Прочтите этикетку дезинфицирующего средства, чтобы определить, есть ли на нем заявка на появление нового патогена.
Что следует учитывать при выборе дезинфицирующего средства Есть четыре основных момента, которые следует учитывать при выборе дезинфицирующего средства, которое наилучшим образом соответствует потребностям вашего учреждения. Ответы на эти вопросы дадут вам основу для определения лучшего продукта (ов) для использования в вашей организации. 1. Эффективность Убивает ли дезинфицирующее средство микробы и патогены, вызывающие наибольшую озабоченность в вашем учреждении? Например, вас может сильно беспокоить Staphylococcus aureus, устойчивый к метициллину (MRSA).Некоторые дезинфицирующие средства одобрены EPA как эффективные против этих бактерий . Nyco® Uno — одно из таких дезинфицирующих средств. Имейте в виду, что патогены могут иметь несколько штаммов, а дезинфицирующие средства сертифицированы для определенных штаммов. Uno также эффективен против Staphylococcus aureus (CA-MRSA), устойчивого к метициллину, вызываемого сообществом. В зависимости от вашей отрасли и типа учреждения — здравоохранения, образования, долгосрочного ухода, гостеприимства — у вас будут разные потребности и требования. 2.Время убийства Как быстро дезинфицирующее средство убивает определенный патоген? Сохраняет ли продукт видимую влажность поверхностей, чтобы выдержать это время уничтожения? Опять же, формулы дезинфицирующих средств зарегистрированы для уничтожения определенных патогенов в течение определенного периода времени, и они должны быть влажными на поверхности все время, чтобы активно работать. Типичное время убийства — от 30 секунд до 5 минут. Если дезинфицирующему средству требуется 10 минут, убедитесь, что оно действительно останется влажным так долго.Дезинфицирующие средства на спиртовой основе могут очень хорошо испаряться до требуемого времени контакта. Прочтите и соблюдайте все инструкции по применению и, при необходимости, увлажнению. 3. Безопасность Безопасен ли продукт для людей и безопасен для поверхностей, на которые он наносится? Как вы узнали ранее в этой статье, некоторые категории дезинфицирующих средств токсичны, некоторые окрашивают, другие вызывают коррозию, а третьи имеют нежелательный запах. Проверьте показатели токсичности и воспламеняемости продуктов, а также любые рекомендации по средствам индивидуальной защиты (СИЗ) для дезинфицирующих средств, которые вы применяете.Убедитесь, что дезинфицирующее средство не повредит какую-либо поверхность, для которой оно предназначено. 4. Простота использования Практичны ли шаги, необходимые для использования данного дезинфицирующего средства, в вашем учреждении? Некоторые приложения требуют выполнения нескольких шагов, что не всегда возможно. Жесткость воды — это один из факторов, который может повлиять на эффективность некоторых формул дезинфицирующих средств. Sani-Spritz Spray очищает и дезинфицирует всего за один шаг, что делает его лучшим выбором в качестве простого, готового к использованию дезинфицирующего средства, которое борется с широким спектром бактерий, вирусов, грибков и плесени в больницах, учреждениях и на производстве. Сортировка информации о различных типах дезинфицирующих средств требует времени, но это важный шаг для обеспечения того, чтобы вы принимали наилучшее решение по техническому обслуживанию для своего учреждения. Наличие под рукой подходящих продуктов и надежного плана по предотвращению заболеваний и инфекций сэкономит усилия и расходы в будущем, а также даст дополнительное душевное спокойствие вам, вашим сотрудникам и любым посетителям, которые проходят через ваши двери. 1 Разъясненная наука. «Мы окружены». Наука разъяснена.com. http://www.scienceclarified.com/scitech/Bacteria-and-Viruses/We-Are-Surounded.html (по состоянию на 21 февраля 2016 г.) Метки: дезинфицирующее средство, дезинфицирующие средства, перекись водорода Теплица и цветоводство: очистка и дезинфекция теплицыПервые шаги к чистой теплицеЕсли у вас были повторяющиеся проблемы с такими болезнями, как корневая гниль Pythium или насекомыми, такими как грибные мошки, возможно, ваша теплица и участки для выращивания горшечных культур нуждаются в хорошей очистке.В процессе выращивания сельскохозяйственных культур на влажных поверхностях накапливаются инфекционные микробы, а на влажных поверхностях разрастаются водоросли, являющиеся укрытием для грибных мошек и прибрежных мух. Внимание к санитарии и дезинфекции теплицы — это шаги, которые производители могут выполнять между циклами выращивания. Некоторые производители ждут недели, прежде чем открывать теплицу, прежде чем убирать мусор, оставшийся от предыдущего вегетационного периода. Лучше очистить как можно раньше, чтобы исключить места зимовки вредителей, чтобы сократить их популяцию до начала весеннего вегетационного периода.Вредителей гораздо легче предотвратить, чем вылечить. Хотя дезинфекцию следует проводить регулярно, время не всегда позволяет выполнить эти дополнительные усилия. Воспользуйтесь возможностью тщательно очистить теплицы между циклами выращивания, когда теплицы полностью пусты. ОчисткаОчистка включает в себя физическое удаление сорняков, мусора и почвы и является первым шагом перед дезинфекцией теплицы и оборудования. Некоторые производители используют пылесос для уборки бетонных и покрытых полов для удаления мусора.Почва и органические остатки растений и питательных сред снижают эффективность дезинфицирующих средств. Есть некоторые чистящие средства, специально разработанные для использования в теплицах, например Strip-It, который представляет собой комбинацию серной кислоты и смачивающих агентов, созданных для удаления водорослей, грязи и отложений жесткой воды. Также возможна мойка под высоким давлением с мылом и водой. Мыло особенно полезно для удаления жирных отложений, однако необходимо тщательное ополаскивание, поскольку остатки мыла могут дезактивировать некоторые дезинфицирующие средства, такие как Q-соли. Начните с вершины и двигайтесь вниз. Подметите стены и внутренние конструкции и очистите пол от почвы, органических веществ и сорняков. Организмы, вызывающие заболевания, могут поселиться на стропилах, подоконниках, верхних частях подвесных трубопроводов и складках пластика. Особый уход необходим для очистки этих участков, а также текстурированных поверхностей, таких как бетон и дерево, которые могут скрывать многие виды организмов. Установите физические барьеры из циновок от сорняков, если полы покрыты грязью или гравием, и отремонтируйте существующие маты.Барьеры от сорняков предотвращают появление сорняков и облегчают борьбу с водорослями. Избегайте использования камня на коврике с сорняками, который будет задерживать почву и влагу, создавая идеальную среду для сорняков, болезней, насекомых и водорослей. Системы орошения также следует очищать от грязи и отложений организмов (также называемых биопленкой) в конце вегетационного периода. Фермеры часто используют продукты с маркировкой для очистки ирригационных систем, такие как серная кислота и смачивающее средство (Strip-It) или дезинфицирующие средства, содержащие перекись водорода и пероксиуксусную кислоту (SaniDate), чтобы смыть слизь и мусор. Преимущества дезинфекции теплицыСо многими патогенами можно до некоторой степени бороться с помощью дезинфицирующих средств. Например, частицы пыли из упавшей питательной среды или горшков могут содержать бактерии или грибы, такие как Rhizoctonia или Pythium . Дезинфицирующие средства помогут контролировать эти патогены. Помимо патогенов растений, некоторые дезинфицирующие средства также предназначены для борьбы с водорослями, которые являются питательной средой для грибных мошек и прибрежных мух. Управление водорослямиВодоросли — это разнообразные группы растений, которые встречаются в самых разных средах.Рост водорослей на дорожках, водопроводных трубах, оборудовании, покрытиях теплиц, на скамейках или под ними и в горшках является постоянной проблемой для производителей. Водоросли образуют непроницаемый слой на поверхности среды, который предотвращает смачивание среды и может засорить линии орошения и запотевания, а также излучатели. Это источник пищи для насекомых-вредителей, таких как прибрежные мухи, и вызывает скользкие дорожки, которые могут стать серьезным риском для рабочих и клиентов. Недавние исследования показали, что водоросли попадают в теплицу через источники воды и из торфа в среде выращивания.Попав в теплую влажную среду с удобрениями, водоросли процветают. Правильное использование воды и удобрения могут помочь замедлить рост водорослей. Избегайте чрезмерного полива медленнорастущих растений и особенно сельскохозяйственных культур на ранних этапах производственного цикла. Дайте поверхности среды высохнуть между поливами. Избегайте чрезмерного стекания удобрений и луж на полах, скамейках и поверхностях теплиц. Пол теплицы должен быть ровным и должен иметь надлежащий дренаж, чтобы предотвратить скапливание воды перед установкой физического барьера для защиты от сорняков. Борьба с водорослями включает комплексный подход, включающий санитарию, изменение окружающей среды и частое использование дезинфицирующих средств. Вода для полива также может быть источником болезнетворных микроорганизмов и водорослей. Для получения информации о технологиях очистки воды для борьбы с водорослями см. Водный образовательный альянс для садоводства: http://www.watereducationalliance.org/ Скамейки и рабочие столы для теплицПо возможности используйте скамейки из проволоки, которые легко дезинфицируются.Деревянные скамейки могут быть источником болезней корневой гнили и заражения насекомыми. Водоросли имеют тенденцию расти на поверхности древесины, создавая идеальную среду для грибных мошек и прибрежных мух, а патогенные микроорганизмы растений могут расти в древесине. У растений, укореняющихся в древесине через контейнеры, разовьется корневая гниль, если условия благоприятны для активности патогенов. Дезинфицируйте скамейки между циклами сбора урожая одним из указанных ниже продуктов. Имейте в виду, что дезинфицирующие средства не являются защитными средствами. Они могут уничтожить определенные патогены, но будут иметь небольшую остаточную активность. Столешницы и рабочие столы должны быть изготовлены из непористой поверхности, например, из ламината, который можно легко дезинфицировать. Избегайте использования голой древесины для этих задач. Очистка контейнеровПатогены растений, такие как Pythium , Rhizoctonia и Thielaviopsis , могут выжить в остатках корней или частицах почвы на поверхностях теплиц. Если у урожая возникла проблема, связанная с заболеванием, избегайте повторного использования контейнеров. Также рекомендуется избегать посадки культур, склонных к проблемам Thielaviopsis , таких как анютины глазки, в контейнеры, которые использовались ранее.Исследования показали, что споры Thielaviopsis способны выживать на переработанных лотках для пробок и заражать новые культуры. Емкости, предназначенные для повторного использования, перед обработкой дезинфицирующим средством следует тщательно промыть, чтобы удалить частицы почвы и растительный мусор, даже если нет признаков заболевания сельскохозяйственных культур. Мусор и органические вещества могут защитить болезнетворные микроорганизмы от контакта с дезинфицирующим раствором. Дезинфицирующие средства для теплицСуществует несколько различных типов дезинфицирующих средств, которые в настоящее время используются в теплицах для борьбы с патогенами растений и водорослями.Это соединения четвертичного аммония (Green-Shield®, Physan 20® и KleenGrow ™), диоксид водорода (ZeroTol® 2.0, Oxidate® 2.0), пероксид водорода и пероксиуксусная кислота (Sanidate®), пероксид водорода, пероксиуксусная кислота и октановая кислота. (X ™ -3), пероксигидрат карбоната одия (GreenClean Pro Granular Algicide) и хлорный отбеливатель. Здесь упоминается алкоголь, хотя он и не используется в качестве общего дезинфицирующего средства, потому что он используется производителями для дезинфекции инструментов для размножения. Все эти продукты обладают разными свойствами.Если возможно, дезинфицирующие средства следует использовать на регулярной основе как в рамках программы очистки перед посевом, так и во время цикла сбора урожая. Соли хлорида четвертичного аммония (Green-Shield®, Physan 20®, KleenGrow ™ ). Продукты Q-salt, обычно используемые производителями, довольно стабильны и хорошо работают при использовании в соответствии с инструкциями на этикетке. Q-соли помечены для грибковых, бактериальных и вирусных патогенов растений и водорослей. Их можно наносить на полы, стены, скамейки, инструменты, горшки и квартиры в качестве дезинфицирующих средств.Physan 20® также предназначен для обработки семян, срезанных цветов и растений. Внимательно прочтите и следуйте инструкциям на этикетке. Рекомендации могут отличаться в зависимости от предполагаемого использования продукта. Например, этикетка Green-Shield® рекомендует замачивать предметы, подлежащие дезинфекции, на 10 минут, а пешеходные дорожки — на час и более. Инструкции рекомендуют сушить поверхности на воздухе после обработки, за исключением режущих инструментов. На этикетке рекомендуется замачивать режущие инструменты на 10 минут перед использованием, а затем использовать влажный инструмент для обработки растений.Один из способов сделать это — использовать два режущих инструмента, одну пару использовать, пока другая замачивает. KleenGrow имеет более высокие органические допуски и более длительную остаточную активность на твердых поверхностях. Q-соли не являются защитными средствами. Они могут уничтожить определенные патогены, но будут иметь небольшую остаточную активность. Контакт с любым типом органических веществ приведет к их инактивации. Поэтому перед нанесением необходимо предварительно очистить объекты, чтобы удалить органические вещества. Поскольку трудно определить, когда они становятся неактивными, часто готовьте свежие растворы (два раза в день при постоянном использовании).В активном состоянии продукты имеют тенденцию к небольшому вспениванию. Когда пенообразование прекращается, это признак того, что они больше не эффективны. Ополаскивание водой не требуется. Двуокись водорода и пиероксиуксусная кислота (ZeroTol® 2.0, OxiDate® 2.0, SaniDate ®12.0 ) Двуокись водорода убивает бактерии, грибки, водоросли и их споры сразу при контакте. Он отмечен как дезинфицирующее средство для использования на поверхностях теплиц, оборудовании, скамейках, горшках, лотках и инструментах, а также для использования на растениях.В рекомендациях на этикетке указано, что перед обработкой все поверхности следует тщательно смочить. Отмечены некоторые меры предосторожности. Двуокись водорода обладает сильным окислительным действием, и ее нельзя смешивать с другими пестицидами или удобрениями. При нанесении непосредственно на растения фитотоксичность может проявляться для некоторых культур, особенно при применении с дозами, превышающими указанные, или если растения находятся в состоянии стресса. Двуокись водорода можно применять через систему орошения. В виде концентрата он вызывает коррозию и вызывает повреждение или раздражение глаз и кожи.Внимательно прочтите и соблюдайте меры предосторожности на этикетке. Обратите внимание, что OxiDate® и SaniDate являются органическими продуктами. Перекись водорода, пероксиуксусная кислота и октановая кислота (X ™ -3) — это сильный окислитель, используемый в качестве альгецида в тепличных конструкциях и полах, и предназначен для использования в химии. Соблюдайте указанные на этикетке нормы и меры предосторожности. Пероксигидрат карбоната натрия (GreenClean Pro Granular Algaecide®) — гранулированный продукт, активируемый водой. При активации пероксидрат карбоната натрия распадается на карбонат натрия и пероксид водорода.GreenClean предназначен для борьбы с водорослями в любой непищевой воде или поверхностях. Нецелевые растения получают контактный ожог, если на них случайно проливаются неразбавленные гранулы. Хлорный отбеливатель. Существуют более стабильные продукты, чем отбеливатель, для дезинфекции поверхностей теплиц. Хлорный отбеливатель можно использовать для горшков или квартир, но его не рекомендуется наносить на стены, скамейки или пол. При правильном использовании хлор является эффективным дезинфицирующим средством и уже много лет используется фермерами.Раствор хлорного отбеливателя и воды недолговечен, а период полураспада (время, необходимое для 50-процентного снижения прочности) раствора хлора составляет всего два часа. По прошествии двух часов количество хлора составляет лишь половину от того количества хлора, которое было вначале. Через четыре часа остается только четверть и так далее. Чтобы обеспечить эффективность хлорных растворов, их следует готовить свежими непосредственно перед каждым использованием. Обычно используется концентрация: одна часть бытового отбеливателя (5,25 процента гипохлорита натрия) на девять частей воды, что дает конечную концентрацию 0.5 процентов. Хлор вызывает коррозию. Повторное использование растворов хлора может быть вредным для пластмасс или металлов. Предметы, которые нужно продезинфицировать хлором, необходимо замачивать в течение 30 минут, а затем промыть водой. Кто-то скажет, что полоскание не требуется. Отбеливатель следует использовать в хорошо проветриваемом помещении. Также следует отметить, что отбеливатель фитотоксичен для некоторых растений, например для пуансеттии. Спирт (70 процентов) — очень эффективное дезинфицирующее средство, которое действует почти сразу при контакте.Это непрактичный материал для замачивания из-за его горючести. Тем не менее, его можно использовать для обработки ножей или режущих инструментов погружением или смахиванием. Ополаскивание водой не требуется. Дезинфицирующие средства следует использовать на регулярной основе как в рамках программы очистки перед посевом, так и во время цикла сбора урожая. Органические дезинфицирующие средства , внесенные в список Organic Material Review Institute, включают OxiDate 2.0, SaniDate 12.0 и PERpose Plus. Этиловый или изопропиловый спирт используется для дезинфекции инструментов. Органические производители должны всегда уточнять у своей сертифицирующей организации, прежде чем использовать какой-либо новый материал в своей практике выращивания. Список продуктов см .: Институты по изучению органических материалов (OMRI), www.omri.org. Эта информация предоставлена с пониманием того, что не предполагается никакой дискриминации и не подразумевается одобрение. В связи с постоянно меняющимися правилами мы не несем ответственности за предложения. Если какая-либо информация в этой статье не соответствует этикетке, следуйте этикетке. Меры по предотвращению заражения болезнями
Ссылки и ресурсы
Этикетки для пестицидовОбновлено 2015 Тина Смит Программа«Тепличные культуры и цветоводство» — на пенсии Массачусетский университет, Амхерст . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||

 После проведения ПСО необходимо провести азопирамовую пробу на наличие остатков крови. Если проба отрицательная, то инструмент можно стерилизовать, если проба положительная, необходимо повторно провести ПСО, затем пробу до получения нужного результата.
После проведения ПСО необходимо провести азопирамовую пробу на наличие остатков крови. Если проба отрицательная, то инструмент можно стерилизовать, если проба положительная, необходимо повторно провести ПСО, затем пробу до получения нужного результата.
 д.
д. 5.2528-09 «Организация дезинфекционных и стерилизационных мероприятий в лечебно-профилактических организациях. Дополнение N 2 к СанПиН 2.1.3.1375-03»
5.2528-09 «Организация дезинфекционных и стерилизационных мероприятий в лечебно-профилактических организациях. Дополнение N 2 к СанПиН 2.1.3.1375-03»
