симптомы и лечение — Рамблер/доктор
Фото: ВикипедияСинегнойная палочка: симптомы и лечениеСинегнойная палочка — род грамотрицательных аэробных неспорообразующих бактерий — Pseudomonas. У многих людей синегнойная палочка вызывает только незначительные симптомы. Однако, если у человека ослаблен иммунитет, угроза может быть очень серьезной и опасной для жизни.
Синегнойная палочка — микробиология
Pseudomonas (Псевдомонады) — общий род бактерий, который может вызвать инфекции в организме при определенных обстоятельствах. Существует много разных типов бактерий Псевдомонады. Только несколько типов могут вызвать инфекцию.
Псевдомонады, как правило, живут и размножаются в воде, почве и влажных районах. Чем теплее и влажнее, тем лучше условия для размножения бактерий.
Хирургические манипуляции или открытые раны могут увеличить риск заражения. Люди с ослабленной иммунной системой также подвержены тяжелым инфекциям Pseudomonas.
Синегнойная палочка может вызвать инфекции уха и кожи, особенно после воздействия воды.
Существуют определенные группы людей, которые уязвимы к инфекциям Pseudomonas. К ним относятся люди:
с ожоговыми ранами;
перенесшие операцию;
использующие катетер;
проходящие химиотерапию;
имеющие диабет;
с диагнозом кистозный фиброз;
Синегнойная палочка — симптомы
Области тела, которые поражает инфекция — это уши, кожа, легкие, мягкие ткани и кровь. Общие симптомы инфекции включают:
Уши — боль, зуд и выделение из уха;
Глаза — боль и покраснения;
Легкие: пневмония, кашель;
Мягкая ткань — выделение зеленого гноя и сладкий фруктовый запах;
Кровь — боль и скованность суставов, лихорадка, озноб и слабость;
Другие возможные симптомы — головная боль, диарея или инфекция мочевых путей.
Синегнойная палочка — диагностика
Чтобы диагностировать инфекцию, причиной которой стала Pseudomonas, врач спросит о любых недавних действиях, которые могут иметь значение, например, плавании или использовании горячей ванны. Он также проведет физическое обследование. Врач назначит анализ крови или жидкости, чтобы подтвердить диагноз.
Он также проведет физическое обследование. Врач назначит анализ крови или жидкости, чтобы подтвердить диагноз.
Синегнойная палочка — лечение
Антибиотики — лучший вариант лечения Pseudomonas или других бактериальных инфекций.
Некоторые разновидности Pseudomonas требуют агрессивного подхода с применением мощных препаратов. Чем раньше начинается лечение, тем эффективнее остановить инфекцию. Это особенно актуально в больничной среде. Бактерии в больницах регулярно подвергаются воздействию антибиотиков и со временем у них развивается устойчивость к этим препаратам. Это затрудняет лечение.
Как только врачи определяют, какой тип бактерий Pseudomonas вызывает инфекцию, врач будет комбинировать препараты, чтобы сделать лечение эффективным. Большинство инфекций Pseudomonas проходят без лечения, либо после минимального лечения. Если симптомы не осложнены, нет необходимости лечить инфекцию.
Лечение синегнойной палочки антибиотиками
При ушных инфекциях врач может назначить антибиотик полимиксин.
Инфекции мочевых путей лечат антибиотиками, такими как левофлоксацин или ципрофлоксацин.
Pseudomonas относительно редко поражает глаза. Если это происходит, врач лечит их с помощью антибиотических капель.
Синегнойная палочка — профилактика
Во многих случаях инфекции Pseudomonas можно предотвратить. Бактерии живут и размножаются во влажных местах. Поэтому, будь то отделение интенсивной терапии или местный бассейн — чистота жизненно важна. Для врачей и медсестер важно практиковать гигиену рук. Необходимо также регулярно менять повязки и следить за ранами.
Синегнойная палочка: причины, симптомы и препараты для лечения
Синегнойная инфекция
Синегнойная инфекция – заболевание, обусловленное заражением синегнойной палочкой.
Причины
Возбудителем синегнойной инфекции является род грамотрицательных аэробных условно-патогенных бактерий Pseudomonas, в том числе P. aeruginosa – синегнойная палочка. Эти организмы живут и размножаются в воде и влажной почве.
Синегнойная инфекция чаще всего распространяется в больницах. Здесь бактерии обитают в общественных туалетах, на умывальниках, общих полотенцах, недостаточно продезинфицированном инструменте, в антисептических растворах, контейнерах для сбора мочи. Поэтому сама по себе госпитализация повышает риск развития внутрибольничной инфекции.
Синегнойная палочка вызывает инфекционные заболевания, степень тяжести которых варьирует от незначительных кожных поражений до угрожающих жизни состояний. В тяжелой форме инфекционные процессы, как правило, развиваются у людей с ослабленным иммунитетом или принимающих иммуносупрессивные препараты, например, при онкологии или после трансплантации. В группу риска входят пациенты с сахарным диабетом, ожоговыми ранами, кистозным фиброзом, использующие катетер, перенесшие операцию, подключенные к аппарату ИВЛ.
Синегнойная палочка на ногтях у женщин может возникать из-за плохой дезинфекции ногтевых пластин и/или инструмента при проведении маникюра.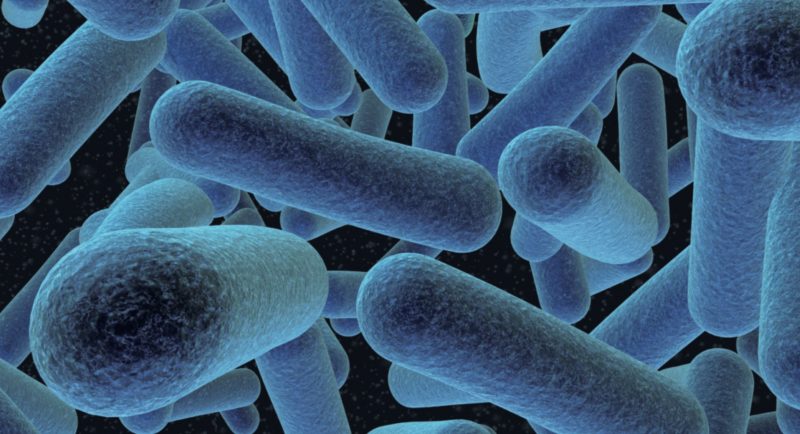 У женщин и мужчин проникновение бактерии возможно из-за специфики работы. Заболеваемости подвержены косметологи, бармены, пекари.
У женщин и мужчин проникновение бактерии возможно из-за специфики работы. Заболеваемости подвержены косметологи, бармены, пекари.
Инфекции глаз развиваются в результате травмы или заражения раствора для хранения контактных линз.
Симптомы синегнойной инфекции
Бактерии могут поражать самые разные органы – респираторный тракт, ЛОР-органы, глаза, желудочно-кишечный тракт, мочевыводящие пути, кожу. Синегнойной палочкой осложняется около 10% раневых инфекций и до 30% ожоговых болезней.
Симптомы инфекции зависят от того, какая система поражена.
Инфекция желудочно-кишечного тракта проявляется в виде пищевого отравления. Ей свойственны боли в животе, снижение аппетита, рвота, диарея, вздутие живота, метеоризм, зловонный запах кала.
В случае поражения уха появляются гнойные выделения, зуд и боль. Если инфекция проникает в глаза, развивается конъюнктивит, наблюдаются гнойно-слизистые выделения и боль в глазах, нарушается зрение.
При наличии кожной инфекции появляется сыпь. Симптомы инфекции легких – кашель и пневмония, инфекции мягких тканей – гнойные выделения со сладковатым фруктовым запахом, инфекции крови – озноб, лихорадка, боль в суставах, общая слабость.
Симптомы инфекции легких – кашель и пневмония, инфекции мягких тканей – гнойные выделения со сладковатым фруктовым запахом, инфекции крови – озноб, лихорадка, боль в суставах, общая слабость.
Инфекция мочевыводящей системы проявляется частым болезненным мочеиспусканием, изменением запаха и цвета мочи, болью в пояснице.
Диагностика синегнойной палочки
Диагноз ставится на основании бактериологического исследования. Выявляется синегнойная палочка в моче, крови и других биологических жидкостях.
Дополнительно проводят тест для определения чувствительности бактерии к антибиотикам.
При необходимости определения степени поражений могут быть назначены рентген, УЗИ, эхокардиография, МРТ или КТ.
Дифференциальная диагностика инфекции осложнена из-за разнообразия ее клинических форм. Желудочно-кишечную инфекцию дифференцируют с кишечной палочкой, колитом, сальмонеллезом, кожную – со стафилококковыми и стрептококковыми поражениями, респираторную – с казеозной пневмонией, бактериальным воспалением и т. д.
д.
Лечение синегнойной инфекции
Основу лечения составляют антибактериальные препараты от синегнойной палочки. В зависимости от локализации и тяжести течения инфекционного процесса их назначают местно, перорально или внутривенно. Чаще всего используются фторхинолоны, амикацин, гентамицин, ципрофлоксацин, цефепим, цефтазидим и имипенем.
При инфицировании глаз антибиотики от синегнойной палочки применяют в форме концентрированных глазных капель.
Тяжелые инфекции, заражение которыми происходит в медицинских учреждениях, устойчивы ко многим антибиотикам, поэтому плохо поддаются лечению. По этой причине врачи часто проводят комбинированную терапию с одновременным применением нескольких препаратов против синегнойной палочки – цефалоспорина, карбапенема и фторхинолона или аминогликозида.
Осложнения
В зависимости от органа, куда проникает бактерия, Pseudomonas aeruginosa может вызвать самые разные осложнения, включая менингит, пневмонию, бактериемию, эндокардит, сепсис, септический шок.
Глазная инфекция часто серьезно повреждает роговицу.
Методы профилактики синегнойной палочки
Инфекционные болезни можно предотвратить. Первостепенное значение имеет соблюдение чистоты и стерильности в медицинских учреждениях. Персонал должен практиковать гигиену рук, тщательно стерилизовать инструменты и оборудование, своевременно менять дезинфицирующие средства, соблюдать санитарные правила при обработке перевязочных материалов, а лучше – заменить изделия многоразового использования одноразовыми.
Пациентам с раневыми и ожоговыми поражениями важно своевременно менять повязки с соблюдением правил антисептики.
Большое значение имеет рациональное применение антибиотиков, особенно у ребенка. Лечение неподходящим антибактериальным средством, несоблюдение рекомендованных дозировок и длительности лечения – эти факторы в разы повышают риск развития устойчивости бактерии к препаратам.
К мерам профилактики относится и сокращение пребывания пациентов в стационаре, в частности, обеспечение короткого дооперационного срока.
Оптимальная микробиологическая чистота больничной среды предупреждает накопление госпитальных штаммов бактерий. Поскольку бактерии размножаются во влажной среде, рекомендуется избегать чрезмерного увлажнения поверхностей, отдавая предпочтение не влажной уборке, а полусухой, используя гелевые формы дезинфектантов, а не жидкие.
Медицинским работникам, пациентам с ожогами, серьезными ранениями и открытыми переломами, больным с дефицитом иммунитета и пожилым людям может быть рекомендована специфическая профилактика – введение поливалентной вакцины (например, Псевдовака), формирующей иммунитет против Pseudomonas aeruginosa, снижающей риск сепсиса и бактериемии при инфекциях, вызванных синегнойной палочкой.
Список использованной литературы
- Справочники MSD;
- Государственный реестр лекарственных средств Украины;
- Справочник Видаль.
Часто задаваемые вопросы про синегнойную палочку
Чем опасна синегнойная палочка?
P. aeruginosa способна вызывать целый ряд инфекционных болезней, особенно у лиц с ослабленным иммунитетом, вплоть до опасных для жизни состояний – бактериемии, септицемии, менингита и сепсиса.
aeruginosa способна вызывать целый ряд инфекционных болезней, особенно у лиц с ослабленным иммунитетом, вплоть до опасных для жизни состояний – бактериемии, септицемии, менингита и сепсиса.
Какой антибиотик действует на синегнойную палочку?
Эффективными являются препараты из групп карбапенемов и цефалоспоринов.
Как долго лечится синегнойная палочка?
Курс терапии зависит от локализации и тяжести поражения, в отдельных случаях он может достигать нескольких недель и даже месяцев, например, при Pseudomonas aeruginosa на ногтях.
Как пахнет синегнойная палочка?
Место, пораженное бактерией, часто имеет специфический сладковатый запах.
Синегнойная псевдомония на ногтях. Лечение
Синегнойная псевдомония на ногтях. Лечение
Синегнойная палочка, зеленая плесень, псевдомония. Страшный сон любого мастера и клиента. Что это?
Псевдомония — это заболевание ногтей, вызванное псевдомонами (бактериями).
Заболевание проявляет себя изменением цвета от зеленого до серо-черного. Протекает бессимптомно, не имеет запаха и не вызывает болевых ощущений. И в этом главная его опасность. Не болит, значит, не опасно. Это большое заблуждение.
Цвет — это продукты жизнедеятельности бактерий, сами они невидимы. По мере развития заболевания ноготь постепенно разрушается и неизбежно приходит момент (если заболевание не лечить), когда патоген через ногтевое ложе попадает в кровь. В результате заражение крови, сепсис.
Бактерии размножаются и развиваются с колоссальной скоростью, поэтому для развития болезни достаточно всего несколько дней.
Малопривлекательная перспектива, согласитесь.
Как происходит заражение?
-
Если перед нанесение покрытия ноготь плохо продезинфицировали или не продезинфицировали вовсе.
 Поэтому не экономьте на средствах для обработки натуральных ногтей. Делайте выбор в сторону качественных профессиональных спец.средств. профессиональные средства работают, как правило, как средства 3 в 1: обезжиривают, дегидратируют и дезинфицируют. Безопасно и экономично.
Поэтому не экономьте на средствах для обработки натуральных ногтей. Делайте выбор в сторону качественных профессиональных спец.средств. профессиональные средства работают, как правило, как средства 3 в 1: обезжиривают, дегидратируют и дезинфицируют. Безопасно и экономично.
-
Если при коррекции наращенных ногтей мастер оставляет отслоения, так называемые «карманы», а далее запечатывает остатки старого покрытия новым. Качественно обработать пространство под отслоенным материалом невозможно, поэтому попавший патоген прекрасно себя чувствует и размножается в герметичной среде.
-
Также мастерам нужно быть внимательными, когда они снимают гель-лак и оставляют тонкий слой прежнего базового покрытия. Это делать можно, но в целях гигиены следует хотя бы через один, два раза удалять покрытие полностью. И при наличии отслоений покрытия, тщательно их удалять.
-
Если клиенты самостоятельно перекрывают ногти с отслоенным искусственным покрытием топом или даже простым лаком.
 Делать это категорически запрещено, тк мы сами создаем благоприятную среду для развития бактерий.
Делать это категорически запрещено, тк мы сами создаем благоприятную среду для развития бактерий.
Что делать если все-таки клиент пришел с псевдомонией?
-
Покрытие следует обязательно снять. При этом следует строго соблюдать правила защиты и обработки. Помните, бактерии находятся и в пыли, а она всегда вокруг нас.
-
По возможности, лучше использовать инструменты и материалы (напр, салфетки, пилки, фрезы) одноразовые или которые уже отслужили свое и их не жалко выбросить. Но не забудьте перед этим все продезинфицировать.
-
Покрытие делать ни в коем случае нельзя! Даже прозрачным лаком. Лак – это тоже герметичное покрытие.
-
Рекомендуем клиенту в течении трех дней делать ванночки с лимонной кислотой или просто лимонным соком. Вода должна быть слегка кислой. Бактерии очень не любят кислую среду и кислород.

-
В зависимости от степени поражения клиент должен отказаться от покрытия не менее чем на неделю. Если ноготь уже заметно поврежден и разрушен, следует человека направить к специалистам.
Материал подготовила технолог бренда Lovely Ольга Волкова. Больше полезной информации в официальном аккаунте в инстаграм.
Синегнойная инфекция — причины, симптомы, диагностика и лечение
Синегнойная инфекция – это инфекционное заболевание, обусловленное инвазией синегнойной палочки. Является ведущей внутрибольничной инфекцией. Для хронических форм характерно поражение респираторного тракта с образованием «биологических пленок», для острого течения – бактериемия и поражение внутренних органов. Диагностика базируется на обнаружении возбудителя в биологических материалах больного. Лечение включает в себя этиотропную антибактериальную терапию, дезинтоксикационные средства, жаропонижающие и другие симптоматические препараты. В некоторых случаях показано хирургическое лечение.
В некоторых случаях показано хирургическое лечение.
Общие сведения
Синегнойная инфекция впервые была описана в 1850 году французским хирургом Седилем. В 1882-м французскому военному фармацевту Жессару удалось выделить чистую культуру возбудителя, а в 1916 году стала известна эпидемиология данного заболевания. Болезнь распространена повсеместно, бактерий обнаруживают в почве, воде и на растениях. Четкая сезонность отсутствует. В стационарах излюбленной локализацией считается физиотерапевтическое и реанимационное оборудование. Группами риска являются недоношенные новорожденные, дети до 3-х месяцев, пожилые, пациенты отделений гемодиализа, химиотерапии, нейрохирургии и реанимации, больные с муковисцидозом и иммуносупрессией.
Синегнойная инфекция
Причины
Возбудитель заболевания – синегнойная палочка (Pseudomonas aeruginosa) и её штаммы, представляет собой условно-патогенный микроорганизм, способный вызывать поражение только при отсутствии адекватного ответа иммунной системы. Источником инфекции служат больные люди и животные, бактерионосители, преимущественная локализация микроорганизма – кожа, кишечник. Заражение происходит воздушно-капельным и пищевым путем. Путь инфицирования при госпитальном заражении чаще контактный – через нестерильный инструментарий, руки медицинского персонала и предметы ухода за больными. Бактерия погибает при кипячении, во время автоклавирования, а также при воздействии 3% перекиси водорода и хлорсодержащих дезинфектантов.
Источником инфекции служат больные люди и животные, бактерионосители, преимущественная локализация микроорганизма – кожа, кишечник. Заражение происходит воздушно-капельным и пищевым путем. Путь инфицирования при госпитальном заражении чаще контактный – через нестерильный инструментарий, руки медицинского персонала и предметы ухода за больными. Бактерия погибает при кипячении, во время автоклавирования, а также при воздействии 3% перекиси водорода и хлорсодержащих дезинфектантов.
Патогенез
При попадании микробов на поврежденную кожу или слизистую оболочку возникает массивная деструкция тканей, обусловленная воздействием экзотоксинов и продуцируемых бактериями веществ. В норме слизистая организма способна нивелировать воздействие синегнойной палочки ввиду мукоцилиарного клиренса и механического барьера. Привлечение нейтрофилов и активный фагоцитоз усиливают образование множества антибактериальных цитокинов, ферментов и свободных радикалов, служат активаторами системы комплемента и других звеньев гуморального иммунитета.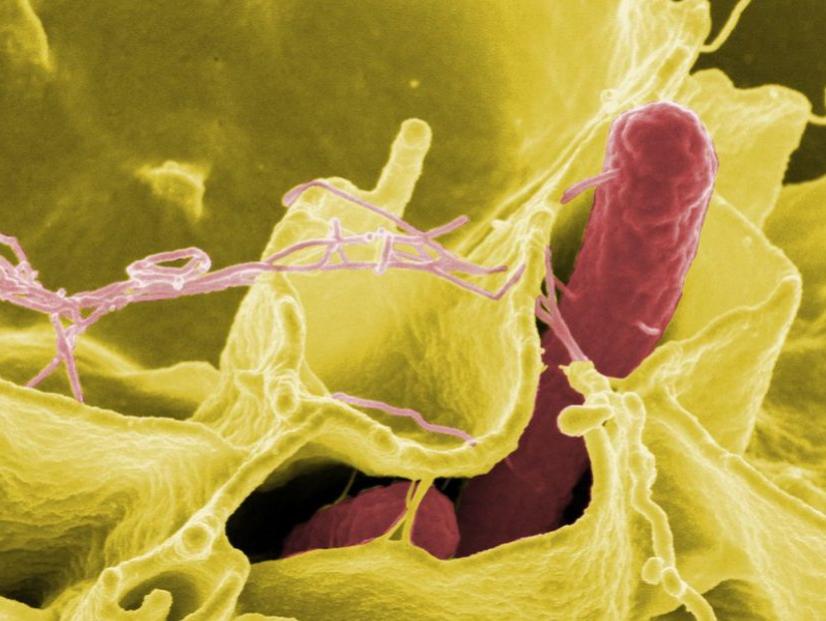
От 33 до 83% штаммов синегнойной палочки имеют эволюционно обусловленный механизм защиты от иммунной системы – образование биопленок, состоящих из скопления пораженных клеток и внеклеточного матрикса, включающего фибрин, секреторное отделяемое слизистых, альгинат, полисахариды и липиды. Известно, что бактерии лизируют нейтрофилы, усиливая рост собственных биопленок.
Классификация
Поражения, вызываемые синегнойной палочкой, можно условно разделить на местные и генерализованные (септические). Некоторые виды, в том числе инфекции ЦНС, сердца и средостения развиваются вследствие диссеминации возбудителя. В зависимости от топологии воспалительного очага различают следующие формы синегнойной инфекции:
- Инфекция респираторного тракта. Пациенты, находящиеся на длительной искусственной вентиляции легких, в 30% случаев переносят трахеобронхит и в 24% – пневмонию синегнойной этиологии.
- Инфекция ЛОР-органов.
 Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки.
Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки. - Инфекция ЖКТ. Проявляется в виде тяжелой диареи, нередко с летальным исходом среди детей до года. С возбудителем связывают около 16% послеоперационных перитонитов.
- Инфекция глаз. Связана с длительным применением контаминированных контактных линз и глазных капель, часто приводит к панофтальмиту.
- Инфекция мочевой системы. Наиболее вероятно развитие катетер-ассоциированного острого пиелонефрита. С данным возбудителем связывают до 13% случаев острого простатита.
- Инфекция кожи. Возникает после пребывания в бассейне со сниженной концентрацией дезинфицирующих средств, может поражать ногти, подкожную клетчатку, мышечные фасции с формированием некрозов.
- Раневая инфекция. Составляет до 10% всех боевых инфекционных осложнений, становится причиной около 30% гнойных процессов при ожоговой болезни.
 Считается поддерживающим фактором формирования трофических язв.
Считается поддерживающим фактором формирования трофических язв.
Симптомы синегнойной инфекции
Инкубационный период патологии крайне вариабелен, может составлять от нескольких суток до десятилетий, поскольку микроорганизм является одним из условно-патогенных компонентов микрофлоры человека. Клинические проявления зависят от пораженного органа. У взрослых при инвазии пищеварительного тракта первыми симптомами являются лихорадка (не более 38,5° C), снижение аппетита, озноб, слабость, тошнота, реже рвота, вздутие и болезненность живота, частый кашицеобразный стул с кровью и слизью.
Маленькие дети при поражении ЖКТ становятся вялыми, сонливыми, отказываются от еды и питья, срыгивают, гастроэнтероколит протекает с высоким риском кишечного кровотечения. Синегнойная патология ЛОР-органов проявляется лихорадкой 37,5° C и выше, резкой болью в ухе, снижением слуха, желто-зеленым обильным отделяемым, иногда с примесью крови. Поражение дыхательного тракта протекает в форме пневмонии – с повышением температуры тела более 38° C, нарастающей одышкой, кашлем с обильной слизисто-гнойной мокротой.
Псевдомонадная инфекция мочевыводящей системы характеризуется лихорадкой, болями в пояснице, частыми болезненными мочеиспусканиями, чувством неполного опорожнения мочевого пузыря, изменением цвета и запаха мочи. Глазные симптомы инвазии синегнойной палочки чаще выявляются в области одного глазного яблока, начинаются с появления рези, болей, чувства жжения, инородного тела, слезотечения, светобоязни и слизисто-гнойного обильного отделяемого. В дальнейшем может возникать снижение и помутнение зрения.
Поражение кожи проявляется высыпаниями в виде пятен и гнойничковых элементов по всему телу, включая сыпь на ладонях, подошвах и в носоглотке, увеличением лимфоузлов, постоянными головными болями (так называемая головная боль пловцов), зеленой окраской одной, реже двух ногтевых пластин, образованием болезненных уплотнений в подкожно-жировой клетчатке. Раневая инфекция возбудителя сопровождается появлением сине-зеленого гнойного отделяемого и гнойно-геморрагических корочек, увеличением зоны покраснения вокруг раны.
Осложнения
Мультисистемность и клиническое разнообразие симптомов синегнойной инфекции отражается на количестве осложнений данного состояния. К наиболее частым негативным последствиям относят генерализацию инфекционного процесса, инфекционно-токсический шок, у грудных детей – некротический колит. Высока вероятность абсцедирования и гангренозных изменений. Вялотекущее течение инфекции на слизистых уха, ротоглотки, носа, конъюнктивы и легких приводит к хронизации воспалительного процесса, формированию мезотимпанита, бронхоэктазов, ползучей язвы роговицы, частичной или полной глухоты, односторонней слепоты.
Диагностика
Диагноз выставляется на основании данных, полученных в ходе консультации инфекциониста. При возникновении обширных гнойных поражений обязательна консультация хирурга, по показаниям приглашаются другие профильные специалисты. Наиболее распространенными диагностическими методами подтверждения псевдомонадной этиологии болезни являются следующие инструментальные и лабораторные исследования:
- Физикальное обследование.
 При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений.
При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений. - Лабораторные исследования. Общеклинический анализ крови свидетельствует о наличии лейкоцитоза, палочкоядерного сдвига влево, ускорения СОЭ. В биохимических параметрах наблюдается увеличение АЛТ, АСТ, СРБ, снижение общего белка, гипоальбуминемия. В общем анализе мочи возможна протеинурия, гематурия. Анализ мокроты подтверждает большое число бактерий и лейкоцитов. В ликворограмме при поражениях головного мозга выявляется нейтрофильный плеоцитоз, клеточно-белковая диссоциация.
- Выявление инфекционных агентов. Золотым стандартом является бактериологическое исследование, осуществляемое в современных условиях методом масс-спектрометрии с обязательным определением антибактериальной чувствительности бактерии.
 Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител.
Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител. - Инструментальные методики. Рентгенография органов грудной клетки, реже МРТ или КТ проводится с целью верификации легочных поражений, дифференциального диагноза. УЗИ органов брюшной полости, мочеполовой системы, мягких тканей, костей и забрюшинного пространства позволяет установить первичный очаг воспаления. Эхо-КГ показана при подозрении на инфекционный эндокардит. Колоноскопия, ФГДС назначаются с целью исключения новообразований пищеварительного тракта.
Дифференциальная диагностика синегнойной инфекции сложна ввиду многообразия клинических форм болезни. Наиболее распространенные поражения желудочно-кишечной системы дифференцируют с сальмонеллезом, шигеллезом и псевдомембранозным колитом. Кожные проявления отличают от гнойно-некротических поражений стрептококковой и стафилококковой этиологии.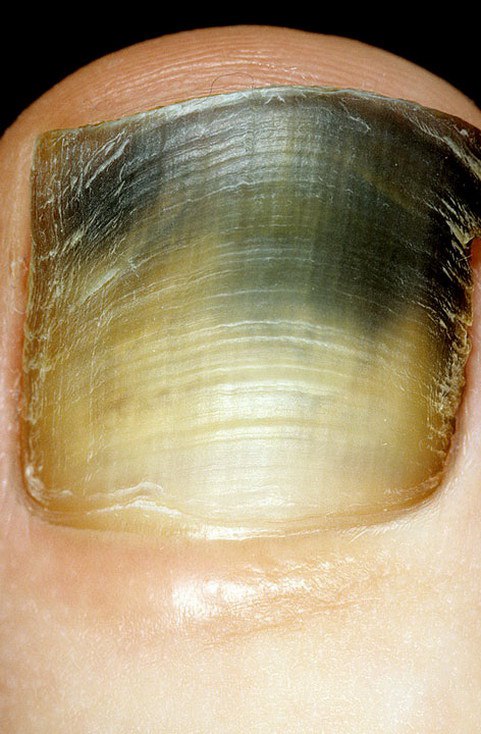 Инфекции дыхательной системы могут напоминать казеозную пневмонию при туберкулезе, саркоидоз, бактериальные воспаления легких. Причинами сепсиса могут быть различные вирусы, бактерии и грибы.
Инфекции дыхательной системы могут напоминать казеозную пневмонию при туберкулезе, саркоидоз, бактериальные воспаления легких. Причинами сепсиса могут быть различные вирусы, бактерии и грибы.
Лечение синегнойной инфекции
Стационарное лечение рекомендуется пациентам с органными поражениями, среднетяжелым и тяжелым течением болезни. Больные с нозокомиальной синегнойной инфекцией продолжают лечение в том отделении, где находились до манифестации инфекционного процесса, с обязательным проведением всех противоэпидемических мероприятий и санацией аппаратуры. Постельный режим необходим до устойчивого купирования лихорадки в течение 3-5 дней, его продолжительность зависит от степени инвазии, наличия осложнений и декомпенсации сопутствующих болезней. Специальная диета не разработана, рекомендован прием пищи с достаточным количеством белка, адекватный питьевой режим.
Этиотропная терапия синегнойной инфекции осложняется наличием у микроорганизма природной резистентности к некоторым антибиотикам пенициллинового и тетрациклинового ряда, триметоприму, частично к цефалоспоринам, карбапенемам и аминогликозидам. Применение антибактериальных средств допускается в режиме монотерапии или комбинированного лечения с сочетанием нескольких групп препаратов, назначаемых местно и системно. Основными антибиотиками, используемыми для инактивации синегнойной инфекции, являются «защищенные» пенициллины, фторхинолоны, цефтазидим, цефепим, имипенем, полимиксин Е, гентамицин, амикацин.
Применение антибактериальных средств допускается в режиме монотерапии или комбинированного лечения с сочетанием нескольких групп препаратов, назначаемых местно и системно. Основными антибиотиками, используемыми для инактивации синегнойной инфекции, являются «защищенные» пенициллины, фторхинолоны, цефтазидим, цефепим, имипенем, полимиксин Е, гентамицин, амикацин.
Средствами борьбы с инфекцией считаются гипериммунная антисинегнойная донорская плазма и противосинегнойный гамма-глобулин, Перечисленные препараты применяются реже в связи с возможным развитием сывороточной болезни, показаны при вялотекущем воспалительном процессе. Симптоматическое лечение включает дезинтоксикационную терапию, противовоспалительные и жаропонижающие средства. Хирургическое вмешательство необходимо при локализованных и разлитых гнойных процессах, заключается во вскрытии и дренировании гнойников, реже – ампутации конечности. Допускается местное применение раствора перекиси водорода, мазей с антибиотиками.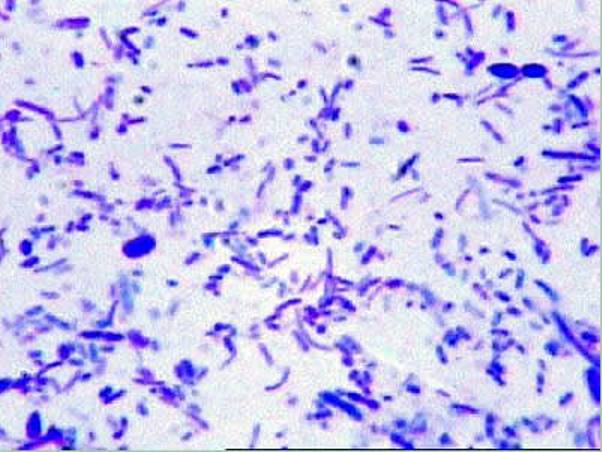
Прогноз и профилактика
Прогноз всегда серьезный. Синегнойная палочка нередко составляет полимикробные ассоциации – с кандидами, стафилококками, клебсиеллами, что утяжеляет течение патологии. Летальность при органных поражениях составляет 18-61%, повышается в случае инвазии внутрибольничного штамма синегнойной палочки. Предикторами вероятного смертельного исхода являются способность возбудителя продуцировать экзотоксин U, мульти-антибиотикорезистентность и септический шок.
Специфическая профилактика (поливалентная вакцина) показана медицинским работникам, ожоговым больным, пациентам с открытыми переломами и глубокими ранами, лицам с иммунным дефицитом, людям старческого возраста. Неспецифические меры сводятся к строгому соблюдению правил обработки медицинских инструментов и оборудования, контролю контаминации синегнойной палочкой персонала. Важны общеукрепляющие методы – закаливание, нормальный сон, полноценная еда, прогулки, физическая активность, неукоснительное соблюдение личной гигиены и своевременная санация гнойных очагов.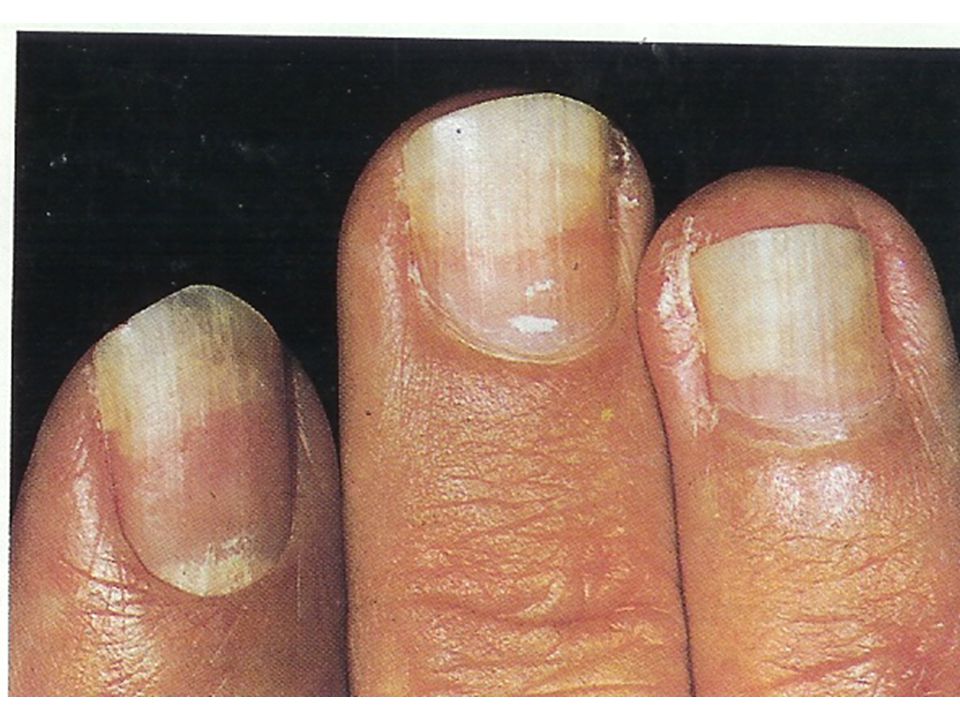
Синегнойная палочка, что это? Симптомы и лечение, как передается синегнойная палочка
Синегнойная палочка (Pseudomonas aeruginosa) вызывает разнообразные гнойно-воспалительные процессы вплоть до генерализованных форм.
Основная часть синегнойной инфекции имеет внутрибольничное происхождение. Она выделяется у каждого третьего госпитализированного пациента. Особые свойства бактерии и особенности ее взаимодействия с организмом человека создают объективные трудности в борьбе с инфекцией. Ситуацию осложняет растущая угроза развития антибиотикорезистентности.
Синегнойные палочки обладают большой адаптиционной способностью. Они способны размножаться в условиях полного отсутствия органических веществ, развиваются даже в дистиллированной воде, не теряют жизнеспособность в целом ряде дезинфицирующих растворов. Бактерии часто инфицируют послеожоговые раневые поверхности, рваные раны, порезы и др. Никогда не поражают здоровые ткани. Инфекция может развиться в мочевыводящих путях при введениях катетеров.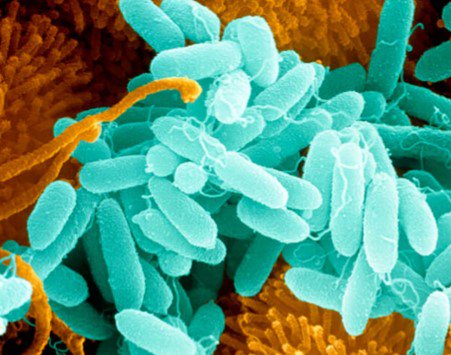 Поражение глаз возникает при травмах и оперативных вмешательствах.
Поражение глаз возникает при травмах и оперативных вмешательствах.
Часто синегнойная инфекция регистрируется при воспалении среднего уха. Она поражает легкие и сердечные клапаны, мозговые оболочки и суставы, желудочно-кишечный тракт и ногти. При проникновении бактерий в кровяное русло развивается бактериальный сепсис.
Что это такое простыми словами?
Простыми словами, синегнойная палочка – это особо патогенная бактерия, которую можно легко заполучить при лечении в стационаре; передача ее в быту возможна, но подобное происходит реже. Наиболее часто микроб «живет» в реанимационных отделениях, ведь в них имеется большое количество аппаратуры и инструментария, используемого многократно. При этом ко многим антисептикам он не чувствителен, а некоторые, например, риванол, употребляет «в пищу». Приписывают бактерии и некий «коллективный разум».
Суть истории о синегнойной палочке и заболеваниях, которые она вызывает – не в том, чтобы лечиться самостоятельно или не ложиться в стационар (ведь ее концентрация больше в больничных стенах, чем на улице или дома). Смысл в том, чтобы делать все возможное, чтобы заболевание не потребовало проведения интенсивной терапии (есть люди, которые настаивают на лечении в отделении реанимации). В это понятие входит плановое обследование, обращение к врачу при появлении каких-то непонятных симптомов, а также – правильное питание, достаточная активность и поддержание – без фанатизма – чистоты кожных покровов.
Смысл в том, чтобы делать все возможное, чтобы заболевание не потребовало проведения интенсивной терапии (есть люди, которые настаивают на лечении в отделении реанимации). В это понятие входит плановое обследование, обращение к врачу при появлении каких-то непонятных симптомов, а также – правильное питание, достаточная активность и поддержание – без фанатизма – чистоты кожных покровов.
Целый ряд особенностей позволяет синегнойной палочке лидировать по частоте возникновения внутрибольничных инфекций:
- Широкая распространенность – бактерия относится к условно-патогенной микрофлоре и в норме встречается на коже, слизистых оболочках, желудочно-кишечном тракте у трети здоровых людей;
- Высокая изменчивость – палочка в короткие сроки приобретает устойчивость к дезинфицирующим средствам и антибиотикам;
- Устойчивость во внешней среде – микроорганизм длительное время переносит отсутствие питательных веществ, перепад температур, воздействие ультрафиолетовых лучей; широкий ряд патогенных веществ – синегнойная палочка содержит в своих структурах эндотоксин и дополнительно вырабатывает экзотоксины, которые угнетают рост конкурентной микрофлоры и активность клеток иммунитета;
- Способность к неспецифической адгезии – бактерия обладает свойством прикрепляться к небиологическим объектам: катетерам, трубкам аппарата искусственной вентиляции легких, эндоскопам, хирургическим инструментам;
- Образование биопленок – колония синегнойных палочек формирует сплошной пласт, покрытый биополимером, который надежно защищает их от воздействия неблагоприятных факторов окружающей среды.

Как передается синегнойная палочка?
Источником возбудителя синегнойной инфекции могут являться как больные, так и люди, являющиеся носителями бактерии. Наибольшую опасность с точки зрения распространения представляют пациенты с поражением легких.
Палочка может передаваться воздушно-капельным, контактным и алиментарным путем. В организм она попадает с обсемененной пищей и водой. Возбудитель может присутствовать на предметах окружающей обстановки (в т. ч. дверных ручках и кранах умывальников). Причиной вспышек внутрибольничных инфекций нередко является пренебрежение правилами асептики и антисептики. Одними из факторов передачи являются некачественно простерилизованный инструментарий и недостаточно хорошо вымытые руки медперсонала.
Патогенность
Особенно высок риск развития обусловленных синегнойной палочкой патологий у пациентов с ослабленным иммунитетом. Бактерия считается условно-патогенной. При достаточно высокой сопротивляемости организма ее размножение конкурентно блокируется нормальной микрофлорой.
Патогенность бактерии обусловлена такими факторами, как ее высокая подвижность и продуцирование целого ряда токсинов, приводящих к нарушению функций клеток крови (эритроцитов), поражению гепатоцитов (клеток печени) и уничтожению лейкоцитов, скапливающихся в очагах воспаления. Резистентность ко многим антибиотикам объясняется тем, что колонии бактерий могут формировать вокруг себя особую защитную капсулу.
Провоцирующие факторы и группа риска
В группе риска находятся дети первых трех месяцев жизни, люди старше 60 лет, ВИЧ-больные, а также:
- пациенты с сахарным диабетом,
- люди после трансплантации органов,
- при приеме гормональных препаратов,
- при наличии пороков развития.
Сегодня врачи успешно прогнозируют, какое заболевание может развиться в зависимости от возраста, первичной патологии и проводимой манипуляции. У людей, нуждающихся в частом проведении внутривенных процедур может развиться остеомиелит.
При лейкозах последствием является абсцесс в ягодичной мышце и сепсис.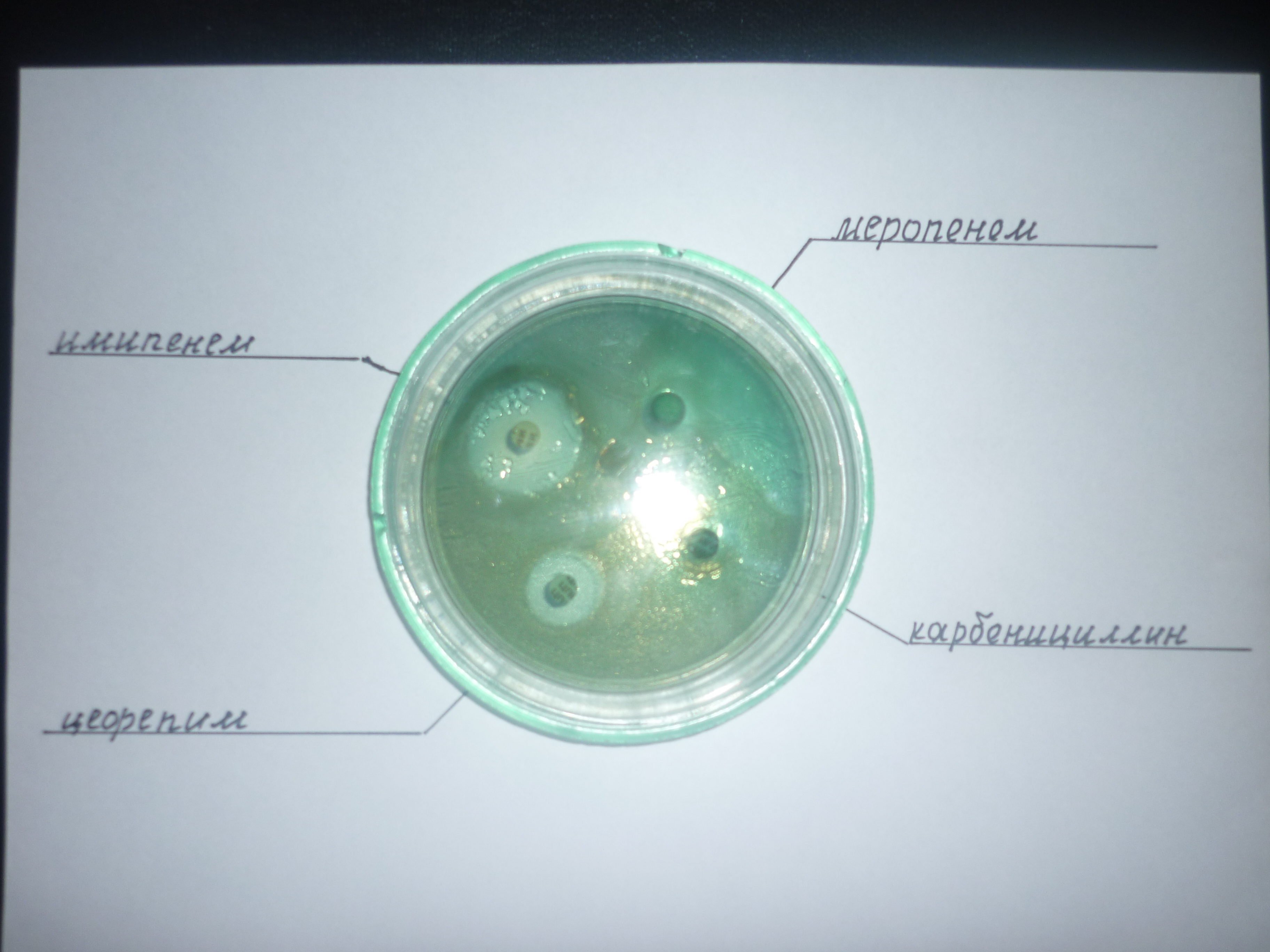 При онкологии повышается риск синегнойной пневмонии. У новорожденных при заражении может возникнуть воспаление кишечника и псевдомонадный менингит.
При онкологии повышается риск синегнойной пневмонии. У новорожденных при заражении может возникнуть воспаление кишечника и псевдомонадный менингит.
Чаще недуг возникает у пациентов интенсивной терапии, ожогового, хирургического и кардиохирургического отделений.
Симптомы синегнойной палочки
С момента занесения инфекции до того как появятся первые клинические признаки проходит от нескольких часов до 5 дней. Как правило, болезнь развивается в непосредственном очаге заражения. Однако она может распространяться и на соседние ткани. В этой ситуации говорят о сочетанном поражении.
Первичное заражение возникает в месте травмы, пореза, ожога, проникновения медицинских инструментов, в области послеоперационного шва. При глобальном поражении возбудитель вместе с током крови способен мигрировать в отдаленные органы.
Синегнойная палочка может вызвать воспаление многих органов и систем, мы рассмотрим лишь наиболее частые ее проявления.
Синегнойная инфекция нервной системы
Поражение нервной системы является одним из самых тяжелых проявлений синегнойной инфекции. Оно может возникать первично и вторично. При первичном развитии синегнойная палочка попадает в центральную нервную систему при проведении спинномозговой пункции, травмах головы, нейрохирургических операциях, при спинальной анестезии (вид обезболивания при хирургических вмешательствах). При вторичном поражении бактерия заносится с кровью из других очагов (при сепсисе).
Оно может возникать первично и вторично. При первичном развитии синегнойная палочка попадает в центральную нервную систему при проведении спинномозговой пункции, травмах головы, нейрохирургических операциях, при спинальной анестезии (вид обезболивания при хирургических вмешательствах). При вторичном поражении бактерия заносится с кровью из других очагов (при сепсисе).
Клиническими формами поражения нервной системы являются менингит (воспаление оболочек мозга – головного или спинного) и менингоэнцефалит (поражение и оболочек, и вещества мозга). Клинические симптомы гнойного синегнойного менингита или менингоэнцефалита не отличаются от гнойного менингита с другим возбудителем. Но заболевания протекают очень тяжело, и большинство случаев заканчивается смертельным исходом.
Синегнойная инфекция ЛОР-органов
Если Псевдомонада «обосновывается» в зеве, возникают следующие симптомы:
- боль в горле, усиливающаяся при глотании;
- повышение температуры;
- красные и отечные миндалины;
- трещины на губах.

Если синегнойная инфекция развивается в горле, то появляются:
- кашель, обычно сухой, возникающий после першения или дискомфорта в горле, усиливается при принятии горизонтального положения;
- повышение температуры;
- слабость;
- быстрая утомляемость.
Если возбудитель «обосновался» в носу, это приводит к развитию длительного насморка, ощущению заложенности носа, снижению обоняния, периодическим головным болям (чаще – с одной стороны, больше в области лба).
Синегнойная палочка в ухе становится причиной наружного отита, который проявляется:
- болью в ухе;
- появлением из него желто-зеленовато-кровянистого густого отделяемого;
- ухудшением слуха;
- повышением температуры.
Для обращения к ЛОР-врачу должно быть достаточно одних только гнойных выделений из уха. Самолечение опасно, так как наружный отит синегнойной этиологии способен быстро прогрессировать, приводя к воспалению среднего уха, скоплению гноя в воздухоносных пазухах сосцевидного отростка, и даже к воспалению мозговых оболочек.
Синегнойная инфекция желудочно-кишечного тракта
характеризуется появлением острого энтероколита или гастроэнтероколита. Выраженность проявлений зависит как от возраста пациента, так и от исходного состояния иммунитета и самого кишечника. Так, у детей старшего возраста и взрослых острое начало с рвоты, болей в области желудка (эпигастрии), а затем по всему животу, появляется слабость, плохой аппетит, тошнота, температура чаще субфебрильная (до 38°), стул до 5-7 раз в день кашицеобразный, с патологическими примесями (слизь, кровь), по цвету коричневато-зеленоватый.
Длительность болезни не более 3-4 дней. Дети раннего детского возраста переносят инфекцию тяжелее – температура более высокая (до 39°), частые срыгивания или рвота, отказ от приема пищи, вялость, частый жидкий стул до 6, а иногда до 10-15 раз в сутки, стул также зеленоватый с патологическими примесями (слизь, кровь), имеет характерный зловонный запах, вздутие живота, громкое урчание. Наряду с острым течением случаются варианты с маловыраженными симптомами, но само заболевание длится до 4х недель. Особенность в раннем детском возрасте – опасность развития кишечного кровотечения, обезвоживания, а в более старшем возрасте – аппендицита и холецистита.
Наряду с острым течением случаются варианты с маловыраженными симптомами, но само заболевание длится до 4х недель. Особенность в раннем детском возрасте – опасность развития кишечного кровотечения, обезвоживания, а в более старшем возрасте – аппендицита и холецистита.
Сопутствующее заболевание при поражении кишечника – развитие дисбактериоза, которое требует длительной терапии в период реабилитации.
Синегнойная инфекция кожи и мягких тканей
оврежденные кожные покровы, обширные раневые и ожоговые поверхности, пролежни и язвы легко могут стать входными воротами для проникновения синегнойной палочки и развития инфекционного процесса. В группу риска входят грудные дети и пациенты со сниженным иммунитетом. Способствует возникновению инфекции влажная среда (например, под промокшей повязкой или под мокрой пеленкой у детей). При синегнойной инфекции появляется характерное сине-зеленое окрашивание раневой поверхности и перевязочного материала.
У пациентов с тяжелыми ожогами синегнойная палочка может проникать в кровь и вызывать сепсис. Струп, образующийся на раневой поверхности, приобретает фиолетовую, черную или темно-коричневую окраску. Под струпом происходит разрушение ткани, образуются кровоизлияния, отек ткани. Воспалительный процесс распространяется дальше, на здоровые участки, о чем свидетельствует их покраснение. Корка отторгается, но образуется новый струп коричневого или черного цвета. Процесс может закончиться развитием гангрены или формированием гнойника (абсцесса). Страдает общее состояние больного. В процесс вовлекаются другие органы, развивается пневмония, почечная недостаточность.
Струп, образующийся на раневой поверхности, приобретает фиолетовую, черную или темно-коричневую окраску. Под струпом происходит разрушение ткани, образуются кровоизлияния, отек ткани. Воспалительный процесс распространяется дальше, на здоровые участки, о чем свидетельствует их покраснение. Корка отторгается, но образуется новый струп коричневого или черного цвета. Процесс может закончиться развитием гангрены или формированием гнойника (абсцесса). Страдает общее состояние больного. В процесс вовлекаются другие органы, развивается пневмония, почечная недостаточность.
Заражение синегнойной палочкой может произойти в джакузи, ванне, плавательном бассейне. В результате такого заражения может развиться фолликулит (воспаление волосяного фолликула). Провоцирующими факторами могут стать переохлаждение, хронические заболевания (сахарный диабет, анемия), неполноценное питание.
При поверхностном фолликулите возникают гнойничковые высыпания, в центре которых проходит волос. Высыпания сопровождаются выраженным зудом. Вокруг гнойничка имеется розово-красный ободок. Болевых ощущений нет. Через 2-3 дня образуется коричневая корка, после отторжения которой может остаться пигментация.
Вокруг гнойничка имеется розово-красный ободок. Болевых ощущений нет. Через 2-3 дня образуется коричневая корка, после отторжения которой может остаться пигментация.
При глубоком фолликулите на коже появляются болезненные красные узелки до 1 см в диаметре, с гнойничком на верхушке, пронизанным волосом. Спустя несколько дней гнойничок вскрывается, образуется желтая корка. Могут развиваться одновременно или последовательно несколько фолликулитов. Чаще множественные фолликулиты развиваются у мужчин. Каждый из них длится от 4 до 7 дней.
Синегнойная инфекция мочевыводящей системы
Это ряд заболеваний – пиелонефрит, цистит, уретрит – которые диагностируются по наличию синегнойной палочки в моче.
Такие патологии не развиваются на «пустом месте». Страдают люди:
- со сниженным иммунитетом;
- имеющие аномалии развития органов мочеполовой системы;
- страдающие почечно-каменной болезнью;
- которым часто приходится катетеризировать мочевой пузырь (например, при аденоме простаты).

Симптомы псевдомонадных поражений мочевыводящей системы не специфичны. Это боль в пояснице, режущие боли при мочеиспускании, болезненные позывы к мочеиспусканию, ощущение неполного опорожнения мочевого пузыря, повышение температуры, изменение цвета и запаха мочи.
Характерно то, что течение такого заболевания длительное, когда периоды обострения с вышеуказанными симптомами чередуются с бессимптомными временными промежутками. При этом «Норфлоксацин», «Монурал» или «5-нитроксолин» не оказывают значительного эффекта. Так псевдомонадная инфекция мочевыводящих путей может длиться несколько месяцев или лет.
Синегнойная инфекция дыхательной системы
Чаще развивается на фоне хронического бронхолегочного заболевания (бронхит, муковисцидоз, бронхоэктатическая болезнь), в группе риска также больные отделений реанимации и интенсивной терапии (на искусственной вентиляции легких, после проведения эндотрахеальной интубации). Возможно развитие как первичного воспаления легких, так и вторичной пневмонии, которая характеризуется затяжным течением, плохой эффективностью антибактериальной терапии, склонностью к деструктивным процессам. Симптомы пневмонии схожи с симптомами при других инфекционных поражениях легких.
Симптомы пневмонии схожи с симптомами при других инфекционных поражениях легких.
Синегнойная палочка в глазах
Инфекция чаще развивается после травмы глаза или хирургического вмешательства. Синегнойная палочка может вызвать гнойный конъюнктивит (чаще у детей), кератит (воспаление роговицы) и даже панофтальмит (повреждение всего глазного яблока). У пациента появляются жалобы на боль в глазу, ощущение постороннего тела, гнойные выделения из глаз, нарушение зрения.
При малейших травматических повреждениях бактерия может проникать в роговицу и вызвать ее воспаление. Кератит может развиться и вследствие загрязнения оптических линз либо раствора для обработки линз. Нередко причиной кератита являются ожоги или радиоактивное облучение. Вначале появляется небольшая язва по центру роговицы, затем она быстро расширяется и может захватывать не только роговицу, а и склеру уже в течение 2 суток болезни. Общее состояние больного, как правило, не нарушается.
При проникающих травмах глаза или после операций возможно развитие гнойного эндофтальмита (поражение внутренних оболочек глаз). Этот процесс может возникнуть при осложнении кератита (перфорации) или вследствие распространения палочки через кровь. Проявляется в виде покраснения глаз, отека век, боли в глазу, скопления гноя перед радужкой, нарушения остроты зрения. Процесс прогрессирует очень быстро. Только немедленное начало лечения может дать шанс спасти зрение.
Этот процесс может возникнуть при осложнении кератита (перфорации) или вследствие распространения палочки через кровь. Проявляется в виде покраснения глаз, отека век, боли в глазу, скопления гноя перед радужкой, нарушения остроты зрения. Процесс прогрессирует очень быстро. Только немедленное начало лечения может дать шанс спасти зрение.
Синегнойная палочка у детей
У детей синегнойная инфекция протекает гораздо тяжелее, чем у взрослых. Всё дело в неокрепшем организме ребёнка. Кроме этого, синегнойная палочка может вызвать опасные заболевания, с которыми малышу будет очень сложно бороться. Специалисты выделяют несколько особенностей протекания этой инфекции у ребят:
- дети болеют этим недугом в десять раз чаще, чем взрослые люди;
- зачастую заболевание поражает недоношенных детей и малышей в первые несколько месяцев их жизни;
- в организме ребёнка бактерия может жить очень долго, из-за чего инфицированные ребята представляют опасность для других детей;
- у ребёнка школьного возраста эта инфекция встречается крайне редко;
- чаще всего микроб попадает в организм ребёнка через пупочный канатик, кожу и ЖКТ;
- труднее всего у ребёнка протекает воспаление ЖКТ.
 Это объясняется токсическими проявлениями и сильным обезвоживанием.
Это объясняется токсическими проявлениями и сильным обезвоживанием.
Диагностика
Диагностикой синегнойной инфекции занимаются врачи различного профиля, что зависит от изначальной причины поступления больного в стационар. В пользу внутрибольничной инфекции говорит вспышка заболевания среди контактирующих между собой людей: пациентов одного отделения или проходящих один и тот же вид исследования. Не составляет трудностей определить кожную форму болезни: края раны, гной и повязки окрашиваются зеленовато-синим пигментом.
Основа диагностики заболевания – это выделение возбудителя одним из методов:
- Бактериологическим – проводится посев на питательные среды мазков, взятых из очага инфекции (зева, уретры, раны) или биологического материала больного (крови, мочи, ликвора, выпотной жидкости). По характеру и свойствам выросшей колонии микроорганизмов бактериологи определяют вид бактерии, ее чувствительность к антибиотикам или бактериофагу.
- ПЦР (полимеразная цепная реакция) – сверхчувствительный метод, способный уловить даже единичные микробные клетки в исследуемом материале.
 При помощи специальных реагентов лаборант выделяет плазмиды бактерий, многократно их копирует и определяет их наличие в растворе. В результате анализа указывается наличие возбудителя, его вид и рассчитанное количество микробных тел в исследуемом образце.
При помощи специальных реагентов лаборант выделяет плазмиды бактерий, многократно их копирует и определяет их наличие в растворе. В результате анализа указывается наличие возбудителя, его вид и рассчитанное количество микробных тел в исследуемом образце. - Серологическим – это определение в крови больного специфических антител к синегнойной палочке. Метод косвенно говорит о ее наличии и используется лишь в тех случаях, когда непосредственное выделение возбудителя затруднительно (при пневмонии и поражении внутренних органов).
Как лечить синегнойную палочку
Схема лечения инфекций, вызванных синегнойной палочкой, также зависит от того, какой орган поражен. Основным препаратом, в любом случае, остается антибиотик. Обычно назначают сразу 2 антибактериальных препарата, для того, чтобы не только максимально воздействовать на синегнойную палочку, но и уничтожить другие возможные патогенные бактерии, особенно это актуально в тех случаях, когда пациент подхватил синегнойную палочку в клинике, уже получая лечение от какой-то другой болезни.
Схемы назначаемых препаратов при разных проявлениях синегнойной инфекции:
- Поражение глаз – конъюнктивиты и изъязвления лечатся местными антибиотиками (аминогликозиды в каплях). Закапывать капли в глаза нужно каждые 30-60 минут. При тяжелых поражениях дополнительно назначаются уколы антибиотика в орбиту (в мягкие ткани рядом с глазом) и антибиотик перорально.
- Поражение мочеполовой системы – в основном, назначаются аминогликозиды и фторхинолоны в таблетках. Обычно для успешного лечения хватает одного антибиотика, главное, правильно его подобрать в начале терапии. В случае невосприимчивости инфекции к этим препаратам, больному назначают цефалоспорины, карбапенемы, пенициллины.
- Эндокардит – высокие дозы аминогликозидов + пенициллин или цефалоспорин широкого спектра действия. Лечение продолжается до шести недель.
- Пневмония – лечение начинается с 2 антибиотиков, по мере улучшения состояния больного один антибиотик отменяют.
- Бактериемия – из-за опасности и тяжести процесса антибактериальное лечение назначают еще до того, как придут результаты посева крови.
 Больной получает аминогликозид + пенициллин или цефалоспорин широкого спектра действия, иногда один из препаратов меняют на фторхинолон (например, ципрофлоксацин) или рифампицин.
Больной получает аминогликозид + пенициллин или цефалоспорин широкого спектра действия, иногда один из препаратов меняют на фторхинолон (например, ципрофлоксацин) или рифампицин. - Менингит – препаратом выбора является цефтазидим, к которому подключают аминогликозид. Антибиотикотерапия длится не менее двух недель.
- Поражение ушей – обычно назначают сочетание антибиотика и кортикостероида (например, метипред).
- Поражения желудочно-кишечного тракта – антибиотик и регидратационная терапия (капельницы с физраствором, глюкозой и витаминами) успешно справляются с болезнью.
- Кожа и мягкие ткани – пациентам назначается схема из двух антибиотиков, как местно (на участки пораженной кожи), так и в таблетках или уколах.
Последствия
Если болезнь не лечить, возможно развитие сепсиса, менингита и пневмонии.
В этом случае частота летального исхода около 75% даже при полноценном лечении. У ребенка часто осложнением выступает остеомиелит, гнойный конъюнктивит, менингит. Если задеты не только ЛОР-органы, но и кишечник, то может развиться токсикоз, внутреннее кровотечение и перфорация стенок кишечника.
Если задеты не только ЛОР-органы, но и кишечник, то может развиться токсикоз, внутреннее кровотечение и перфорация стенок кишечника.
Профилактика
Профилактика этого заболевания сложна из-за того, что бактерия устойчива к огромному количеству дезинфицирующих средств:
- в больницах персонал регулярно обрабатывает оборудование раствором хлорамина, карболовой кислоты и перекиси водорода. Кроме этого, сотрудники медицинских учреждений должны систематически кипятить и автоклавировать оборудование;
- профилактика проникновения микроба в пупочную рану новорождённых предполагает соблюдение правил асептики во время её обработки;
- грамотное лечение хронических недугов;
- поддержание иммунитета на высоком уровне;
- здоровый образ жизни, включающий не только правильное питание, но и мероприятия, укрепляющие организм;
- применение бактериофага. Это специфическая профилактика, которая используется, если есть угроза заражения пациента. Бактериофаг часто применяют во время обработки послеоперационных ран;
- вакцинация. Так доктора защищают своих пациентов от заражения бактерией перед проведением плановой операции.
Во внебольничной среде риск заражения этой бактерией очень мал, но каждому человеку нужно стараться следовать указанным мероприятиям для профилактики заражения. Ведь развитие недуга легче предупредить, чем потом его лечить.
Бактериальный фарингит: описание болезни, причины, симптомы, стоимость лечения в Москве
Бактериальный фарингит относится к сезонным заболеваниям горла, пик которых приходится на конец зимы и начало весны. Патогенные микроорганизмы проникают в слизистую глотки и вызывают ее воспаление. Для быстрого восстановления нормального состояния здоровья и предупреждения осложнений надо срочно обратиться за медицинской помощью. Самолечение при болезни крайне не рекомендуется.
Бактерии, вызывающие воспаление слизистой глотки, попадают извне или из очагов воспаления в организме, расположенных рядом с глоткой или на определенном отдалении. Если острая форма заболевания не была правильно пролечена, то она переходит в хроническую и регулярно дает обострения в тот момент, когда происходит понижение местного или общего иммунитета.
Основные возбудители
В качестве основных болезнетворных бактерий, которые могут спровоцировать появление фарингита, врачами называются следующие:
В норме они полностью подавляются иммунной системой человека и не могут активно развиваться и вызывать болезнь. Только если нет достаточного защитного ответа, они начинают активно захватывать ткани слизистой. При хронической форме заболевания они находятся в угнетенном состоянии до момента понижения иммунитета, даже краткосрочного.
К более редким возбудителям, которые также могут спровоцировать появление проблемы, относятся: менингококки, синегнойная палочка, гонококки и хламидии. Точно определить возбудителя патологии позволяют анализы, которые могут быть назначены врачом.
Факторы, повышающие вероятность болезни
Врачи выделяют определенные факторы, которые в значительной степени повышают вероятность появления болезни. На их фоне происходит снижение иммунитета, из-за чего болезнетворные агенты начинают активно развиваться. Главными способствующими воспалению факторами являются:
-
курение в активной форме или пассивной – никотиновый дым при вдыхании приводит к снижению местного иммунитета глотки и атрофии ее слизистой, из-за чего она становится беззащитна перед болезнетворными агентами;
-
беспорядочные половые связи — из-за них организм часто сталкивается с нагрузкой на иммунитет, и он начинает давать сбои в работе;
-
проживание в районе с неблагоприятной экологической обстановкой;
-
перемерзания местные или общие;
-
работа на вредном производстве, где приходится вдыхать токсичные газы;
-
недостаток витаминов и минералов в рационе;
-
хроническое переутомление;
-
сильные стрессы;
-
недосыпание;
-
аутоиммунные патологии;
-
паразитарные поражения организма;
-
вирусные инфекции.
Если имеются предрасполагающие к болезни факторы, то даже незначительные симптомы начала развития фарингита являются поводом для посещения врача.
Как происходит заражение?
Бактериальная форма фарингита является заразной. Больной представляет опасность уже с самого начала болезни и на протяжении 5-7 дней. Бактерии, поражающие горло, выделяются в окружающую среду с частицами слюны при кашле и чихании, а также бытовым путем при использовании одной посуды.
Особенно активно заражение происходит в детских коллективах при игре общими игрушками и из-за несоблюдения правил гигиены. Вследствие этого врачи настоятельно не рекомендуют водить больного ребенка в детский сад или школу. Пребывание в коллективе опасно для самого больного, так как почти всегда становится причиной осложнений, а также для окружающих, которых он заражает.
В ряде случаев занесение болезнетворных бактерий в ткани происходит без контакта с больным. При травмировании глотки не редко появляется острое воспаление, даже и без падения иммунитета. Связано это с тем, что через ранку болезнетворные агенты проникают в ткани, минуя многие барьеры иммунной системы.
Отличия от вирусной формы
Вирусная и бактериальная формы болезни во многом схожи, но есть некоторые отличия, которые даже не врачу позволят понять природу воспаления. При бактериальном поражении у больного фарингит начинается остро с резкого повышения температуры и чаще всего до критических значений. Симптомов поражения носа нет. Если болезнь вирусная, то воспаление горла возникает через 3-4 дня после появления насморка. Температура поднимается не сильно. Бактериальный фарингит, симптомы которого смазаны, может быть диагностирован только специалистом.
При появлении бактериального воспаления пытаться лечить болезнь своими силами недопустимо. При такой форме патологии ошибки в лечении могут легко стать причиной развития тяжелых осложнений, которые в ряде случаев представляют угрозу для жизни. Вирусная форма болезни имеет не столь стремительное течение, поэтому при отсутствии у больного возможности срочно обратиться к отоларингологу, допустимо домашнее лечение с полосканием солевым раствором.
При беременности
У беременной женщины происходит естественное снижение активности иммунитета, чтобы организм не отторгал ребенка как чужеродный объект. Из-за этого воспаления глотки по причине бактериального поражения являются достаточно частым явлением. Лизобакт при фарингите у беременных для лечения не используется.
Особая опасность бактериального поражения связана с тем, что оно может привести к тяжелым нарушениям развития плода, если терапия осуществляется с ошибками. Также из-за отечности тканей происходит снижение объема кислорода в крови. Сильная интоксикация организма ухудшает состояние и повышает вероятность преждевременных родов или выкидыша.
Самолечение при таком заболевании у беременных невозможно. Для устранения проблемы потребуется применение разрешенных антибиотиков, а также антисептических и противовоспалительных препаратов, которые правильно сможет назначить только врач. При легкой форме заболевания терапия проводится амбулаторно, под врачебным контролем. Если же есть угроза прерывания беременности или состояние женщины оценивается как среднетяжелое или тяжелое, то показана обязательная госпитализация.
Диагностика
Первичный диагноз и лечение по общей схеме определяются больному при первом же обращении к врачу. Предварительный диагноз ставится на основании визуального осмотра глотки и сбора анамнеза. Далее требуется проведение более серьезной диагностики для определения возбудителя болезни и оценки общего состояния пациента.
1. Общий анализ крови. Нужен для определения степени воспаления и общего состояния.
2. Общий анализ мочи. Необходим для оценки работы почек и ряда обменных процессов в организме.
3. Мазок из зева с дальнейшим посевом на питательную среду. Это исследование позволяет установить возбудителя заболевания и определить, какой антибиотик будет против него максимально эффективен.
При необходимости врач может направить пациента на консультацию к другим специалистам, если будут определены осложнения болезни или то, что она является последствием иной патологии. Бактериальный фарингит лечение иногда может иметь достаточно широкое.
Профилактика
Предупредить на 100% заражение бактериями невозможно, но соблюдение профилактических мер во многом понижает риск появления фарингита. Главные меры предупреждения заболевания такие:
-
соблюдение правил гигиены;
-
отказ от случайных половых связей;
-
полоскания рта и промывание носа после пребывания в общественном транспорте или людном месте;
-
своевременное лечение кариозных зубов;
-
полноценная терапия вирусных инфекций, из-за которых чаще всего происходит снижение иммунитета;
-
ношение одежды по погоде;
-
использование эфирных масел в сезон болезней.
Детей родителям, для защиты от заражения опасными бактериями, надо с раннего детства приучать к использованию только своей посуды и правилам гигиены.
Различные пути введения антибиотиков для эрадикации Pseudomonas aeruginosa у пациентов с муковисцидозом
Вопрос обзора
Как наилучшим образом использовать антибиотики для устранения легочной инфекции, вызванной микробом под названием Pseudomonas aeruginosa (синегнойная палочка), у людей, страдающих муковисцидозом?
Актуальность
Муковисцидоз — это наследственное заболевание, при котором воздушные пути часто бывают заблокированы слизью. Муковисцидоз ассоциирован с инфекциями органов грудной клетки, которые могут привести к прогрессирующей дыхательной недостаточности и смерти. Бактерия, которая называется синегнойной палочкой — Pseudomonas aeruginosa — является частой причиной такой инфекции, и она с трудом поддаёся лечению при развитии инфекционного процесса.
Мы хотели сравнить различные комбинации ингаляционных, пероральных и внутривенных антибиотиков для устранения синегнойной палочки — Pseudomonas aeruginosa — у людей с муковисцидозом, чтобы выяснить, какой метод лечения лучше всего работает и является более экономически эффективным.
Дата поиска
Доказательства актуальны на 10 октября 2016 года.
Характеристика исследований
Мы включили семь испытаний с участием 744 человек с муковисцидозом обоих полов, любого возраста как с легкой, так и с более тяжелой формой поражения легких. Испытания продолжались от 28 дней до 27 месяцев. Мы не могли объединить многие результаты, поскольку в испытаниях использовали различные методы лечения. В двух исследованиях сравнивали тобрамицин с плацебо (лечение пустшкой). В трех исследованиях использовали комбинацию перорального ципрофлоксацина и ингаляционного (вдыхаемого) колистина в экспериментальной группе, но использовали разные препараты сравнения: в одном испытании сравнивали эту комбинацию с отсутствием лечения, в другом — с вдыхаемым тобрамицином и в третьем испытании сравнивали комбинацию с пероральным ципрофлоксацином и вдыхаемым тобрамицином. В другом испытании изучили ингаляционный тобрамицин и сравнили лечение длительностью 28 дней с лечением, продолжавшимся 56 дней. В последнем испытании сравнили регулярные циклы ингаляционного (вдыхаемого) тобрамицина (плюс пероральный ципрофлоксацин или плацебо) с лечением ингаляционным тобрамицином (плюс пероральный ципрофлоксацин или плацебо), используемым на основе результатов культур, выращиваемых в лаборатории.
Основные результаты
По результатам двух небольших испытаний (38 добровольцев) лечение ранней инфекции в течение 2 месяцев ингаляционными антибиотиками имело превосходство над отсутствием лечения и устранило Pseudomonas aeruginosa у большинства пациентов. В одном из этих испытаний сообщалось о результатах, полученных в течение более длительного периода, и было предположено, что эффект от лечения может длиться до 12 месяцев. Еще одно небольшое исследование (26 человек), которое длилось два года, показало, что лечение ранней инфекции комбинацией ингаляционных и пероральных антибиотиков лучше, чем отсутствие лечения для устранения Pseudomonas aeruginosa. В испытании, в котором сравнили лечение в течение 28 дней распыленным через небулайзер раствором тобрамицина для ингаляции (88 человек) с лечением в течение 56 дней, было показано, что оба режима лечения были одинаково переносимы и успешны в отношении устранения синегнойной палочки — Pseudomonas aeruginosa. Четыре прямых сравнения пероральных или ингаляционных антибиотиков (или их комбинаций), в одном из которых сообщалось о 223 лицах, не нашли разницы между различными комбинациями антибиотиков. В недавнем испытании с участием 306 детей (в возрасте до 12 лет) сравнили регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо) с лечением только тогда, когда было показано, что ребенок был инфицирован синегнойной палочкой. В этом испытании было показано, что, когда детям давали регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо), у меньшего числа детей обнаруживался рост Pseudomonas aeruginosa (синегнойной палочки) из мокроты. В этом испытании сделали поправку на возраст и не показали никакой разницы по числу эпизодов роста Pseudomonas aeruginosa из образцов между группами, и не было разницы в продолжительности времени, до момента, когда у детей были следующие эпизоды инфекции органов грудной клетки.
Качество доказательств
Некоторые из исследований были проведены до 20 лет назад, и их результаты могут быть не применимы сегодня. Некоторые испытания были небольшими. Все испытания имели довольно короткий период наблюдения. Таким образом, мы не смогли показать, приводит ли лечение людей с муковисцидозом к улучшению их самочувствия или продлению их жизни. С учетом видов лечения, используемых в большинстве испытаний, добровольцам было легко угадать, какое лечение они получали, что могло повлиять на некоторые результаты. Два исследования были поддержаны представителями фармацевтической индустрии. Дальнейшие исследования по-прежнему необходимы, чтобы увидеть, улучшает ли самочувствие и качество жизни у людей с муковисцидозом полное устранение бактерий, и чтобы установить, какие комбинации антибиотиков обеспечивают лучший способ устранения синегнойной палочки — Pseudomonas aeruginosa.
В целом качество доказательств было от умеренного до очень низкого, а это означает, что дальнейшие исследования могут изменить оценку размера эффекта лечения. Будущие, более крупные испытания (с большей мощностью) могут показать, что одно лечения является более эффективным в эрадикации (уничтожении) синегнойной палочки — Pseudomonas aeruginosa, чем другое.
Факторы риска и симптомы бактерий
Что такое инфекции, вызванные псевдомонадой?
Инфекции Pseudomonas — это инфекции, вызываемые разновидностью бактерий Pseudomonas, которые обычно встречаются в почве, воде и растениях. Тип, который обычно вызывает инфекции у людей, называется Pseudomonas aeruginosa . У некоторых здоровых людей его штаммы даже растут на коже во влажных частях тела, например, в подмышках или в области гениталий.
Если у вас хорошее здоровье, вы можете заразиться псевдомонадой и не заболеть.У других людей появляется только легкая кожная сыпь или инфекция ушей или глаз. Но если вы заболели или ваша иммунная система уже ослаблена, псевдомонады могут вызвать серьезную инфекцию. В некоторых случаях это может быть опасно для жизни.
Причины и факторы риска заражения Pseudomonas
Заразиться псевдомонадой можно разными способами. Он может расти на фруктах и овощах, поэтому вы можете заболеть от употребления зараженной пищи. Он также хорошо себя чувствует во влажных помещениях, таких как бассейны, гидромассажные ванны, ванные комнаты, кухни и раковины.
Самые тяжелые инфекции возникают в больницах. Псевдомонады могут легко расти в увлажнителях и типах медицинского оборудования — например, катетерах, — которые не очищены должным образом. Если медицинские работники плохо моют руки, они также могут передать бактерии от инфицированного пациента вам.
Ваш риск заражения pseudomonas также повышается, если вы:
Принимаете лекарства, подавляющие вашу иммунную систему, например, лекарства от рака
Симптомы инфекции Pseudomonas
Симптомы зависят от того, где находится инфекция.Псевдомонады могут заразить любую часть вашего тела, например кровь, легкие, желудок, мочевыводящие пути или сухожилия. Также могут инфицироваться пролежни, раны и ожоги.
Места возникновения инфекции и их признаки могут включать:
- Уши: боль и выделения
- Кожа: сыпь, которая может включать прыщи, заполненные гноем
- Глаза: боль, покраснение , отек
- Кости или суставы: боль и припухлость в суставах; Боль в шее или спине, продолжающаяся несколько недель
- Раны: зеленый гной или выделения с фруктовым запахом
- Пищеварительный тракт: головная боль, диарея
- Легкие: пневмония; сильный кашель и заложенность носа
- Мочевыводящие пути: Инфекции мочевыводящих путей
Лихорадка также часто является признаком тяжелой инфекции псевдомонад.
Диагностика инфекции, вызванной псевдомонадой
Если ваш врач подозревает наличие псевдомонады, он возьмет образец вашей крови или другой биологической жидкости и отправит его в лабораторию для анализа. Результаты также могут помочь им решить, какие типы антибиотиков лучше всего подойдут для лечения инфекции.
Лечение псевдомонад
Если у вас легкая форма псевдомонад, ваш врач может назначить курс антибиотиков. В зависимости от того, где находится ваша инфекция, это лекарство может быть в форме крема, глазных или ушных капель или таблеток, которые вы принимаете внутрь.
При тяжелой инфекции может потребоваться несколько недель приема антибиотиков, которые вам будут вводить через капельницу. Все бактерии pseudomonas немного отличаются друг от друга, а штаммы постоянно меняются, поэтому эти типы инфекций трудно поддаются лечению. Во многих случаях вам может потребоваться принимать более одного вида антибиотиков.
Профилактика Pseudomonas Infection
Вы можете снизить риск заболевания, стараясь избегать контакта с этим типом бактерий. Попробуйте эти простые советы, чтобы держать эти неприятные микробы в страхе:
Часто мойте руки. Это лучший способ избежать заражения псевдомонадой. Если вы находитесь в больнице, убедитесь, что врачи и медсестры всегда моют руки, прежде чем прикасаться к вам.
Ополосните фрукты и овощи перед едой. Даже зелень салата следует хорошо промыть.
Очистите бутылки с водой. Стерилизовать кипятком перед каждым использованием.
Избегайте нечистых бассейнов и гидромассажных ванн. Pseudomonas будут процветать в них, если их не чистить часто, а уровень хлора и pH не контролируется.
Задайте вопросы о вашем медицинском обслуживании. Поговорите со своим врачом, если вы беспокоитесь о заражении. Спросите, какое медицинское оборудование вы используете — нужно ли оно и как часто его чистят.
Позаботьтесь о своем здоровье. Если ваш врач прописал вам лекарство для лечения какого-либо состояния здоровья, принимайте его точно так, как предписано. Не пропускайте дозу. После операции внимательно следите за признаками инфекции. Если у вас поднялась температура, появилась боль, покраснение или выделения на месте операции, немедленно обратитесь к врачу.
Перспективы инфекции Pseudomonas
В большинстве случаев антибиотики могут избавить от инфекции, но важно следовать указаниям врача и сосредоточиться на профилактике. Если один курс антибиотиков не избавляет полностью от бактерий, вызывающих вашу инфекцию, возможно, вам придется принимать их достаточно регулярно, чтобы держать инфекцию под контролем.
Инфекции, вызванные Pseudomonas aeruginosa: основы практики, общие сведения, патофизиология
Уильямс Е.П., Кэмерон К.Заражение Bacillus Pyocyaneus как причина детской смертности. Папский представитель по общественному здравоохранению . 1894. 20: 355-60. [Медлайн].
Мацумото Т., Вайт С.Р., Мозли Р.В., Хоули Р.Дж., Лаки Г.Р. Боевая хирургия в зоне связи. I. Военная рана и бактериология (предварительное сообщение). Мил Мед . 1969 Сентябрь 134 (9): 655-65. [Медлайн].
Villavicencio RT. История синего гноя. J Am Coll Surg . 1998 августа 187 (2): 212-6.[Медлайн].
Поллак M. Pseudomonas Aeruginosa. Манделл Г.Л., Беннетт Дж. Э., Долин Р., ред. Принципы и практика инфекционных болезней . 5-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2000. 2310-27.
CDC. Угрозы устойчивости к антибиотикам в Соединенных Штатах, 2013. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/drugresistance/pdf/ar-threats-2013-508.pdf.
Учебник бактериологии. Интернет-учебник бактериологии Тодара . [Полный текст].
Illgner U, Uekoetter A, Runge S, Wetz HH. Инфекция Pseudomonas aeruginosa при артропатии стопы Шарко. Ступня, щиколотка, внутренняя . 2013 Февраль 34 (2): 234-7. [Медлайн].
Национальная система надзора за внутрибольничными инфекциями (NNIS). Отчет Национальной системы надзора за внутрибольничными инфекциями (NNIS), сводка данных с января 1992 г. по июнь 2004 г., выпущенный в октябре 2004 г.Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/nhsn/pdfs/datastat/nnis_2004.pdf.
Ratjen F, Munck A, Kho P, Angyalosi G. Лечение ранней инфекции Pseudomonas aeruginosa у пациентов с муковисцидозом: испытание ELITE. Грудь . 2010 апр. 65 (4): 286-91. [Медлайн].
Aloush V, Navon-Venezia S, Seigman-Igra Y, Cabili S, Carmeli Y. Синегнойная палочка с множественной лекарственной устойчивостью: факторы риска и клиническое воздействие. Противомикробные агенты Chemother . 2006 Январь 50 (1): 43-8. [Медлайн].
Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Монотерапия бета-лактамом в сравнении с комбинированной терапией бета-лактам-аминогликозидом при сепсисе у иммунокомпетентных пациентов: систематический обзор и метаанализ рандомизированных исследований. BMJ . 2004 20 марта. 328 (7441): 668. [Медлайн].
Bitsori M, Maraki S, Koukouraki S, Galanakis E. Pseudomonas aeruginosa Инфекция мочевыводящих путей у детей: факторы риска и исходы. Дж Урол . 2012 Январь 187 (1): 260-4. [Медлайн].
Идальго Дж. А., Винлуан С. М., Энтони Н. Цефтазидим / авибактам: новый ингибитор цефалоспоринов / небета-лактамных бета-лактамаз для лечения осложненных инфекций мочевыводящих путей и осложненных внутрибрюшных инфекций. Лекарство Des Devel Ther . 2016 26 июля. 10: 2379-86. [Медлайн].
Торрес А., Ранг D, Мелник Д., Рекеда Л., Чен Х, Риккобене Т. и др. Рандомизированное испытание цефтазидима-авибактама в сравнении с меропенемом для лечения бактериальной пневмонии, приобретенной в больнице и связанной с аппаратом искусственной вентиляции легких (REPROVE): анализы в соответствии с конечными точками, указанными FDA США. Открытый форум Infect Dis . 2019 6 (4) апреля: ofz149. [Медлайн].
Allergan объявляет об одобрении FDA препарата Avycaz (цефтазидим и авибактам) для детей. [Полный текст].
Жанель Г.Г., Чанг П., Адам Х., Зеленицкий С., Денисуик А., Швейцер Ф. и др. Цефтолозан / тазобактам: новая комбинация ингибиторов цефалоспоринов / β-лактамаз, обладающая активностью против грамотрицательных бацилл с множественной лекарственной устойчивостью. Наркотики . 2014 Январь 74 (1): 31-51.[Медлайн].
Джанкола С.Е., Махони М.В., Биас Т.Э., Хирш Е.Б. Критическая оценка цефтолозан-тазобактама при осложненных инфекциях мочевыводящих путей и внутрибрюшных инфекциях. Ther Clin Risk Manag . 2016 19 мая. 12: 787-97. [Медлайн].
Kmeid JG, Youssef MM, Kanafani ZA, Kanj SS. Комбинированная терапия грамотрицательных бактерий: какие есть доказательства ?. Expert Rev Anti Infect Ther . 2013 декабря 11 (12): 1355-62. [Медлайн].
Asuphon O, Montakantikul P, Houngsaitong J, Kiratisin P, Sonthisombat P. Оптимизация внутривенного дозирования фосфомицина в комбинации с карбапенемами для лечения инфекций Pseudomonas aeruginosa у пациентов в критическом состоянии на основе моделирования фармакокинетики / фармакодинамики (PK / PD). Int J Заразить Dis . 2016 Сентябрь 50: 23–9. [Медлайн].
Lingscheid T, Tobudic S, Poeppl W., Mitteregger D, Burgmann H. Активность дорипенема плюс фосфомицин in vitro против лекарственно-устойчивых клинических изолятов крови. Фармакология . 2013. 91 (3-4): 214-8. [Медлайн].
Linden PK, Kusne S, Coley K, Fontes P, Kramer DJ, Paterson D. Использование парентерального колистина для лечения серьезной инфекции, вызванной устойчивой к антимикробным препаратам синегнойной палочкой. Clin Infect Dis . 1 декабря 2003 г. 37 (11): e154-60. [Медлайн].
Sabuda DM, Laupland K, Pitout J, Dalton B, Rabin H, Louie T. и др. Использование колистина для лечения синегнойной палочки с множественной лекарственной устойчивостью. Может ли заразить Dis Med Microbiol . 2008 19 ноября (6): 413-8. [Медлайн].
Левин А.С., Бароне А.А., Пенсу Дж., Сантос М.В., Мариньо И.С., Арруда Е.А. и др. Внутривенный колистин для лечения внутрибольничных инфекций, вызванных множественной лекарственной устойчивостью Pseudomonas aeruginosa и Acinetobacter baumannii. Clin Infect Dis . 1999 Май. 28 (5): 1008-11. [Медлайн].
Abuqaddom AI, Darwish RM, Muti H. Влияние некоторых факторов состава, используемых в офтальмологических препаратах, на активность тиомерсала против Pseudomonas aeruginosa и Staphylococcus aureus. J Appl Microbiol . 2003. 95 (2): 250-5. [Медлайн].
Bliziotis IA, Samonis G, Vardakas KZ, Chrysanthopoulou S, Falagas ME. Эффект комбинированной терапии аминогликозидами и бета-лактамом по сравнению с монотерапией бета-лактамом на возникновение устойчивости к противомикробным препаратам: метаанализ рандомизированных контролируемых исследований. Clin Infect Dis . 2005 г. 15 июля. 41 (2): 149-58. [Медлайн].
Chamot E, Boffi El Amari E, Rohner P, Van Delden C.Эффективность комбинированной антимикробной терапии бактериемии Pseudomonas aeruginosa. Противомикробные агенты Chemother . 2003 Сентябрь 47 (9): 2756-64. [Медлайн].
Крауч Брюэр С., Вундернк Р.Г., Джонс С.Б., Липер К.В. мл. Пневмония, связанная с искусственной вентиляцией легких, вызванная синегнойной палочкой. Сундук . 1996 апр. 109 (4): 1019-29. [Медлайн].
Cunha BA. Клиническая значимость пенициллинрезистентного Streptococcus pneumoniae. Заражение семином респира .2002 Сентябрь 17 (3): 204-14. [Медлайн].
Cunha BA. Новые возможности использования старых антибиотиков: нитрофурантоин, амикацин, колистин, полимиксин B, доксициклин и миноциклин. Med Clin North Am . 2006 ноябрь 90 (6): 1089-107. [Медлайн].
Cunha BA. Пневмония, связанная с искусственной вентиляцией легких: при правильном выборе оптимальна монотерапия. Crit Care . 2006. 10 (2): 141. [Медлайн].
Cunha BA. Множественная лекарственная устойчивость (МЛУ) Klebsiella, Acinetobacter и Pseudomonas aeruginosa. Антибиотики для клиницистов . 2006. 10: 354-355.
Cunha BA. Pseudomonas aeruginosa: резистентность и терапия. Заражение семином респира . 2002. 17: 231-239. [Медлайн].
Эдельштейн М.В., Склеенова Е.Н., Шевченко О.В., Д’суза Ю.В., Тапальский Д.В., Азизов И.С. и др. Распространение высокорезистентного VIM-2-положительного ST235 Pseudomonas aeruginosa в Беларуси, Казахстане и России: продольное эпидемиологическое и клиническое исследование. Ланцет Infect Dis . 2013 г. 8 июля [Medline].
Эджворт Дж. Д., Тричер Д. Ф., Эйкин С. Дж. 25-летнее исследование внутрибольничной бактериемии в отделении интенсивной терапии для взрослых. Crit Care Med . 1999, 27 августа (8): 1421-8. [Медлайн].
Fiorillo L, Zucker M, Sawyer D, Lin AN. Синдром псевдомонадных горячих ног. N Engl J Med . 2 августа 2001 г. 345 (5): 335-8. [Медлайн].
Garcia-Lechuz JM, Cuevas O, Castellares C, Perez-Fernandez C, Cercenado E, Bouza E.Streptococcus pneumoniae, инфекции кожи и мягких тканей: характеристика возбудителей и клиническое заболевание. евро J Clin Microbiol Infect Dis . 2007 Апрель 26 (4): 247-53. Epub. [Медлайн].
Гэвин П.Дж., Сусено М.Т., Кук Ф.В., Петерсон Л.Р., Томсон Р.Б. мл. Левосторонний эндокардит, вызванный синегнойной палочкой: успешное лечение меропенемом и тобрамицином. Диагностика Microbiol Infect Dis . 2003 Октябрь 47 (2): 427-30. [Медлайн].
Heal CF, Buettner PG, Cruickshank R, Graham D, Browning S, Pendergast J, et al.Уменьшает ли однократное применение местного хлорамфеникола на зашитых ранах высокого риска частоту раневой инфекции после незначительной операции? Проспективное рандомизированное двойное слепое плацебо-контролируемое исследование. BMJ . 2009 15 января. 338: a2812. [Медлайн]. [Полный текст].
Хобан DJ, Жанель Г.Г. Клинические последствия устойчивости к макролидам при внебольничных инфекциях дыхательных путей. Expert Rev Anti Infect Ther . 2006 декабрь 4 (6): 973-80. [Медлайн].
Ibrahim EH, Ward S, Sherman G, Kollef MH.Сравнительный анализ пациентов с ранней и поздней нозокомиальной пневмонией в отделениях интенсивной терапии. Сундук . 2000 Май. 117 (5): 1434-42. [Медлайн].
Janeczko L. Исследование обнаруживает быстрое распространение широко лекарственной устойчивости P. aeruginosa. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/808645. Дата обращения: 4 августа 2013 г.
Karlowsky JA, Draghi DC, Jones ME, Thornsberry C, Friedland IR, et al. Эпиднадзор за чувствительностью к противомикробным препаратам среди клинических изолятов Pseudomonas aeruginosa и Acinetobacter baumannii от госпитализированных пациентов в США, с 1998 по 2001 год. Противомикробные агенты Chemother . 2003 май. 47 (5): 1681-8. [Медлайн].
Клибанов О.М., Рааш Р.Х., Рублейн Ю. Сравнение однократной и комбинированной антибиотикотерапии при грамотрицательных инфекциях. Энн Фармакотер . 2004 Февраль 38 (2): 332-7. [Медлайн].
Micek ST, Lloyd AE, Ritchie DJ, Reichley RM, Fraser VJ, Kollef MH. Инфекция кровотока, вызванная Pseudomonas aeruginosa: важность надлежащего начального противомикробного лечения. Противомикробные агенты Chemother .2005 апр. 49 (4): 1306-11. [Медлайн].
Muramatsu H, Horii T, Morita M, Hashimoto H, Kanno T., Maekawa M. Влияние основных аминокислот на восприимчивость к карбапенемам в клинических изолятах Pseudomonas aeruginosa. Int J Med Microbiol . 2003 Июнь 293 (2-3): 191-7. [Медлайн].
Paul M, Silbiger I, Grozinsky S, Soares-Weiser K, Leibovici L. Монотерапия бета-лактамным антибиотиком по сравнению с комбинированной терапией бета-лактам-аминогликозидным антибиотиком при сепсисе. Кокрановская база данных Syst Rev . 2006. (1): CD003344. [Медлайн].
Quittner AL, Modi AC, Wainwright C, Otto K, Kirihara J, Montgomery AB. Определение минимальных клинически значимых различий по шкале респираторных симптомов, пересмотренной в опроснике по муковисцидозу, в двух популяциях пациентов с муковисцидозом и хронической инфекцией дыхательных путей, вызванной Pseudomonas aeruginosa. Сундук . 2009 июнь 135 (6): 1610-8. [Медлайн]. [Полный текст].
Retsch-Bogart GZ, Quittner AL, Gibson RL, Oermann CM, McCoy KS, Montgomery AB, et al.Эффективность и безопасность ингаляционного азтреонам лизина для лечения псевдомонад дыхательных путей при муковисцидозе. Сундук . 2009 Май. 135 (5): 1223-32. [Медлайн]. [Полный текст].
Schoni MH. Макролидная антибактериальная терапия у больных муковисцидозом. Swiss Med Wkly . 31 мая 2003 г., 133 (21-22): 297-301. [Медлайн].
Шорр А.Ф. Обзор исследований влияния грамотрицательной бактериальной устойчивости на исходы в отделении интенсивной терапии. Crit Care Med . 2009 Апрель, 37 (4): 1463-9. [Медлайн].
van Delden C. Инфекции кровотока, вызванные Pseudomonas aeruginosa: как их лечить ?. Int J Антимикробные агенты . 2007 30 ноября Приложение 1: S71-5. [Медлайн].
Veesenmeyer JL, Hauser AR, Lisboa T, Rello J. Вирулентность и терапия синегнойной палочки: развивающиеся стратегии трансляции. Crit Care Med . 2009 Май. 37 (5): 1777-86. [Медлайн]. [Полный текст].
Вонберг Р.П., Гастмайер П. Изоляция пациентов с инфекционным муковисцидозом: результаты систематического обзора. Инфекционный контроль Hosp Epidemiol . 2005 26 апреля (4): 401-9. [Медлайн].
Ван С., Квок М., Макнамара Дж. К., Кунья Б.А. Колистин для лечения грамотрицательных бациллярных инфекций с множественной лекарственной устойчивостью (МЛУ). Антибиотики для клиницистов . 2007. 11: 389-396.
Беннет, Джон. Грамотрицательные бациллы. Принципы инфекционных болезней Манделла, Дугласа и Беннета . Восьмой.
Клиническая презентация инфекции, вызванной псевдомонадой: история, физика, причины
Бендиак Г. Н., Ратьен Ф. Подход к лечению синегнойной палочки при муковисцидозе. Semin Respir Crit Care Med . 2009 30 октября (5): 587-95. [Медлайн].
Поллак М. Вирулентность синегнойной палочки. Ред. Заразить Dis . 1984. 6: S617-26.
Burkholder W. Кислая кожица, бактериальная гниль луковиц. Фитопатология . 1950. 40: 115-8.
Werth BJ, Carreno JJ, Reveles KR. Изменяющиеся тенденции в заболеваемости септицемией Pseudomonas aeruginosa у госпитализированных взрослых в США с 1996 по 2010 гг. Am J Infect Control . 2015 1 мая. 43 (5): 465-8. [Медлайн].
Reichert F, Piening B, Geffers C, Gastmeier P, Bührer C, Schwab F.Патоген-специфическая кластеризация внутрибольничных инфекций кровотока у очень недоношенных детей. Педиатрия . 2016 г. 8 марта [Medline].
Розенфельд М., Эмерсон Дж., Макнамара С. и др. Факторы риска для возраста на момент первоначального приобретения Pseudomonas в когорте эпических наблюдений за муковисцидозом. J Cyst Fibros . 2012 г. 1 мая. [Medline].
Morgan DJ, Rogawski E, Thom KA и др. Перенос бактерий с множественной лекарственной устойчивостью на перчатки и халаты медицинских работников после контакта с пациентом увеличивается из-за загрязнения окружающей среды. Crit Care Med . 2012 Апрель 40 (4): 1045-51. [Медлайн].
Кильхофнер М., Атмар Р.Л., Хэмилл Р.Дж., Мушер Д.М. Опасные для жизни инфекции Pseudomonas aeruginosa у пациентов с инфекцией вируса иммунодефицита человека. Clin Infect Dis . 1992 14 февраля (2): 403-11. [Медлайн].
Giamarellou H, Antoniadou A. Антипсевдомонадные антибиотики. Med Clin North Am . 2001, январь 85 (1): 19-42, т. [Medline].
[Руководство] Комитет по инфекционным болезням.Применение системных фторхинолонов. Педиатрия . 2006 Сентябрь 118 (3): 1287-92. [Медлайн].
Langton Hewer SC, Smyth AR. Стратегии антибиотиков для искоренения синегнойной палочки у людей с муковисцидозом. Кокрановская база данных Syst Rev . 2017 25 апреля. 4: CD004197. [Медлайн].
Douidar SM, Snodgrass WR. Возможная роль фторхинолонов в педиатрических инфекциях. Ред. Заразить Dis . 1989 ноябрь-декабрь.11 (6): 878-89. [Медлайн].
Carmeli Y, Troillet N, Eliopoulos GM, Samore MH. Возникновение устойчивой к антибиотикам синегнойной палочки: сравнение рисков, связанных с различными антипсевдомонадными агентами. Противомикробные агенты Chemother . 1999 июн. 43 (6): 1379-82. [Медлайн].
Альтемайер WA, Тонелли MR, Aitken ML. Псевдомонадный перикардит, осложняющий муковисцидоз. Педиатр Пульмонол . 1999, 27 января (1): 62-4. [Медлайн].
Arbulu A, Holmes RJ, Asfaw I. Трехстворчатая вальвулэктомия без замены. Двадцать лет опыта. J Thorac Cardiovasc Surg . 1991 декабрь 102 (6): 917-22. [Медлайн].
Ashdown LR, Guard RW. Распространенность мелиоидоза человека в Северном Квинсленде. Ам Дж. Троп Мед Хиг . 1984 Май. 33 (3): 474-8. [Медлайн].
Baltch AL, Griffin PE. Бактериемия Pseudomonas aeruginosa: клиническое исследование 75 пациентов. Am J Med Sci . 1977 сентябрь-октябрь. 274 (2): 119-29. [Медлайн].
Баум Дж., Барза М. Актуальное или субконъюнктивальное лечение бактериальных язв роговицы. Офтальмология . 1983 Февраль 90 (2): 162-8. [Медлайн].
Брюэр SC. Клинические исследования в интенсивной терапии: пневмония, связанная с искусственной вентиляцией легких, вызванная синегнойной палочкой. Сундук . 1996. 109: 4: 1020-30.
Бирн С., Мэддисон Дж., Коннор П. и др.Клиническая оценка меропенема по сравнению с цефтазидимом для лечения Pseudomonas spp. инфекции у больных муковисцидозом. J Antimicrob Chemother . 1995 г., июль 36, приложение A: 135-43. [Медлайн].
Кливленд Р.П., Хазлетт Л.Д., Леон М.А., Берк Р.С. Роль комплемента в инфекции роговицы мышей, вызванной синегнойной палочкой. Инвест офтальмол Vis Sci . 1983, 24 февраля (2): 237-42. [Медлайн].
Cunha BA. Устойчивость к антибиотикам. Med Clin North Am . 2000 ноябрь 84 (6): 1407-29. [Медлайн].
Дэвис С.Д., Сарфф Л.Д., Хиндюк Р.А. Сравнение терапевтических способов лечения экспериментального псевдомонадного кератита. Ам Дж. Офтальмол . 1979 Май. 87 (5): 710-6. [Медлайн].
Эджворт Дж. Д., Тричер Д. Ф., Эйкин С. Дж. 25-летнее исследование внутрибольничной бактериемии в отделении интенсивной терапии для взрослых. Crit Care Med . 1999, 27 августа (8): 1421-8. [Медлайн].
Международная кооперативная группа по антимикробной терапии EORTC.Цефтазидим в сочетании с коротким или длительным курсом амикацина для эмпирической терапии грамотрицательной бактериемии у онкологических больных с гранулоцитопенией. N Engl J Med . 1987, 31 декабря. 317 (27): 1692-8. [Медлайн].
Fagon JY, Chastre J, Domart Y и др. Нозокомиальная пневмония у пациентов, получающих непрерывную ИВЛ. Проспективный анализ 52 эпизодов с использованием защищенной кисти для образцов и методов количественного культивирования. Am Rev Respir Dis .1989 апр. 139 (4): 877-84. [Медлайн].
Germiller JA, Эль-Кашлан, HK, Шах, Великобритания. Хронические инфекции кохлеарных имплантатов, вызванные Pseudomonas. Отол Нейротол . 2005 26 марта (2): 196-201. [Медлайн].
Giamarellou H. Эмпирическая терапия инфекций у лихорадочного, нейтропенического, скомпрометированного хозяина. Med Clin North Am . 1995 Май. 79 (3): 559-80. [Медлайн].
Giamarellou H. Злокачественный наружный отит: терапевтическое развитие летальной инфекции. J Antimicrob Chemother . 1992 г. 30 (6): 745-51. [Медлайн].
Гиттерман Б. Кратко: аминогликозиды. Обзор педиатрии . 1998 19 августа (8): 285.
Griffiths AL, Jamsen K, Carlin JB и др. Влияние сегрегации на эпидемический штамм Pseudomonas aeruginosa в клинике муковисцидоза. Am J Respir Crit Care Med . 2005 г. 1. 171 (9): 1020-5. [Медлайн].
Харрис А., Торрес-Вьера С., Венкатараман Л. и др.Эпидемиология и клинические исходы пациентов с полирезистентной синегнойной палочкой. Clin Infect Dis . 1999 Май. 28 (5): 1128-33. [Медлайн].
Highsmith AK, Ле ПН, Хаббаз РФ, Мунн В.П. Характеристики синегнойной палочки, выделенной из водоворотов и купающихся. Инфекционный контроль . 1985 6 октября (10): 407-12. [Медлайн].
Ho PL, Chan KN, IP MS, et al. Влияние инфекции Pseudomonas aeruginosa на клинические параметры стационарных бронхоэктазов. Сундук . 1998 декабрь 114 (6): 1594-8. [Медлайн].
Husson MO, Richet H, Aubert A, et al. Сравнительная активность меропенема с 15 другими противомикробными средствами против 1798 изолятов Pseudomonas aeruginosa in vitro во французском многоцентровом исследовании. Clin Microbiol Infect . 1999 августа, 5 (8): 499-503. [Медлайн].
Isles A, Maclusky I, Corey M, et al. Инфекция Pseudomonas cepacia при муковисцидозе: возникающая проблема. J Педиатр . 1984 Февраль 104 (2): 206-10. [Медлайн].
Канг К.И., Ким С.Х., Парк В.Б. и др. Клинические особенности и исходы пациентов с внебольничной бактериемией Pseudomonas aeruginosa. Clin Microbiol Infect . 2005 Май. 11 (5): 415-8. [Медлайн].
Karlowicz MG, Buescher ES, Surka AE. Фульминантный сепсис с поздним началом в отделении интенсивной терапии новорожденных, 1988–1997 гг., И влияние отказа от эмпирической терапии ванкомицином. Педиатрия . 2000 Декабрь 106 (6): 1387-90. [Медлайн].
Керем Э. Роль синегнойной палочки в патогенезе болезни легких при муковисцидозе: больше вопросов, чем ответов. Детская пульмонология — Приложение . 1997. 14: 403-11.
Комшян С.В., Таблан О.К., Палутке В., Рейес М.П. Характеристики левостороннего эндокардита, вызванного синегнойной палочкой, в Медицинском центре Детройта. Ред. Заразить Dis .1990 июль-авг. 12 (4): 693-702. [Медлайн].
Koprnova J, Beno P, Korcova J, et al. Бактериемия, вызванная Pseudomonas aeruginosa: результаты трехлетнего национального исследования в Словацкой Республике. J Chemother . 2005 17 октября (5): 470-6. [Медлайн].
Lahiri T. Подходы к лечению начальной инфекции Pseudomonas aeruginosa у детей с муковисцидозом. Clin Chest Med . 2007 июн. 28 (2): 307-18. [Медлайн].
Малати Дж., Ли Дж. К., Чжан М. и др.Щелкните здесь, чтобы прочитать о потере слуха и степени повреждения лабиринта при Pseudomonas media otitis. Малати Дж., Ли Дж. Си, Чжан М., Стивенс Дж., Антонелли П. Дж.. Отделение отоларингологии, Университет Флориды, Гейнсвилл, 32610-0264, США. Отоларингол Хирургия головы и шеи . 2005 Январь 132 (1): 25-9. [Медлайн].
Малати Дж., Ли Дж. К., Чжан М. и др. Потеря слуха и степень повреждения лабиринта при среднем отите Pseudomonas. Отоларингол Хирургия головы и шеи . 2005 Янв.132 (1): 25-9. [Медлайн].
Marchetti F, Bua J. Необходимы дополнительные доказательства для лечения антибиотиками колонизации Pseudomonas aeruginosa. Arch Dis Детский . 2005 ноябрь 90 (11): 1204. [Медлайн].
Masekela R, зеленый RJ. Роль макролидов в бронхоэктазиях, не связанных с муковисцидозом. Медиаторы воспаления . 2012. 2012: 134605. [Медлайн]. [Полный текст].
Медицинское письмо.Лекарства от инфекций, передающихся половым путем. Med Lett Drugs Ther . 1999 24 сентября. 41 (1062): 85-90. [Медлайн].
Медицинское письмо. Выбор антибактериальных препаратов. Med Lett Drugs Ther . 1999, 22 октября. 41 (1064): 95-104. [Медлайн].
Милнер С.М. Уксусная кислота для лечения синегнойной палочки при поверхностных ранах и ожогах. Ланцет . 4 июля 1992 г. 340 (8810): 61. [Медлайн].
Моррисон А.Дж. младший, Венцель РП.Эпидемиология инфекций, вызванных синегнойной палочкой. Ред. Заразить Dis . 1984 сентябрь-октябрь. 6 Дополнение 3: S627-42. [Медлайн].
Mukhopedhyay S, Singh M, Cater JI. Распыленная терапия антипсевдомонадными антибиотиками при муковисцидозе: метаанализ преимуществ и рисков. Грудь . 1996. 51: 364.
Малл, CC. История болезни: гангренозная эктима как проявление псевдомонадного сепсиса у ранее здорового ребенка. Анналы Emerg Med .2000 Октябрь, 36: 4.
Nagaki M, Shimura S, Tanno Y и др. Роль хронической инфекции Pseudomonas aeruginosa в развитии бронхоэктазов. Сундук . 1992 ноябрь 102 (5): 1464-9. [Медлайн].
Neo EN, Haritharan T, Thambidorai CR, Suresh V. Некротический фасциит, вызванный псевдомонадой, у иммунокомпетентного младенца. Pediatr Infect Dis J . 2005 24 октября (10): 942-3. [Медлайн].
Obritsch MD, Fish DN, MacLaren R, Jung R.Нозокомиальные инфекции, вызванные синегнойной палочкой с множественной лекарственной устойчивостью: эпидемиология и варианты лечения. Фармакотерапия . 2005 25 октября (10): 1353-64. [Медлайн].
Пандей А, Малени Р., Астхана АК. Pseudomonas aeruginosa, продуцирующая бета-лактамазу, у госпитализированных пациентов. Индийский Дж. Патол Микробиол . 2005 Октябрь, 48 (4): 530-3. [Медлайн].
Пол М., Лейбовичи Л. Комбинированная антибактериальная терапия бактериемии Pseudomonas aeruginosa. Ланцет Infect Dis . 2004 августа, 4 (8): 519-27. [Медлайн].
Radford R, Brahma A, Armstrong M, Tullo AB. Тяжелый склерокератит, вызванный синегнойной палочкой, у лиц, не носящих контактные линзы. Глаз . 2000, 14 февраля (часть 1): 3-7. [Медлайн].
Rajashekaraiah KR, Rice TW, Kallick CA. Излечение синегнойной палочки из шприцев наркоманов, больных эндокардитом. J Заразить Dis . 1981 ноябрь 144 (5): 482. [Медлайн].
Ройлидес Э., Батлер К.М. и др. Псевдомонадные инфекции у детей с вирусной инфекцией иммунодефицита человека. Pediatric Infect Dis J . 1992. 11: 547-53.
Сайман Л. Применение макролидных антибиотиков у больных муковисцидозом. Curr Opin Pulm Med . 2004 ноябрь 10 (6): 515-23. [Медлайн].
Schimpff SC, Муди М, Янг В.М. Связь колонизации Pseudomonas aeruginosa с развитием бактериемии Pseudomonas у онкологических больных. Противомикробные средства Chemother . 1970. 10: 240-4. [Медлайн].
Таббара К.Ф., Эль-Шейх Х.Ф., Обед Б. Бактериальный кератит, связанный с контактными линзами длительного ношения. Br J Офтальмол . 2000 Март 84 (3): 327-8. [Медлайн].
Таблан О.К., Чорба Т.Л., Шидлоу Д.В. и др. Колонизация Pseudomonas cepacia у пациентов с муковисцидозом: факторы риска и клинические исходы. J Педиатр . 1985 Сентябрь 107 (3): 382-7. [Медлайн].
Taneja N, Meharwal SK, Sharma SK, Sharma M. Значение и характеристика псевдомонад в образцах мочевыводящих путей. Дж. Коммунальное письмо . 2004 г., 36 (1): 27-34. [Медлайн].
Цекоурас А.А., Джонсон А., Миллер Г., Ортон Х.И. Некротический фасциит, вызванный Pseudomonas aeruginosa: клинический случай. J Заразить . 1998 Сентябрь 37 (2): 188-90. [Медлайн].
Tumaliuan JA, Stambouly JJ, Schiff RJ, et al.Псевдомонадный перикардит и тампонада у младенца с инфекцией вируса иммунодефицита человека. Arch Pediatr Adolesc Med . 1997 Февраль 151 (2): 207-8. [Медлайн].
Уайтхед Б., Хелмс П., Гудвин М. и др. Трансплантация сердце-легкие при муковисцидозе. 2: Результат. Arch Dis Детский . 1991 сентябрь 66 (9): 1022-6; обсуждение 1016-7. [Медлайн].
Wu BY, Peng CT, Tsai CH, Chiu HH. Внебольничная бактериемия и сепсис Pseudomonas aeruginosa у ранее здоровых младенцев. Acta Paediatr Тайвань . 1999 июль-авг. 40 (4): 233-6. [Медлайн].
Yeung CK, Lee KH. Внебольничная фульминантная инфекция желудочно-кишечного тракта Pseudomonas у ранее здоровых младенцев. J Детский педиатр . 1998 Декабрь 34 (6): 584-7. [Медлайн].
Безрецептурные антисептические продукты для местного применения: информация о безопасности лекарств — FDA требует изменения этикеток и одноразовой упаковки для снижения риска заражения. FDA . 13.11.2013. Доступно по адресу http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm374892.htm.
Zegans ME, DiGiandomenico A, Ray K, Naimie A, Keller AE, Stover CK, et al. Ассоциация образования биопленок, экспрессии экзополисахарида Psl и клинических результатов при кератите, вызванном Pseudomonas aeruginosa: анализ изолятов в стероидах для исследования язв роговицы. JAMA Офтальмол . 2016 г. 4 февраля [Medline].
Pseudomonas aeruginosa — Информационные и эпидемиологические службы
© Деннис Кункель Микроскопия
Pseudomonas aeruginosa — это грамотрицательные бактерии, которые обычно встречаются в окружающей среде, например почва, вода и другие влажные места
Какие болезни вызывает синегнойная палочка?
Pseudomonas aeruginosa — условно-патогенный микроорганизм.Бактерии используют ослабленную иммунную систему человека для создания инфекции, и этот организм также производит токсины, повреждающие ткани. Pseudomonas aeruginosa вызывает инфекции мочевыводящих путей, инфекции дыхательной системы, дерматиты, инфекции мягких тканей, бактериемию, инфекции костей и суставов, желудочно-кишечные инфекции и различные системные инфекции, особенно у пациентов с тяжелыми ожогами, а также у больных раком и СПИДом с подавленным иммунитетом.
Кто более восприимчив к инфекции Pseudomonas aeruginosa?
Эта бактерия представляет особую опасность для людей с муковисцидозом, которые очень восприимчивы к псевдомонадным легочным инфекциям.Pseudomonas aeruginosa также вызывает серьезную озабоченность у больных раком и ожогами, а также у людей с ослабленным иммунитетом. Летальность среди людей, инфицированных синегнойной палочкой, приближается к 50 процентам.
Эпидемиология синегнойной палочки
Pseudomonas aeruginosa в первую очередь является внутрибольничным возбудителем. По данным CDC, общая заболеваемость инфекциями P. aeruginosa в больницах США в среднем составляет около 0.4 процента (4 на 1000 выписок), и эта бактерия является четвертым по распространенности внутрибольничным патогеном, на который приходится 10,1 процента всех внутрибольничных инфекций. В больнице P. aeruginosa находит множество резервуаров: дезинфицирующие средства, респираторное оборудование, продукты питания, раковины, краны и швабры. Этот организм часто повторно попадает в больничную среду с фруктами, растениями, овощами, а также посетителями и пациентами, переведенными из других учреждений. Передается от пациента к пациенту через руки персонала больницы, при прямом контакте пациента с загрязненными резервуарами, а также при приеме внутрь зараженных пищевых продуктов и воды.
Инкубационный период
Обычно 24-72 часа.
Диагностика синегнойной палочки
Диагностика инфекции P. aeruginosa зависит от выделения и лабораторной идентификации бактерии. Он хорошо растет на большинстве лабораторных сред и обычно выделяется на кровяном агаре или эозин-метилтиониновом синем агаре. Его идентифицируют на основании морфологии по Граму, неспособности ферментировать лактозу, положительной оксидазной реакции, фруктового запаха и способности расти при 42 ° C.Флуоресценция в ультрафиолетовом свете помогает на ранней стадии идентификации колоний P. aeruginosa, а также может помочь определить ее присутствие в ранах.
Лечение синегнойной палочки
Pseudomonas aeruginosa часто устойчива ко многим широко применяемым антибиотикам. Хотя многие штаммы чувствительны к гентамицину, тобрамицину, колистину и амикацину, появились устойчивые формы. Комбинация гентамицина и карбенициллина часто используется для лечения тяжелых инфекций Pseudomonas.Несколько типов вакцин проходят испытания, но в настоящее время нет доступных для общего использования.
* — Иногда (неправильно) пишется Pseudomonas aeroginosa
Свяжитесь с EHA Consulting Group сегодня, чтобы получить дополнительную информацию о том, как мы можем помочь вашей компании.
Инфекция Pseudomonas: симптомы и лечение
A Инфекция Pseudomonas — это бактериальная инфекция. Pseudomonas — это группа бактерий, присутствующих в окружающей среде в почве и воде во всем мире.Обычно они не вызывают заболеваний у здоровых людей. Вместо этого они оппортунистичны. Это означает, что они обычно вызывают инфекцию, используя возможность, в которой хозяин уязвим. Возможность может включать ослабление иммунной системы, серьезное заболевание или нарушение барьера, такого как кожа.
Бактерии Pseudomonas любят влажные участки. Они прекрасно себя чувствуют в раковинах, туалетах, ванных комнатах, кухнях, бассейнах и гидромассажных ваннах. В больницах они также могут присутствовать в катетерах, емкостях для мочи и вентиляторах.Они могут жить даже на контактных линзах, в устаревших антисептических и контактных растворах. Иногда Pseudomonas обитает в подмышечных впадинах и на половых органах здоровых людей.
Наиболее распространенный тип инфекции Pseudomonas вызван Pseudomonas aeruginosa (P. aeruginosa) . Заражение этим штаммом чаще всего происходит у госпитализированных пациентов. Этот вид инфекции называется внутрибольничной инфекцией. В больнице это часто вызывает пневмонию, ИМП (инфекцию мочевыводящих путей) и инфекцию в области хирургического вмешательства.Однако он также может заразить кровь и сердце. В сообществе инфекций, вызываемых Pseudomonas , обычно проявляются в форме инфекции уха, глаз или кожи. В очень редких случаях другие штаммы, такие как Pseudomonas fluorescens , вызывают заболевание у людей.
В больнице Pseudomonas передается через контакт с зараженными руками, оборудованием и поверхностями. Соблюдение строгих правил инфекционного контроля может предотвратить эту передачу. В сообществе он распространяется в основном через неправильно обслуживаемые и дезинфицированные бассейны и горячие ванны.
Симптомы инфекции различаются в зависимости от того, на какую часть тела она нацелена. Симптомы также варьируются от легких до тяжелых. К группе повышенного риска инфицирования и развития тяжелого заболевания относятся госпитализированные люди с ослабленной иммунной системой или ослабленным здоровьем.
Поскольку это бактериальная инфекция, лечение Pseudomonas включает антибиотики. В зависимости от того, где находится инфекция и насколько серьезна она, антибиотики могут быть местными, пероральными или внутривенными. Серьезные осложнения, например сепсис, могут привести к летальному исходу.Общественные инфекции обычно проходят при правильном лечении. Обратитесь к врачу, если у вас появятся признаки инфекции уха, глаз или кожи.
Инфекции хирургической области | Johns Hopkins Medicine
Ваша кожа — естественный барьер от инфекций. Даже при наличии множества мер предосторожности и протоколов для предотвращения заражения любая операция, вызывающая разрыв кожи, может привести к инфекции. Врачи называют эти инфекции инфекциями области хирургического вмешательства (SSI), потому что они возникают на той части тела, где проводилась операция.Если вам сделают операцию, вероятность развития ИОХВ составляет от 1% до 3%.
Типы инфекций области хирургического вмешательства
ИОХВ обычно возникает в течение 30 дней после операции. CDC описывает 3 типа инфекций в области хирургического вмешательства:
Поверхностный послеоперационный хирургический синдром. Эта инфекция возникает как раз на участке кожи, где был сделан разрез.
Глубокий инцизионный имплант. Эта инфекция возникает под областью разреза в мышцах и тканях, окружающих мышцы.
Орган или пространство SSI. Этот тип инфекции может быть в любой области тела, кроме кожи, мышц и окружающих тканей, которые были задействованы во время операции. Это включает в себя орган тела или пространство между органами.
Признаки и симптомы инфекций в области хирургического вмешательства
Любая ИОХВ может вызвать покраснение, задержку заживления, лихорадку, боль, болезненность, тепло или отек. Это другие признаки и симптомы определенных типов SSI:
.Поверхностная послеоперационная ИОХВ может выделять гной из раны.Образцы гноя можно выращивать в культуре, чтобы определить типы микробов, вызывающих инфекцию.
При глубоком послеоперационном вмешательстве также может выделяться гной. Место раны может открыться само по себе, или хирург может снова открыть рану и обнаружить внутри раны гной.
Орган или пространство SSI может показывать выделения гноя из дренажа, проходящего через кожу в пространство или орган тела. Скопление гноя, называемое абсцессом, представляет собой замкнутую область гноя и распадающейся ткани, окруженную воспалением.Абсцесс можно увидеть, когда хирург повторно вскрывает рану или при специальных рентгеновских исследованиях.
Причины и факторы риска инфекций в области хирургического вмешательства
Инфекции после операции вызваны микробами. К наиболее распространенным из них относятся бактерии Staphylococcus , Streptococcus и Pseudomonas . Микробы могут заразить хирургическую рану посредством различных форм контакта, например, от прикосновения к зараженному лицу, осуществляющему уход, или хирургического инструмента, через микробы в воздухе или через микробы, которые уже находятся на вашем теле или в нем и затем распространяются в рану.
Степень риска ИОХВ зависит от типа вашей хирургической раны. Хирургические раны классифицируются следующим образом:
Чистые раны. Они не воспалены и не загрязнены и не требуют операции на внутренних органах.
Чисто загрязненные раны. У них нет доказательств инфекции во время операции, но есть операция на внутреннем органе.
Зараженные раны.Они включают операцию на внутреннем органе с вытеканием содержимого из органа в рану.
Грязные раны. Это раны, в которых на момент операции присутствует известная инфекция.
Это другие факторы риска ИОХВ:
Операция продолжительностью более 2 часов
Наличие других медицинских проблем или заболеваний
Быть пожилым человеком
Избыточный вес
Курение
Рак
Со слабой иммунной системой
Болеют диабетом
Отделение неотложной помощи
Абдоминальная хирургия
Помощь в профилактике инфекций в области хирургического вмешательства
Если вам предстоит операция, спросите своего врача, что вы можете сделать, чтобы снизить риск инфекции в области хирургического вмешательства.Важно бросить курить до операции и рассказать хирургам о своей истории болезни, особенно если у вас диабет или другое хроническое заболевание. Также избегайте бритья тех участков кожи, которые планирует оперировать хирург.
Какими бы любопытными они ни были, близкие не должны трогать вашу рану или место операции. Тщательно следуйте инструкциям врача по уходу за раной после операции. Позвоните своему врачу, если у вас появится жар или гной, покраснение, жар, боль или болезненность возле раны или любые другие признаки или симптомы инфекции в области хирургического вмешательства.
Лечение инфекций в области хирургического вмешательства
Большинство ИОХВ можно лечить антибиотиками. Иногда для лечения ИОХВ может потребоваться дополнительная операция или процедуры. Во время выздоровления убедитесь, что друзья и члены семьи моют руки до и после того, как они войдут в вашу комнату. Убедитесь, что врачи, медсестры и другие лица, осуществляющие уход, тоже моют руки.
границ | Толерантность и устойчивость биопленок Pseudomonas aeruginosa к антимикробным агентам — как P. aeruginosa может избежать применения антибиотиков
Введение
Исследования, проведенные за последние три десятилетия, показали, что бактерии в большинстве случаев живут в режиме роста биопленок, тогда как состояние планктонных отдельных клеток считается переходной фазой.Переход бактерий от планктонного режима роста к состоянию биопленки зависит от продукции адгезинов и компонентов внеклеточного матрикса, которые служат каркасом и заключают бактерии в биопленки (Tolker-Nielsen, 2015). Матрикс в биопленках Pseudomonas aeruginosa состоит в основном из полисахаридов, белков, внеклеточной ДНК и липидов, и его состав зависит от штамма, а также от условий роста и возраста биопленки (Pamp et al., 2007). Многие штаммы P. aeruginosa способны синтезировать три экзополисахарида, Pel, Psl и альгинат, которые играют роль в формировании биопленок в качестве компонентов матрикса (Høiby et al., 1974; Govan and Deretic, 1996; Friedman and Kolter, 2004; Мацукава, Гринберг, 2004; Оверхэдж и др., 2005; Ма и др., 2006, 2009). Наряду с экзополисахаридами белки, такие как пили типа IV, фимбрия Cup, адгезины CdrA, лектины LecAB и амилоидные волокна Fap, могут быть частью P.aeruginosa (O’Toole, Kolter, 1998; Vallet et al., 2001; Klausen et al., 2003; Tielker et al., 2005; Diggle et al., 2006; Giltner et al., 2006; Borlee et al., 2003; Tielker et al., 2005; Diggle et al., 2006; Giltner et al., 2006; Borlee et al. al., 2010; Dueholm et al., 2013; Rybtke et al., 2015a). Более того, внеклеточная ДНК (еДНК) функционирует как важный матричный компонент в биопленках P. aeruginosa (Whitchurch et al., 2002; Allesen-Holm et al., 2006). Кроме того, были представлены доказательства участия рамнолипидов в формировании микроколоний у P.aeruginosa (Pamp, Tolker-Nielsen, 2007).
Вторичный мессенджер циклический дигуанозин-5′-монофосфат (c-di-GMP) является ключевым регулятором жизненного цикла биопленок у многих бактерий, включая P. aeruginosa (Fazli et al., 2014; Jenal et al., 2017 ). Высокие клеточные уровни c-di-GMP вызывают выработку адгезинов и компонентов внеклеточного матрикса, которые приводят к образованию биопленок, тогда как низкие уровни c-di-GMP подавляют выработку адгезинов и компонентов внеклеточного матрикса и вызывают диспергирование биопленок, так что бактерии включитесь в планктонный режим роста.Синтез и разложение c-ди-GMP в бактериях происходит за счет противоположной активности дигуанилатциклаз (DGC) и c-ди-GMP фосфодиэстеразы (PDE). Многие из DGC и PDE содержат сенсорные домены, которые, как считается, позволяют бактериям реагировать на сигналы окружающей среды и регулировать производство компонентов матрикса биопленки. Некоторые из двухкомпонентных сигнальных систем у P. aeruginosa связаны с регуляцией продукции компонентов внеклеточного матрикса (Goodman et al., 2004; Barraud et al., 2009; An et al., 2010; Мэлоун и др., 2010; Петрова, Зауэр, 2010; Москосо и др., 2011; Ли и др., 2013). В качестве яркого примера, двухкомпонентная система GacA / GacS регулирует экспрессию ряда генов, включая те, которые кодируют синтез экзополисахаридов Pel и Psl, и было показано, что она пересекается с передачей сигналов c-di-GMP (Goodman et al. , 2004, 2009; Moscoso et al., 2011). Чувствительность кворума (QS) также влияет на формирование биопленки у P. aeruginosa (Davies et al., 1998). Система QS в P. aeruginosa состоит из двух систем, основанных на ацилгомосеринлактонах, Las и Rhl, и системы PQS на основе хинолонов, которые взаимосвязаны и комплексно регулируют друг друга (Juhas et al., 2005) . PQS положительно регулирует продукцию матричного компонента эДНК (Allesen-Holm et al., 2006), тогда как система Rhl регулирует выработку рамнолипидов, что важно для образования биопленок, и толерантность биопленок P. aeruginosa к иммунным клеткам. (Памп и Толкер-Нильсен, 2007; Ван Акер и др., 2009).
Одной из наиболее важных особенностей микробных биопленок является то, что бактерии способны выжить при лечении антибиотиками в высоких дозах (Costerton et al., 1999). Если биопленка рассредоточена, планктонные бактерии проявляют чувствительность к антибиотикам и показывают низкие значения минимальной ингибирующей концентрации (МИК). Термин «толерантность» отличает этот тип выживаемости при лечении антибиотиками, ассоциированной с биопленкой, от «устойчивости», которая характеризуется повышенными МПК и устойчивым фенотипом бактерий, диспергированных в биопленке.Механически устойчивость возникает из-за приобретенных мутаций и обычно включает в себя модулирующие антибиотики ферменты, оттокные насосы или мутации, которые устраняют молекулярную мишень антибиотика и позволяют бактериям выжить после лечения антибиотиком, даже если они не встроены в биопленку. Напротив, устойчивые к антибиотикам клетки в биопленках способны выдерживать высокие концентрации антибиотиков, только если они встроены в биопленки. Как устойчивость, так и толерантность участвуют в устойчивости биопленок к лечению антибиотиками (Lebeaux et al., 2014).
Термин «толерантность к антибиотикам» также может использоваться в контексте популяций планктонных бактерий, и здесь он описывает бактериальные клетки, которые выживают при лечении бактерицидными антибиотиками, не приобретая детерминант устойчивости к антибиотикам. Толерантность планктонных бактерий к антибиотикам в основном вызвана измененным физиологическим состоянием клеток в результате стресса окружающей среды и опосредована клеточными стрессовыми реакциями и связанными с ними системами (Brauner et al., 2016; Трастой и др., 2018). В биопленках, прикрепленных или не прикрепленных к поверхностям, бактерии агрегируются в самостоятельно продуцируемом внеклеточном матриксе, образуя структурированную среду, с которой не сталкиваются планктонные клетки. Специфическая для биопленок среда запускает развитие толерантных субпопуляций, которые составляют значительную часть биопленки, и механизмы толерантности, например, связанные с внеклеточным матриксом или анаэробными условиями (Brauner et al., 2017; Trastoy et al. ., 2018), которые отличаются от клеток планктона.
Биопленки являются причиной стойких инфекций, связанных с различными медицинскими имплантатами, а также с такими заболеваниями, как хронические раны, хроническая обструктивная болезнь легких, инфекции мочевыводящих путей и муковисцидоз (Costerton et al., 1999; Tolker-Nielsen , 2014; Ciofu et al., 2015; Rybtke et al., 2015b). Способность микробных биопленок переносить антибиотики и компоненты иммунной системы хозяина является основной причиной проблемных инфекций, которые они вызывают (Høiby et al., 2015). Используемые в настоящее время антибиотики могут уменьшить количество бактерий в биопленках, но они не могут полностью уничтожить биопленки (Fernandez-Barat et al., 2017), и, следовательно, часто возникают рецидивы инфекций биопленок. Следовательно, для лечения инфекций биопленки может потребоваться удаление инфицированных тканей или имплантированных устройств и последующая длительная противомикробная терапия. Было продемонстрировано, что молодые биопленки гораздо более восприимчивы к антибиотикам, чем более развитые биопленки (Hengzhuang et al., 2014; Стюарт, 2015), подчеркивая важность раннего вмешательства в лечение биопленочных инфекций. Основным клиническим следствием толерантности биопленок к антибиотикам является то, что высокая концентрация антибиотиков, необходимая для лечения инфекций биопленки [для некоторых антибиотиков до 1000 раз выше, чем для планктонных клеток (Macia et al., 2014)], не может быть достигнута in vivo. при системном введении без токсичности (Hengzhuang et al., 2012). Обеспечение высоких концентраций антибиотиков путем местного применения, комбинированных антимикробных препаратов и последовательной терапии или использования адъювантов для повышения эффективности антибиотиков — это терапевтические стратегии, которые используются или были предложены для лечения инфекций биопленки (Høiby et al., 2015; Ciofu et al., 2017).
Детальное понимание механизмов, которые участвуют в устойчивости биопленок к антимикробной активности, в конечном итоге позволит нам разработать эффективные методы лечения широкого спектра стойких инфекций. Поэтому проводится больше исследований, чтобы пролить свет на молекулярные механизмы, которые участвуют в устойчивости биопленок к противомикробным препаратам. В настоящем обзоре мы сначала описываем общие механизмы, которые способствуют устойчивости к антимикробным препаратам, связанным с биопленками.Впоследствии мы описываем вклад конкретных генов в биопленку, связанную с толерантностью к антибиотикам. Затем, чтобы подчеркнуть многофакторный характер толерантности к биопленкам, мы сосредоточимся на конкретных классах антибиотиков и опишем связанные с биопленкой механизмы толерантности к противомикробным препаратам, которые играют роль в толерантности к каждому из этих классов антибиотиков (рис. 1). Наконец, описаны механизмы, участвующие в развитии мутационной устойчивости клеток биопленки к антибиотикам.
Рисунок 1 .Механизмы, участвующие в связанной с биопленкой толерантности к различным классам антибиотиков. Бета-лактамы представлены серыми эллипсами, фторхинолоны — зеленым, аминогликозиды — синим, а антимикробные пептиды (колистин) — оранжевым. Механизмы, обеспечивающие толерантность к нескольким классам антибиотиков, перечислены в области перекрытия эллипсов. Механизмы, специфичные для определенного класса антибиотиков, перечислены в соответствующей области эллипса.
Общие механизмы толерантности к биопленкам
Описанные здесь механизмы устойчивости биопленок к антибиотикам основаны на работе с P.aeruginosa , но также может иметь отношение к биопленкам, образованным другими организмами (Hall and Mah, 2017).
Физическая терпимость — ограниченное проникновение
Когда антибиотики используются в попытке вылечить инфекции биопленки, они должны пересечь внеклеточный матрикс биопленки, чтобы достичь встроенных бактерий. В ряде исследований было высказано предположение, что матрицы биопленок не препятствуют диффузии антибиотиков в целом, но ограниченное проникновение антибиотиков через биопленки может происходить в тех случаях, когда антибиотики связываются с компонентами матрикса биопленки или бактериальных мембран (Рисунок 1; e .г., Walters et al., 2003; Ценг и др., 2013). Используя флуоресцентно меченые антибиотики, Tseng et al. (2013) прямо продемонстрировали, что положительно заряженный тобрамицин секвестрируется на периферии биопленок P. aeruginosa , тогда как нейтральный ципрофлоксацин легко проникает в биопленки. Поскольку матрица биопленки может быть насыщена антибиотиками, которые она связывает, толерантность к противомикробным препаратам, вызванная затрудненным проникновением, может быть только временной. Однако это может дать бактериям достаточно времени, чтобы адаптироваться к более устойчивому состоянию (Bagge et al., 2004b; Памп и др., 2008; Киндрачук и др., 2011). Кроме того, этот механизм может иметь отношение к инфекциям, когда концентрация антибиотиков в очаге инфекции низка, так что антибиотики не могут насыщать матрикс биопленки.
Staudinger et al. (2014) сообщили, что когда P. aeruginosa выращивали в виде агрегатов, независимых от продукции экзополисахаридов в вязкой среде, которая ограничивает подвижность бактерий, тогда бактерии дикого типа и мутантный штамм pelApslBCDalgD с дефицитом экзополисахаридов демонстрировали одинаковый уровень устойчивости к антибиотикам. .На основании этих результатов было высказано предположение, что внеклеточный матрикс не играет роли в устойчивости к противомикробным препаратам, проявляемой агрегатами P. aeruginosa . Однако впоследствии было продемонстрировано, что сверхэкспрессия матрикса биопленки, продемонстрированная различными клиническими изолятами, в значительной степени защищает агрегаты P. aeruginosa от антимикробной обработки (Goltermann and Tolker-Nielsen, 2017). Гиперпродуцирующие альгинаты мутантные бактерии mucA , растущие в агрегатах, показали значительно повышенную устойчивость к антибиотикам по сравнению с бактериями дикого типа в агрегатах.Точно так же агрегаты, образованные мутантами P. aeruginosa wspF и yfiR , которые избыточно продуцируют экзополисахариды Pel и Psl, показали сильно повышенную устойчивость к антибиотикам по сравнению с бактериями дикого типа, растущими в агрегатах. Повышенная толерантность к антибиотикам была напрямую связана с перепроизводством экзополисахаридов, поскольку дополнительные мутации, которые сделали штаммы mucA , wspF, и yfiR дефицитными по синтезу экзополисахаридов, привели к уровням толерантности к антибиотикам дикого типа.Избыточное производство компонентов матрикса биопленки увеличивало устойчивость агрегатов P. aeruginosa к тобрамицину, но также в некоторой степени и к ципрофлоксацину. Поскольку диффузия ципрофлоксацина не должна ограничиваться компонентами матрицы, это может указывать на то, что присутствие компонентов матрицы изменяет физиологию бактерий в агрегатах, например, ограничивая проникновение питательных веществ или кислорода в агрегаты.
Физиологическая толерантность — медленный рост и стойкость
Биопленки содержат субпопуляции бактерий, характеризующиеся широким распространением метаболической активности.Субпопуляции на периферии биопленки проявляют высокую физиологическую активность, в то время как субпопуляции, расположенные во внутренних частях биопленок, демонстрируют низкую физиологическую активность или отсутствие роста (Pamp et al., 2008; Stewart et al., 2016). Эта неоднородность обусловлена потреблением кислорода и питательных веществ метаболически активными бактериями, расположенными на периферии биопленки, оставляя мало кислорода и питательных веществ или не оставляя их для бактерий, расположенных внутри биопленки (Stewart et al., 2016).Прямым следствием низкой скорости метаболизма для толерантности к антибиотикам является неактивность основных мишеней антибиотиков, что в разной степени влияет на эффективность всех бактерицидных антибиотиков. Например, низкий синтез белка изменяет эффективность ингибиторов синтеза белка, таких как аминогликозиды, низкий синтез ДНК влияет на эффект хинолонов, а низкий уровень выработки пептидогликана влияет на эффект бета-лактамов (рис. 1). На рис. 2В показано распределение живых и мертвых бактерий в обработанном ципрофлоксацином препарате P.aeruginosa , микроколония биопленки, выращенная в проточной камере.
Рисунок 2 . Влияние ципрофлоксацина, колистина и комбинации двух антибиотиков на субпопуляции биопленок P. aeruginosa PAO1. На изображениях показаны вертикальные срезы выращенных в проточной камере микроколоний биопленки P. aeruginosa , которые не обрабатывались антибиотиком в качестве контроля (A) , ципрофлоксацином (B) , колистином (C) или ципрофлоксацином и колистин (D) .Живые бактериальные клетки выглядят зелеными из-за экспрессии gfp , тогда как мертвые бактериальные клетки выглядят красными из-за окрашивания йодидом пропидия (Pamp et al., 2009). Рисунок адаптирован из Cytometry Part A 75: 90–103 с разрешения John Wiley and Sons.
Слабый эффект антибиотиков на бактерии с низкой метаболической активностью в дополнение к неактивности мишени также вызван адаптивными стрессовыми реакциями, такими как SOS (Bernier et al., 2013) и строгим ответом (Nguyen et al., 2011). Строгий ответ — это адаптивный ответ на голодание по питательным веществам и железу, которое может происходить в биопленках в некоторых средах, и было показано, что он играет важную роль в толерантности биопленок к антибиотикам (Nguyen et al., 2011). У многих видов бактерий, включая P. aeruginosa , голодание активирует строгий ответ, индуцируя продукты генов relA и spoT для синтеза алармона (p) ppGpp, который регулирует экспрессию многих генов.Nguyen et al. (2011) продемонстрировали повышенную чувствительность к фторхинолонам, меропенему, колистину и гентамицину биопленок, образованных мутантом с двойным нокаутом P. aeruginosa Δ relAspoT , и предоставили доказательства того, что этот фенотип был вызван нарушением антиоксидантной способности и, как следствие, усиление эндогенного оксидативного стресса. Однако в случае колистина это противоречит сообщениям, показывающим, что бактерицидный эффект этого антибиотика не зависит от ROS (OH .) (Brochmann et al., 2014; Kolpen et al., 2016). Более того, было обнаружено, что активация строгого ответа предотвращает накопление прооксидантов HAQ (Nguyen et al., 2011; Schafhauser et al., 2014).
SOS-ответ может быть важным механизмом выживания бактерий в стрессовых условиях. Белки, которые участвуют в SOS-ответе, включают репрессор транскрипции LexA и ДНК-связывающий активирующий белок RecA (в E. coli ). В биопленках SOS-ответ может быть активирован из-за нескольких специфических для биопленок стрессов, таких как окислительный стресс (Boles and Singh, 2008) и недостаток питательных веществ, и было показано, что он индуцируется в зависимости от возраста у E.coli , вызывающие толерантность к фторхинолону офлоксацину (Bernier et al., 2013).
Другой адаптивный ответ голодания на ограничение питательных веществ, как было показано, происходит за счет участия катаболического репрессора, контролирующего белок Crc, который подавляет метаболическую активность клеток в биопленках. Биопленки, образованные мутантом P. aeruginosa crc , были более чувствительны к ципрофлоксацину (который влияет на метаболически активные клетки) и более толерантны к колистину (который эффективен на метаболически неактивных клетках), чем биопленки дикого типа (Zhang et al., 2012). Таким образом, метаболически неактивная субпопуляция в биопленках P. aeruginosa возникает не только из-за ограничения питательных веществ. Похоже, что клетки ощущают ограниченные питательные условия и затем дифференцируются на метаболически неактивные субпопуляции посредством Crc, возможно, как стратегия выживания (Zhang et al., 2012). Поскольку кислород плохо растворим и быстро вдыхается аэробными микроорганизмами, градиенты концентрации кислорода являются общей чертой бактериальных биопленок (Stewart et al., 2016). Таким образом, с помощью микроэлектродного профилирования было показано, что концентрация кислорода в биопленках P. aeruginosa быстро снижается (Walters et al., 2003). Обнаружение усиления глобального, O 2 -чувствительного, анаэробного регулятора Anr в транскриптомных исследованиях популяций биопленок подтвердило, что клетки в биопленках испытывают гипоксию (Stewart et al., 2015). Эти аноксические или гипоксические условия приводят к снижению скорости роста бактерий (Williamson et al., 2012; Sønderholm et al., 2018).Исследования модели in vitro колонии биопленки показали, что 70% (62% ципрофлоксацин, 69% тобрамицин и 110% цефтазидим) толерантности к антибиотикам можно объяснить ограничением кислорода в этих условиях (Borriello et al., 2004) . P. aeruginosa может расти анаэробно за счет использования альтернативных акцепторов электронов, таких как NO 3 — и NO 2 — для дыхания посредством денитрификации или ферментации аргинина. Однако эти альтернативные пути имеют более низкую энергетическую эффективность, чем аэробное дыхание (Arai, 2011).В модели биопленки из альгинатных шариков Sønderholm et al. показали, что самая высокая скорость роста была получена с комбинацией O 2 и NO 3 —, что обеспечивает как аэробное дыхание, так и денитрификацию (Sønderholm et al., 2017). Недостаток кислорода вызывает снижение метаболической активности клеток в более глубоком слое биопленки, изменяя эффективность бета-лактамов, фторхинолонов и аминогликозидов. Исключением являются полимиксины и другие соединения, нацеленные на мембрану, такие как SDS, EDTA и хлоргексидин, которые предпочтительно убивают нерастущие бактерии биопленки (Pamp et al., 2008; Chiang et al., 2012; Brochmann et al., 2014; Колпен и др., 2016).
Другой механизм толерантности, связанный с низким напряжением кислорода в биопленках, связан с потребностью молекул кислорода для образования ROS (гидроксильных радикалов), которые, как было показано, важны для бактерицидного эффекта антибиотиков (Dwyer et al., 2015; Ван Акер и Коенье, 2017). Вызванная антибиотиками продукция АФК была описана во время обработки биопленок P. aeruginosa и Proteus mirabilis хинолонами (Aiassa et al., 2010; Jensen et al., 2014) и Burkholderia cenocepacia с аминогликозидами (Van Acker et al., 2013). Биопленки, образованные мутантами, лишенными антиоксидантных систем, таких как каталазы ( katA для P. aeruginosa и katB для B. cenocepacia ), показали повышенную чувствительность к антибиотикам. Антиоксидантные системы, такие как каталаза и супероксиддисмутаза, активируются за счет активации строгого ответа в биопленках (Хакимова и др., 2013; Martins et al., 2018), таким образом улучшая антиоксидантную способность биопленок и, следовательно, их устойчивость к антибиотикам.
Поскольку метаболизм бактерий играет важную роль в толерантности биопленок к антибиотикам, было предложено несколько стратегий, направленных на выработку энергии, чтобы преодолеть толерантность к антибиотикам (Meylan et al., 2018).
Толерантность к антибиотикам также может быть вызвана образованием так называемых клеток-персистеров. Клетки-персистеры — это медленно делящиеся или неделящиеся бактерии, которые менее уязвимы для антибиотиков, чем основная часть бактериальной популяции, и когда лечение антибиотиками прекращается, эти клетки могут переходить в вегетативное состояние и восстанавливать инфекции (Lewis, 2010).Доля клеток-персистеров в биопленках обычно мала (~ 0,01%), и их следует отличать от пространственно ограниченной субпопуляции толерантных, метаболически неактивных бактерий, которые составляют большую часть биопленки и неактивны из-за недостатка питательных веществ. Считается, что клетки-персистеры являются результатом дифференцировки бактерий в состояние покоя. Пониженный метаболизм, проявляемый клетками-персистерами, очевидно, позволяет им избегать действия антибиотиков, которые нацелены на фундаментальные клеточные процессы (например,g., репликация, трансляция или синтез клеточной стенки) (Рисунок 1). Скрининг мутантов предоставил доказательства того, что ряд генов (например, rpoS , spoT , relA , dksA , dinG , spuC , algR , pilH , y pheA ) участвуют в формировании персистеров у P. aeruginosa , что позволяет предположить, что множественные пути могут приводить к развитию персистерных клеток (Murakami et al., 2005; Видучич и др., 2006; Де Гроот и др., 2009). Работа с E. coli показала, что второй мессенджер ppGpp управляет образованием персистеров через протеазу Lon и активацию модулей токсин-антитоксин (ТА) (Harms et al., 2016). Однако более поздние работы показали, что данные, предполагающие участие модулей ТА в формировании клеток-персистеров, находятся под влиянием непреднамеренного инфицирования мутантных штаммов бактериофагом ϕ80. Эксперименты, проведенные с незараженными бактериями, больше не подтверждают роль модулей ТА в E.coli персистера (Harms et al., 2017).
Поскольку клетки-персистеры могут играть важную роль в стойких инфекциях, были предприняты усилия по оживлению клеток-персистеров с целью восстановления их чувствительности к антибиотикам. Было продемонстрировано, что маннитол увеличивает эффективность аминогликозида тобрамицина в отношении клеток-персистеров биопленки P. aeruginosa (Barraud et al., 2013). Этот эффект блокировался добавлением ингибитора протонной движущей силы или P.aeruginosa , мутантный штамм, неспособный метаболизировать маннит, что позволяет предположить, что маннит восстанавливает персистирующий фенотип за счет активной физиологической реакции бактерий. Таким образом, маннит, который, как известно, улучшает функцию легких при МВ за счет облегчения очищения от слизи, также может повышать чувствительность биопленок легких к антибиотикам (Barraud et al., 2013). Различные стратегии анти-персистеров недавно были рассмотрены группой Яна Михильса (Defraine et al., 2018).
Толерантность к биопленкам, вызванная экспрессией определенных генов
Ряд генов был идентифицирован как специфически вовлеченный в толерантность P.aeruginosa к антибиотикам. Мы используем термин толерантность в этом случае, потому что эти гены специфически экспрессируются в биопленках и, следовательно, опосредуют резистентность к антибиотикам, связанную с биопленками, но не опосредуют устойчивость к антибиотикам в планктонных культурах. В этом разделе мы описываем участие генов brlR и эффлюксной помпы в толерантности к антибиотикам, но больше примеров конкретных генов, участвующих в толерантности к антибиотикам, ассоциированной с биопленкой, приведены ниже в разделе, посвященном толерантности к определенным классам антибиотиков.
Доказательства роли молекулы-мессенджера c-di-GMP в устойчивости биопленок P. aeruginosa к антибиотикам были предоставлены Gupta et al. (2014). Как описано во вводной части, уровень c-di-GMP повышен в клетках биопленки по сравнению с клетками планктона. Было обнаружено, что искусственное повышение уровня c-di-GMP до уровня «биопленки» в планктонных культурах приводит к более высокой толерантности бактериальных клеток к антибиотикам. PA3177 был идентифицирован как активная дигуанилатциклаза (DGC), инактивация которой делает клетки биопленки чувствительными к тобрамицину (Poudyal and Sauer, 2018b).Также было показано, что PA3177 способствует восприимчивости биопленок в зависимости от уровней c-di-GMP и Br1R. Регулятор локуса устойчивости биопленки, BrlR, является Mer-подобным активатором транскрипции биопленочной толерантности к антибиотикам у P. aeruginosa . Было обнаружено, что биопленки, образованные мутантом brlR , более восприимчивы к различным антибиотикам, чем биопленки дикого типа, тогда как планктонно выращенные мутантные бактерии brlR были так же восприимчивы к антибиотикам, как и бактерии дикого типа (Liao and Sauer, 2012).Было предоставлено доказательство того, что BrlR является активатором транскрипции оттокных насосов, кодируемых оперонами mexAB-oprM и mexEF-oprN , и было обнаружено, что подавление транскрипции этих генов является важным фактором фенотипа чувствительности к антибиотикам, наблюдаемого для brlR биопленок (Liao et al., 2013). Более того, было показано, что активность регулятора транскрипции BrlR стимулируется связыванием c-di-GMP (Chambers et al., 2014). BrlR активирует также экспрессию транспортеров ABC, при этом транспортер ABC PA1874-1877 напрямую способствует устойчивости биопленок к антибиотикам (Poudyal and Sauer, 2018a).Zhang и Mah (2008) показали, что PA1874-1877 был в 10 раз выше экспрессирован в биопленках P. aeruginosa по сравнению с планктонными клетками, и что делеция генов, кодирующих этот насос, увеличивает восприимчивость биопленок к тобрамицину, гентамицину и ципрофлоксацину, в то время как планктонный восприимчивость не пострадала. Делеция генов, кодирующих эту помпу (PA1874-1877), привела к увеличению чувствительности биопленок P. aeruginosa к тобрамицину и гентамицину. Помимо воздействия на экспрессию генов, кодирующих белки, участвующие в эффлюксных насосах и переносчиках нескольких лекарственных препаратов ABC, BrlR также влияет на экспрессию генов, кодирующих модификацию LPS и состава мембранных белков, а также на метаболизм и выработку энергии.Это множество различных потенциальных мишеней может объяснить участие BrlR в регуляции толерантности биопленок к различным антибиотикам (Poudyal and Sauer, 2018a). Однако, в отличие от результатов, описанных выше, Stewart et al. (2015) не смогли обнаружить разницу в устойчивости биопленок к антибиотикам к тобрамицину между P. aeruginosa дикого типа и мутантом brlR дикого типа. Возможно, что разница в толерантности к тобрамицину между диким типом и мутантом brlR наблюдается только при высоких концентрациях антибиотика, которые не исследовались Stewart et al.(2015).
Насосы для оттока нескольких лекарств бактерий способны перекачивать антибиотики из бактериальной клетки с помощью энергии, требующей процесса, зависящего от мембранного потенциала и АТФ. Различные формы стрессов могут вызывать оттокные насосы, такие как индукция у P. aeruginosa MexXY-OprM за счет окислительного стресса, MexEF-OprN за счет нитрозативного стресса и MexCD-OprJ за счет агентов, повреждающих мембраны (Poole, 2014). Поскольку эти типы стрессов могут встречаться в биопленках, они могут приводить к индукции откачивающих насосов у P.aeruginosa , способствующих устойчивости к антибиотикам. У других видов, таких как Burkholderia cenocepacia , было показано, что эффлюксные насосы участвуют в устойчивости биопленок к тобрамицину и ципрофлоксацину (Buroni et al., 2014).
Допуск
in vivo биопленокРазличные механизмы толерантности к антибиотикам могут иметь значение для выживания биопленок в различных средах (Hall and Mah, 2017). In vivo, локальная среда биопленки может быть весьма изменчивой в зависимости от места заражения.Например, фармакокинетические / фармакодинамические исследования показали, что для преодоления толерантности биопленок в легких мыши к антибиотикам требуются высокие дозы и / или длительное лечение (Hengzhuang et al., 2012). Эти высокие дозы нельзя вводить системно пациентам в клинических условиях из-за токсичности, но их можно достичь путем местного введения (ингаляционная терапия). In vivo, размеры биопленок меньше, чем у большинства моделей in vitro (Høiby et al., 2015), а местная биопленочная среда может быть весьма изменчивой в зависимости от места заражения. Следовательно, разные механизмы толерантности к антибиотикам могут быть основной причиной выживания бактерий при различных типах инфекций биопленок. Например, у пациентов с муковисцидозом биопленки P. aeruginosa не прикрепляются к поверхности, а присутствуют в виде скоплений клеток в слизи дыхательных путей (Bjarnsholt et al., 2013) и окружены воспалительными полиморфно-ядерными клетками, которые потребляют большая часть доступного кислорода (Kolpen et al., 2010; Jensen et al., 2017). Соответственно, были предоставлены доказательства того, что бактерии в этих биопленках находятся в анаэробных условиях (Worlitzsch et al., 2002; Aanaes et al., 2011). Напротив, биопленки P. aeruginosa , которые прикрепляются к эндотрахеальным трубкам, вызывая нозокомиальную вентиляционную пневмонию у пациентов в отделениях интенсивной терапии, скорее всего, локализованы в аэробной среде, что позволяет предположить, что бактерии на периферии этих биопленок испытывают аэробные свойства. условия (Høiby et al., 2015).
In vivo сложность толерантности биопленок к антибиотикам может быть увеличена из-за гетерогенности образующих биопленки клинических штаммов с различными паттернами экспрессии генов из-за клональной эволюции и адаптации во время хронических инфекций, таких как хроническая инфекция легких с P. aeruginosa у пациентов с МВ (Росси и др., 2018).
Многовидовые биопленки часто встречаются в природе, но их значение при хронических инфекциях неясно, поскольку визуализация биопленок in vivo во многих случаях показывала моновидовые бактериальные агрегаты, за исключением биопленок полости рта и кишечника (Burmolle et al., 2010). Сообщалось, что in vitro, установили многовидовые биопленки, включая P. aeruginosa, продемонстрировали повышенную толерантность к антибиотикам по сравнению с моновидовыми биопленками (Ryan et al., 2008; Tavernier et al., 2017).
Толерантность биопленок к разным классам антибиотиков
В этом разделе мы описываем связанные с биопленкой механизмы толерантности к противомикробным препаратам, которые играют роль в толерантности к определенным классам антибиотиков. Это подчеркивает многогранный характер толерантности к антибиотикам, связанной с биопленками.
Связанная с биопленкой толерантность к бета-лактамным антибиотикам
Тест in vitro на минимальную ингибирующую биопленку концентрацию бета-лактамов показал, что концентрации бета-лактамов в 1000 раз выше, чем у планктонных МИК (Moskowitz et al., 2004; Macia et al., 2014). В целом бета-лактамы обладают слабым антибиопленочным действием. Это связано с тем, что бета-лактамный механизм действия направлен на синтез пептидогликана и эффективен только на активно растущих, делящихся клетках.Таким образом, основной механизм толерантности биопленок к бета-лактамам связан с медленным ростом бактерий в биопленках (рис. 1).
Индукция транскрипции бета-лактамазы или избыточной бета-лактамазы, высвобождаемой из убитых бактерий во внешнем чувствительном слое биопленки в ответ на присутствие бета-лактамного антибиотика, ухудшает проникновение молекул бета-лактама через слои биопленки (Dibdin et al. др., 1996; Багге и др., 2004а). Используя трансляционное слияние ampC с нестабильным зеленым флуоресцентным белком-репортером, Bagge et al.(2004a) продемонстрировали, что в отсутствие бета-лактамного антибиотика уровень бета-лактамазы, кодируемой ampC , в биопленках P. aeruginosa незначителен. Однако экспрессия фермента была обнаружена на периферии биопленки при индукции низкими концентрациями имипенема (сильный индуктор ampC ), в то время как высокие концентрации имипенема приводили к индукции ampC по всей биопленке. Инактивация молекул бета-лактама ферментами в матрице биопленки имеет фармакокинетические / фармакодинамические последствия, так как зависит от времени действие цефтазидима, цефалоспорина, который гидролизуется бета-лактамазой AmpC P.aeruginosa , был изменен на дозозависимый эффект (Hengzhuang et al., 2013), предполагая, что бета-лактамы должны использоваться в высоких дозах, чтобы подавить способность ферментов к разложению (Bowler et al., 2012) . Альтернативно, лечение инфекций биопленок комбинацией бета-лактамов и ингибиторов бета-лактамаз (таких как цефтолозан / тазобактам или цефтазидим / авибактам (Torrens et al., 2016) или стабильных бета-лактамаз соединений, таких как карбапенем меропенем, может преодолеть это механизм толерантности.Соответственно, меропенем показал хорошую активность in vitro на биопленках P. aeruginosa (Moskowitz et al., 2004).
Связанная с биопленкой толерантность к фторхинолоновым антибиотикам
In vitro фторхинолоны гораздо более активны против бактерий биопленки, чем бета-лактамы, и минимальные концентрации ингибирования биопленки (MBIC) P. aeruginosa больше похожи на МИК планктона (Moskowitz et al., 2004; Macia et al. al., 2014), чем у других антибиотиков. Поскольку фторхинолоны обладают хорошим антибиотикопленочным действием, а также хорошим проникновением в ткани и доступны для перорального применения, они часто используются в комбинированной терапии для лечения инфекций биопленки, таких как инфекции, связанные с имплантатами костей и суставов, и хронические инфекции легких (Høiby et al. др., 2015; Ciofu et al., 2017).
Хинолоны представляют собой незаряженные молекулы и легко диффундируют через матрицу биопленки. In vitro исследование хинолонов на субоптимально растущих или нерастущих P.aeruginosa проявляла значительную бактерицидную активность (Eng et al., 1991). Однако низкая концентрация кислорода в биопленках влияет на бактерицидный эффект хинолонов, вероятно, из-за образования АФК в недостаточных количествах, чтобы вызвать бактерицидный эффект (рис. 1). Низкий уровень кислорода, по-видимому, является основным механизмом толерантности биопленок к хинолонам вместе с адаптивными ответами, такими как SOS и строгим ответом (Stewart et al., 2015). Было показано, что воздействие на низкое давление кислорода путем воздействия на биопленки гипербарической кислородной терапии (ГБО) улучшает антибиотический эффект хинолонов (Kolpen et al., 2017; Gade et al., 2018).
Связанная с биопленкой толерантность к аминогликозидным антибиотикам
Множество механизмов, по-видимому, играет роль в устойчивости биопленок P. aeruginosa к аминогликозидным антибиотикам (рис. 1). Эти механизмы включают связывание аминогликозидов различными компонентами матрикса биопленки, а также экспрессию специфических генов, которые придают биопленку-ассоциированную толерантность к аминогликозидам.
Альгинат может действовать как щит против аминогликозидных антибиотиков в биопленках, образованных чрезмерным продуцированием альгината P.aeruginosa штаммов. Таким образом, были предоставлены доказательства того, что биопленки, образованные штаммом P. aeruginosa с избыточным продуцированием альгината, были значительно более устойчивы к тобрамицину, чем биопленки, образованные изогенным немукоидным штаммом (Hentzer et al., 2001). Кроме того, было показано, что экзополисахарид Psl обеспечивает некоторую степень связанной с биопленкой толерантности к аминогликозидам. В одном исследовании защитный эффект Psl против тобрамицина был выражен у молодых P.aeruginosa (Billings et al., 2013), но другие исследования предоставили доказательства роли Psl в толерантности к тобрамицину зрелых биопленок P. aeruginosa (Yang et al., 2011). Экзополисахарид Pel может также обеспечивать защиту от аминогликозидов в биопленках P. aeruginosa . Таким образом, биопленки, образованные мутантами, лишенными Pel, оказались более чувствительными к тобрамицину и гентамицину, чем соответствующие биопленки дикого типа (Colvin et al., 2011).Более того, эДНК также может играть роль в препятствовании проникновению аминогликозидов в биопленки P. aeruginosa . ДНК может связывать положительно заряженные антибиотики, такие как аминогликозиды (Ramphal et al., 1988; Hunt et al., 1995), и, соответственно, Chiang et al. (2013) представили доказательства того, что биопленки, образованные мутантом P. aeruginosa , дефицитным по высвобождению ДНК, были чувствительны к тобрамицину, но становились толерантными к тобрамицину, если они были снабжены ДНК, включенной в биопленку.
Толерантность биопленок P. aeruginosa к аминогликозидам также была связана с внеклеточной ДНК-опосредованной активацией генов pmr и arn посредством связывания магния, а также местного подкисления (Mulcahy et al., 2008). Продукты гена arn придают толерантность к аминогликозидам за счет добавления аминоарабинозы к липидной части А ЛПС (Lewenza, 2013). Кроме того, регулируемый PmrA локус PA4773-4775 кодирует ферменты, которые катализируют синтез спермидина, который представляет собой полиамин, который локализуется на внешней мембране и снижает проницаемость внешней мембраны для аминогликозидов (Johnson et al., 2012).
Ген ndvB был идентифицирован как участвующий в толерантности биопленок P. aeruginosa PA14 к тобрамицину и гентамицину посредством скрининга мутантных транспозонов (Mah et al., 2003). Мутант ndvB был менее устойчив к тобрамицину и гентамицину, чем дикий тип при выращивании в биопленках, но при планктонном выращивании мутант ndvB и дикий тип были одинаково чувствительны к аминогликозидам. Механизм оказался специфичным для биопленки из-за специфической экспрессии гена ndvB в клетках биопленки по сравнению с планктонными клетками (Mah et al., 2003; Beaudoin et al., 2012). Было показано, что толерантность, опосредованная ndvB , обусловлена секвестрацией лекарства циклическими периплазматическими глюканами, а также ролью в активации генов окисления этанола (Mah et al., 2003; Beaudoin et al., 2012).
Ряд ранее описанных механизмов, которые включают экспрессию в биопленках определенных опосредующих толерантность к антибиотикам генов, таких как brlR и PA1874-1877, придают толерантность к аминогликозидам (Mah et al., 2003; Zhang and Mah, 2008; Liao and Sauer, 2012; Poudyal and Sauer, 2018a).Кроме того, как описано ранее, было высказано предположение, что строгий ответ у P. aeruginosa играет роль в устойчивости биопленок к различным антибиотикам, включая аминогликозиды, за счет снижения окислительного стресса (Nguyen et al., 2011).
Недостаток кислорода и низкая скорость метаболизма бактериальных клеток в более глубоких слоях биопленок также играет роль в толерантности биопленок к аминогликозидам, поскольку аминогликозиды требуют активного кислородзависимого поглощения через цитоплазматическую мембрану для того, чтобы чтобы достичь своей рибосомальной мишени, а недостаток кислорода ухудшает мембранный потенциал и транспорт этих молекул в цитоплазму (рис. 1; Verklin and Mandell, 1977; Taber et al., 1987; Стюарт и др., 2015). Соответственно, снижение давления кислорода путем воздействия на биопленки гипербарической кислородной терапии (HBOT) улучшает антибиотический эффект аминогликозидов как in vitro, (Møller et al., 2019), так и in vivo, (Lerche et al. , 2017). Кроме того, также было высказано предположение, что набор метаболитов, таких как фумарат, которые способствуют активности цикла TCA, может усиливать летальность тобрамицина для бактерий P. aeruginosa с низкой метаболической активностью (персистеры) (Koeva et al., 2017).
Связанная с биопленкой толерантность к антимикробным пептидам
Большинство антимикробных пептидов заряжены положительно, как и аминогликозиды. Следовательно, некоторые механизмы, которые участвуют в толерантности биопленок P. aeruginosa к аминогликозидам, также могут играть роль в толерантности биопленок к антимикробным пептидам. Например, можно ожидать, что связывание антимикробных пептидов отрицательно заряженными компонентами матрикса биопленки, такими как эДНК, может играть роль в толерантности к P.aeruginosa в отношении антимикробных пептидов. Кроме того, было показано, что экзополисахарид Psl обеспечивает защиту биопленок P. aeruginosa от колистина и полимиксина B (Billings et al., 2013). Более того, были представлены доказательства того, что строгий ответ играет роль в устойчивости биопленок P. aeruginosa к колистину (Nguyen et al., 2011; Khakimova et al., 2013).
Как описано ранее, повышенная регуляция генов pmr и arn в P.aeruginosa могут образовываться в результате хелатирования катионов и подкисления, опосредованных eDNA (Mulcahy et al., 2008; Wilton et al., 2016). Более того, были представлены доказательства того, что воздействие колистина на биопленки P. aeruginosa приводит к активации генов pmr и arn в метаболически активной периферической субпопуляции (Pamp et al., 2008). Продукты гена arn опосредуют снижение чистого отрицательного заряда ЛПС, что снижает взаимодействие и поглощение полимиксинов (Lewenza, 2013).Повышающая регуляция оперона pmr / arn играет роль в толерантности биопленок P. aeruginosa к колистину вместе с активацией откачивающего насоса MexAB-OprM (Pamp et al., 2008). Кроме того, Chiang et al. показали, что также оттокные насосы, кодируемые генами mexCD-oprJ и muxABC-opmB , экспрессируются в ответ на воздействие колистина (Рисунок 1; Chiang et al., 2012). Колистин не мог уничтожить метаболически активную периферическую субпопуляцию, но был эффективен в устранении метаболически неактивной субпопуляции в более глубоких слоях биопленки (рис. 2C; Pamp et al., 2008). Это согласуется с данными, показывающими повышенную бактерицидную активность колистина на биопленках P. aeruginosa , выращенных в анаэробных условиях (Kolpen et al., 2016).
Было показано, что комбинация колистина, нацеленного на метаболически неактивную популяцию, с антибиотиками, нацеленными на метаболически активную популяцию, такими как ципрофлоксацин и тобрамицин, способна уничтожить P. aeruginosa биопленок in vitro (Рисунок 2; Pamp et al., 2008) и in vivo (Herrmann et al., 2010). У пациентов с муковисцидозом эрадикационная терапия с использованием ингаляций колистина или тобрамицина и перорального ципрофлоксацина используется для лечения легочных инфекций P. aeruginosa после первого выявления бактерий в секретах дыхательных путей (Høiby et al., 2015).
Было показано, что концентрации различных классов антибиотиков ниже МИК могут стимулировать образование биопленок как у грамположительных, так и у грамотрицательных бактерий.Соответствующие механизмы были недавно рассмотрены (Ranieri et al., 2018) и включают высвобождение eDNA, индукцию фаговых элементов и различные регуляторные реакции. Например, в случае P. aeruginosa имипенем может индуцировать продукцию альгината (Bagge et al., 2004b), ципрофлоксацин может вызывать SOS-ответ, а тобрамицин может индуцировать образование биопленки через c-di-GMP с повышенной толерантностью биопленки ( Hoffman et al., 2005).
Развитие устойчивости к антибиотикам в биопленках
Все описанные механизмы толерантности способствуют устойчивости биопленок, которые обеспечивают благодатную почву для появления устойчивых к антибиотикам мутантов.Сообщается, что в планктонных культурах толерантность предшествует возникновению устойчивости (Levin-Reisman et al., 2017).
Устойчивость к антибиотикам подразумевает мутации в генетических детерминантах устойчивости, ведущие к увеличению минимальных ингибирующих концентраций антибиотика для бактериальных клеток, разрушенных из биопленки, и это считается побочным эффектом длительной поддерживающей терапии антибиотиками.
В отличие от планктонных, быстро делящихся клеток, которые традиционно используются для изучения развития устойчивости к антибиотикам в встряхиваемых культурах, бактерии, выращенные на биопленке, сталкиваются с градиентами питательных веществ и кислорода, которые приводят к гетерогенной бактериальной популяции, включая медленнорастущие или неделящиеся клетки. (Стюарт, 2015; Стюарт и др., 2016). Знание о мутагенезе в неделящихся или лишенных питательных веществ клетках (стационарная фаза или адаптивный мутагенез (Foster, 2007; Sekowska et al., 2016)) предполагает, что частота мутаций будет выше и представлена разными типами мутаций в биопленках по сравнению с планктонным культурам (Bjedov et al., 2003; Bharatan et al., 2004; Kivisaar, 2010; Maharjan, Ferenci, 2017). Механизмы, ответственные за усиление мутагенеза биопленок, включают окислительный стресс (Boles and Singh, 2008), SOS-ответы на повреждение ДНК и RpoS-зависимые ответы (Bjedov et al., 2003; Кивисаар, 2010). По сравнению с планктонными однородными популяциями, пространственно-структурированная и неоднородная среда биопленок может рассматриваться как совокупность различных ниш с разным селективным давлением (Rainey et al., 2000; Kassen and Rainey, 2004; Melnyk et al., 2015). которые предоставляют возможность большему количеству устойчивых мутантов сохраняться без конкуренции в биопленке (Perron et al., 2007).
Общей чертой, наблюдаемой в экспериментах по эволюции биопленок, является более высокая степень диверсификации бактериальной популяции, чем в исследованиях эволюции с использованием планктонных культур (Steenackers et al., 2016). Другой характеристикой эволюции биопленок, особенно наблюдаемой при хронических инфекциях, является частое выделение бактерий с высокой частотой мутаций, например гипермутации из-за мутаций в их механизмах репарации ДНК (Oliver et al., 2000; Labat et al., 2005; Macia et al., 2005; Daurel et al., 2007). Это происходит несмотря на общепринятый факт, что фенотипы мутаторов являются самоограничивающимися из-за высокого риска вредных мутаций (Denamur and Matic, 2006). Это говорит о том, что мутаторы сохраняются в некоторых нишах биопленок и, вероятно, компенсируют медленный рост бактерий, обеспечивая пул спонтанных мутантов, которые позволяют адаптировать биопленку и возникать устойчивость в биопленках.Ранее было показано, что когда адаптация ограничена количеством мутаций, отбор благоприятствует штаммам с повышенной частотой мутаций из-за мутационной инактивации системы репарации ошибочного спаривания (Bjedov et al., 2003). Повышенная адаптивность мутаторов по сравнению с диким типом наблюдалась при выращивании в конкурентных экспериментах на биопленках проточных клеток (Lujan et al., 2011; Macia et al., 2011).
Недавно в ходе экспериментальных исследований эволюции in vitro было показано, что устойчивость к антибиотикам развивается разными путями в планктонных культурах и биопленках, подвергшихся воздействию субингибиторных уровней ципрофлоксацина (Ahmed et al., 2018). В то время как размер устойчивой к ципрофлоксацину субпопуляции был выше в биопленках, уровни устойчивости (МПК) были ниже по сравнению с планктонно развитыми культурами, что коррелирует с мутациями в оттокных насосах в биопленках и мутациями в генах-мишенях в планктонных культурах. Также было продемонстрировано быстрое появление мутантов nfxB , сверхэкспрессирующих эффлюксную помпу MexCD-OprJ, в биопленках, подвергшихся воздействию низких доз ципрофлоксацина, с мутантами, составляющими 80–90% популяции биопленок после 4 дней лечения (Рисунок 3; Zaborskyte et al. ., 2016). Это говорит о том, что рост биопленки способствует возникновению и поддержанию мутантов с низким уровнем устойчивости, что представляет собой мутации первого этапа с потенциальным накоплением мутаций, приводящих к увеличению MIC на более поздних этапах.
Рисунок 3 . Развитие мутантов nfxB в 72-часовой биопленке проточных клеток PAO1 во время лечения низкими дозами ципрофлоксацина. Биопленки PAO1 mCherry -P CD — gfp ( mCherry интегрированы в сайт attB ; mini-Tn7 :: P CD — gfp вставлены выше гена glmS). выращивали в трех независимых каналах камер проточной кюветы в течение 72 ч, а затем обрабатывали 0.2 мкг / мл CIP в общей сложности 96 часов. Визуализация с помощью CLSM проводилась каждые 24 часа. Красный цвет представляет клетки дикого типа из-за конститутивной экспрессии mCherry , тогда как зеленый цвет показывает мутанты nfxB из-за экспрессии репортера P CD — gfp , регуляция которого специфически повышается у этих мутантов. Изображения показывают ортогональные трехмерные виды биопленки (левая панель) или перспективный вид (правая панель) с наложением флуоресценции красного и зеленого каналов (Zaborskyte et al., 2016).Рисунок воспроизведен из «Противомикробные агенты и химиотерапия», 61, выпуск 3, e02292–16 с разрешения Американского общества микробиологов.
Выводы и перспективы
Патоген ESKAPE Pseudomonas aeruginosa, является важной причиной стойких инфекций из-за его способности образовывать биопленки, которые проявляют толерантность и устойчивость к антимикробным агентам. Множественные и разнообразные механизмы, используемые P. aeruginosa для выживания при лечении антибиотиками при росте в биопленке, представляют собой важную терапевтическую проблему.Молекулярные механизмы, лежащие в основе толерантности биопленок к антибиотикам, являются мишенями для терапевтических вмешательств, направленных на усиление антибиотического действия антибиотиков. Чтобы определить наилучшие цели вмешательства, необходимо уточнить относительный вклад механизмов, участвующих в толерантности биопленок к определенным классам антибиотиков. Кроме того, могут запускаться различные механизмы толерантности in vivo в месте инфицирования биопленкой в зависимости от конкретных условий окружающей среды, таких как доступ к питательным веществам и кислороду, которые зависят от нескольких факторов, таких как васкуляризация тканей, а также степени и типа воспаления. (Дженсен и др., 2017). Тщательное понимание относительной важности механизмов толерантности к антибиотикам для сохранения различных типов биопленочных инфекций требует дальнейших исследований. Знание сложности биопленочной толерантности к антибиотикам и специфической для биопленок динамики эволюции устойчивости к антибиотикам в конечном итоге обеспечит основу для разработки терапевтических решений для пациентов, страдающих хроническими инфекциями биопленок.
Авторские взносы
OC и TT-N в равной степени внесли свой вклад в концепцию и написание обзора.
Финансирование
Работа поддержана грантами Датского совета независимых исследований и Фонда Лундбека.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Аанаес, К., Рикельт, Л. Ф., Йохансен, Х. К., фон, Б. К., Пресслер, Т., Хойби, Н., и другие. (2011). Снижение давления кислорода слизистой оболочки верхнечелюстных пазух у пациентов с муковисцидозом. J. Cyst. Фиброс. 10, 114–120. DOI: 10.1016 / j.jcf.2010.12.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ахмед М. Н., Порсе А., Соммер М. О. А., Хёби Н. и Чофу О. (2018). Эволюция устойчивости к антибиотикам в биопленках и планктонных популяциях Pseudomonas aeruginosa , подвергшихся воздействию субингибиторных уровней ципрофлоксацина. Антимикробный. Агенты Chemother. 62, e00320 – e00318. DOI: 10.1128 / AAC.00320-18
CrossRef Полный текст | Google Scholar
Айасса В., Барнс А. И. и Албеса И. (2010). Устойчивость к ципрофлоксацину за счет усиления антиоксидантной защиты биопленок и планктона Proteus mirabilis . Biochem. Биофиз. Res. Commun. 393, 84–88. DOI: 10.1016 / j.bbrc.2010.01.083
CrossRef Полный текст | Google Scholar
Аллесен-Хольм, М., Баркен, К. Б., Янг, Л., Клаузен, М., Уэбб, Дж. С., Кьеллеберг, С., и др. (2006). Характеристика высвобождения ДНК в культурах и биопленках Pseudomonas aeruginosa, . Мол. Microbiol. 59, 1114–1128. DOI: 10.1111 / j.1365-2958.2005.05008.x
CrossRef Полный текст | Google Scholar
Ан, С., Ву, Дж., И Чжан, Л. Х. (2010). Модуляция диспергирования биопленки Pseudomonas aeruginosa с помощью фосфодиэстеразы циклического Di-GMP с предполагаемым доменом, чувствительным к гипоксии. Заявл. Environ. Microbiol. 76, 8160–8173. DOI: 10.1128 / AEM.01233-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Багге, Н., Хентцер, М., Андерсен, Дж. Б., Чофу, О., Гивсков, М., и Хёби, Н. (2004a). Динамика и пространственное распределение экспрессии бета-лактамаз в биопленках Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 48, 1168–1174. DOI: 10.1128 / AAC.48.4.1168-1174
CrossRef Полный текст | Google Scholar
Багге, Н., Шустер, М., Хентцер, М., Чофу, О., Гивсков, М., Гринберг, Э. П. и др. (2004b). Биопленки Pseudomonas aeruginosa , подвергшиеся воздействию имипенема, демонстрируют изменения в глобальной экспрессии генов и продукции бета-лактамазы и альгината. Антимикробный. Агенты Chemother. 48, 1175–1187. DOI: 10.1128 / AAC.48.4.1175-1187.2004
CrossRef Полный текст | Google Scholar
Барро, Н., Бусон, А., Яролимек, В., и Райс, С. А. (2013). Маннитол повышает чувствительность к антибиотикам бактерий-персистеров в биопленках Pseudomonas aeruginosa . PLoS One 8: e84220. DOI: 10.1371 / journal.pone.0084220
CrossRef Полный текст | Google Scholar
Barraud, N., Schleheck, D., Klebensberger, J., Webb, J. S., Hassett, D.J., Rice, S.A., et al. (2009). Передача сигналов оксида азота в биопленках Pseudomonas aeruginosa опосредует активность фосфодиэстеразы, снижение уровней циклического ди-GMP и усиление диспергирования. J. Bacteriol. 191, 7333–7342. DOI: 10.1128 / JB.00975-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бодуан, Т., Zhang, L., Hinz, A.J., Parr, C.J., и Mah, T.F. (2012). Специфический для биопленок ген устойчивости к антибиотикам ndvB важен для экспрессии генов окисления этанола в биопленках Pseudomonas aeruginosa . J. Bacteriol. 194, 3128–3136. DOI: 10.1128 / JB.06178-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бернье, С. П., Лебо, Д., Де Франческо, А. С., Валомон, А., Субигу, Г., Коппи, Дж. Й. и др. (2013). Голодание вместе с SOS-ответом опосредует высокую биопленочную толерантность к фторхинолону офлоксацину. PLoS Genet. 9: e1003144. DOI: 10.1371 / journal.pgen.1003144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхаратан, С. М., Редди, М., и Гоуришанкар, Дж. (2004). Отчетливые признаки чувствительности к мутаторам реверсий lacZ и спектра прямых мутаций lacI / lacO на хромосоме неделящейся Escherichia coli . Генетика 166, 681–692. DOI: 10.1534 / genetics.166.2.681
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Биллингс, Н., Миллан, М., Калдара, М., Рускони, Р., Тарасова, Ю., Стокер, Р. и др. (2013). Компонент Psl внеклеточного матрикса обеспечивает быстродействующую антибиотическую защиту в биопленках Pseudomonas aeruginosa . PLoS Pathog. 9: e1003526. DOI: 10.1371 / journal.ppat.1003526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bjarnsholt, T., Alhede, M., Alhede, M., Eickhardt-Sorensen, S.R., Moser, C., Kuhl, M., et al. (2013). Биопленка in vivo. Trends Microbiol. 21, 466–474. DOI: 10.1016 / j.tim.2013.06.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bjedov, I., Tenaillon, O., Gerard, B., Souza, V., Denamur, E., Radman, M., et al. (2003). Стресс-индуцированный мутагенез у бактерий. Наука 300, 1404–1409. DOI: 10.1126 / science.1082240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болес Б. Р. и Сингх П. К. (2008). Эндогенный оксидативный стресс способствует разнообразию и приспособляемости сообществ биопленок. Proc. Natl. Акад. Sci. USA 105, 12503–12508. DOI: 10.1073 / pnas.0801499105
CrossRef Полный текст | Google Scholar
Борли Б. Р., Гольдман А. Д., Мураками К., Самудрала Р., Возняк Д. Дж. И Парсек М. Р. (2010). Pseudomonas aeruginosa использует адгезин, регулируемый циклическим ди-GMP, для усиления внеклеточного матрикса биопленки. Мол. Microbiol. 75, 827–842. DOI: 10.1111 / j.1365-2958.2009.06991.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Борриелло, Г., Вернер, Э., Роу, Ф., Ким, А. М., Эрлих, Г. Д., и Стюарт, П. С. (2004). Ограничение кислорода способствует толерантности к антибиотикам Pseudomonas aeruginosa в биопленках. Антимикробный. Агенты Chemother. 48, 2659–2664. DOI: 10.1128 / AAC.48.7.2659-2664.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боулер Л. Л., Жанель Г. Г., Болл Т. Б. и Савард Л. Л. (2012). Зрелые биопленки Pseudomonas aeruginosa преобладают по сравнению с молодыми биопленками в присутствии цефтазидима. Антимикробный. Агенты Chemother. 56, 4976–4979. DOI: 10.1128 / AAC.00650-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браунер А., Фридман О., Гефен О., Балабан Н. К. (2016). Различение устойчивости, толерантности и стойкости к лечению антибиотиками. Нац. Rev. Microbiol. 14, 320–330. DOI: 10.1038 / nrmicro.2016.34
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браунер А., Шореш Н., Фридман, О., Балабан, Н.К. (2017). Экспериментальная основа для количественной оценки бактериальной толерантности. Biophys. J. 112, 2664–2671. DOI: 10.1016 / j.bpj.2017.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брохманн, Р. П., Тофт, А., Чофу, О., Бриалес, А., Колпен, М., Хемпель, К. и др. (2014). Бактерицидное действие колистина на планктонную болезнь Pseudomonas aeruginosa не зависит от образования гидроксильных радикалов. Внутр. J. Antimicrob.Агенты 43, 140–147. DOI: 10.1016 / j.ijantimicag.2013.10.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Burmolle, M., Thomsen, T. R., Fazli, M., Dige, I., Christensen, L., Homoe, P., et al. (2010). Биопленки при хронических инфекциях — возможность — моновидовые биопленки при многовидовых инфекциях. FEMS Immunol. Med. Microbiol. 59, 324–336. DOI: 10.1111 / j.1574-695X.2010.00714.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бурони, С., Matthijs, N., Spadaro, F., Van, A.H., Scoffone, V.C., Pasca, M.R., et al. (2014). Дифференциальная роль насосов оттока RND в устойчивости к противомикробным препаратам сидячих и планктонных клеток Burkholderia cenocepacia . Антимикробный. Агенты Chemother. 50, 7424–7429. DOI: 10.1128 / AAC.03800-14
CrossRef Полный текст | Google Scholar
Чемберс, Дж. Р., Ляо, Дж., Шурр, М. Дж. И Зауэр, К. (2014). Br1R из Pseudomonas aeruginosa представляет собой c-di-GMP-чувствительный фактор транскрипции. Мол. Microbiol. 92, 471–487. DOI: 10.1111 / mmi.12562
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chiang, W. C., Nilsson, M., Jensen, P.O., Hoiby, N., Nielsen, T. E., Givskov, M., et al. (2013). Внеклеточная ДНК защищает от аминогликозидов в биопленках Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 57, 2352–2361. DOI: 10.1128 / AAC.00001-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чианг, W.К., Памп, С. Дж., Нильссон, М., Гивсков, М., и Толкер-Нильсен, Т. (2012). Метаболически активная субпопуляция в биопленках Pseudomonas aeruginosa выживает при воздействии нацеленных на мембрану антимикробных препаратов с помощью различных молекулярных механизмов. FEMS Immunol. Med. Microbiol. 65, 245–256. DOI: 10.1111 / j.1574-695X.2012.00929.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Киофу, О., Толкер-Нильсен, Т., Йенсен, П. О., Ван, Х. и Хёби, Н.(2015). Устойчивость к противомикробным препаратам, инфекции дыхательных путей и роль биопленок в легочных инфекциях у пациентов с муковисцидозом. Adv. Препарат Делив. Ред. 85, 7–23. DOI: 10.1016 / j.addr.2014.11.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колвин, К. М., Гордон, В. Д., Мураками, К., Борли, Б. Р., Возняк, Д. Дж., Вонг, Г. К. и др. (2011). Полисахарид pel может выполнять структурную и защитную роль в матрице биопленки Pseudomonas aeruginosa . PLoS Pathog. 7: e1001264. DOI: 10.1371 / journal.ppat.1001264
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Костертон, Дж. У., Стюарт, П. С., и Гринберг, Э. П. (1999). Бактериальные биопленки: частая причина хронических инфекций. Наука 284, 1318–1322. DOI: 10.1126 / science.284.5418.1318
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даурел К., Прунье А. Л., Чау Ф., Гарри Л., Леклерк Р. и Фантен Б.(2007). Роль гипермутабельности на приспособленность бактерий и появление резистентности при экспериментальном остеомиелите, вызванном Staphylococcus aureus . FEMS Immunol. Med. Microbiol. 51, 344–349. DOI: 10.1111 / j.1574-695X.2007.00310.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис Д. Г., Парсек М. Р., Пирсон Дж. П., Иглевски Б. Х., Костертон Дж. У. и Гринберг Э. П. (1998). Участие межклеточных сигналов в развитии бактериальной биопленки. Наука 280, 295–298. DOI: 10.1126 / science.280.5361.295
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Гроот, В., Верстратен, Н., Фоварт, М., Кинт, К. И., Вербек, А. М., Бёленс, С., и др. (2009). Новые гены персистентности в Pseudomonas aeruginosa идентифицированы с помощью высокопроизводительного скрининга. FEMS Microbiol. Lett. 297, 73–79. DOI: 10.1111 / j.1574-6968.2009.01657
CrossRef Полный текст | Google Scholar
Дефрейн, В., Фоварт, М., и Михилс, Дж. (2018). Борьба с бактериальной персистентностью: текущие и новые стратегии и методы лечения. Устойчивость к наркотикам. Updat. 38, 12–26. DOI: 10.1016 / j.drup.2018.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дибдин, Г. Х., Ассиндер, С. Дж., Николс, В. В., и Ламберт, П. А. (1996). Математическая модель проникновения бета-лактама в биопленку Pseudomonas aeruginosa при одновременной инактивации высвободившимися бета-лактамазами. J. Antimicrob. Chemother. 38, 757–769. DOI: 10.1093 / jac / 38.5.757
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диггл, С. П., Стейси, Р. Э., Додд, К., Камара, М., Уильямс, П., и Винзер, К. (2006). Галактофильный лектин, LecA, способствует развитию биопленок у Pseudomonas aeruginosa . Environ. Microbiol. 8, 1095–1104. DOI: 10.1111 / j.1462-2920.2006.001001.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дуэхольм, М.С., Сондергаард, М. Т., Нильссон, М., Кристиансен, Г., Стенсбаль, А., Овергаард, М. Т. и др. (2013). Экспрессия амилоидов Fap в Pseudomonas aeruginosa , P. fluorescens, и P. putida приводит к агрегации и повышенному образованию биопленок. MicrobiologyOpen 2, 365–382. DOI: 10.1002 / mbo3.81
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дуайер, Д. Дж., Коллинз, Дж. Дж., И Уокер, Г. К. (2015). Раскрытие физиологических сложностей летальности антибиотиков. Annu. Rev. Pharmacol. Toxicol. 55, 313–332. DOI: 10.1146 / annurev-pharmtox-010814-124712
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Энг, Р. Х., Падберг, Ф. Т., Смит, С. М., Тан, Э. Н. и Черубин, К. Э. (1991). Бактерицидное действие антибиотиков на медленно растущие и нерастущие бактерии. Антимикробный. Агенты Chemother. 35, 1824–1828. DOI: 10.1128 / AAC.35.9.1824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фазли, М., Альмблад, Х., Рыбтке, М. Л., Гивсков, М., Эберл, Л., и Толкер-Нильсен, Т. (2014). Регуляция образования биопленок у видов Pseudomonas и Burkholderia . Environ. Microbiol. 16, 1961–1981. DOI: 10.1111 / 1462-2920.12448
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фернандес-Барат, Л., Чофу, О., Краг, К. Н., Пресслер, Т., Йохансен, У., Мотос, А., и др. (2017). Фенотипический сдвиг в популяциях Pseudomonas aeruginosa из легких с муковисцидозом после 2-недельной антипсевдомонадной терапии. J. Cyst. Фиброс. 16, 222–229. DOI: 10.1016 / j.jcf.2016.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фостер, П. Л. (2007). Стресс-индуцированный мутагенез у бактерий. Крит. Rev. Biochem. Мол. Биол. 42, 373–397. DOI: 10.1080 / 1040
01648494
CrossRef Полный текст | Google Scholar
Фридман Л. и Колтер Р. (2004). Гены, участвующие в формировании матрикса в биопленках Pseudomonas aeruginosa PA14. Мол. Microbiol. 51, 675–690. DOI: 10.1046 / j.1365-2958.2003.03877.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаде, П. А. В., Олсен, Т. Б., Йенсен, П. О., Кольпен, М., Хойби, Н., Хеннеберг, К. А., и др. (2018). Моделирование убийства ципрофлоксацина, усиленного обработкой гипербарическим кислородом, в биопленках Pseudomonas aeruginosa PAO1. PLoS One 13: e0198909. DOI: 10.1371 / journal.pone.0198909
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гилтнер, К.Л., ван Шайк, Э. Дж., Одетт, Г. Ф., Као, Д., Ходжес, Р. С., Хассет, Д. Дж. И др. (2006). Связывающий домен пилинового рецептора Pseudomonas aeruginosa типа IV действует как адгезин как для биотических, так и для абиотических поверхностей. Мол. Microbiol. 59, 1083–1096. DOI: 10.1111 / j.1365-2958.2005.05002.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гольтерманн, Л., Толкер-Нильсен, Т. (2017). Важность экзополисахаридной матрицы в противомикробной толерантности агрегатов Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 61, e02696 – e02616. DOI: 10.1128 / AAC.02696-16
CrossRef Полный текст | Google Scholar
Гудман А. Л., Куласекара Б., Ритч А., Бойд Д., Смит Р. С. и Лори С. (2004). Сигнальная сеть реципрокно регулирует гены, связанные с острой инфекцией и хронической персистентностью у Pseudomonas aeruginosa . Dev. Cell 7, 745–754. DOI: 10.1016 / j.devcel.2004.08.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гудман, А.Л., Мериги, М., Хиодо, М., Вентр, И., Филлу, А., и Лори, С. (2009). Прямое взаимодействие между белками сенсорной киназы опосредует фенотипы острых и хронических заболеваний у бактериального патогена. Genes Dev. 23, 249–259. DOI: 10.1101 / gad.1739009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гован, Дж. Р., и Деретич, В. (1996). Микробный патогенез при муковисцидозе: мукоид Pseudomonas aeruginosa и Burkholderia cepacia . Microbiol. Rev. 60, 539–574.
PubMed Аннотация | Google Scholar
Гупта, К., Ляо, Дж., Петрова, О. Е., Черный, К. Э., Зауэр, К. (2014). Повышенные уровни второго мессенджера c-di-GMP способствуют устойчивости к противомикробным препаратам Pseudomonas aeruginosa . Мол. Microbiol. 92, 488–506. DOI: 10.1111 / mmi.12587
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холл, К. У. и Мах, Т. Ф. (2017). Молекулярные механизмы устойчивости и толерантности к антибиотикам на основе биопленок патогенных бактерий. FEMS Microbiol. Ред. 41, 276–301. DOI: 10.1093 / femsre / fux010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хармс А., Фино К., Соренсен М. А., Семси С. и Гердес К. (2017). Профаги и динамика роста искажают экспериментальные результаты с устойчивыми к антибиотикам клетками-персистерами. MBio 8, e01964 – e01917. DOI: 10.1128 / mBio.01964-17
CrossRef Полный текст | Google Scholar
Хармс А., Мезоннев Э. и Гердес К.(2016). Механизмы устойчивости бактерий при стрессе и воздействии антибиотиков. Наука 354, aaf 4268-1 – aaf 4268-9. DOI: 10.1126 / science.aaf4268
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hengzhuang, W., Ciofu, O., Yang, L., Wu, H., Song, Z., Oliver, A., et al. (2013). Высокий уровень бета-лактамазы изменяет фармакодинамику бета-лактамных антибиотиков в биопленках Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 57, 196–204.DOI: 10.1128 / AAC.01393-12
CrossRef Полный текст | Google Scholar
Хэнчжуан В., Хойби Н. и Чофу О. (2014). Фармакокинетика и фармакодинамика антибиотиков при инфекциях биопленок Pseudomonas aeruginosa in vitro и in vivo. Methods Mol. Биол. 1147, 239–254. DOI: 10.1007 / 978-1-4939-0467-9_17
CrossRef Полный текст | Google Scholar
Хэнчжуан В., Ву Х., Чофу О., Сонг З. и Хойби Н. (2012). Фармакокинетика / фармакодинамика колистина и имипенема in vivo при инфекции биопленки Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 56, 2683–2690. DOI: 10.1128 / AAC.06486-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hentzer, M., Teitzel, G.M., Balzer, G.J., Heydorn, A., Molin, S., Givskov, M., et al. (2001). Избыточное производство альгината влияет на структуру и функцию биопленки Pseudomonas aeruginosa . J. Bacteriol. 183, 5395–5401. DOI: 10.1128 / JB.183.18.5395-5401.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Херрманн, Г., Ян, Л., Ву, Х., Сонг, З., Ван, Х., Хойби, Н. и др. (2010). Комбинации колистин-тобрамицин превосходят монотерапию в отношении уничтожения биопленок Pseudomonas aeruginosa . J. Infect. Дис. 202, 1585–1592. DOI: 10.1086 / 656788
CrossRef Полный текст | Google Scholar
Хоффман, Л. Р., Д’Аргенио, Д. А., Маккосс, М. Дж., Чжан, З., Джонс, Р. А., и Миллер, С. И. (2005). Аминогликозидные антибиотики вызывают образование бактериальной биопленки. Природа 436, 1171–1175.DOI: 10.1038 / nature03912
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Høiby, N., Bjarnsholt, T., Moser, C., Bassi, G.L., Coenye, T., Donelli, G., et al. (2015). Руководство ESCMID по диагностике и лечению биопленочных инфекций, 2014 г. Clin. Microbiol. Заразить. 21 (Дополнение 1), S1 – S25. DOI: 10.1016 / j.cmi.2014.10.024
CrossRef Полный текст | Google Scholar
Høiby, N., Jacobsen, L., Jorgensen, B.A., Lykkegaard, E., and Weeke, B.(1974). Инфекция Pseudomonas aeruginosa при муковисцидозе. Наличие преципитирующих антител против Pseudomonas aeruginosa в зависимости от концентрации шестнадцати белков сыворотки и клинического и рентгенографического статуса легких. Acta Paediatr. Сканд. 63, 843–848. DOI: 10.1111 / j.1651-2227.1974.tb04874.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хант Б. Э., Вебер А., Бергер А., Рэмси Б. и Смит А. Л. (1995).Макромолекулярные механизмы ингибирования активности тобрамицина в мокроте. Антимикробный. Агенты Chemother. 39, 34–39. DOI: 10.1128 / AAC.39.1.34
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дженсен П. О., Бриалес А., Брохманн Р. П., Ван Х., Краг К. Н., Колпен М. и др. (2014). Образование гидроксильных радикалов способствует бактерицидной активности ципрофлоксацина против биопленок Pseudomonas aeruginosa . Pathog. Дис. 70, 440–443.DOI: 10.1111 / 2049-632X.12120
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дженсен, П. О., Колпен, М., Краг, К. Н., и Кул, М. (2017). На характеристики микросреды и физиологию биопленок при хронических инфекциях пациентов с МВ сильно влияет иммунный ответ хозяина. APMIS 125, 276–288. DOI: 10.1111 / apm.12668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Johnson, L., Mulcahy, H., Kanevets, U., Ши, Ю., и Левенца, С. (2012). Спермидин, локализованный на поверхности, защищает внешнюю мембрану Pseudomonas aeruginosa от лечения антибиотиками и окислительного стресса. J. Bacteriol. 194, 813–826. DOI: 10.1128 / JB.05230-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джухас М., Эберл Л. и Туммлер Б. (2005). Определение кворума: сила сотрудничества в мире Pseudomonas . Environ. Microbiol. 7, 459–471.DOI: 10.1111 / j.1462-2920.2005.00769.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хакимова М., Альгрен Х. Г., Харрисон Дж. Дж., Инглиш, А. М. и Нгуен, Д. (2013). Строгий ответ контролирует каталазы в Pseudomonas aeruginosa и необходим для устойчивости к перекиси водорода и антибиотикам. J. Bacteriol. 195, 2011–2020. DOI: 10.1128 / JB.02061-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Киндрачук, К.Н., Фернандес, Л., Бейнс, М., и Хэнкок, Р. Э. (2011). Участие АТФ-зависимой протеазы PA0779 / AsrA в индукции теплового шока в ответ на тобрамицин у Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 55, 1874–1882. DOI: 10.1128 / AAC.00935-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кивисаар, М. (2010). Механизмы стационарного мутагенеза у бактерий: мутационные процессы у псевдомонад. FEMS Microbiol.Lett. 312, 1–14. DOI: 10.1111 / j.1574-6968.2010.02027.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клаузен М., Хейдорн А., Рагас П., Ламбертсен Л., Ааес-Йоргенсен А., Молин С. и др. (2003). Формирование биопленок с помощью Pseudomonas aeruginosa дикого типа, жгутиков и мутантов пилей типа IV. Мол. Microbiol. 48, 1511–1524. DOI: 10.1046 / j.1365-2958.2003.03525.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коева, М., Гуцу, А. Д., Хеберт, В., Вейджер, Дж. Д., Йонкер, Л. М., О’Тул, Г. А. и др. (2017). Стратегия лечения хронических инфекций, вызванных Pseudomonas aeruginosa, , антиперсистерная стратегия. Антимикробный. Агенты Chemother. 61, e00987 – e00917. DOI: 10.1128 / AAC.00987-17
CrossRef Полный текст | Google Scholar
Колпен, М., Аппельдорф, К. Ф., Брандт, С., Мусави, Н., Краг, К. Н., Айдоган, С., и др. (2016). Повышенная бактерицидная активность колистина на биопленках Pseudomonas aeruginosa в анаэробных условиях. Pathog. Дис. 74: ftv086. DOI: 10.1093 / femspd / ftv086
CrossRef Полный текст | Google Scholar
Колпен, М., Хансен, К. Р., Бьярнсхольт, Т., Мозер, К., Кристенсен, Л. Д., ван, Г. М. и др. (2010). Полиморфноядерные лейкоциты потребляют кислород в мокроте от хронической пневмонии Pseudomonas aeruginosa при муковисцидозе. Грудь 65, 57–62. DOI: 10.1136 / thx.2009.114512
CrossRef Полный текст | Google Scholar
Колпень, м., Lerche, C.J., Kragh, K. N., Sams, T., Koren, K., Jensen, A.S, et al. (2017). Гипербарический кислород сенсибилизирует бескислородную биопленку Pseudomonas aeruginosa к ципрофлоксацину. Антимикробный. Агенты Chemother. 61, e01024 – e01017. DOI: 10.1128 / AAC.01024-17
CrossRef Полный текст | Google Scholar
Лабат, Ф., Прадиллон, О., Гарри, Л., Пехмаур, М., Фантин, Б., и Денамур, Э. (2005). Мутаторный фенотип дает преимущество в патогенезе хронической инфекции мочевыводящих путей Escherichia coli . FEMS Immunol. Med. Microbiol. 44, 317–321. DOI: 10.1016 / j.femsim.2005.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лебо, Д., Гиго, Дж. М., и Белойн, К. (2014). Инфекции, связанные с биопленками: устранение разрыва между клиническим ведением и фундаментальными аспектами непокорности к антибиотикам. Microbiol. Мол. Биол. Rev. 78, 510–543. DOI: 10.1128 / MMBR.00013-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лерче, К.J., Christophersen, L.J., Kolpen, M., Nielsen, P.R., Trostrup, H., Thomsen, K., et al. (2017). Гипербарическая терапия кислородом увеличивает эффективность тобрамицина при экспериментальном эндокардите, вызванном стафилококком Staphylococcus aureus . Внутр. J. Antimicrob. Агенты 50, 406–412. DOI: 10.1016 / j.ijantimicag.2017.04.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Левин-Райсман И., Ронин И., Гефен О., Бранисс И., Шореш Н. и Балабан Н. К. (2017). Толерантность к антибиотикам способствует развитию резистентности. Наука 355, 826–830. DOI: 10.1126 / science.aaj2191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Ю., Гейне С., Энтиан М., Зауэр К. и Франкенберг-Динкель Н. (2013). NO-индуцированная дисперсия биопленок в Pseudomonas aeruginosa опосредуется фосфодиэстеразой, связанной с доменом MHYT. J. Bacteriol. 195, 3531–3542. DOI: 10.1128 / JB.01156-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ляо, Дж., и Зауэр, К. (2012). MerR-подобный регулятор транскрипции BrlR способствует устойчивости к биопленкам Pseudomonas aeruginosa . J. Bacteriol. 194, 4823–4836. DOI: 10.1128 / JB.00765-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ляо, Дж., Шурр, М. Дж., И Зауэр, К. (2013). Подобный MerR регулятор BrlR придает толерантность к биопленке путем активации насосов оттока нескольких лекарственных препаратов в биопленках Pseudomonas aeruginosa . J. Bacteriol. 195, 3352–3363. DOI: 10.1128 / JB.00318-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лухан, А. М., Масия, М. Д., Янг, Л., Молин, С., Оливер, А., и Смания, А. М. (2011). Эволюция и адаптация биопленок Pseudomonas aeruginosa под действием мутаторов с дефицитом системы репарации несовпадений. PLoS One 6: e27842. DOI: 10.1371 / journal.pone.0027842
CrossRef Полный текст | Google Scholar
Ма, Л., Коновер, М., Лу, Х., Парсек, М. Р., Бейлс, К., и Возняк, Д. Дж. (2009). Сборка и разработка матрицы биопленки Pseudomonas aeruginosa . PLoS Pathog. 5: e1000354. DOI: 10.1371 / journal.ppat.1000354
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, Л., Джексон, К. Д., Лэндри, Р. М., Парсек, М. Р., и Возняк, Д. Дж. (2006). Анализ условных вариантов psl Pseudomonas aeruginosa выявил роль полисахарида psl в адгезии и поддержании постприлипания структуры биопленки. J. Bacteriol. 188, 8213–8221. DOI: 10.1128 / JB.01202-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Масиа, М. Д., Бланкер, Д., Тогорес, Б., Сауледа, Дж., Перес, Дж. Л., и Оливер, А. (2005). Гипермутация является ключевым фактором в развитии множественной устойчивости к противомикробным препаратам у штаммов Pseudomonas aeruginosa , вызывающих хронические инфекции легких. Антимикробный. Агенты Chemother. 49, 3382–3386. DOI: 10.1128 / AAC.49.8.3382-3386.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Масиа, М.Д., Перес, Дж. Л., Молин, С., и Оливер, А. (2011). Динамика популяций мутаторов и устойчивых к антибиотикам популяций в фармакокинетической / фармакодинамической модели лечения биопленкой Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 55, 5230–5237. DOI: 10.1128 / AAC.00617-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Macia, M. D., Rojo-Molinero, E., and Oliver, A. (2014). Тестирование чувствительности к противомикробным препаратам у бактерий, растущих на биопленках. Clin. Microbiol. Заразить. 20, 981–990. DOI: 10.1111 / 1469-0691.12651
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, Т. Ф., Питтс, Б., Пеллок, Б., Уокер, Г. К., Стюарт, П. С., и О’Тул, Г. А. (2003). Генетическая основа устойчивости биопленки Pseudomonas aeruginosa к антибиотикам . Природа 426, 306–310. DOI: 10.1038 / nature02122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махарджан, Р.П., Ференци Т. (2017). Сдвиг мутационного ландшафта в 6 состояниях питания: мутагенез, вызванный стрессом, как серия отчетливых взаимосвязей между входом стресса и выходом мутации. PLoS Biol. 15: e2001477. DOI: 10.1371 / journal.pbio.2001477
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мэлоун, Дж. Г., Джегер, Т., Спанглер, К., Ритц, Д., Спанг, А., Арриумерлу, К. и др. (2010). YfiBNR опосредует циклический ди-GMP-зависимый вариант малой колонии и персистентность у Pseudomonas aeruginosa . PLoS Pathog. 6: e1000804. DOI: 10.1371 / journal.ppat.1000804
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартинс, Д., Маккей, Г., Сампаткумар, Г., Хакимова, М., Инглиш, А. М., и Нгуен, Д. (2018). Активность супероксиддисмутазы придает (p) ppGpp-опосредованную толерантность к антибиотикам к стационарной фазе Pseudomonas aeruginosa . Proc. Natl. Акад. Sci. USA 115, 9797–9802. DOI: 10.1073 / pnas.1804525115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацукава, М., и Гринберг, Э. П. (2004). Предполагаемые гены синтеза экзополисахаридов влияют на развитие биопленки Pseudomonas aeruginosa . J. Bacteriol. 186, 4449–4456. DOI: 10.1128 / JB.186.14.4449-4456.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мёллер С. А., Йенсен П. О., Хёби Н., Чофу О., Краг К. Н., Бьярнсхольт Т. и др. (2019). Гипербарическая обработка кислородом увеличивает гибель агрегирующих изолятов Pseudomonas aeruginosa от пациентов с муковисцидозом. J. Cyst. Фиброс. DOI: 10.1016 / j.jcf.2019.01.005 (в печати).
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Москосо, Дж. А., Миккельсен, Х., Хиб, С., Уильямс, П., и Филлу, А. (2011). Датчик RetS Pseudomonas aeruginosa переключает секрецию типа III и типа VI посредством передачи сигналов c-di-GMP. Environ. Microbiol. 13, 3128–3138. DOI: 10.1111 / j.1462-2920.2011.02595.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Московиц, С.М., Фостер, Дж. М., Эмерсон, Дж., И Бернс, Дж. Л. (2004). Клинически осуществимый анализ чувствительности биопленок для изолятов Pseudomonas aeruginosa от пациентов с муковисцидозом. J. Clin. Microbiol. 42, 1915–1922. DOI: 10.1128 / JCM.42.5.1915-1922.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mulcahy, H., Charron-Mazenod, L., and Lewenza, S. (2008). Внеклеточная ДНК хелатирует катионы и индуцирует устойчивость к антибиотикам в биопленках Pseudomonas aeruginosa . PLoS Pathog. 4: e1000213. DOI: 10.1371 / journal.ppat.1000213
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мураками К., Оно Т., Видучич Д., Каяма С., Мори М., Хирота К. и др. (2005). Роль гена rpoS из Pseudomonas aeruginosa в толерантности к антибиотикам. FEMS Microbiol. Lett. 242, 161–167. DOI: 10.1016 / j.femsle.2004.11.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нгуен, Д., Joshi-Datar, A., Lepine, F., Bauerle, E., Olakanmi, O., Beer, K., et al. (2011). Активные реакции голодания опосредуют толерантность к антибиотикам в биопленках и бактериях с ограниченным питанием. Наука 334, 982–986. DOI: 10.1126 / science.1211037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оливер А., Кантон Р., Кампо П., Бакеро Ф. и Бласкес Дж. (2000). Высокая частота гипермутации Pseudomonas aeruginosa при муковисцидозе легких. Наука 288, 1251–1254. DOI: 10.1126 / science.288.5469.1251
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Тул, Г. А., и Колтер, Р. (1998). Подвижность жгутиков и подергивание необходимы для развития биопленки Pseudomonas aeruginosa . Мол. Microbiol. 30, 295–304. DOI: 10.1046 / j.1365-2958.1998.01062.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оверхэдж, Дж., Шемионек, М., Уэбб, Дж.С., Рем Б. Х. (2005). Экспрессия оперона psl в биопленках Pseudomonas aeruginosa PAO1: PslA выполняет важную функцию в образовании биопленок. Заявл. Environ. Microbiol. 71, 4407–4413. DOI: 10.1128 / AEM.71.8.4407-4413.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Памп, С. Дж., Гьермансен, М., Йохансен, Х. К., и Толкер-Нильсен, Т. (2008). Толерантность к антимикробному пептиду колистину в биопленках Pseudomonas aeruginosa связана с метаболически активными клетками и зависит от генов pmr и mexAB-oprM. Мол. Microbiol. 68, 223–240. DOI: 10.1111 / j.1365-2958.2008.06152.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pamp, S.J., Gjermansen, M., and Tolker-Nielsen, T. (2007). «Матрица биопленки: липкий каркас» в Образ жизни биопленки: механизмы и адаптации. ред. С. Кьеллеберг и М. Гивсков (Норфолк, Великобритания: Horizon Bioscience), 37–69.
Google Scholar
Памп, С. Дж., Штернберг, К., и Толкер-Нильсен, Т.(2009). Понимание микробного многоклеточного образа жизни с помощью технологии проточных клеток и конфокальной микроскопии. Цитометрия A 75, 90–103. DOI: 10.1002 / cyto.a.20685
CrossRef Полный текст | Google Scholar
Памп, С. Дж., И Толкер-Нильсен, Т. (2007). Множественные роли биосурфактантов в развитии структурной биопленки с помощью Pseudomonas aeruginosa . J. Bacteriol. 189, 2531–2539. DOI: 10.1128 / JB.01515-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перрон, Г.Г., Гонсалес А. и Баклинг А. (2007). Динамика «источник-поглотитель» определяет эволюцию устойчивости к антибиотикам и стоимость ее плейотропной пригодности. Proc. Биол. Sci. 274, 2351–2356. DOI: 10.1098 / rspb.2007.0640
CrossRef Полный текст | Google Scholar
Петрова О. Э., Зауэр К. (2010). Новая двухкомпонентная регуляторная система BfiSR регулирует развитие биопленок, контролируя малую РНК rsmZ через CafA. J. Bacteriol. 192, 5275–5288. DOI: 10.1128 / JB.00387-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пул, К. (2014). Ответы на стресс как детерминанты устойчивости к противомикробным препаратам у Pseudomonas aeruginosa : отток нескольких лекарственных препаратов и др. Банка. J. Microbiol. 60, 783–791. DOI: 10.1139 / cjm-2014-0666
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Поудьял, Б., и Зауэр, К. (2018a). Азбука устойчивости биопленок к лекарствам: MerR-подобный регулятор BrlR является активатором транспортных систем ABC, при этом PA1874-77 способствует устойчивости биопленок Pseudomonas aeruginosa к тобрамицину. Антимикробный. Агенты Chemother. 62, e01981 – e01917. DOI: 10.1128 / AAC.01981-17
CrossRef Полный текст | Google Scholar
Поудьял, Б., и Зауэр, К. (2018b). Ген PA3177 кодирует активную дигуанилатциклазу, которая способствует устойчивости биопленок к антимикробным препаратам, но не формирует биопленки с помощью Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 62, e01049 – e01018. DOI: 10.1128 / AAC.01049-18
CrossRef Полный текст | Google Scholar
Рейни П.Б., Баклинг, А., Кассен, Р., Тревизано, М. (2000). Возникновение и поддержание разнообразия: выводы из экспериментальных бактериальных популяций. Trends Ecol. Evol. 15, 243–247. DOI: 10.1016 / S0169-5347 (00) 01871-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ramphal, R., Lhermitte, M., Filliat, M., and Roussel, P. (1988). Связывание антипсевдомонадных антибиотиков с макромолекулами мокроты при муковисцидозе. J. Antimicrob. Chemother. 22, 483–490. DOI: 10.1093 / jac / 22.4.483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раньери, М. Р., Уитчерч, К. Б., и Берроуз, Л. Л. (2018). Механизмы стимуляции биопленки субингибирующими концентрациями антимикробных препаратов. Curr. Opin. Microbiol. 45, 164–169. DOI: 10.1016 / j.mib.2018.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росси, Э., Фальконе, М., Молин, С., и Йохансен, Х. К. (2018).Транскриптомика in situ с высоким разрешением Pseudomonas aeruginosa раскрывает не зависящие от генотипа патофенотипы при муковисцидозе легких. Нац. Commun. 9: 3459. DOI: 10.1038 / s41467-018-05944-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райан Р. П., Фухи Ю., Гарсия Б. Ф., Ватт С. А., Нихаус К., Янг Л. и др. (2008). Межвидовая передача сигналов через диффузный сигнальный фактор Stenotrophomonas maltophilia влияет на формирование биопленок и толерантность к полимиксину у Pseudomonas aeruginosa . Мол. Microbiol. 68, 75–86. DOI: 10.1111 / j.1365-2958.2008.06132.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рыбтке, М., Бертельсен, Дж., Янг, Л., Хёби, Н., Гивсков, М., и Толкер-Нильсен, Т. (2015a). Белок LapG играет роль в формировании биопленки Pseudomonas aeruginosa , контролируя присутствие адгезина CdrA на поверхности клетки. Microbiologyopen. 4, 917–930. DOI: 10.1002 / mbo3.301
CrossRef Полный текст | Google Scholar
Рыбтке, М., Халтквист, Л. Д., Гивсков, М., и Толкер-Нильсен, Т. (2015b). Pseudomonas aeruginosa Инфекции биопленок: структура сообщества, толерантность к противомикробным препаратам и иммунный ответ. J. Mol. Биол. 427, 3628–3645. DOI: 10.1016 / j.jmb.2015.08.016
CrossRef Полный текст | Google Scholar
Шафхаузер, Дж., Лепин, Ф., Маккей, Г., Альгрен, Х. Г., Хакимова, М., и Нгуен, Д. (2014). Строгий ответ модулирует биосинтез 4-гидрокси-2-алкилхинолина и иерархию чувствительности кворума в Pseudomonas aeruginosa . J. Bacteriol. 196, 1641–1650. DOI: 10.1128 / JB.01086-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сековска А., Вендель С., Фишер Э. К., Норхольм М. Х. Х. и Данчин А. (2016). Генерация горячих точек мутаций в стареющих бактериальных колониях. Sci. Отчет 6: 2. DOI: 10.1038 / s41598-016-0005-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sønderholm, M., Koren, K., Wangpraseurt, D., Jensen, P.O., Kolpen, M., Kragh, K. N., et al. (2018). Инструменты для изучения моделей роста и химической динамики агрегированных Pseudomonas aeruginosa , подвергнутых воздействию различных акцепторов электронов в модели альгинатных шариков. NPJ Biofilms Microbiomes 4: 3. DOI: 10.1038 / s41522-018-0047-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сондерхольм, М., Краг, К. Н., Корен, К., Якобсен, Т. Х., Дарч, С. Э., Альхеде, М., и др. (2017). Pseudomonas aeruginosa Образование агрегатов в модельной системе альгинатных гранул проявляет характеристики, подобные in vivo. Заявл. Environ. Microbiol. 83, e00113 – e00117. DOI: 10.1128 / AEM.00113-17
CrossRef Полный текст | Google Scholar
Штаудингер Б. Дж., Мюллер Дж. Ф., Халлдорссон С., Болес Б., Ангермейер А., Нгуен Д. и др. (2014). Состояния, связанные с дефектом муковисцидоза, способствуют развитию хронической инфекции Pseudomonas aeruginosa . Am. J. Respir. Крит. Care Med. 189, 812–824. DOI: 10.1164 / rccm.201312-2142OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стинакерс, Х.П., Париджс И., Фостер К. Р., Вандерлейден Дж. (2016). Экспериментальная эволюция популяций биопленок. FEMS Microbiol. Ред. 40, 373–397. DOI: 10.1093 / femsre / fuw002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стюарт П. С., Франклин М. Дж., Уильямсон К. С., Фолсом Дж. П., Богли Л. и Джеймс Г. А. (2015). Вклад стрессовых реакций в толерантность к антибиотикам в биопленках Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 59, 3838–3847. DOI: 10.1128 / AAC.00433-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стюарт П. С., Чжан Т., Сюй Р., Питтс Б., Уолтерс М. К., Роу Ф. и др. (2016). Теория реакции-диффузии объясняет гипоксию и гетерогенный рост микробных биопленок, связанных с хроническими инфекциями. NPJ. Биопленки. Микробиомы. 2: 16012. DOI: 10.1038 / npjbiofilms.2016.12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Табер, Х.В., Мюллер, Дж. П., Миллер, П. Ф. и Эрроу, А. С. (1987). Бактериальное поглощение аминогликозидных антибиотиков. Microbiol. Ред. 51, 439–457.
PubMed Аннотация | Google Scholar
Тавернье, С., Краббе, А., Хаджиоглу, М., Стуэр, Л., Генри, С., Риголе, П. и др. (2017). Состав сообщества определяет активность антибиотиков в отношении многовидовых биопленок. Антимикробный. Агенты Chemother. 61, e00302 – e00317. DOI: 10.1128 / AAC.00302-17
CrossRef Полный текст | Google Scholar
Тилкер, Д., Hacker, S., Loris, R., Strathmann, M., Wingender, J., Wilhelm, S., et al. (2005). Pseudomonas aeruginosa лектин LecB расположен на внешней мембране и участвует в образовании биопленок. Микробиология 151, 1313–1323. DOI: 10.1099 / mic.0.27701-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Торренс, Г., Кабот, Г., Окампо-Соса, А. А., Конехо, М. К., Заморано, Л., Наварро, Ф. и др. (2016). Активность цефтазидима-авибактама против клинических и изогенных лабораторных изолятов Pseudomonas aeruginosa , экспрессирующих комбинации наиболее важных механизмов устойчивости к бета-лактамам. Антимикробный. Агенты Chemother. 60, 6407–6410. DOI: 10.1128 / AAC.01282-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Trastoy, R., Manso, T., Fernandez-Garcia, L., Blasco, L., Ambroa, A., Perez Del Molino, M. L., et al. (2018). Механизмы бактериальной толерантности и персистенции в желудочно-кишечной и респираторной средах. Clin. Microbiol. Ред. 31, e00023 – e00018. DOI: 10.1128 / CMR.00023-18
CrossRef Полный текст | Google Scholar
Ценг, Б.S., Zhang, W., Harrison, J.J., Quach, T.P., Song, J.L., Penterman, J., et al. (2013). Внеклеточный матрикс защищает биопленки Pseudomonas aeruginosa , ограничивая проникновение тобрамицина. Environ. Microbiol. 15, 2865–2878. DOI: 10.1111 / 1462-2920.12155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валле И., Олсон Дж. У., Лори С., Лаздунски А. и Филлу А. (2001). Пути шаперона / ашера Pseudomonas aeruginosa : идентификация кластеров фимбриальных генов (чашка) и их участие в формировании биопленок. Proc. Natl. Акад. Sci. USA 98, 6911–6916. DOI: 10.1073 / pnas.111551898
CrossRef Полный текст | Google Scholar
Ван, Г. М., Кристенсен, Л. Д., Альхеде, М., Фиппс, Р., Дженсен, П. О., Кристоферсен, Л., и др. (2009). Инактивация гена rhlA в Pseudomonas aeruginosa предотвращает продукцию рамнолипидов, отключая защиту от полиморфно-ядерных лейкоцитов. APMIS 117, 537–546. DOI: 10.1111 / j.1600-0463.2009.02466.х
CrossRef Полный текст | Google Scholar
Ван Акер, Х., и Коэне, Т. (2017). Роль активных форм кислорода в опосредованном антибиотиком уничтожении бактерий. Trends Microbiol. 25, 456–466. DOI: 10.1016 / j.tim.2016.12.008
CrossRef Полный текст | Google Scholar
Ван Акер, Х., Сасс, А., Баззини, С., Де, Р. К., Удине, К., Мессиан, Т. и др. (2013). Выращенные на биопленке клетки комплекса Burkholderia cepacia выживают при лечении антибиотиками, избегая образования активных форм кислорода. PLoS One 8: e58943. DOI: 10.1371 / journal.pone.0058943
CrossRef Полный текст | Google Scholar
Верклин, Р. М. младший, и Манделл, Г. Л. (1977). Изменение эффективности антибиотиков при анаэробиозе. J. Lab. Clin. Med. 89, 65–71.
PubMed Аннотация | Google Scholar
Видучич, Д., Оно, Т., Мураками, К., Сусиловати, Х., Каяма, С., Хирота, К., и др. (2006). Функциональный анализ генов spoT, relA и dksA на толерантность к хинолонам у Pseudomonas aeruginosa в условиях отсутствия роста. Microbiol. Иммунол. 50, 349–357. DOI: 10.1111 / j.1348-0421.2006.tb03793.x
CrossRef Полный текст | Google Scholar
Уолтерс, М. К. III, Роу, Ф., Багникорт, А., Франклин, М. Дж., И Стюарт, П. С. (2003). Вклад проникновения антибиотиков, ограничения кислорода и низкой метаболической активности в толерантность биопленок Pseudomonas aeruginosa к ципрофлоксацину и тобрамицину. Антимикробный. Агенты Chemother. 47, 317–323. DOI: 10.1128 / AAC.47.1.317-323.2003
CrossRef Полный текст | Google Scholar
Whitchurch, C. B., Tolker-Nielsen, T., Ragas, P. C., and Mattick, J. S. (2002). Внеклеточная ДНК необходима для образования бактериальной биопленки. Наука 295: 1487. DOI: 10.1126 / science.295.5559.1487
CrossRef Полный текст | Google Scholar
Уильямсон, К. С., Ричардс, Л. А., Перес-Осорио, А. К., Питтс, Б., Макиннерни, К., Стюарт, П. С. и др. (2012). Неоднородность биопленок Pseudomonas aeruginosa включает экспрессию факторов гибернации рибосом в толерантной к антибиотикам субпопуляции и индуцированную гипоксией стрессовую реакцию в метаболически активной популяции. J. Bacteriol. 194, 2062–2073. DOI: 10.1128 / JB.00022-12
CrossRef Полный текст | Google Scholar
Уилтон, М., Шаррон-Мазенод, Л., Мур, Р., и Левенца, С. (2016). Внеклеточная ДНК подкисляет биопленки и индуцирует устойчивость к аминогликозидам у синегнойной палочки. Антимикробный. Агенты Chemother. 60, 544–553. DOI: 10.1128 / AAC.01650-15
CrossRef Полный текст | Google Scholar
Worlitzsch, D., Tarran, R., Ulrich, M., Schwab, U., Cekici, A., Meyer, K. C., et al. (2002). Эффекты снижения концентрации кислорода в слизи в дыхательных путях. Инфекции, вызванные псевдомонадой, у пациентов с муковисцидозом. J. Clin. Инвестировать. 109, 317–325. DOI: 10.1172 / JCI0213870
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, Л., Ху, Ю., Лю, Ю., Чжан, Дж., Улструп, Дж., И Молин, С. (2011). Выявленные роли внеклеточных полимерных веществ в развитии биопленки Pseudomonas aeruginosa . Environ.Microbiol. 13, 1705–1717. DOI: 10.1111 / j.1462-2920.2011.02503.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заборските, Г., Андерсен, Дж. Б., Краг, К. Н., и Чофу, О. (2016). Мониторинг в реальном времени появления и динамики мутанта nfxB в биопленке P. aeruginosa , подвергшейся воздействию субингибирующих концентраций ципрофлоксацина. Антимикробный. Агенты Chemother. 61, e02292 – e02216. DOI: 10.1128 / AAC.02292-16
CrossRef Полный текст | Google Scholar
Чжан, Л., Чанг, В. К., Гао, К., Гивсков, М., Толкер-Нильсен, Т., Янг, Л. и др. (2012). Белок контроля катаболитной репрессии Crc играет роль в развитии устойчивых к противомикробным препаратам субпопуляций в биопленках Pseudomonas aeruginosa .
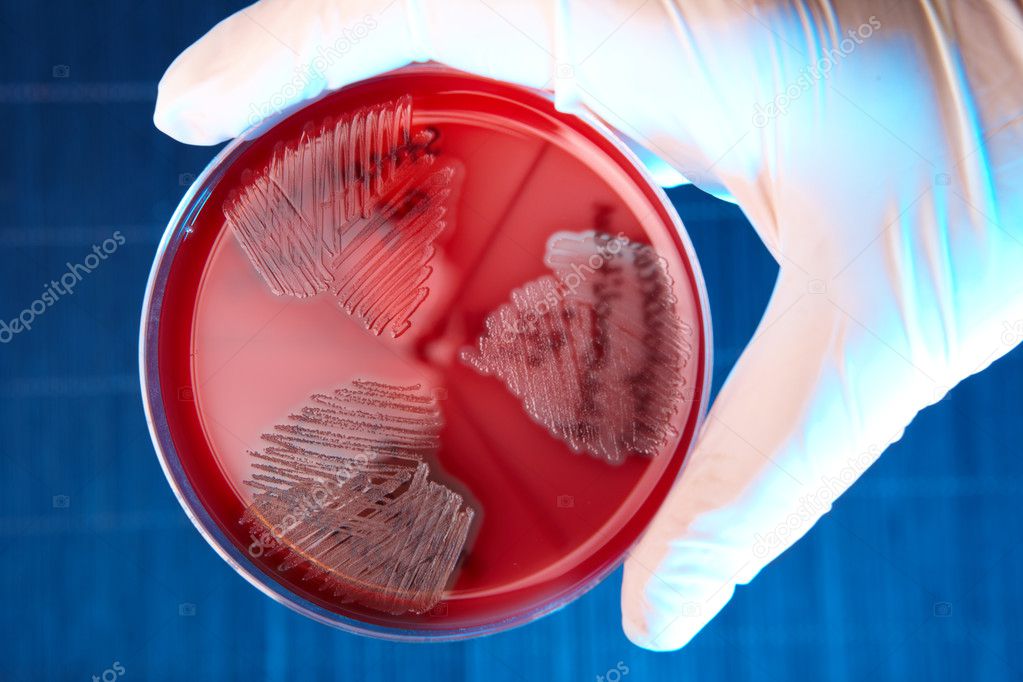 Поэтому не экономьте на средствах для обработки натуральных ногтей. Делайте выбор в сторону качественных профессиональных спец.средств. профессиональные средства работают, как правило, как средства 3 в 1: обезжиривают, дегидратируют и дезинфицируют. Безопасно и экономично.
Поэтому не экономьте на средствах для обработки натуральных ногтей. Делайте выбор в сторону качественных профессиональных спец.средств. профессиональные средства работают, как правило, как средства 3 в 1: обезжиривают, дегидратируют и дезинфицируют. Безопасно и экономично.
 Делать это категорически запрещено, тк мы сами создаем благоприятную среду для развития бактерий.
Делать это категорически запрещено, тк мы сами создаем благоприятную среду для развития бактерий.

 Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки.
Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки. Считается поддерживающим фактором формирования трофических язв.
Считается поддерживающим фактором формирования трофических язв.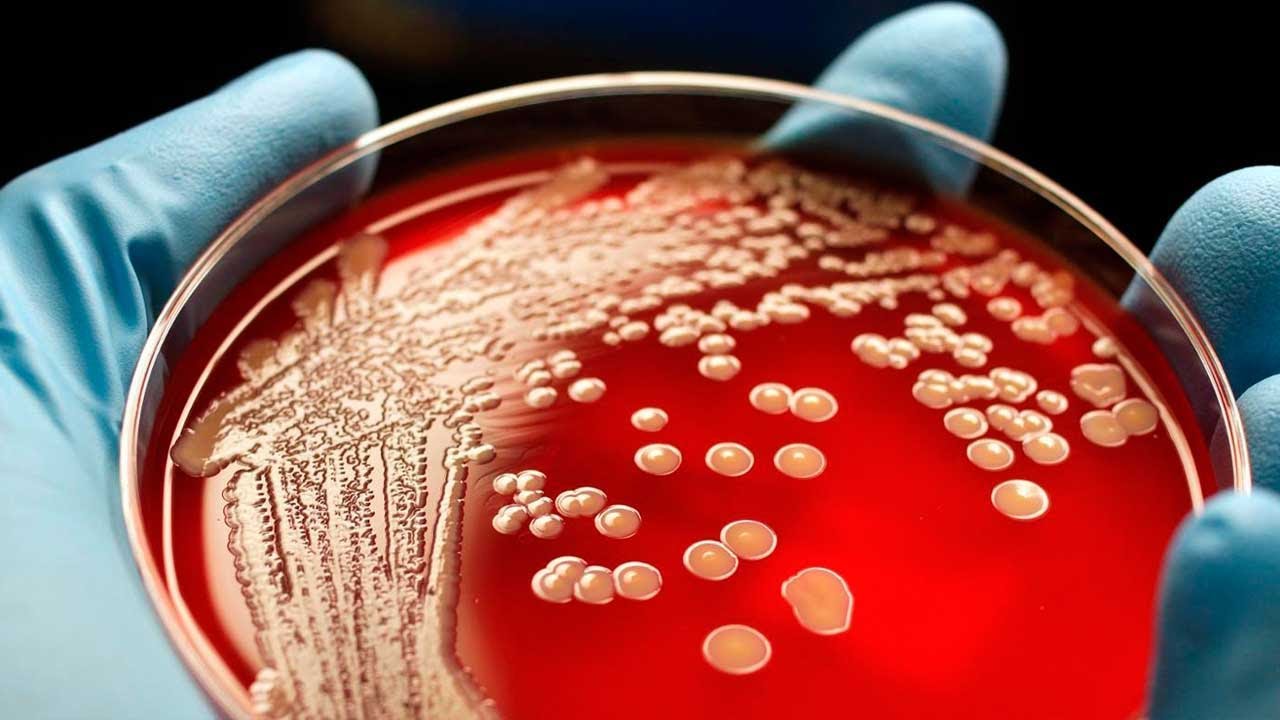 При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений.
При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений. Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител.
Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител.

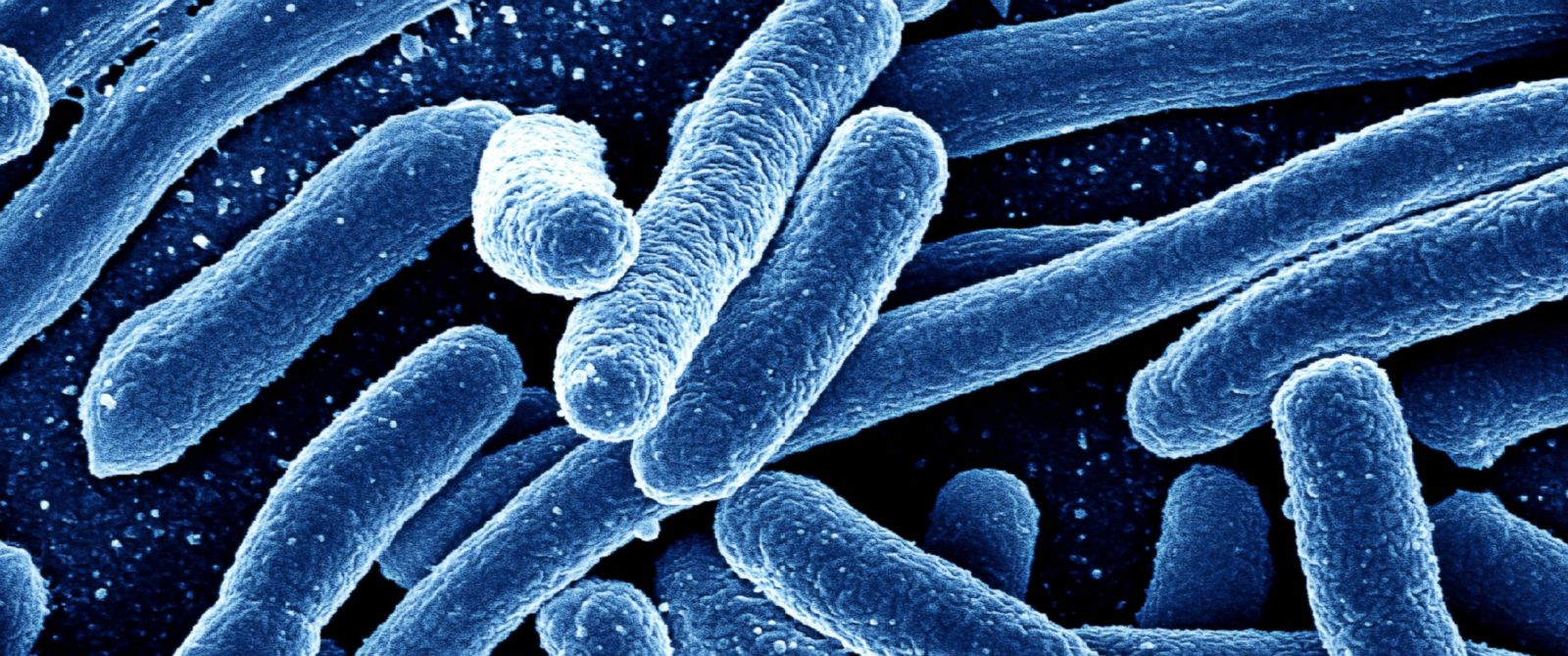

 Это объясняется токсическими проявлениями и сильным обезвоживанием.
Это объясняется токсическими проявлениями и сильным обезвоживанием.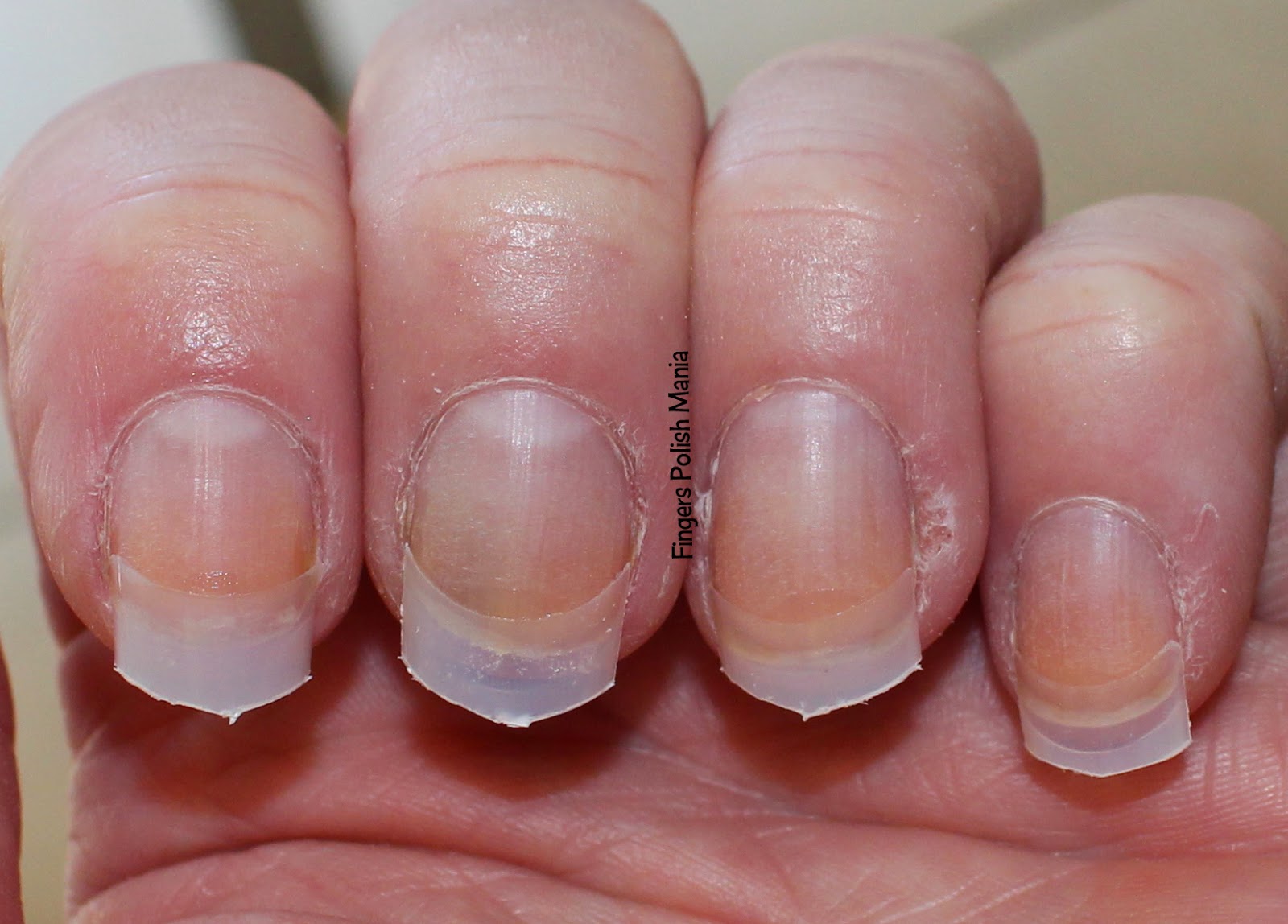 При помощи специальных реагентов лаборант выделяет плазмиды бактерий, многократно их копирует и определяет их наличие в растворе. В результате анализа указывается наличие возбудителя, его вид и рассчитанное количество микробных тел в исследуемом образце.
При помощи специальных реагентов лаборант выделяет плазмиды бактерий, многократно их копирует и определяет их наличие в растворе. В результате анализа указывается наличие возбудителя, его вид и рассчитанное количество микробных тел в исследуемом образце.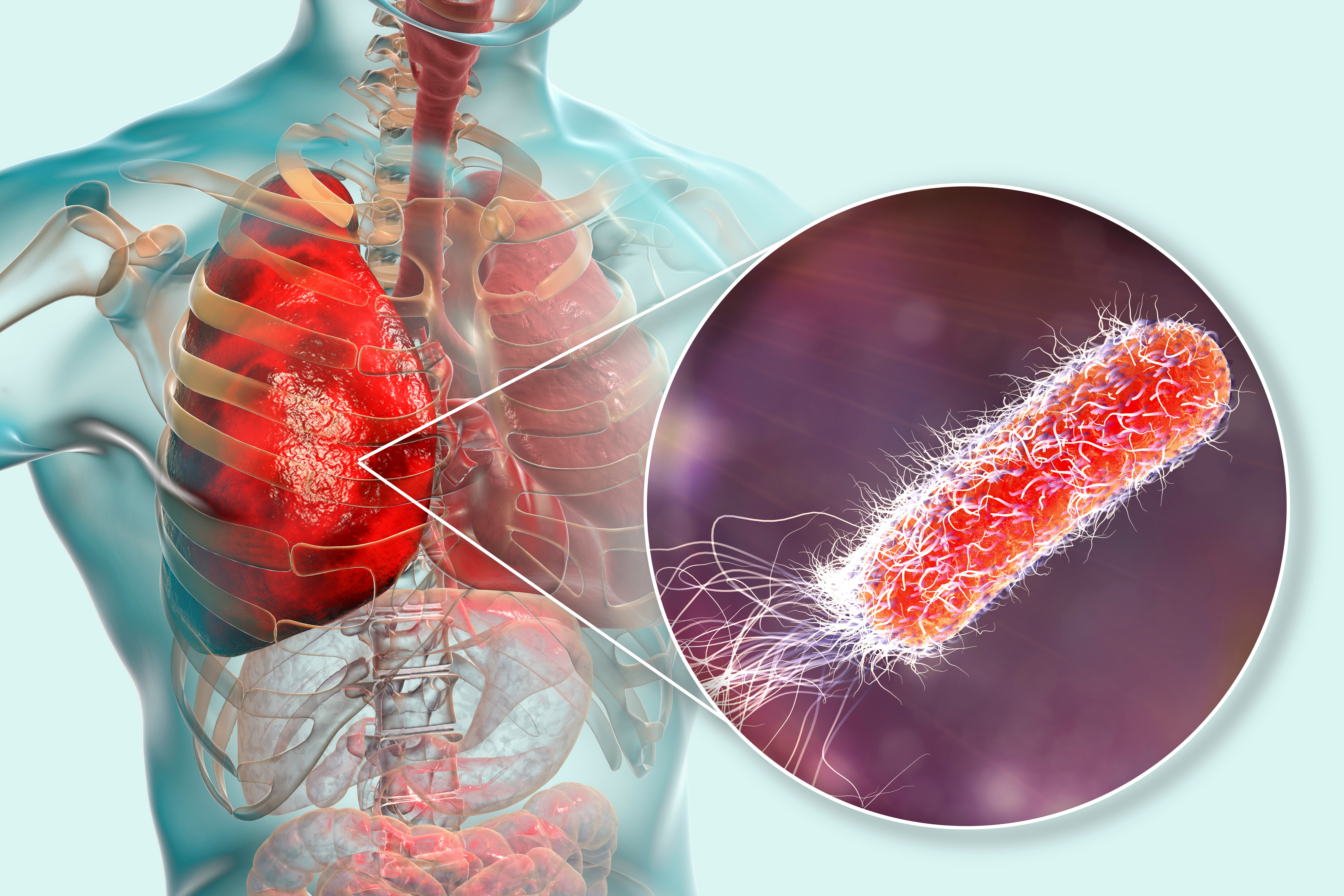 Больной получает аминогликозид + пенициллин или цефалоспорин широкого спектра действия, иногда один из препаратов меняют на фторхинолон (например, ципрофлоксацин) или рифампицин.
Больной получает аминогликозид + пенициллин или цефалоспорин широкого спектра действия, иногда один из препаратов меняют на фторхинолон (например, ципрофлоксацин) или рифампицин.