Методы стерилизации — Студопедия
· Термическая: паровая и воздушная (сухожаровая)
· Химическая: газовая или химическими растворами (стерилянтами)
· Плазменная (плазмой перекиси водорода)
· Радиационная стерилизация — применяется в промышленном варианте
· Метод мембранных фильтров — применяется для получения небольшого количества стерильных растворов, качество которых может резко ухудшиться при действии других методов стерилизации(бактериофаг, селективные питательные среды, антибиотики)[1]
Термические методы стерилизации[править | править исходный текст]
Преимущества термических методов стерилизации:
· Надёжность
· Отсутствие необходимости удаления стерилянтов с предметов медицинского назначения
· Удобство работы персонала
· Стерилизация проводится в упаковках, что позволяет сохранить стерильность некоторый период времени.
Паровая стерилизация[править | править исходный текст]
Осуществляется подачей насыщенного водяного пара под давлением в паровых стерилизаторах (автоклавах).
Паровая стерилизация под давлением считается наиболее эффективным методом, так как чем выше давление, тем выше температура пара, стерилизующего материал; бактерицидные свойства пара выше, чем воздуха, поэтому для стерилизации применяют пересыщенный пар.
Паровой стерилизации подвергают изделия из текстиля (бельё, вату, бинты, шовный материал), из резины, стекла, некоторых полимерных материалов, питательные среды,лекарственные препараты.
| Режимы паровой стерилизации для современных аппаратов | |||
| Температура | Давление | Время | Описание |
| 132 °C | 2,1 атм | 3,5 мин | Основной режим. Стерилизуют все изделия (стекло, металл, текстиль, кроме резиновых) |
| 132 °C | 2,1 атм | 20 мин | режим «прионовой стерилизации» |
| 120 °C | 1,1 атм | 20 мин | щадящий режим (стекло, металл, резиновые изделия, полимерные изделия — согласно паспорту; текстиль) |
При паровой стерилизации используют следующие упаковочные материалы:
· Стерилизационная коробка (бикс) простая.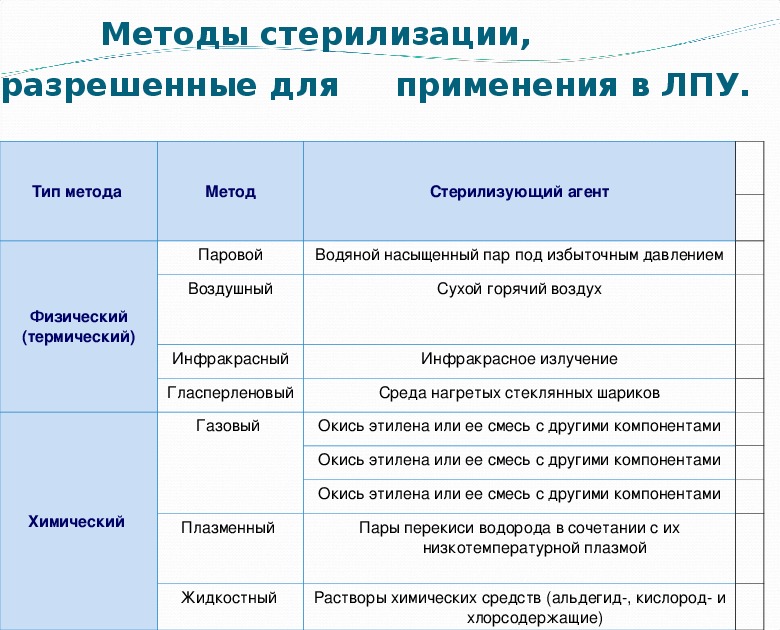 Срок хранения 3 суток после стерилизации.
Срок хранения 3 суток после стерилизации.
· Стерилизационная коробка (бикс) с фильтром. Срок хранения 20 суток после стерилизации.
· Крафт-пакеты со скрепками. Срок хранения — трое суток после стерилизации.
· Крафт-пакеты заклеивающиеся. Срок хранения — 50 суток после стерилизации.
· Ткань (бязь — КРОМЕ МАРЛИ). Срок хранения — трое суток после стерилизации.
· Комбинированные упаковки (прозрачная синтетическая плёнка + бумага). Срок хранения от 180 суток до 720 суток.
Тиндализация[править | править исходный текст]
Основная статья: Тиндализация
Тиндализацию применяют для стерилизации растворов, неустойчивых к действию высокой температуры. Она состоит в неоднократном нагревании до температуры 70—100°С с промежутками в 24 ч.
Химические методы стерилизации[править | править исходный текст]
Используются при обработке приборов, аппаратов, сложных оптических систем, крупногабаритных изделий или изделий из титана, полимерных смол, резин.
Для газовой(холодной) стерилизации используют герметичные контейнеры с парами окиси этилена, формальдегида или специализированными многокомпонентными системами.
Для химической стерилизации растворами применяются основных четыре группы веществ:
· Кислота+окислитель(например «Первомур»)
· Альдегид(например формалин)
· Детергент(например хлоргексидина биглюконат)
· Галоид(например Повидон-йод)
Концентрации и время стерилизации зависит от используемого антисептика или дезинфектанта.
Стерилизация ионизирующим излучением[править | править исходный текст]
· радиационный метод или лучевую стерилизацию γ-лучами применяют в специальных установках при промышленной стерилизации однократного применения — полимерных шприцев, систем переливания крови, чашек Петри, пипеток и других хрупких и термолабильных изделий.
· Ряд лет в фармтехнологии для стерилизации используется ультрафиолетовое (УФ) (длина волны 253,7 нм). Источники УФ-излучения — ртутные кварцевые лампы. Их мощное бактериостатическое действие основано на совпадении спектра испускания лампы и спектра поглощения ДНК микроорганизмов, что может являться причиной их гибели при длительной обработке излучением кварцевых ламп. При недостаточно мощном действии УФ в прокариотической клетке активизируются процессы световой и темновой репарации и клетка может восстановиться. Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.
Источники УФ-излучения — ртутные кварцевые лампы. Их мощное бактериостатическое действие основано на совпадении спектра испускания лампы и спектра поглощения ДНК микроорганизмов, что может являться причиной их гибели при длительной обработке излучением кварцевых ламп. При недостаточно мощном действии УФ в прокариотической клетке активизируются процессы световой и темновой репарации и клетка может восстановиться. Метод применяется для стерилизации воздуха приточно-вытяжной вентиляции, оборудования в биксах, также для стерилизации дистиллированной воды.
Автоклав — аппарат для стерилизации водяным паром под давлением и при температуре более 100°. Автоклав применяют для стерилизации перевязочных материалов, белья для операций, инструментов, посуды для бактериологических лабораторий, питательных сред для выращивания микроорганизмов и др. Принцип действия автоклава основан на возрастании температуры кипения воды при повышении давления (при давлении в 1 атм t° кипения воды 99,1С, а при давлении в 2 атм.
Основные части автоклава (рис. 1): кожух, водопаровая камера, стерилизационная камера, крышка с резиновой прокладкой. Водопаровая камера из специальной высококачественной; стали предназначена для получения пара. Предназначенный для стерилизации материал помещают в стерилизационную камеру. Массивная крышка с резиновой прокладкой наглухо закрывает водопаровую камеру.
Крышку к корпусу прикрепляют болтами и сверху зажимают барашковыми гайками. Наружный кожух предохраняет автоклав от механических повреждений.
К автоклаву придается арматура: манометр с сифонной трубкой и трехходовым краном, водомерная стеклянная трубка для измерения уровня воды в водопаровой камере автоклава, предохранительный клапан для предупреждения чрезмерного повышения давления в автоклаве, воздушный и спускной краны для удаления воздуха в начале стерилизации и для удаления конденсата из стерилизационной камеры.

Методы контроля эффективности стерилизации
В комплексе мероприятий по стерилизации изделий медицинского назначения важное значение имеет организация и проведение контроля за ее эффективностью. Используемые до настоящего времени методы и средства контроля не всегда позволяют выявить дефекты стерилизации, что влечет за собой повышение уровня внутрибольничных инфекций.
Контроль эффективности работы стерилизационного оборудования осуществляется физическими, химическими и биологическим (бактериологическим) методами. Надежность этих методов неодинакова. Физические и химические методы предназначены для оперативного контроля и позволяют контролировать соблюдение параметров режимов паровой, газовой, воздушной стерилизации, температуру, давление, экспозицию. Недостаток этих методов заключается в том, что они не могут служить доказательством эффективной стерилизации. Достоверным для определения эффективности является только бактериологический метод.
Физические методы
Физические методы контроля осуществляются с помощью средств измерения температуры (термометры, термопары), давления (манометры, мановакуумметры) и времени (таймеры). Современные стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные параметры каждого цикла стерилизации.
Современные стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные параметры каждого цикла стерилизации.
Химические методы
В течение десятков лет для проведения химического контроля применялись химические вещества, изменяющие свое агрегатное состояние или цвет при температуре, близкой к температуре стерилизации (бензойная кислота для контроля паровой стерилизации, сахароза, гидрохинон и ряд других веществ — для контроля воздушной стерилизации). При изменении цвета и расплавлении указанных веществ результат стерилизации признавался удовлетворительным. Однако многолетние наблюдения и данные литературы указывают, что при удовлетворительных результатах химического контроля с помощью названных индикаторов, бактериологический контроль в ряде случаев (до 12%) выявляет неудовлетворительный результат стерилизации.
Кроме того, эти вещества имеют существенный недостаток. Переход их в другое агрегатное состояние не дает представления о продолжительности воздействия температуры, при которой происходит их расплавление.
Принимая во внимание недостаточную достоверность использования указанных индикаторов для контроля, а также значительную трудоемкость и неудобство их практического применения, в 70-х годах были разработаны химические индикаторы, изменение цвета которых происходит при воздействии температуры, принятой для данного режима, в течение времени, необходимого для стерилизации. По изменению окраски этих индикаторов можно судить о том, что основные параметры процесса стерилизации — температура и время — выдержаны. Длительное применение таких индикаторов показало их высокую надежность.
Более сложные индикаторы предназначены для контроля критических параметров процесса стерилизации. Критическими параметрами являются: для парового метода стерилизации — температура, время воздействия данной температуры, водяной насыщенный пар; для воздушного метода стерилизации — температура и время воздействия данной температуры; для газовых методов стерилизации — концентрация используемого газа, температура, время воздействия, уровень относительной влажности; для радиационной стерилизации — полная поглощенная доза.
До конца 80-х годов не существовало стандартов на выпускаемые различными фирмами химические индикаторы и не было попыток классифицировать их. Лишь в 1995 году международная организация по стандартизации (ISO) опубликовала документ «Стерилизация медицинских изделий. Химические индикаторы. Часть 1».
С января 2002 года в России введен в действие ГОСТ Р ИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования». Согласно этому документу химические индикаторы распределены на шесть классов.
Индикаторы 1-го класса являются индикаторами («свидетелями») процесса. Примером такого индикатора является термоиндикаторная лента, наклеиваемая перед проведением стерилизации на текстильные упаковки или стерилизационные коробки. Изменение цвета ленты указывает, что упаковка подверглась воздействию процесса стерилизации. Такие же индикаторы могут помещаться в наборы хирургических инструментов или операционного белья.
2-й класс индикаторов предназначен для использования в специальных тестовых процедурах, например, при проведении теста Бовье-Дика (Bowie-Dick test). Этот тест не контролирует параметры стерилизации, он оценивает эффективность удаления воздуха из камеры парового стерилизатора.
Этот тест не контролирует параметры стерилизации, он оценивает эффективность удаления воздуха из камеры парового стерилизатора.
Индикаторы 3-го класса являются индикаторами одного параметра. Они оценивают максимальную температуру, но не дают представления о времени ее воздействия. Примерами такого рода индикаторов являются описанные выше химические вещества.
4-й класс — это многопараметровые индикаторы. Они содержат красители, изменяющие свой цвет при сочетанном воздействии нескольких параметров стерилизации, чаще всего — температуры и времени. Примером таких индикаторов служат термовременные индикаторы для контроля воздушной стерилизации.
5-й класс — интегрирующие индикаторы. Эти индикаторы реагируют на все критические параметры метода стерилизации. Характеристика этого класса индикаторов сравнивается с инактивацией высокорезистентных микроорганизмов.
6-й класс — индикаторы-эмуляторы. Эти индикаторы должны реагировать на все контрольные значения критических параметров метода стерилизации.
Биологический метод
Наряду с физическими и химическими применяется бактериологический метод контроля стерилизации. Он предназначается для контроля эффективности стерилизационного оборудования. До недавнего времени для контроля паровой и воздушной стерилизации использовались пробы садовой земли, содержащей микроорганизмы, высокорезистентные к воздействию стерилизующих факторов. Однако устойчивость микроорганизмов в различных пробах неодинакова, что не позволяет стандартизировать результаты контроля.
В настоящее время для проведения бактериологического контроля используются биотесты, имеющие дозированное количество спор тест-культуры. Контроль эффективности стерилизации с помощью биотестов рекомендуется проводить 1 раз в 2 недели. В зарубежной практике принято применять биологическое тестирование не реже 1 раза в неделю.
В ряде случаев возникает необходимость проведения контроля с помощью биотестов каждой загрузки стерилизатора. Прежде всего, речь идет о стерилизации инструментов, используемых для выполнения сложных оперативных вмешательств, требующих применения высоконадежных стерильных материалов. Каждая загрузка имплантируемых изделий также должна подвергаться бактериологическому контролю. При этом использование простерилизованных материалов задерживается до получения отрицательных результатов контроля. Тех же принципов при определении периодичности контроля рекомендуется придерживаться в отношении газовой стерилизации, являющейся по сравнению с другими методами более сложной.
Каждая загрузка имплантируемых изделий также должна подвергаться бактериологическому контролю. При этом использование простерилизованных материалов задерживается до получения отрицательных результатов контроля. Тех же принципов при определении периодичности контроля рекомендуется придерживаться в отношении газовой стерилизации, являющейся по сравнению с другими методами более сложной.
Перевязочный материал — материал, применяемый во время операций и перевязок для осушения ран и полостей, защиты их от вторичного инфицирования, дренирования, а также тампонады с целью остановки кровотечения. П. м. изготавливают из несинтетических и синтетических, тканых и нетканых материалов. К перевязочному материалу относят марлю, вату, лигнин, полимерные пленки и сетки, вискозное полотно и др. П. м. может быть асептическим, антисептическим (содержит антисептик), гемостатическим (содержит гемостатический препарат). Изготовленные из П. м. тампоны, турунды, салфетки, бинты и другие готовые к применению изделия называются перевязочными средствами (рис. 1—3). Перевязочные материалы и средства должны хорошо впитывать и испарять влагу; не замедлять регенераторные процессы в ране, не вызывать аллергических реакций и не оказывать других вредных воздействий на организм; обладать достаточной прочностью и эластичностью; не изменять своих свойств при стерилизации, контакте с лекарственными препаратами и раневым отделяемым.
1—3). Перевязочные материалы и средства должны хорошо впитывать и испарять влагу; не замедлять регенераторные процессы в ране, не вызывать аллергических реакций и не оказывать других вредных воздействий на организм; обладать достаточной прочностью и эластичностью; не изменять своих свойств при стерилизации, контакте с лекарственными препаратами и раневым отделяемым.
Марля — редкая сеткообразная ткань, изготавливаемая из льняного, хлопчатобумажного и вискозного волокна. Она легко впитывает воду, обладает достаточной прочностью и эластичностью. Отбеленная вискозная марля отличается шелковистостью, но имеет худшие гигроскопические и тепловые свойства, меньшую стойкость к некоторым лекарственным средствам и более высокую воспламеняемость. Помимо этого, во влажном состоянии она теряет прочность и может разрушаться после автоклавирования. Гигроскопичность марли определяют, опуская в воду два ее куска размером 55 см. При хорошей гигроскопичности они быстро намокают и тонут не менее чем за 10 с, впитывая двойное по массе количество воды (определяется взвешиванием). При контакте с вязким фибринозно-гнойным экссудатом марля через 8 ч утрачивает гигроскопичность, что является существенным недостатком, т.к. требуется частая смена повязки при лечении гнойных ран. Для повышения дренирующих свойств ее смачивают гипертоническим раствором натрия хлорида, пропитывают гидрофильными мазями на основе полиэтиленгликоля (левосином, левомеколем, диоксиколем). Это способствует созданию высокого осмотического давления, которое увеличивает отток жидкости из раны в повязку. Кроме того, ввиду высокой адгезии (прилипания) марли к стенкам раны замедляются регенераторные процессы; перевязки болезненны, при этом травмируются грануляции, в результате чего может возникнуть вторичное кровотечение. Отбеленную марлю выпускают в рулонах шириной 64, 84 и 90 см, длиной не менее 100 м и комплектуют в кипы массой не более 80 кг. Изготавливают также гигроскопическую антисептическую и гемостатическую марлю. Антисептическую марлю импрегнируют стрептомицином, фурацилином или пропитывают перед употреблением для придания антисептических свойств йодопироном, хлоргексидином, хлорамином и др.
При контакте с вязким фибринозно-гнойным экссудатом марля через 8 ч утрачивает гигроскопичность, что является существенным недостатком, т.к. требуется частая смена повязки при лечении гнойных ран. Для повышения дренирующих свойств ее смачивают гипертоническим раствором натрия хлорида, пропитывают гидрофильными мазями на основе полиэтиленгликоля (левосином, левомеколем, диоксиколем). Это способствует созданию высокого осмотического давления, которое увеличивает отток жидкости из раны в повязку. Кроме того, ввиду высокой адгезии (прилипания) марли к стенкам раны замедляются регенераторные процессы; перевязки болезненны, при этом травмируются грануляции, в результате чего может возникнуть вторичное кровотечение. Отбеленную марлю выпускают в рулонах шириной 64, 84 и 90 см, длиной не менее 100 м и комплектуют в кипы массой не более 80 кг. Изготавливают также гигроскопическую антисептическую и гемостатическую марлю. Антисептическую марлю импрегнируют стрептомицином, фурацилином или пропитывают перед употреблением для придания антисептических свойств йодопироном, хлоргексидином, хлорамином и др. Гемостатическую марлю пропитывают треххлористым или полуторахлористым железом. С гемостатической целью применяют марлю из оксицеллюлозы, гемостатическую фибринную пленку. Из гигроскопической марли делают бинты, салфетки, тампоны, турунды и шарики.
Гемостатическую марлю пропитывают треххлористым или полуторахлористым железом. С гемостатической целью применяют марлю из оксицеллюлозы, гемостатическую фибринную пленку. Из гигроскопической марли делают бинты, салфетки, тампоны, турунды и шарики.
Бинты — скатанные в виде валика длинные полосы марли различной ширины, используемые для укрепления повязок. Они выпускаются нестерильными в упаковке по 20—30 штук или стерильными в упаковке из пергаментной бумаги, пригодные для длительного хранения. Наиболее широко распространены бинты следующих размеров (см): 161000; 14700; 10500; 7500; 5500. Чтобы повязка лежала прочно и правильно, следует выбирать ширину бинта в зависимости от размеров бинтуемой анатомической области: для туловища рекомендуют бинт шириной 10—16 см, для конечностей — 10—14 см, для головы — 5—7 см, для пальцев и кисти — 5 см.
Салфетки — прямоугольные стерильные куски марли (размерами 1416; и 3345 см), сложенные в 3—4 слоя таким образом, чтобы их края были завернуты внутрь для предупреждения осыпания и попадания нитей в рану. Салфетки применяют для осушения раны или полости, для отгораживания операционного поля и дополнительного изолирования его при вскрытии различных полостей (абсцессов, флегмон, полых органов и др.).
Салфетки применяют для осушения раны или полости, для отгораживания операционного поля и дополнительного изолирования его при вскрытии различных полостей (абсцессов, флегмон, полых органов и др.).
Тампоны — длинные полосы марли (до 50 см) различной ширины (до 10 см), также сложенные в 3—4 слоя с завернутыми внутрь краями. Их используют для ограничения операционного поля, тампонады ран с целью остановки кровотечения и реже для дренирования. Узкие полоски марли шириной 2 см и длиной до 10—15 см называют турундами. Их делают так же, как и тампоны, применяют для осушивания и дренирования свищей и узких ран.
Марлевые шарики — небольшие кусочки марли (55; 1010 см), сложенные в несколько слоев в виде треугольника или четырехугольника и применяемые для осушивания ран и полостей, обработки рук хирурга и кожи в области операционного поля. Иногда для этих целей делают ватно-марлевые шарики, заворачивая комочки гигроскопической ваты в небольшие кусочки марли.
Вата — нетканный материал, состоящий из беспорядочно переплетающихся между собой волокон. Вату для медицинских целей делают из хлопка, из хлопка с добавлением вискозного волокна или из 100% вискозного штапеля. Синтетическая вата имеет худшую гигроскопичность и термостойкость и редко применяется в качестве перевязочного материала. Медицинская вата бывает 2 видов — простая (необезжиренная, серая) и гигроскопическая (белая). Серая вата не гигроскопична, плохо пропускает пар и при стерилизации в автоклаве в глубине ватного рулона могут сохраниться патогенные микроорганизмы. Поэтому применяется она в хирургии как мягкая подкладка при наложении гипсовых повязок или шин, а также как теплоизолирующий материал (согревающие компрессы). Для перевязок используют только стерильную гигроскопическую вату. Она обладает высокой всасывающей способностью и увеличивает поглощающие свойства повязок. В повязке вату прокладывают между слоями марли. Гигроскопическую вату используют также для приготовления ватно-марлевых тампонов, шариков для обработки кожи растворами антисептиков и смазывания ее клеолом. Вата из нейтрализованной солями кальция и натрия оксицеллюлозы обладает гемостатическими свойствами.
Вата из нейтрализованной солями кальция и натрия оксицеллюлозы обладает гемостатическими свойствами.
Лигнин — особым способом обработанная древесина деревьев хвойных пород, выпускается в виде пластов тонкой гофрированной бумаги, обладает более высокими чем марля всасывающими свойствами, но не имеет широкого распространения ввиду малой прочности и эластичности.
Для оказания первой и доврачебной помощи в качестве асептической повязки применяют индивидуальный перевязочный пакет. Это стерильная повязка единого образца, заключенная в защитную оболочку. Она применяется с целью остановки кровотечения, предохранения раны (ожога) от вторичного инфицирования и воздействия неблагоприятных факторов окружающей среды. Индивидуальный перевязочный пакет состоит из бинта шириной 10 см и длиной 7 м, двух ватно-марлевых подушек 17,532 см, одна из которых фиксирована, а другая может передвигаться по бинту на заданное расстояние. После наложения повязки конец бинта закрепляют прилагаемой к пакету булавкой. Выпускают также готовые к употреблению стерильные марлевые бинты с ватно-марлевой подушечкой различных размеров, бактерицидную бумагу и пластырь для лечения ссадин и поверхностных ран, пакеты стерильной гигроскопической ваты.
Выпускают также готовые к употреблению стерильные марлевые бинты с ватно-марлевой подушечкой различных размеров, бактерицидную бумагу и пластырь для лечения ссадин и поверхностных ран, пакеты стерильной гигроскопической ваты.
Ассортимент перевязочных материалов и средств значительно расширяется в связи с использованием полимеров, которые имеют гладкую поверхность без ворса и поэтому не прилипают к стенке раны, легко и атравматично снимаются, не замедляют регенераторные процессы. Некоторые полимерные пленки содержат антисептические и гемостатические лекарственные препараты. Выпускают полимерные перфорированные пленки, пленочные повязки из полихлорвинила, двухслойный перевязочный материал из гладких полимерных волокон и др. Все эти материалы обладают ценным функциональным качеством — атравматичностью, но имеют худшие дренажные свойства по сравнению с ватно-марлевой повязкой.
Для фиксации широко используют марлевые бинты, лейкопластырь, клеол, коллодий, трубчатые трикотажные и эластичные сетчато-трубчатые («Рэтэласт») бинты и т. д. (см. Десмургия). Трубчатые и сетчато-трубчатые бинты благодаря эластичности материала растягиваются до нужной величины и надеваются на тот или иной участок тела поверх стерильного материала. Они плотно облегают тело, не распускаются при надрезании, могут быть использованы также в качестве давящей повязки и для удержания трансплантатов после кожной пластики. Винт «Рэтэласт» изготавливают нестерильным из резиновых и хлопчатобумажных нитей, свернутым в рулоны длиной 5—20 м и упакованным в полиэтиленовые пакеты. В зависимости от диаметра трубчатые бинты имеют 7 номеров и предназначены: № 1—2 — для пальцев, кисти и стопы; № 3—4 — для предплечья, плеча и голени: № 5—6 — для головы, бедра: № 7 — для груди, живота и таза. С целью компрессии при варикозном расширении подкожных вен или после флебэктомии широко применяют эластичные трикотажные бинты. При небольших поверхностных ранах используют бактерицидный лейкопластырь — пластырь с узкой полоской бактерицидной марли, наложенной в центре клейкой поверхности пластырной ленты.
д. (см. Десмургия). Трубчатые и сетчато-трубчатые бинты благодаря эластичности материала растягиваются до нужной величины и надеваются на тот или иной участок тела поверх стерильного материала. Они плотно облегают тело, не распускаются при надрезании, могут быть использованы также в качестве давящей повязки и для удержания трансплантатов после кожной пластики. Винт «Рэтэласт» изготавливают нестерильным из резиновых и хлопчатобумажных нитей, свернутым в рулоны длиной 5—20 м и упакованным в полиэтиленовые пакеты. В зависимости от диаметра трубчатые бинты имеют 7 номеров и предназначены: № 1—2 — для пальцев, кисти и стопы; № 3—4 — для предплечья, плеча и голени: № 5—6 — для головы, бедра: № 7 — для груди, живота и таза. С целью компрессии при варикозном расширении подкожных вен или после флебэктомии широко применяют эластичные трикотажные бинты. При небольших поверхностных ранах используют бактерицидный лейкопластырь — пластырь с узкой полоской бактерицидной марли, наложенной в центре клейкой поверхности пластырной ленты.
Для защиты ссадин и ушитых операционных ран от вторичного инфицирования пользуются различными препаратами, которые при высыхании образуют прочную эластичную пленку: лифузоль, фуропласт, пластубол, клей БФ-6, жидкость Новикова и др. Большинство из них обладают выраженной антибактериальной активностью. Однако пленкообразующие препараты не рекомендуют применять при выраженном воспалительном процессе, а также при загрязненных и кровоточащих ранах.
Перевязочный материал (марля, вата, трубчатые бинты и др.) стерилизуют в автоклавах (см. Стерилизация) под давлением 0,2 ± 0,02 МПа (2 ± 0,2 кгс/см2) в специальных металлических коробках (биксах), в упаковке из влагонепроницаемой бумаги или пергамента при температуре 132± 2° в течение 20—22 мин. Срок сохранения стерильности материала в невскрытых биксах и упаковках до 3 суток с момента окончания стерилизации. Синтетические П. м., как правило, стерилизуют в заводских условиях. Нестерильный перевязочный материал для хранения складывают в специальный шкаф, расположенный не ближе 1 м от нагревательных приборов. Помещение для хранения перевязочного материала должно хорошо вентилироваться и не иметь повышенной влажности.
Помещение для хранения перевязочного материала должно хорошо вентилироваться и не иметь повышенной влажности.
Перевязочный материал и операционное белье стерилизуют в биксах. Применяют три вида укладки бикса: • универсальная укладка • целенаправленная укладка • видовая укладка Универсальная – укладывают материал и белье для одной небольшой, типичной операции. Этот вид укладки используют при работе в перевязочных и при малых операциях. Укладку производят по секторам. Бикс делят на секторы, которые заполняются определенным видом материала или белья: в один сектор помещаются салфетки, в другой – шарики, в третий – тампоны и т. д. Целенаправленная – укладывают материал и белье для определенной операции. Например, для аппендэктомии, резекции желудка. В бикс укладывается набор перевязочного материала и белья, необходимый для осуществления операции. Видовая – укладывают определенный вид материала или белья. Этот вид укладки применяют в операционных, где выполняется большое количество различных операций. Укладка осуществляется следующим образом – в один бикс хирургические халаты, в другой – простыни, в третий – салфетки и т. д. Укладку бикса осуществляют следующим образом. Проверяют исправность бикса. Протирают дно, стенки, крышку бикса вначале изнутри, а затем снаружи 0,5 % нашатырным спиртом. На боковой стенке бикса круговую пластинку (поясок герметичности), сдвигают так, чтобы открыть боковые отверстия. Бикс выстилается сложенной вдвое простыней, при этом концы её должны свисать наружу. На дно бикса кладут индикатор контроля стерильности. Перевязочный материал и белье укладывают в бикс рыхло, вертикально, по секторам или послойно. Каждый предмет кладут так, чтобы легко было достать, не нарушая укладку. В середину бикса кладут ещё индикатор контроля стерильности. Края простыни выстилающей бикс заворачивают один на другой. Сверху ближе к замку бикса кладут еще один контрольный индикатор. Закрывают крышку бикса на замок. К ручке бикса крепят бирку – паспорт. Этап 3 – стерилизация. Перевязочный материал и белье стерилизуют автоклавированием при стандартных режимах.
Укладка осуществляется следующим образом – в один бикс хирургические халаты, в другой – простыни, в третий – салфетки и т. д. Укладку бикса осуществляют следующим образом. Проверяют исправность бикса. Протирают дно, стенки, крышку бикса вначале изнутри, а затем снаружи 0,5 % нашатырным спиртом. На боковой стенке бикса круговую пластинку (поясок герметичности), сдвигают так, чтобы открыть боковые отверстия. Бикс выстилается сложенной вдвое простыней, при этом концы её должны свисать наружу. На дно бикса кладут индикатор контроля стерильности. Перевязочный материал и белье укладывают в бикс рыхло, вертикально, по секторам или послойно. Каждый предмет кладут так, чтобы легко было достать, не нарушая укладку. В середину бикса кладут ещё индикатор контроля стерильности. Края простыни выстилающей бикс заворачивают один на другой. Сверху ближе к замку бикса кладут еще один контрольный индикатор. Закрывают крышку бикса на замок. К ручке бикса крепят бирку – паспорт. Этап 3 – стерилизация. Перевязочный материал и белье стерилизуют автоклавированием при стандартных режимах. Этап 4 – хранение стерильного материала. Боковые отверстия простерилизованного бикса должны быть закрыты. Биксы со стерильным материалом хранятся отдельно от биксов с нестерильным. После стерилизации хранить не вскрытый бикс можно 3 суток, после вскрытия 1 сутки. Неиспользованные биксы подвергаются повторной стерилизации.
Этап 4 – хранение стерильного материала. Боковые отверстия простерилизованного бикса должны быть закрыты. Биксы со стерильным материалом хранятся отдельно от биксов с нестерильным. После стерилизации хранить не вскрытый бикс можно 3 суток, после вскрытия 1 сутки. Неиспользованные биксы подвергаются повторной стерилизации.
Современные методы стерилизации — Мегаобучалка
К современным методам стерилизации по праву можно отнести гласперленовый метод предназначен для быстрой стерилизации небольших цельнометаллических инструментов, не имеющих полостей, каналов и замковых частей. Метод крайне прост — инструмент погружается в среду мелких стеклянных шариков, нагретых до температуры 190 — 2900С (таким образом, чтобы над рабочей поверхностью инструмента оставался слой шариков не менее 10 мм) на 20 — 180 секунд, в зависимости от размера и массы инструмента.
Этот метод используется, в основном, стоматологами для экспресс-стерилизации мелких инструментов — боров, пульпоэкстракторов, корневых игл, алмазных головок и др. , а также рабочих частей более крупных — зондов, гладилок, экскаваторов, шпателей и т.д. Так же можно стерилизовать акупунктурные иглы.
, а также рабочих частей более крупных — зондов, гладилок, экскаваторов, шпателей и т.д. Так же можно стерилизовать акупунктурные иглы.
Преимущества метода — короткое время стерилизации и отсутствие расходных материалов.
Для термолабильных медицинских изделий (эндоскопы и принадлежности к ним, диализаторы, катетеры и т.п.) наиболее приемлемым является метод газовой стерилизации. Для этого используются химические соединения, обладающие безусловным спороцидным действием: окись этилена, бромистый метил, смесь окиси этилена и бромистого метила (смесь ОБ) и формальдегид. Несмотря на то, что окись этилена является токсическим веществом (при однократном воздействии проявляет себя как малоопасное вещество 4-го класса опасности, при постоянном воздействии — как вещество 2-го класса опасности), она чрезвычайно популярна в качестве стерилизующего агента. Однако, ее токсичность вынуждает проводить дегазацию стерильных изделий (с дожиганием выделяющейся окиси этилена — она весьма горюча).
Газовая стерилизация — метод значительно более сложный, чем традиционные методы стерилизации паром и горячим воздухом. При этом необходимо на строго определенном уровне поддерживать температуру, влажность, концентрацию стерилизующего газа, давление и экспозицию.
Самым известным этиленоксидным стерилизатором является установка «Комбимат» . Стерилизация проводится при температуре 42 — 550С за 60 — 90 минут. Результат практического использования показывает значительное превосходство этиленоксидного метода стерилизации над альтернативными в универсальности, экономичности, ремонтопригодности и технической обеспеченности. Применение данного метода для стерилизации высокоточной термолабильной медицинской аппаратуры получило высокую оценку специалистов ЦСО Центральной Клинической Больницы (Москва) , где этиленоксидные стерилизаторы применяются более 20-ти лет. По заключению специалистов, применение этиленоксидной стерилизации позволяет обеспечить своевременную стерилизацию всего объема термолабильной аппаратуры и инструментария, имеющегося в данном ЛПУ, снизить капитальные затраты на оборудование, текущие затраты на закупку расходных материалов, повысить производительность оборудования, оборачиваемость стерилизуемых изделий и продлить сроки их эксплуатации.
Рисунок 1
Стерилизация термолабильных изделий формальдегидом стоит на втором месте после этиленоксида. Оптимальный диапазон температуры при формальдегидной стерилизации должен быть 60 — 800С, давление — от 0,25 до 0,475 бар, при концентрации формальдегида от 8 до 15 мг/л. Реально формальдегид используется в концентрации около 30 мг/л, экспозиция до 60 минут; при этом общая продолжительность цикла составляет 3,5 часа (с учетом дегазации простерилизованных изделий (аэрации)).
Наиболее популярным аппаратом для формальдегидной стерилизации является установка «Формомат». Пару лет назад стерилизатор подвергся модернизации и теперь выпускается под маркой «Евро-Формомат».
Рисунок 2
Так называемая плазменная стерилизация, действующим стерилизантом которой являются пары перекиси водорода в сочетании с низкотемпературной плазмой, представляющей собой продукты распада пероксида водорода (гидроксильные группы ОН, ООН), образующиеся под воздействием электромагнитного излучения с выделением видимого и ультрафиолетового излучения, в настоящее время находится в стадии становления и, возможно, со временем получит определенное распространение в учреждениях здравоохранения. Пероксид водорода и плазма не обладают такими проникающими способностями, как этиленоксид, но имеют большое преимущество — распадается на нетоксичные продукты — воду и кислород, не оказывая вредного воздействия на окружающую среду.
Пероксид водорода и плазма не обладают такими проникающими способностями, как этиленоксид, но имеют большое преимущество — распадается на нетоксичные продукты — воду и кислород, не оказывая вредного воздействия на окружающую среду.
Стерилизация проводится при температуре 46 — 500С за 54 — 72 минуты. На сегодняшний день отсутствуют общепризнанные международные стандарты для данного метода. Имеются определенные ограничения в отношении стерилизации материалов, содержащих целлюлозу и каучук.
Высокая стоимость оборудования и расходных материалов сужает спектр применения данного метода стерилизации. Кроме того, стерилизация полых многоканальных изделий требует применения дополнительных расходных приспособлений, еще более увеличивающих стоимость цикла стерилизации.
Один из самых высоких потенциалов окисления имеет озон. Именно поэтому он уже давно привлекает внимание специалистов, занимающихся проблемами стерилизации. В течение многих лет озон используется для обеззараживания питьевой воды и воздуха, и лишь только недавно он был предложен для стерилизации в медицине. Стерилизация производится озоно-воздушной смесью, продуцируемой генератором озона из атмосферного воздуха. Однако, окислительная способность озона и ограничивает его спектр применения. При контакте с ним могут повреждаться изделия из стали, меди, резины и др. Кроме того, озон токсичен, а имеющиеся сегодня аппараты не позволяют обезопасить персонал от контакта с ним. Немаловажным обстоятельством является то, что повторяемость метода до сих пор под вопросом. Для контролирования процесса существуют только индикаторы первого класса (свидетели процесса).
Стерилизация производится озоно-воздушной смесью, продуцируемой генератором озона из атмосферного воздуха. Однако, окислительная способность озона и ограничивает его спектр применения. При контакте с ним могут повреждаться изделия из стали, меди, резины и др. Кроме того, озон токсичен, а имеющиеся сегодня аппараты не позволяют обезопасить персонал от контакта с ним. Немаловажным обстоятельством является то, что повторяемость метода до сих пор под вопросом. Для контролирования процесса существуют только индикаторы первого класса (свидетели процесса).
Рисунок 3
Стерилизантом при радиационной стерилизации является проникающее гамма- или бета-излучение. Наиболее широко используется гамма-излучающий изотоп кобальта-60, реже изотоп цезия-137, в связи с его низким уровнем энергии и излучения. Бета-излучающие изотопы используются вообще крайне редко, так как бета-излучение обладает гораздо меньшей проникающей способностью.
Эффективность радиационной стерилизации зависит от общей дозы излучения и не зависит от времени. Средняя летальная доза для микроорганизмов всегда одинакова, проводится ли облучение при низкой интенсивности в течение длительного промежутка времени или недолго при высокой интенсивности излучения. Доза 25 кГр (2,5 Мрад) надежно гарантирует уничтожение высокорезистентных споровых форм микроорганизмов.
Средняя летальная доза для микроорганизмов всегда одинакова, проводится ли облучение при низкой интенсивности в течение длительного промежутка времени или недолго при высокой интенсивности излучения. Доза 25 кГр (2,5 Мрад) надежно гарантирует уничтожение высокорезистентных споровых форм микроорганизмов.
Радиационная стерилизация обладает рядом технологических преимуществ: высокая степень инактивации микроорганизмов, возможность стерилизации больших партий материалов, автоматизация процесса, возможность стерилизации материалов в любой герметичной упаковке (кроме радионепрозрачной). Немаловажным обстоятельством является то, что температура стерилизуемых изделий в ходе стерилизации не повышается.
Заключение
Подводя итоги, следует отметить следующее. Уничтожение микроорганизмов физическими и химическими методами, которые используются при стерилизации медицинских изделий, подчиняется экспоненциальному закону. Это означает, что неизбежно имеется конечная вероятность того, что микроорганизм может выживать независимо от степени проведенной обработки. Для конкретной обработки вероятность выживания определена количеством и типами микроорганизмов и условиями их существования до и во время обработки. Следовательно, стерильность любого изделия в ряду изделий, подвергнутых стерилизации, может выражаться только в терминах вероятности существования нестерильного изделия.
Для конкретной обработки вероятность выживания определена количеством и типами микроорганизмов и условиями их существования до и во время обработки. Следовательно, стерильность любого изделия в ряду изделий, подвергнутых стерилизации, может выражаться только в терминах вероятности существования нестерильного изделия.
Применение современных стерилизантов, тепловая и холодная стерилизация гибкого инструментария после каждого исследования позволяют достигать высокого уровня дезинфекции и стерильности аппаратуры.
В качестве стерилизантов используют насыщенный высокотемпературный водяной пар (стерилизация паром), сухой горячий воздух (стерилизация жаром), химические вещества (стерилизация химическая), газ (стерилизация газовая), реже используют ионизирующие излучения (лучевая стерилизация), фильтрование через мелкопористые фильтры (механическая стерилизация), многократное прогревание жидкостей на водяной бане при 100 0С (дробная стерилизация) или 56 0С (тиндализация).Список использованной литературы:
1. ГОСТ Р ИСО 11135-2000 (Введен постановлением госстандарта РФ ОТ 27.10.2000 №279-СТ) «Валидация и текущий контроль стерилизации оксидом этилена.
ГОСТ Р ИСО 11135-2000 (Введен постановлением госстандарта РФ ОТ 27.10.2000 №279-СТ) «Валидация и текущий контроль стерилизации оксидом этилена.
2. Абрамова И.М. Пути оптимизации способов и средств предстерилизационной очистки, стерилизации и методов их контроля // Актуальные проблемы дезинфектологии в профилактике инфекционных и паразитарных заболеваний. Материалы Всероссийской научной конференции, посвященной 100-летию со дня рождения В.И.Вашкова / Под ред. М.Г.Шандалы. — М: ИТАР-ТАСС, 2002. -С. 31-37.
3. Абрамова И.М. Современные возможности выбора химических стерилизующих средств для изделий медицинского назначения из термолабильных материалов в лечебно-профилактических учреждениях // Дезинфекционное дело, 2003. — № 2. — С. 35-38.
4. Благовидов Д.Ф., Зарубин Г.Л., Федяев Б.П., Рубан Г.И. Вопросы контроля централизованной стерилизации в лечебно-профилактических учреждениях.// Журнал микробиологии. -1996.- № 10. -С. 129-133.
5. Вашков В.И. Средства и методы стерилизации, применяемые в медицине. -М.: Медицина, 1999.- 368 с.
-М.: Медицина, 1999.- 368 с.
6. Методические рекомендации по организации централизованных стерилизационных в лечебно-профилактических учреждениях. Утверждены Минздравом СССР 21.12.1989 г., №15-6/8.- М., 1989. -322 с.
7. Основы инфекционного контроля: Практическое руководство/ Американский международный союз здравоохранения. Пер. с англ., 2-е изд. — М.: Альпина Паблишер, 2003. — 478 с.
8. Прилуцкий В.И., Шомовская Н.Ю. Пути повышения устойчивости к коррозии металлических медицинских инструментов при обработке анолитом АНК с различной минерализацией и концентрацией оксидантов // Задачи современной дезинфектологии и пути их решения. Материалы Всероссийской научной конференции, посвященной 70-летию НИИ дезинфектологии Минздрава России. Часть 1. Под общей ред. М.Г.Шандалы. — М.: ИТАР-ТАСС, 2003. — С. 186-187.
9. Рамкова Н.В. Разработка условий стерилизации изделий медицинского назначения. Дезинфекция и стерилизация. Перспективы развития. Материалы Всесоюзной научной конференции. Волгоград, 1983.-С. 109-110.
Волгоград, 1983.-С. 109-110.
10. Рамкова Н.В. Стерилизация изделий медицинского назначения в профилактике внутрибольничных инфекций. Актуальные проблемы внутрибольничных инфекций. Российская научно-практическая конференция. — М., 1993.-243 с.
11. Рубан Г.И. Совершенствование стерилизационного дела в медицинских учреждениях: Автореф. дисс. канд. мед. наук., М., 1983.-182 с.
12. Руководство по инфекционному контролю в стационаре. Пер.с англ. / Под ред. Р.Венцеля, Т.Бревера, Ж-П.Бутцлера. — Смоленск: МАКМАХ, 2003. — 272 с.
13. Шандала М.Г. Дезинфектология как научная специальность // Дезинфекционное дело.- 2004. — № 4. — С. 25-27.
Новые методы дезинфекции и стерилизации
Новые методы дезинфекции включают в себя постоянное антимикробное покрытие, которое может быть применено как к живым, так и к неживым объектам (Сурфацин), дезинфицирующие средства с уменьшенным временем экспозиции (Ортофтальальдегид), а также противомикробное средство, которое может быть применено к живым и неживым объектам (Оксигенированная вода).
Новые методы стерилизации включают процесс химической стерилизации эндоскопов с интегрируемой системой очистки (Endoclens), биологические индикаторы быстрого чтения для стерилизации окисью этилена (Attest) и стерилизация низкотемпературной плазмой перикиси водорода, которая имеет более короткий временной цикл и улучшенную эффективность (Sterrad 50).
Необходимость соответствующих процедур дезинфекции подчеркивается множеством вспышек инфекционных заболеваний в результате неправильного обеззараживания предметов ухода за больными. Поскольку не все подобные предметы подлежат обязательной стерилизации, медицинские учреждения самостоятельно определяют, когда нужно проводить уборку, дезинфекцию и стерилизацию, основываясь как на интенсивности использования таких предметов, так и на стоимости проведения подобных мероприятий (во многих случаях это является определяющим фактором). В статье мы рассмотрим новые методы дезинфекции и стерилизации
Рациональный подход к проведению дезинфекции и стерилизации
Более 35 лет назад американский ученый Эрл Х. Сполдинг разработал подход к дезинфекции и стерилизации оборудования и предметов ухода за больными, этот подход был ясен, логичен и рационален и использовался и дополнялся специалистами в сфере дезинфекции на протяжении уже долгого времени. Сполдинг был уверен в том, что частота проведения дезинфекции предмета должна напрямую зависеть от интенсивности его использования. Им были описаны три категории объектов дезинфекции «Критические», «Полукритические», «Некритические». Предметы, относящиеся в категорию «Критических» (те, что должны проникать в стерильные ткани или сосудистую систему пациента, или те через которые проходят потоки крови, имплантируемые устройства), должны быть стерильны в момент использования. «Полукритические» предметы (контактирующие со слизистыми оболочками, поврежденными участками кожи, к примеру эндоскопы, оборудование для дыхательной терапии, диафрагмы) требуют дезинфекцию высокого уровня (т.е. уничтожение всех микроорганизмов, исключая большое число бактериальных спор).
Сполдинг разработал подход к дезинфекции и стерилизации оборудования и предметов ухода за больными, этот подход был ясен, логичен и рационален и использовался и дополнялся специалистами в сфере дезинфекции на протяжении уже долгого времени. Сполдинг был уверен в том, что частота проведения дезинфекции предмета должна напрямую зависеть от интенсивности его использования. Им были описаны три категории объектов дезинфекции «Критические», «Полукритические», «Некритические». Предметы, относящиеся в категорию «Критических» (те, что должны проникать в стерильные ткани или сосудистую систему пациента, или те через которые проходят потоки крови, имплантируемые устройства), должны быть стерильны в момент использования. «Полукритические» предметы (контактирующие со слизистыми оболочками, поврежденными участками кожи, к примеру эндоскопы, оборудование для дыхательной терапии, диафрагмы) требуют дезинфекцию высокого уровня (т.е. уничтожение всех микроорганизмов, исключая большое число бактериальных спор). Категория «Некритические» (судна, манжеты, прикроватные тумбочки и т.д.) требуют только дезинфекцию низкого уровня.
Категория «Некритические» (судна, манжеты, прикроватные тумбочки и т.д.) требуют только дезинфекцию низкого уровня.
Ортофтальальдегид: Новое химическое средство стерилизации
Ортофтальальдегид – прозрачная, светло-синего цвета жидкость (pH 7.5), выпускается обычно в концентрации 0.55% по ДВ. Ортофтальальдегид показа отличную антимикробную активность в лабораторных исследованиях. К примеру, он показал гораздо более высокую антимикробную активность (5-log10 снижение численности колонии за 5 минут) в сравнении с глутаральдегидом. Среднее время для достижения 6-log10 снижения численности колонии бактерий M. Bovis, при использовании 0,21% Ортофтальальдегида составило 5 минут, в сравнении с 32 минутами, при использовании 1.5% раствора глутаральдегида. При тестировании активности препарата против широкого спектра микроорганизмов, глутаральдегид-резистентных бактерий и спор Bacillus subtilis, Ортофтальальдегид показал высокую активность против тестируемых бактерий, включая глутаральдегид-резистентные штаммы, но 0. 5% раствор Ортофтальальдегида не показал спорацидной активности при экспозиции 270 минут. Увеличение pH c 6.5 до 8 увеличило спорацидную активность вещества. Ортофтальальдегид имеет несколько потенциальных преимуществ в сравнении с глутаральдегидом. Он не требует активации, не вызывает раздражения слизистых оболочек глаз и полостей носа, имеет высокую стабильность при уровне pH от 3 до 9, не требует мониторинга экспозиции и практически не имеет запаха. Как и глутаральдегид, ортофтальальдегид имеет хорошую совместимость с различными метериалами. Потенциальный минус вещества в том, что оно окрашивает белки в серый цвет (включая незащищенный участки кожи), эта проблема решается сопутствующим предупреждением об этом для персонала, пользующегося препаратом (т.е. использования средств защит, перчаток, очков и т.д.). Ограниченные клинические исследования показали, что в 100 случаях стерилизации эндоскопов ортофтальальдегидом с экспозицией 5 минут было достигнуто снижение популяции колоний бактерий более чем на 5-log10 и ортофтальальдегид был эффективен в течение 14-дневного цикла использования. По данным производителя при стерилизации автоматических репроцессоров эндоскопов действие ортофтальальдегида до снижения его эффективной концентрации (около 82 циклов использования) будет длиться дольше в сравнении с глутаральдегидом (до 40 циклов использования).
5% раствор Ортофтальальдегида не показал спорацидной активности при экспозиции 270 минут. Увеличение pH c 6.5 до 8 увеличило спорацидную активность вещества. Ортофтальальдегид имеет несколько потенциальных преимуществ в сравнении с глутаральдегидом. Он не требует активации, не вызывает раздражения слизистых оболочек глаз и полостей носа, имеет высокую стабильность при уровне pH от 3 до 9, не требует мониторинга экспозиции и практически не имеет запаха. Как и глутаральдегид, ортофтальальдегид имеет хорошую совместимость с различными метериалами. Потенциальный минус вещества в том, что оно окрашивает белки в серый цвет (включая незащищенный участки кожи), эта проблема решается сопутствующим предупреждением об этом для персонала, пользующегося препаратом (т.е. использования средств защит, перчаток, очков и т.д.). Ограниченные клинические исследования показали, что в 100 случаях стерилизации эндоскопов ортофтальальдегидом с экспозицией 5 минут было достигнуто снижение популяции колоний бактерий более чем на 5-log10 и ортофтальальдегид был эффективен в течение 14-дневного цикла использования. По данным производителя при стерилизации автоматических репроцессоров эндоскопов действие ортофтальальдегида до снижения его эффективной концентрации (около 82 циклов использования) будет длиться дольше в сравнении с глутаральдегидом (до 40 циклов использования).
Сурфацин: Новое антимикробное действующее вещество
Передача некоторых возбудителей внутрибольничных заболеваний, главным образом, устойчивых к ванкомицину Enterococcus spp (VRE), метициллин-устойчивых Staphylococcus aureus, Clostridium difficile (MRSA) связана с заражением ими поверхностей. Передача заболеваний производится косвенным контактом персонала медучреждения с больными или зараженными поверхностями. Исследование проб с поверхностей в больничных палатах зараженных VRE дали положительный результат в 7-37% случаев. Молекулярный анализ штаммов, участвующих во вспышках заболеваний в ряде случаев продемонстрировал, что изоляты, полученные из окружающей среды были идентичны этим штаммам.
Резистентные к антибиотикам патогенны, такие как VRE и MRSA обладают схожей восприимчивостью к дезинфикантам, что и нерезистентные к антибиотикам штаммы. Однако, дезинфиканты, которые обычно используются, к примеру, фенолы или четвертично аммониевые соединения, хоть и эффективны при уничтожении таких патогенов, но не обладают остаточной активностью. Следовательно, после проведения дезинфекции поверхности могут быть заражены вторично достаточно быстро.
Сурфацин – новое, стойкое антимикробное действующее вещество, которое можно использовать как на живых, так и на неживых объектах. Он включает водонерасворимые интимикробные соединения (Иодид серебра) в составе покрытия для поверхностей (модифицированный полигексаметилен бигуанид), способный химически распознавать и взаимодействовать двуслойными липидами бактериальных клеточных мембран с помощью электростатического притяжения. Близкий контакт поверхностей с микробами приводит к передаче антибактериального компонента (серебро) напрямую от покрытия к микроорганизму. Микроорганизмы, контактирующие микроорганизмы накапливают серебро до того момента, пока необходимый уровень токсичности не будет достигнут; мертвые бактерии в конечном счета разрушаются и «открепляются» от поверхности. Количество серебра и количество микроорганизмов, контактирующих с обработанными поверхностями, определяет то, как долго покрытие будет эффективным.
Предварительные исследования показывают, что обработанные поверхности дают хороший эффект в уничтожении резистентных к антибиотикам бактерий, помещенных напрямую на различные поверхности с различным уровнями сложности 100 CFU/кв. см. на протяжении 13 дней. Антимикробная активность сохраниласть при сухой чистке и влажной чистке, с использованием четвертично аммониевых соединений. По данным производителя продемонстрировано удаление бактерий, грибов, дрожжей и вирусов при нанесении препарата на поверхности с уровнем сложности 106 СFU/мл. Устойчивая антимикробная активность была продемонстрирована на тестируемых микроорганизмах. При этом, время удаления микроорганизмов варьируется.
Новое действующее вещество может наноситься на поверхности методами погружения, протирания, орошения, без предварительной обработки этих поверхностей. Покрытие не подвергается фоторедукции, деградации и не приводит к изменению цвета обработанной поверхности при воздействии интенсивного ультрафиолетового излучения. Препарат сцепляется фактически с любыми материалами, он не отслаивается и не трескается. Обработанные поверхности, подвергнутые тесту, в ходе которого были очищены механически, сохранили свою антибактериальную активность. Окончательно обработанные поверхности оставались химически инертны и сохранили свою биоцидную активность после различных физических и химических воздействий, таких как температура (тестировалась температура от -20oС до +130oС), растворители (спирт), вещества с pH от 4 до 10, вещества с высокой ионной силой, стерилизация обычными методами (паром, оксидом этилена, гамма излучением). Покрытие содержащие малое количество иодида серебра (примерно 10 мкг/кв. см покрытой поверхности) и покрытые поверхности резистентны к образованию биопленки. Препарат не токсичен для млекопитающих.
Новый дезинфекант: Оксигенированная вода
Концепция электролиза соли для создания дезинфицирующего средства привлекательна тем, что основные материалы и электроэнергия дешевы, а конечный продукт – вода не загрязняет окружающую среду. Механизм действия не достаточно ясен, возможно он является разновидностью окисляющих препаратов. Основными действующими веществами являются хлорноватистая кислота в концентрации, с примерной концентрацией 144 мг/л и свободные радикалы хлора. Это дезинфицирующее средство производится путем пропускания физраствора через электроды с титановым покрытием при силе тока в 9 А. Получаемое вещество имеет pH 5.0 – 6.5 окислительно-восстановительный потенциал > 950 мВ. Оборудование для производства вещества может быть дорогим, так как такие параметры как pH и окислительно-востановительные потенциал должны тщательно отслеживаться. Вещество, как показано, является нетоксичными для биологических тканей. Хотя, как заявлено, препарат не окисляет и не повреждает эндоскопы, один из производителей эндоскопов аннулировал гарантию на свою продукцию в случае проведения дезинфекции оборудования оксигенированной водой.
Антибактериальная активность была исследована на примере бактерий, микробактерий, вирусов, грибов и спор. Последние исследовния показали, что вновьпроизведенная оксиенированная вода, дает очень быстрый эффект (менее чем за 2 минуты) при уничтожении 5-log10 колонии микроорганизмов (Mycobacterium tuberculosis, M. chelonae, poliovirus, HIV, MRSA, Escherichia coli, Candida albicans, Enterococcus faecalis, Pseudomonas aeruginosa) при отсутствии нагрузки по органическим загрязнениям. Необходимы дальнейшие исследования для определения, возможно ли использовать оксигенированную воду в качестве альтернативы другим дезинфекантам.
Стерилизация. Отличия и особенности.
Мероприятия по профилактике внутрибольничных инфекций (ВБИ) – важная часть функционирования любой современной больницы. Решая эту задачу, больница обеспечивает высокое качество противоэпидемической помощи населению. Один из факторов передачи инфекции – различные изделия, которые нет возможности подвергать термической обработке. В этом случае приходится подбирать альтернативный способы стерилизации, чтобы обеспечить профилактику на должном уровне.
Особенно широко стали использовать неустойчивые к высоким температурам, хрупкие инструменты в последние годы в хирургии, офтальмологии, нейрохирургии и ряде других областей. Их обработка требует использования низкотемпературных способов стерилизации, чтобы инструменты не потеряли свои свойства. Аналогично обстоит дело и с перчатками, обеспечивающими защиту рук медицинского персонала.
Особенности стерилизации этилен оксидом
Этилен оксид – вещество, открытое в 1859 году Ш. Вюрцем. Его активное использование в качестве стерилизующего средства началось в 50-х годах двадцатого века. До этого благодаря высокой проникающей способности его с успехом применяли в качестве инсектицида.
Окись этилена обладает выраженными алкилирующими свойствами, благодаря чему оказывает губительное действие на протоплазмы, провоцируя свертывание белковых структур. Именно благодаря сильной алкилирующей способности обеспечивается хорошее противомикробное действие средства.
Этилен оксид или окись этилена – одно из наиболее изученных химических соединений, применяемый в стерилизации перчаток и медицинского инструментария. Газ способен оказывать спорицидное воздействие, у него высокая проникающая способность, благодаря чему обеспечивается качественное уничтожение микроорганизмов.
Окись этилена не способна привести к коррозии металла, его воздействие не снижает качество оптики, не изменяет пропускную способность различных материалов, включая полимеры, пластмассы. Благодаря этому свойству его можно использовать в медицинской практике для стерилизации многих видом инструментов.
Стерилизация перчаток с помощью этилен оксида – это простой, легко контролируемый метод. Он безопасен для пациентов, но возникает проблема с безопасностью для персонала.
Так, например, медицинский персонал, работающий с окисью этилена, должен быть хорошо знаком с правилами безопасности. Связано это с тем, что газ обладает канцерогенными свойствами, контакт с ним нежелателен. Также специалисты отмечают, что несоблюдение правил стерилизации ведет к нарушению стерильности инструментов, перчаток и других средств, применяемых в лечебном учреждении.
Стерилизация с помощью оксида этилена в США в последние годы постепенно выходит из обихода. Связано это с тем, что методика считается устаревшей, является опасной для персонала медицинского учреждения, возлагает на него слишком большую ответственность.
Обработка перчаток и другого медицинского инструмента с помощью окиси этилена стоит на трех основных элементах:
- огромная ответственность выполняющего стерилизацию персонала;
- дешевая металлическая коробка с простым таймером;
- использование большого количества расходных материалов.
По сути, как считают американские доктора и медицинский персонал, стерилизация окисью этилена устарела, в первую очередь, потому, что является почти полностью ручной. Это значит, что персонал самостоятельно проводит все манипуляции, подвергает себя опасности из-за необходимости контактировать с канцерогенным газом. А, между тем, канцерогенность оксида азота доказана.
Особенности радиационной стерилизации
Альтернативой довольно вредной для персонала стерилизации с помощью оксида этилена стала стерилизация с помощью радиации. Она может быть использована в отношении всех изделий, свойства которых не меняются под ее влиянием. Медицинские перчатки входят в этот перечень.
В радиационной стерилизации используется два вида излучения:
- Бета-излучение;
- Гамма-излучение.
В основном в качестве изотопа, дающего необходимый спектр, применяют изотоп кобальт-60. Также возможно – пусть и редко из-за невысокой излучательной способности – применение изотопа Цезия-137. Лучший эффект радиационный метод стерилизации дает при совместном использовании гамма- и бета-излучения, так как бета-излучение обладает меньшей проникающей способностью, чем гамма.
Основная особенность радиационного метода стерилизации состоит в том, что эффективность не зависит от времени стерилизации, но зависит от общей дозы излучения. То есть эффективность короткого, но сильного излучения будет сравнима с эффективностью длительного, но слабого излучения.
Радиационная стерилизация хорошо зарекомендовала себя в промышленной стерилизации различных изделий. Связано это с тем, что проводить процедуру можно даже с медицинским оборудованием, находящимся в упаковке. Подобный способ обработки подходит для изделий из полимеров, таких как перчатки, шприцы, системы для переливания крови и др. Радиационную стерилизацию также можно применять в обработке лекарственных препаратов, шовных материалов и др.
Чтобы оценить качество стерилизации с помощью радиоактивного излучения, применяются специальные тест-полоски, способные менять окраску при получении определенной дозы облучения. Их нанесение возможно как на внешнюю тару, так и на индивидуальную упаковку каждого изделия.
Преимущества и недостатки каждого метода
В России применяются как стерилизация с помощью этилен оксида, так и обработка медицинского инструментария радиационным методом. Каждый из способов имеет свои преимущества и недостатки, которые стоит учитывать, выбирая метод обработки.
| Этилен оксид | Радиационный метод |
Преимущества | Способность проникать в материал упаковки, каналы изделий Использование одноразовых картриджей, благодаря которым процесс утечки газа минимален Простота контроля эффективности стерилизации Возможность использовать на большом числе медицинских изделий | Высокая способность инактивировать микроорганизмы, а также некоторые вирусы. Возможность стерилизовать большеразмерные изделия в промышленных объемах Полная автоматизация всего процесса стерилизации, минимальное вмешательство человека Возможность стерилизации прямо в герметичной упаковке или таре |
Недостатки | После обработки требуется аэрация, чтобы удалить остатки окиси этилена Стерилизационные камеры имеют ограничение по объемам в зависимости от модели Требуется обработка водой и углекислым газом для снижения выделения окиси этилена в окружающую среду Существует опасность возгорания картриджа | Невозможность установки радиационного стерилизатора в условиях лечебного учреждения из-за его высокой стоимости, необходимости тщательно соблюдать технику безопасности. |
Радиационная стерилизация постепенно вытесняет стерилизацию с помощью этилен оксида. Объясняется это просто: первый метод более автоматизирован, более безопасен как для медицинского персонала, так и для окружающей среды. Этилен оксид – вещество, обладающее доказанными канцерогенными свойствами. Использование его в течение длительного времени способно привести к изменениям в структуре крови, развитию рака крови.
Да, стерилизацию радиационным методом нельзя выполнять прямо в условиях лечебного учреждения, но в сравнении с оксидом этилена это единственный ее недостаток.
Вернуться к списку публикаций
39.Современные методы дезинфектологии и стерилизации. Химический метод дезинфекции.
В качестве стерилизантов используют насыщенный высокотемпературный водяной пар (стерилизация паром), сухой горячий воздух (стерилизация жаром), химические вещества (стерилизация химическая), газ (стерилизация газовая).
К современным методам стерилизации по праву можно отнести гласперленовый метод предназначен для быстрой стерилизации небольших цельнометаллических инструментов, не имеющих полостей, каналов и замковых частей. Метод крайне прост — инструмент погружается в среду мелких стеклянных шариков, нагретых до температуры 190 — 2900С (таким образом, чтобы над рабочей поверхностью инструмента оставался слой шариков не менее 10 мм) на 20 — 180 секунд, в зависимости от размера и массы инструмента.
Для термолабильных медицинских изделий (эндоскопы и принадлежности к ним, диализаторы, катетеры и т.п.) наиболее приемлемым является метод газовой стерилизации. Для этого используются химические соединения, обладающие безусловным спороцидным действием: окись этилена, бромистый метил, смесь окиси этилена и бромистого метила (смесь ОБ) и формальдегид. Стерилизация термолабильных изделий формальдегидом стоит на втором месте после этиленоксида.
Так называемая плазменная стерилизация, действующим стерилизантом которой являются пары перекиси водорода в сочетании с низкотемпературной плазмой, представляющей собой продукты распада пероксида водорода (гидроксильные группы ОН, ООН), образующиеся под воздействием электромагнитного излучения с выделением видимого и ультрафиолетового излучения, в настоящее время находится в стадии становления.
Стерилизация производится озоно-воздушной смесью, продуцируемой генератором озона из атмосферного воздуха. Однако, окислительная способность озона и ограничивает его спектр применения. При контакте с ним могут повреждаться изделия из стали, меди, резины и др. Кроме того, озон токсичен, а имеющиеся сегодня аппараты не позволяют обезопасить персонал от контакта с ним.
40 Медицинские отходы. Классификация, правила сбора, утилизация.
Отходы ЛПУ делятся на 5 классов опасности. Три первых ранжируют отходы по степени эпидемиологической значимости, четвертый класс – токсикологически опасные отходы, пятый — радиационно опасные:
Класс А (неопасные).
Класс Б (опасные).
Класс В (чрезвычайно опасные).
Класс Г (отходы, близкие по составу к промышленным).
Класс Д (радиоактивные отходы).
Классифицирование отходов позволило ввести в действие систему раздельного сбора их по классам с последующей транспортировкой и уничтожением (утилизацией).
Отходы класса «А» собираются в одноразовые пакеты или многоразовые емкости. Правила сбора данного класса отходов аналогичны требованиям, предъявляемым к обычным твердым бытовым отходам.
Классы «Б» и «В» обязательно собираются в одноразовую упаковку. Транспортирование их вне пределов лечебного отделения в открытом виде запрещено.
Одноразовые пакеты с отходами классов «А», «Б», «В» проходят обязательную маркировку с нанесением кода подразделения ЛПУ, даты и фамилии ответственного за сбор отходов лица.
Класс «Г» — отходы, по своему составу близкие к промышленным.
Степень токсичности каждого их вида определена согласно Классификатору промышленных отходов и соответствующим методическим рекомендациям.
Сбор, хранение и удаление отходов класса «Д» осуществляется в соответствии с требованиями правил работы с радиоактивными веществами и другими источниками ионизирующих излучений.
Санитарные правила также предъявляют требования к местам сбора и временного хранения отходов (открытые площадки, внутрикорпусные помещения). Данным документом определен общий порядок проведения дезинфекции отходов и инвентаря с реализацией системы сбора и удаления отходов к местам установки контейнеров для временного хранения их, предупреждения распространения инфекций.
Планы по сбору и удалению отходов должны составляться для каждого ЛПУ отдельно, в зависимости от вида и типа учреждения и специфики профиля работы.
Одноразовая упаковка, контейнеры для сбора отходов, помещения для внутрикорпусного их сбора должны удовлетворять санитарно-гигиеническим и эпидемиологическим требованиям, а также правилам, исключающим возможность распространения инфекции.
При этом отходы классов «Б» и «В» должны быть подвергнуты обязательному термическому обезвреживанию.
Отходы класса «А» могут быть подвергнуты термическому обезвреживанию или вывезены на специальные полигоны.
Руководители ЛПУ по согласованию с ЦГСЭН должны утвердить инструкцию, регламентирующую правила безопасного обращения с отходами и определяющую личную ответственность персонала.
Отходы класса «Д», образующиеся в радиологических отделениях МО, загрязнённые радионуклидами, в соответствии с действующими санитарными нормативами, выдерживаются в хранилищах до полного распада, затем утилизируются на полигонах ТБО.
Обращение с отходами классов Г и Д регулируется нормативами для токсичных и радиоактивных отходов.
Методы стерилизации
Различают термические методы — физический: паровой, воздушный, гласперленовый (в среде нагретых шариков), а также ультрафиолетовое облучение воздуха помещений: перевязочных, процедурных, операционных. В клинической практике чаще всего применяются термические методы стерилизации, которые заключаются в воздействии пара под избыточным давлением и температуры стерилизации (автоклавирование) и воздействии сухого горячего воздуха, достигающего температуры стерилизации (используются сухожаровые шкафы разной модификации).
Химические методы стерилизации осуществляются растворами дезинфицирующих средств или газами изделий из полиэтилена, аппаратуры для искусственной вентиляции легких (ИВЛ), различных эндоскопов с волоконной оптикой. К химическому методу относится газовая стерилизация оксидом этилена, окисью пропилена, бромистым метилом и их смесью, а также пароформальдегид-ный метод.
Ультразвуковой метод стерилизации.
Стерилизация инфракрасным излучением.
Радиационный метод в (установке с источником излучения для промышленной стерилизации изделий однократного применения).
Выбор метода зависит от многих факторов, основными из которых являются:
324
Метод стерилизации
Критические параметры
Паровая
Время, температура, насыщенный пар
Воздушная (сухим теплом)
Время и температура
Оксидом этилена (ЭО)
Время, температура, влажность и концентрация ЭО
Радиационная
Полная поглощенная доза
Пароформальдегидная
Время, температура, влажность иконцентрация паров формальдегида
Централизованное стерилизационное отделение (ЦСО)
Стерилизация изделий медицинского назначения осуществляется в централизованных стерилизационных отделениях ЛПУ. В лечебно-профилактических учреждениях России действует технология стерилизации «Чистый инструмент». Такие системы предусматривают организацию потоков «грязных» и стерильных изделий, что полностью исключает возможность использования нестерильных изделий и обеспечивает полный контроль каждой единицы в пределах больницы. Главное место в организации и работе этих потоков занимают ЦСО, которые позволяют значительно улучшить качество обеззараживания и стерилизации медицинского инструментария.
ЦСО имеет три зоны: «грязную», «чистую» и «стерильную». Все зоны отделены стенами. Поступление материалов, изделий осуществляется через шлюзы в одном направлении по принципу «от грязного к чистому, стерильному» .
В «грязную» зону ЦСО поступает использованный материал, в том числе и прошедший этап дезинфекции на рабочих местах согласно требованиям нормативных документов. Тележки, на которых доставляется этот материал,
325
моются и дезинфицируются в специальной комнате ЦСО. Весь загрязненный материал принимается и сортируется, затем перемещается в комнаты для подготовки специальных инструментов, мойки, дезинфекции и предстерилиза-ционной очистки. Проводится контроль каждого этапа обработки изделий медицинского назначения, и изделия передаются в «чистую» зону. Хирургические перчатки после сортировки стираются и упаковываются вместе с тест-индикаторами процесса стерилизации. Все инструменты в «чистой» зоне проходят технический контроль изделий и упаковку в: биксы (стерилизационные коробки), бязевые упаковки, современные упаковочные материалы (см. далее) с размещением в контрольные точки термовременных индикаторов процесса стерилизации 4-го класса (см. далее). Укладка белья, склад чистых изделий проводится в «чистой» зоне. Пройдя технический контроль, упакованное белье и изделия автоклавируются и перемещаются через шлюз на стерильный склад, откуда производится выдача готовой стерильной продукции или ее складирование в пределах сроков стерилизации.
Невостребованные стерильные материалы возвращаются на склад чистых изделий.
Условия, обеспечивающие стерильность медицинских изделий в ЦСО
Основными условиями, обеспечивающими стерильность медицинских изделий в ЦСО, являются:
Зонирование технологического процесса и наличие разграничительных стен в отделении.
Транспортные потоки не пересекаются, исключается риск повторной контаминации стерильных медицин ских изделии.
Использование технических средств на операциях предстерилизационной (с применением современного моечного и дезинфекционного оборудования, в том числе оборудования проходного типа) и стерилиза ции (использование проходных форвакуумных па ровых стерилизаторов с автоматическим микропро цессорным управлением, наличием свободно програм-
326
мируемых режимов стерилизации и т.п.), обеспечивает 100% стерильность.
Стерилизационная камера и основные узлы изготов лены из высоколегированной нержавеющей во избе жание коррозии в процессе эксплуатации стали. Сте рилизаторы должны отвечать требованиям ГОСТ Р 51935-2002.
Профессиональная подготовка обслуживающего пер сонала должна соответствовать требованиям к эксп луатации используемого оборудования.
Использование современных средств контроля каче ства каждого этапа обработки и процесса стерили зации.
Обеспечение соответствующего санитарного режима на выполняемых технологических операциях и в со ответствующих зонах ЦСО.
Стерилизационные упаковки
Эффективность стерилизации зависит от упаковки. Основная функция упаковки — защита стерильного материала от повторного обсеменения микроорганизмами (рекон-таминации). Стерильный материал и стерильная упаковка не должны рассматриваться отдельно друг от друга. Без соответствующей упаковки стерильный материал бесполезен, так как нестерилен. Изделия, простерилизован-ные без упаковки, должны быть использованы непосредственно после стерилизации. Стерилизация сухим теплом или влажным материалом в упаковке позволяет сохранить стерильность изделий. Стерилизационные упаковочные материалы должны быть легко проницаемы для соответствующих стерилизующих агентов, в закрытом виде непроницаемы для микроорганизмов и сохранять целостность после стерилизации соответствующим методом.
Для упаковки используются многоразовые стерилизационные коробки (биксы), различные крафт-пакеты, современные упаковочные материалы.
Стерилизации подвергаются сухие изделия в упаковках из бумаги (крафт-пакеты) мешочной непропитанной,
327
бумаги мешочной влагопрочной. Существуют упаковки из двуслойной х.-б. ткани, соответствующей ОСТу 42-21-2-85. Сроки сохранения стерильности зависят от упаковки. Биксы без фильтра хранятся трое суток, с фильтром — 20 суток. Упаковки из двуслойной х.-б. ткани или крафт-пакеты хранятся до трех суток в стерильных условиях. Все упаковки маркируют.
В зависимости от химического индикатора с 1994 года пакеты изготавливаются трех разновидностей:
с химическим индикатором паровой стерилизации ИСПС;
с химическим индикатором воздушной стерилизации ИСВС;
с химическим индикатором паровой и воздушной сте рилизации ИЭ «ВИНАР».
С 1998 года Минздравом РФ разрешены к применению импортные бумажные пакеты, соответствующие требованиям международного стандарта. Срок хранения таких пакетов 20 дней. Сегодня применяются самоклеящиеся пакеты из влагопрочной бумаги для паровой и воздушной стерилизации. На внешней стороне пакета нанесен химический индикатор 1 класса с указанием соответствующего метода стерилизации и описанием конечного цвета индикатора, приобретаемого после стерилизации. Пакеты герметично закрывают с помощью самоклеящейся ленты, нанесенной на клапан пакета, без использования дополнительного оборудования.
В ВНИМАНИЕ! Изменение цвета индикатора 1 класса не позволяет судить о соблюдении параметров стерилизации и достижении условий, достаточных для надежной стерилизации изделий. Для этой цели необходимо использовать химические индикаторы 4—6 классов и другие методы контроля, разрешенные к применению.
Применение пакетов для стерилизации
1. Перед применением пакеты осматривают, проверяя их целостность и срок годности по маркировке тары. Нельзя пользоваться поврежденными пакетами и с истекшим сроком годности!
зга
Размер пакета выбирают с учетом габаритов стери лизуемого медицинского изделия. Во избежание разрыва швов пакетов в процессе стерилизации пакеты не следует заполнять более чем на 2/3 объема или длины пакета.
Медицинские изделия размещают рабочими частями к закрытой стороне пакета.
Для предотвращения повреждения пакетов колющи ми и режущими инструментами могут быть использованы следующие приемы: упаковывание изделий последователь но в два пакета или обертывание рабочих частей таких изделий чистыми марлевыми или бумажными салфетками.
Укомплектованный изделием пакет закрывают сле дующим образом:
• снимают антиадгезивное покрытие с липкого слоя клапана;
• перегибают по линии сгиба клапан и прижимают его
к лицевой стороне пакета, проглаживая рукой от центра к краям пакета. Перед закрытием пакета из него следует удалить воздух путем проглаживания в сторону открытого конца.
Пакеты с упакованными изделиями укладывают в корзины для стерилизации.
Стерилизацию изделий, упакованных в пакеты, осу ществляют в стерилизаторах, разрешенных в установлен ном порядке к применению в Российской Федерации, со блюдая требования инструкции по эксплуатации стерили заторов и правила загрузки стерилизационной камеры.
Изделия, оставшиеся влажными после стерилизации паровым методом, подсушивают непосредственно при сте рилизации.
При стерилизационной обработке происходит визу ально различимое изменение цвета химического индикато ра на лицевой стороне пакета: индикатор ИСПС — для паровой стерилизации, меняет свой цвет с желтого на ко ричневый;
индикатор ИСВС — для воздушной стерилизации ме няет свой цвет с фиолетового на коричневый;
индикатор ИЭ «ВИНАР» — для паровой и воздушной стерилизации, меняет исходный цвет после воздей-
329
ствия водяного насыщенного пара на темно-розовый, а в сухом горячем воздухе — на коричневый.
Срок хранения медицинских изделий после стери лизации в пакетах составляет 20 дней.
Запрещается использовать изделия из пакетов если:
нарушена целостность пакета;
химический индикатор не изменил свой цвет;
пакет находится во влажном состоянии.
При отсутствии нарушений пакет вскрывают при помощи ножниц со стороны клапана с соблюдением мер асептики. Изделие выкладывают на «стерильный стол» или сразу используют по назначению.
Хранятся пакеты в защищенном от света месте.
После использования пакеты подлежат утилизации как бытовые отходы.
Современные прозрачные упаковочные материалы компании «Медтест» предназначены для сохранения стерильности медицинских изделий в течение длительного времени после стерилизации. Они выполнены из специальной стерилизационной бумаги с фильтрующим эффектом, отвечающей требованиям международного стандарта. Вовнутрь прозрачной упаковки закладывается индикатор стерильности, но и на внешней стороне пакета имеется индикатор процесса, обеспечивающий двойной контроль.
Понятие об автоклавировании
Автоклав (от греч. ауто — сам и лат. клавис — ключ) — означает «самозапирание». Автоклавирование, или стерилизация в паровом стерилизаторе, применяется для процесса стерилизации инструмента, любых ИМН из металла, стекла, резины и текстиля, растворов, лигатурного шовного материала. Стерилизаторы паровые имеют различные габариты с различной степенью автоматизации. Объем рабочей камеры составляет 10, 25, 75, 120 л.
В паровых стерилизаторах создается высокая температура (до 138 °С) и высокое давление (до 2,5 атм.), благо-
330
даря которым обеспечиваются условия для вытеснения воздуха из всей стерилизационной камеры, а, следовательно, и оптимальное насыщение паром. Простейший паровой стерилизатор состоит из котла с двойной стенкой и герметически закрывающейся крышки, позволяющей поднять давление пара до определенного предела. Устройство современных паровых стерилизаторов соответствуют требованиям нового стандарта 2002 года, который можно сравнить с международным стандартом EN285-96. В них существует высокоэффективная система вакуумной сушки, возможность выбора режимов стерилизации (3 режима, а не 2), имеется короткий режим стерилизации при полной автоматизации процесса стерилизации, которые обеспечивают высокое качество стерилизации. Выполняются тестовые (контрольные) автоматические режимы. Для документирования параметров процесса стерилизации имеется принтер и самописец (регистратор), фиксирующий результаты стерилизации каждой конкретной партии.
Режимы стерилизации
1-й режим — температура 132 °С, давление 2 атм., время 20 мин.
Первый режим (основной) предназначен для стерилизации изделий из бязи, марли (перевязочного материала, белья и т.д.), стекла, включая шприцы с пометкой «200 «С», изделий из коррозийностойкого металла.
2-й режим — температура 120 °С, давление 1,1 атм., время 45 мин.
Второй режим (щадящий) рекомендуется для изделий из тонкой резины, латекса (хирургические перчатки и т.д.) и отдельных видов полимеров (полиэтилен высокой плотности).
3-й режим — температура 134 «С — 5 мин, 2 атм.
Условия проведения стерилизации: все изделия, стерилизуемые паром под давлением, предварительно помещают в упаковку — стерилизационные коробки (биксы или контейнеры) с фильтром или без фильтров, крафт-пакеты и другую упаковку, предназначенную для паровой стерилизации.
331
Соблюдаются требования ведения журнала контроля работы парового стерилизатора (форма работы стерилизаторов — 257/у).
Воздушный метод стерилизации
Проводится в воздушном стерилизаторе сухим горячим воздухом. Рекомендуется для стерилизации любых ИМН из металла, стекла, силиконовой резины. Воздушные стерилизаторы (сухожаровые шкафы) имеют различные габариты с различной степенью автоматизации и объемом рабочей камеры, как с односторонней загрузкой, так и проходного типа. В стерилизационной камере создается однородная рабочая температура от 160 °С до 180 °С с предельными отклонениями от —10 до +5 °С, благодаря принудительной циркуляции воздуха и автоматическому поддержанию температуры. Современные воздушные стерилизаторы имеют высокоэффективную систему охлаждения и эффективную теплоизоляцию.
Режимы стерилизации
1-й режим — температура 180 «С, время 60 мин.
Первый режим (основной) предназначен для стерилизации изделий из стекла, включая шприцы с пометкой «200 «С», изделий из металла: хирургические, стоматологические, гинекологические инструменты, в том числе кор-розийнонестойких металлов.
2-й режим — температура 160 ‘С, время 150 мин. Второй режим (щадящий) предназначен для стерилизации изделий из силиконовой резины, а также деталей некоторых аппаратов и приборов.
Условия проведения стерилизации: изделия стерилизуются без упаковки на сетках или упакованными в бумагу упаковочную, соответствующую требованиям действующего Отраслевого стандарта, а также в разрешенные зарубежные упаковочные материалы.
Соблюдаются требования ведения журнала контроля работы воздушного стерилизатора (форма 257/у).
332
Порядок работы на воздушных стерилизаторах (сухожаровые шкафы)
Загрузка производится в холодный стерилизатор.
Нагревание.
Стерилизация: отсчет времени стерилизации начи нать от достижения нужной температуры стерилизации (180 °С) до истечения срока экспозиции (60 минут).
Охлаждение: до 40-50 °С.
5. Разгрузка. Последовательность действий:
Разложить на металлические сетки хирургический инструментарий так, чтобы часть отверстий была от крыта для циркуляции нагретого воздуха.
Поместить в пяти точках индикаторы стерильности (см. таблицу 23).
Закрыть дверцу шкафа, включить рубильник.
Прогреть стерилизационную камеру в течение 5— 10 минут.
Открыть дверцу сухожарового шкафа, установить сетки с хирургическими инструментами на полки шкафа.
Закрыть дверцу сухожарового шкафа.
Установить ручку реле времени на требуемую дли тельность стерилизации.
Примечание. По достижении заданной температуры в стерилизаторе на пульте управления загорится сигнальная лампа, указывающая начало стерилизации.
При автоматической стерилизации электронагреватели по окончании заданного цикла автоматически отключаются и сигнальная лампа гаснет.
При полуавтоматическом режиме работы шкафа медицинская сестра по окончании стерилизации отключает его от сети, выключив рубильник или выключатель.
Стерилизация растворами химических веществ
Перекись водорода обладает выраженным обеззараживающим свойством. Для стерилизации используется 6%
333
раствор перекиси водорода — экспозиция 180 мин, температура 50 °С; при полном погружении для стерилизации изделий из полимеров, резины, стекла и коррозийно-нестойких металлов экспозиция — 360 мин при температуре 18 °С.
По окончании срока экспозиции изделия промывают двукратно стерильной водой и переносят в стерильные контейнеры, например, стерилизационные коробки, выстланные стерильной простыней (полотенцем), и плотно закрывают (срок стерильности — трое суток) или выкладывают на стерильный инструментальный стол для использования.
Примечание: 6% раствор перекиси водорода может использоваться в течение 7 суток со дня приготовления при условии хранения его в закрытой таре в темном месте. Использовать в дальнейшем можно только при условиях контроля содержания активно действующих веществ.
«Дезоксон-1» — бесцветная жидкость с характерным запахом уксусной кислоты, хорошо растворима в воде, спирте. Выпускается во флаконах из темного стекла и при температуре 10 °С сохраняет активность в течение года.
Для стерилизации используются рабочие растворы 1% (по надуксусной кислоте), для чего разводят 200 мл препарата в 800 мл водопроводной воды. Используется только один раз.
Условия проведения стерилизации: при полном погружении на время стерилизационной выдержки 45 мин при температуре 18 °С. Затем стерильные изделия промывают в стерильной воде, погружая на 5 мин, с троекратной сменой воды, а затем помещают в стерильную стери-лизационную коробку на стерильную простыню. Срок сохранения изделия стерильным — 3 суток.
«Дезоксон-1* обладает выраженным коррозийным действием, а поэтому не всегда годен для стерилизации инструментов. Работают, соблюдая меры предосторожности.
Методы — стерилизация (женщины)
Ваш браузер отключил или блокирует Javascript.
Если вы используете блокировщик контента, убедитесь, что вы не отключили глобально Javascript.
Если вы отключили его вручную в своем браузере, включите его, чтобы улучшить работу с этим сайтом.
ОСНОВЫ
Что это?
Стерилизация для женщин — это процедура, которая блокирует маточные трубы, чтобы яйца не достигли матки.Многие называют это «завязкой трубок». Врачи могут назвать это перевязкой маточных труб или окклюзией маточных труб. Это постоянная форма контроля рождаемости.
Есть 4 способа выполнить процедуру:
- Разрежьте трубки пополам или вырежьте часть, затем запечатайте концы.
- Используйте электрический ток, чтобы заблокировать трубки.
- Закройте трубки снаружи зажимом или кольцом.
- Снимите трубки.
Насколько хорошо он предотвращает беременность?
Очень эффективная форма контроля рождаемости — один из самых низких показателей беременности из всех методов контроля рождаемости.
Менее 1 из 100 женщин забеременеет за год использования.
КАК ЭТО РАБОТАЕТ?
Блокирует или удаляет маточные трубы, чтобы яйца не достигли матки.
КАКОВЫ НАЗВАНИЯ ПРОДУКТОВ?
Зажим Filshie или Hulka, кольцо Falope или Yoon
ПРОФИ
- Очень эффективно.Не нужно снова думать о контроле над рождаемостью. Количество отказов очень низкое.
- Секс может быть спонтанным, не беспокоясь о беременности.
- Без гормонов.
- Можно сделать операцию сразу после рождения ребенка. Если вам сделали кесарево сечение (кесарево сечение), хирург воспользуется разрезом, который использовался для родов.
Минусы
- Навсегда.Вы должны быть уверены, что никогда не захотите иметь еще одного ребенка. Молодые женщины с большей вероятностью пожалеют о том, что прошли процедуру, чем женщины старшего возраста.
- Эти методы требуют хирургического вмешательства. Это можно сделать через крошечные разрезы, и в тот же день вы отправитесь домой. (Или, если у вас есть кесарево сечение, это можно сделать через этот разрез.)
- Женская стерилизация сложнее, стоит дороже и имеет более высокий процент неудач, чем вазэктомия (мужская стерилизация).
ВОЗМОЖНЫЕ ПРОБЛЕМЫ
Существует небольшой риск проблем, связанных с операцией.Сюда входят:
- Инфекция
- Кровотечение
- Боль
- Травма другого органа или крупного кровеносного сосуда
- Невыполнение процедуры.
Методы — стерилизация (мужчины)
Ваш браузер отключил или блокирует Javascript.
Если вы используете блокировщик контента, убедитесь, что вы не отключили глобально Javascript.
Если вы отключили его вручную в своем браузере, включите его, чтобы улучшить работу с этим сайтом.
ОСНОВЫ
Что это?
Стерилизация для мужчин — это процедура, которая блокирует сперму до того, как она покинет организм и, возможно, станет причиной беременности.Это также называется вазэктомией. Это постоянная форма контроля рождаемости.
Хирург сначала прокалывает или вырезает крошечное отверстие в мошонке. Затем трубки, по которым проходит сперма (семявыносящий проток), перевязывают, герметизируют с помощью тепла или обрезают, чтобы заблокировать их. Это амбулаторная операция. В тот же день мужчина уходит домой.
Насколько хорошо он предотвращает беременность?
Очень эффективная форма контроля рождаемости — один из самых низких показателей беременности из всех методов контроля рождаемости.
Некоторые женщины действительно беременеют после того, как их партнерша перенесла вазэктомию. Но цифры очень маленькие. Примерно 1 из 100 женщин, которым была проведена вазэктомия, забеременеет через год использования.
КАК ЭТО РАБОТАЕТ?
Вазэктомия закрывает трубки, по которым проходит сперма, поэтому сперма не смешивается со спермой и не вызывает беременность.
ПРОФИ
- Очень эффективный контроль рождаемости. После того, как тесты подтвердят, что в сперме нет спермы, больше не нужно думать о контроле над рождаемостью. Количество отказов очень низкое.
- Секс может быть спонтанным, не беспокоясь о беременности.
- Это проще, дешевле и меньше отказов, чем при женской стерилизации. Без гормонов.
- Вазэктомия позволяет мужчинам брать на себя ответственность за контроль рождаемости.
Минусы
- Навсегда.Мужчине не следует делать вазэктомию, если он не уверен, что никогда не захочет иметь еще одного ребенка.
- Не сразу вступает в силу. Сначала вы должны использовать другую форму контроля рождаемости. Ваш врач скажет вам, когда следует вернуться на анализ, чтобы подтвердить, что в вашей сперме нет сперматозоидов. Можно безопасно прекратить использование противозачаточных средств после того, как два теста не покажут спермы.
ВОЗМОЖНЫЕ ПРОБЛЕМЫ
Существует небольшой риск проблем, связанных с операцией.Сюда входят:
- Инфекция
- Набухание
- Кровотечение
- Боль, которая может продолжаться примерно у 2 из 100 мужчин
Процесс стерилизации оксидом этилена, Метод C | TechTip
перейти к содержанию Страница Facebook открывается в новом окне Страница Twitter открывается в новом окне Страница YouTube открывается в новом окне Страница Linkedin открывается в новом окнеСТЕРИС АСТ
STERIS AST Сайт
- Услуги
- Стерилизация по контракту
- Электронный луч
- Гамма-облучение
- Рентгеновское излучение
- Оксид этилена
- Устойчивый EO ® Услуги стерилизации
- Испытание на парообразование и перекись водорода
- Услуги по тестированию
- Антимикробная эффективность
- Тестирование бионагрузки
- Биологические индикаторы
- Тестирование и консультирование в чистых помещениях
- Квалификация дезинфицирующих средств
- Идентификация микробов
- Микробиологические пределы Тестирование
- Радиационная стерилизация Услуги по валидации Стерилизация
- Тестирование
- Услуги аналитического тестирования
- Тестирование на бактериальный эндотоксин (LAL)
- Косметический анализ
- Тестирование выпуска лекарственного препарата
- Анализ элементарных примесей
- Услуги по разработке и валидации методов
- Исследования стабильности
- Анализ сырья
- Решения для проверки остаточных примесей
- Тестирование продукции
- Ускоренное испытание на срок службы
- Проверка конструкции (DV)
- Luer Connectors
- Luer Connectors Электрооборудование
- Тестирование упаковки
- Ускоренное старение в реальном времени
- Тестирование холодовой цепи
- Тестирование упаковки для опасных грузов (UN DG)
- Моделирование распределения
- ISTA 6-Amazon.Com SIOC Testing
- Целостность стерильного барьера и прочность уплотнения
- Другие услуги
- Контрактная паровая стерилизация
- Испытание многоразового устройства
- Техническая поддержка
- Radiation TechTeam®
- Форма запроса центра радиационных технологий
- Рекомендации по предоставлению материалов
- EO TechTeam®
- Radiation TechTeam®
- Стерилизация по контракту
- Industries
- Медицинское оборудование
- Медицинское оборудование
- Стерилизация тканей
- Расходные материалы для чистых помещений
- Фармацевтические препараты
- Фармацевтические препараты для животных и животных Потребительский сектор
- Косметика и туалетные принадлежности
- Пищевые продукты и исследования
- Упаковка
- Реставрация и утилизация
- Садоводство
- Промышленное применение
- Исследования и разработки
- Фармацевтические препараты для животных и животных Потребительский сектор
- Ресурсы
- TechTips
- Литература
- Отраслевые статьи
- Формы обработки клиентов
- Формы запросов на лабораторные испытания
- Новости и события
- Новости
- Образование и события
- О компании США
- Соответствие нормативным требованиям
- FDA Регистрация устройств и лекарств
- Сертификаты
- Почему STERIS?
- Наши ценности
- Соответствие нормативным требованиям
- Наши представительства
- Свяжитесь с нами
Военно-медицинские книги и учебные пособия в Интернете
БОЛЬНИЦА МОРСКОЙ 3 И 2
Предоставляет информацию по следующим темам: профилактика, распознавание и лечение заболеваний и травм, а также в администрации медицинских отделений на берегу, на плаву и в полевых условиях с морской пехотой; оказать первую помощь; помощь в транспортировке больных и раненых; помочь с физическим осмотром; оказывать медицинскую помощь пациентам, в том числе прием лекарственных препаратов и парентеральных растворов; собирать лабораторию образцы и выполнять простые лабораторные процедуры; помощь в закупках, хранение, выдача и ведение бухгалтерского учета медицинских принадлежности; проинструктировать по вопросам личной гигиены, оказания первой помощи и самопомощи; помочь в подготовка и ведение медицинской документации; помогать в обслуживании утвержденные санитарные нормы; и помочь в профилактике и лечении химические, биологические и радиологические травмы.
БОЛЬНИЦА Бригадир 1 и С
Предоставляет информацию о следующих темы: Способности контролировать и вести больничные и пациенты скорой помощи; распознавание и лечение неотложной стоматологической помощи условия; проведение медицинских осмотров; выполнение и интерпретация результаты элементарных лабораторных процедур; сброс окружающей среды и профилактические медицинские функции, такие как удаление сточных вод и мусора, сексуальное контактные интервью и сообщения о передаваемых заболеваниях, а также общественное питание санитарные процедуры; заказ, получение и выдача материалов и обслуживание соответствующие бухгалтерские записи; проведение массовых иммунизаций; подготовка и ведение кадрового учета; выполнение различных аспектов Программа по делам умерших; обеспечение соблюдения правил и норм для методы и процедуры обеспечения безопасности; медицинские аспекты ядерных, биологических и химическая защита; администрация и программы здравоохранения; правовые последствия в медицинская помощь; и выполнение общих обязанностей, связанных с управление лечебными отделениями на берегу и на плаву.
СТОМАТОЛОГИЧЕСКИЙ ТЕХНИК, ТОМ 01
Этот курс направлен на следующие предметы: общее управление и ориентация; технический администрация и обязанности; анатомия головы и шеи; анатомия полости рта и патология; неотложная помощь при заболеваниях и травмах полости рта; устный фармакология; питание и диета; инфекционный контроль; стерилизация и инфекция; стоматологическая безопасность и безопасность оборудования; корабль, морской флот, и военно-морское мобильное строительство; помощь раненым и война с РУБ.
СТОМАТОЛОГИЧЕСКИЙ ТЕХНИК, ТОМ 02
Этот курс направлен на следующие предметы: стоматологическая радиология и обследования; профилактические и оперативная стоматология; челюстно-лицевая хирургия; пародонтальный, эндодонтический и протезный помощь; неотложная помощь стоматологического кабинета и судебная стоматология.
БОЛЬНИЦА CORPSMAN Исправленное издание
Охватывает анатомию и физиология; основы ухода за больными; оборудование для оказания первой помощи, расходные материалы, спасение и транспортировка; процедуры неотложной медицинской помощи; отравление; препарат, средство, медикамент злоупотребления и воздействие опасных материалов; фармация и токсикология; клинический лаборатория; медицинские аспекты химической, биологической и радиологической войны; диета и питание; неотложная стоматологическая помощь; профилактическая медицина; физический экзамены; медицинские записи; поставка; администрация; здравоохранение администрация; и покойные дела.
БОЛЬНИЦА МОРСКОЙ 3 И 2
Задания для санитара 3 и 2
БОЛЬНИЦА 1 и К
Ультрафиолетовая стерилизационная системаНазначение вопросов для больницы Санитар 1 и К
Описание метода испытаний и ввода в эксплуатацию — Описание метода HQ
Ультрафиолетовая система стерилизациииспользуется во многих системах очистки воды для дезинфекции и контроля бактерий.Ультрафиолетовая или УФ-энергия находится в электромагнитном спектре между видимым светом и рентгеновскими лучами и лучше всего может быть описана как невидимое излучение. Ультрафиолетовый свет имеет длину волны от 200 до 390 нанометров (нм). Наиболее эффективная длина волны с точки зрения микробиологической дезинфекции составляет 254 нм, поскольку именно здесь находится оптимальная энергоемкость.
Принцип системы УФ-стерилизации
Типичные системы УФ-дезинфекции включают поток воды через сосуд, содержащий УФ-лампу.• Когда вода проходит через этот сосуд, микроорганизмы подвергаются воздействию интенсивной энергии ультрафиолетового света, которая вызывает повреждение генетических молекул (например, нуклеиновых кислот: ДНК или РНК), необходимых для репродуктивных функций.
Чтобы уничтожить микроорганизмы, УФ-лучи УФ-системы стерилизации должны действительно попадать на клетку. Ультрафиолетовая энергия проникает через внешнюю клеточную мембрану, проходит через тело клетки и разрушает ее ДНК, препятствуя размножению. Это повреждение предотвращает размножение или репликацию микроорганизма в организме человека или животного-хозяина.Поскольку микроорганизм не может размножаться, не может возникнуть инфекция. Обеззараживание воды достигается, когда УФ-свет вызывает инактивацию микробов.
Преимущества системы УФ-стерилизации
УФ-дезинфекция не добавляет химикатов в воду. Система УФ-стерилизации эффективна против бактерий и вирусов. Криптоспоридиумы, лямблии и другие биологические патогены инактивируются, а возобновление роста бактерий прекращается. Большинство УФ-устройств имеют звуковой детектор УФ-излучения, который уведомляет пользователя о недостаточной интенсивности лампы.
Есть и недостатки, такие как регулярное обслуживание и замена лампы. УФ-устройства убивают бактерии только в одной точке системы полива и не оказывают никакого остаточного бактерицидного эффекта ниже по течению. Трубопровод системы полива, обработанный УФ-дезинфекцией, необходимо периодически дезинфицировать химическим дезинфицирующим средством. Обрабатываемая вода не должна быть мутной или мутной. Любой уровень цвета, присутствующий в воде, будет препятствовать проникновению УФ-излучения в воду и уничтожению находящихся внутри нее микроорганизмов.
Дезинфекция — это обычно окончательный процесс очистки воды. Цель дезинфекции — уничтожить патогенные микроорганизмы в воде и обеспечить дополнительную защиту от последующего заражения.
Ниже приводится точное описание метода, которое может быть полезно, когда кто-то хочет провести тестирование и ввод в эксплуатацию УФ-системы стерилизации.
Пусконаладочные работы системы и завершение строительства. Проверки фильтра
Перед вводом системы в эксплуатацию необходимо убедиться в следующем.
- Система была проверена по утвержденным монтажным чертежам.
- Убедитесь, что давление на входе в фильтр превышает 2,5 бар (38 фунтов на квадратный дюйм) во время цикла ополаскивания.
- Убедитесь, что фильтр установлен в правильном направлении потока.
- Убедитесь, что все контрольные трубки подключены правильно и все соединения затянуты.
- Убедитесь, что трехходовой мини-клапан установлен в автоматическое положение. Стрелка на ручке должна указывать на АВТО, а наклейка ο на фильтре.
- Убедитесь, что установленная труба соответствует утвержденному чертежу или номинальный диаметр должен составлять 3 дюйма (75 мм).
- Если были установлены рекомендуемые запорные клапаны на входе и выходе, убедитесь, что они закрыты.
Проверки перед вводом в эксплуатацию УФ-стерилизатора
Проверьте радиационную камеру на герметичность и вентиляцию в соответствии со следующей процедурой:
- Ослабьте (откройте) вентиляционный винт на радиационной камере
- Медленно откройте запорный клапан на входе радиационной камеры
- Заполните радиационную камеру до тех пор, пока вода не начнет выходить из вентиляционного винта
- Закройте вентиляционный винт, приложив небольшое усилие
- Проверить радиационную камеру на герметичность
- Открыть запорный клапан после радиационной камеры (необходимо только для ручного закрытия) запорный клапан)
Этап ввода в эксплуатацию системы УФ-стерилизации
При вводе в эксплуатацию системы фильтрации необходимо выполнить следующие действия:
- Медленно откройте запорный клапан на входе фильтра.Вода потечет в фильтр.
- Проверить на утечки и при необходимости отремонтировать.
- Убедитесь, что минимальное давление на входе остается 2,5 бара (38 фунтов на кв. Дюйм) или выше.
- Медленно откройте запорный клапан на выходе из фильтра.
- Если есть перепускной клапан, закройте его медленно.
- Убедитесь, что поток через фильтр не превышает заявленную максимальную скорость потока.
- Начните ручную промывку, повернув трехходовой клапан в положение ОТКРЫТО на несколько секунд, а затем верните его в положение АВТО.
- Во время цикла самоочистки проверьте давление на входе фильтра и в камере ротора.
Примечание. Минимальное давление в камере ротора должно быть на 1,5 бара (22 фунта на кв. Дюйм) ниже входного давления.
Ввод в эксплуатацию УФ-системы фильтрации , необходимо выполнить следующие шаги:
- Включить главный выключатель или подсоединить сетевой штекер
- Проверить параметры в режиме программирования системы управления и при необходимости изменить, см.
- Медицинское оборудование